Abstract
目的
探讨小檗碱与硼替佐米联合对多发性骨髓瘤(MM)细胞增殖及诱导细胞凋亡的作用及其可能的机制。
方法
以MM细胞株U266细胞为研究对象,以小檗碱和硼替佐米作用后,采用MTT法检测其对U266细胞增殖的影响,采用流式细胞术检测其对U266细胞凋亡的影响,采用ELISA法检测其对细胞caspase-3、-8、-9表达的影响,采用Western blot法检测其对细胞Fas相关死亡结构域蛋白(FADD)、TNF受体相关死亡域蛋白(TRADD)表达的影响。采用金(正均)氏公式计算协同系数Q值分析两药的协同作用。
结果
①两药单独作用时对U266细胞增殖的抑制作用均呈时间、剂量依赖关系;小檗碱(20 µmol/L)与硼替佐米(5 nmol/L)联合作用对U266细胞增殖具有协同抑制作用(Q值为1.31~1.65)。②无论单独用药还是联合用药,与对照组比较,用药组早期凋亡细胞的比例均显著增加(P值均<0.05);两药联合对U266细胞具有协同促进凋亡的作用(作用6、12 h, Q值分别为0.896和1.197)。③两药联合应用后U266细胞caspase-3、-8、-9、表达水平均较对照组、单药组明显增加,差异有统计学意义(P值均<0.05)。④两药联合应用(24、48 h)后U266细胞TRADD(0.91±0.01、0.70±0.01)、FADD(0.98±0.01、0.98±0.01)蛋白水平均较对照组(0.54±0.01、0.41±0.01)明显增加,差异有统计学意义(P值均<0.05)。
结论
小檗碱联合硼替佐米可协同促进MM细胞凋亡,这种作用可能是通过上调TRADD及FADD蛋白表达水平而实现的。
Keywords: 多发性骨髓瘤, 小檗碱, 硼替佐米, 体外研究
Abstract
Objective
To investigate the effects of berberine in combination with bortezomib on proliferation and apoptosis of multiple myeloma (MM) cell line.
Methods
MM cell line U266 cells were treated with berberine and/or bortezomib. The effects of berberine and/or bortezomib on proliferation of cells were measured by methylthiazolyl tetrazolium bromide (MTT). Flow cytometric Annexin Ⅴ/PI double staining method was used to detect effect of either drug alone or in combination on apoptosis of MM cell line U266. ELISA was used to measure the expression of casepase-3,-8,-9 affected by the two drugs. Western blot was used to detect the expression of the apoptosis-related protein TRADD and FADD. King formula was used to determine if there was a synergistic effect of berberine in combination with bortezomib.
Results
①Both berberine and bortezomib as single agent had dose- and time-dependent effects of proliferation inhibition on U266 cells. Berberine (20 µmol/L) and bortezomib (5 nmol/L) had a synergistic effect of proliferation inhibition (Q value: 1.31–1.65). ②The proportion of early stage apoptosis in both single agent groups and combination group significantly increased compared to control group (P< 0.05). Berberine and bortezomib had a synergistic effect on cell apoptosis (Q value after 6 h and 12 h were 0.896 and 1.197, respectively). ③Berberine in combination with bortezomib significantly upregulated expressions of caspase-3, -8 and -9, which were statistically significant (P<0.05). ④Berberine in combination with bortezomib significantly upregulated expressions of TRADD (0.91±0.01, 0.70±0.01) and FADD (0.98±0.01, 0.98±0.01) compared with control group (both P<0.05).
Conclusion
Berberine in combination with bortezomib had synergistic effects on proliferation inhibition and apoptosis, which were mediated by up-regulated levels of TRADD and FADD.
Keywords: Multiple myeloma, Berberine, Bortezomib, In vitro
多发性骨髓瘤(multiple myeloma, MM)是一种起源于浆细胞的恶性肿瘤,以硼替佐米为代表的新药治疗显著延长了患者的无进展生存,但几乎所有患者均因耐药而最终复发死亡,迄今仍不可治愈。有研究证实,小檗碱能通过有效抑制IL-6分泌抑制肿瘤增殖,是一种潜在的天然抗MM药物[1]–[4]。能否将小檗碱联合硼替佐米应用于MM以提高临床疗效,目前尚未见报道。本研究我们以人MM细胞株U266细胞为研究对象,探讨小檗碱与硼替佐米联合对MM细胞增殖及诱导细胞凋亡的作用及其可能的机制。
材料与方法
1.细胞培养及实验分组:U266细胞由北京沙东生物技术有限公司药理实验室提供,细胞密度为2.0 × 106/ml,于含10%灭活胎牛血清(FBS)的RPMI 1640培养基,置于37 °C、5% CO2的培养箱中培养,每3~4 d按1∶2传代培养,取对数生长期的细胞用于实验。
实验分组:①对照组:以培养基代替药物;②小檗碱组:加入小檗碱(购自美国Sigma公司),终浓度为20 µmol/L;③硼替佐米组:加入硼替佐米(由西安杨森制药有限公司惠赠),终浓度为5 nmol/L;④联合作用组:小檗碱终浓度为20 µmol/L,硼替佐米终浓度为5 nmol/L。
2.采用MTT法检测药物对U266细胞增殖的影响:MTT试剂盒购自北京博奥森生物技术有限公司。按说明书进行操作。检测两药物单独(小檗碱浓度梯度为10、20、30、40、60 µmol/L,硼替佐米浓度梯度为1.25、5、10、20、40 nmol/L)或联合作用24、48 h后对细胞的增殖抑制率。应用OriginPro7.5软件计算小檗碱和硼替佐米作用于细胞系的半数抑制浓度(IC50)。每组设3个复孔,实验重复3次。用金(正均)氏公式判断小檗碱和硼替佐米的联合作用是否具有协同抑制细胞增殖的作用。公式为:Q= EA+B/(EA+EB–EA·EB)(注:EA为A药效应,EB为B药效应,EA+B为联合用药效应)。
3.采用流式细胞术检测药物对U266细胞凋亡的影响:Annexin Ⅴ/PI双染试剂盒购自上海美吉生物医药科技有限公司,按说明书进行操作,上流式细胞仪(美国BD公司产品)检测两药单独或联合作用6、12 h后U266细胞的凋亡率。Annexin Ⅴ+/PI−为早期凋亡细胞,Annexin Ⅴ+/PI+为坏死及晚期凋亡细胞。每组设3个复孔,实验重复3次。用金(正均)氏公式判断小檗碱和硼替佐米的联合作用是否具有协同早期促细胞凋亡作用。
4.采用ELISA法检测药物对U266细胞caspase-3、-8、-9表达的影响:ELISA检测试剂盒购自武汉华美生物工程有限公司。按说明书进行操作。检测两药物单独或联合作用2、6 h后细胞caspase-3、-8、-9的表达水平。每组设3个复孔,实验重复3次。
5.采用Western blot法检测药物对U266细胞Fas相关死亡结构域蛋白(Fas-associated death domain protein, FADD)、TNF受体相关死亡结构域蛋白(TNF-associated death domain protein, TRADD)表达的影响:对四组细胞分别提取蛋白,经SDS-PAGE电泳后,将蛋白质电转移至硝酸纤维素膜上,依次加入相应一抗、二抗进行孵育,曝光显影后对蛋白条带进行扫描。每组设3个复孔,实验重复3次。
6.统计学处理:采用SPSS 17.0软件进行统计学分析。实验数据用x±s表示,两组比较采用独立样本t检验,多组数据比较采用方差分析。P<0.05为差异有统计学意义。
结果
一、药物对U266细胞增殖的影响
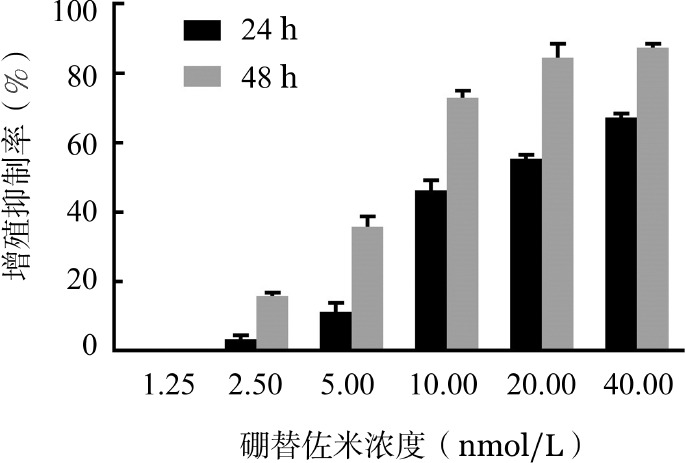
1.小檗碱对U266细胞增殖的影响:分别用不同终浓度的小檗碱与U266细胞共同孵育24、48 h,结果显示,在同一时间组内,随着浓度的增加,小檗碱对U266细胞增殖抑制作用逐渐增强;而在同一浓度下,随着作用时间的延长,小檗碱对细胞增殖抑制作用也逐渐增强,呈剂量和时间依赖性(图1)。作用24 h时IC50值为>60 µmol/L,作用48 h时IC50值为54.22 µmol/L。
图1. MTT法检测不同浓度小檗碱作用不同时间后对U266细胞增殖的影响(每组设3个复孔,实验重复3次).
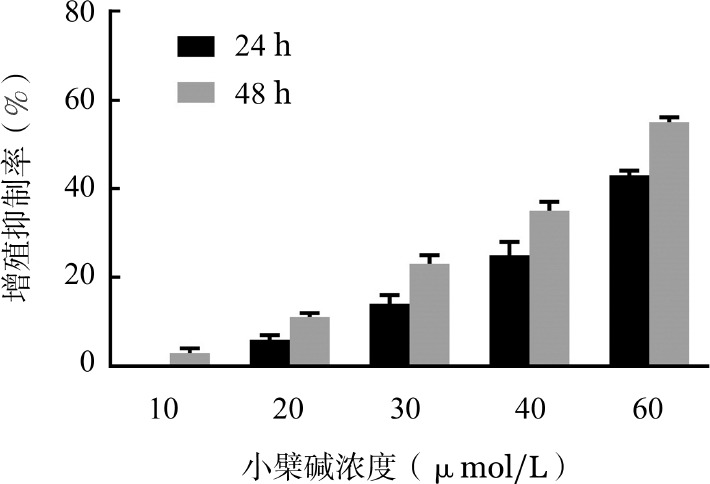
2.硼替佐米对U266细胞增殖的影响:分别用不同终浓度的硼替佐米与U266细胞共同孵育24、48 h,结果显示,在同一时间组内,随着浓度的增加,硼替佐米对U266细胞增殖抑制作用逐渐增强;而在同一浓度下,随着作用时间的延长,硼替佐米对细胞增殖抑制作用也逐渐增强,呈剂量和时间依赖性(图2)。作用24 h时IC50值为11.8 nmol/L,作用48 h时IC50值为6.1 nmol/L。
图2. MTT检测不同浓度硼替佐米作用不同时间后对U266细胞增殖的影响(每组设3个复孔,实验重复3次).
3.两药联合对U266细胞的增殖的影响:根据检测所得两药单独作用24、48 h后对细胞增殖抑制的结果,选择5、10 nmol/L硼替佐米作为联合用药的浓度,与不同浓度的小檗碱共同作用于U266细胞,检测作用24、48 h时对细胞的增殖的影响。结果显示5 nmol/L硼替佐米联合不同浓度小檗碱组24、48 h时Q值介于1.31±0.23和1.65±0.22之间,提示两药为协同作用。10 nmol/L硼替佐米联合不同浓度小檗碱组24、48 h时Q值介于1.00±0.15和1.07±0.14之间,提示两药为相加作用,考虑与硼替佐米药物浓度较高有关(图3)。
图3. 不同浓度的小檗碱与硼替佐米单独及联合作用24(A)、48(B)h后对U266细胞增殖的影响(每组设3个复孔,实验重复3次).
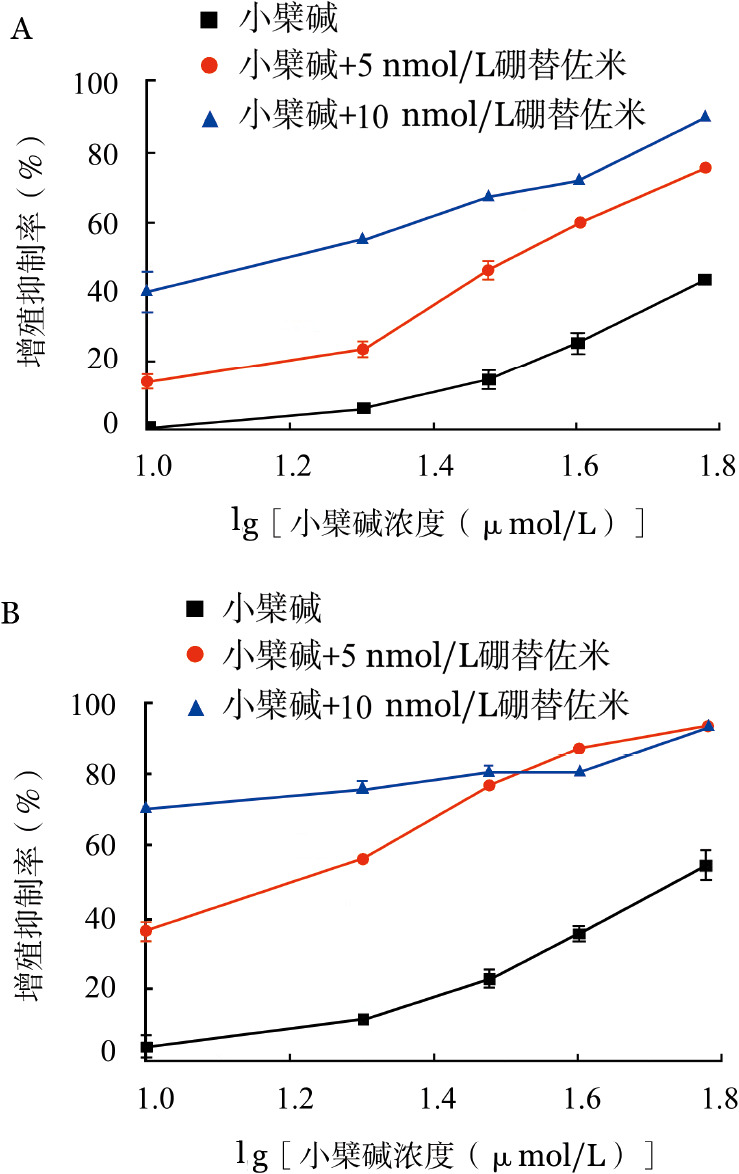
横坐标代表小檗碱不同浓度取lg值
同时发现,硼替佐米5 nmol/L与小檗碱20 µmol/L联合作用组在48 h时细胞增殖抑制率为(56.23 ± 0.59)%,硼替佐米10 nmol/L与小檗碱20 µmol/L联合作用组在24 h细胞增殖抑制率为(56.36±0.30)%,均接近IC50值;通过金氏方程检验上述实验组联合作用组在24 h及48 h时Q值均大于1.15,表现为协同作用,联合用药后U266细胞增殖抑制率与单药小檗碱比较明显升高。硼替佐米10 nmol/L与小檗碱20 µmol/L联合作用组在48 h细胞增殖抑制率为(76.71±1.79)%,Q值为1.01,协同作用不明显,考虑与硼替佐米浓度较高有关。故选取硼替佐米终浓度5 nmol/L、小檗碱终浓度20 µmol/L为进行后续实验的联合浓度(图3)。
二、药物对U266细胞凋亡的影响
1.小檗碱与硼替佐米单独及联合作用6 h对U266细胞凋亡的影响:结果详见表1。四组数据经方差分析显示P<0.001。进一步采用LSD法进行组间比较,结果显示与空白对照组比较,硼替佐米组的细胞凋亡率增高差异无统计学意义(P=0.070),其他两组的细胞凋亡率均显著增高,差异均有统计学意义(P值均<0.01);小檗碱、硼替佐米两药单独用药组比较,细胞凋亡率差异无统计学意义(P= 0.090);联合作用组较小檗碱组(P=0.010)、硼替佐米组(P=0.020)细胞凋亡率均增高,差异均有统计学意义。两药物联合应用时,Q值为0.896,提示联合用药为相加的效果。
表1. 流式细胞术检测小檗碱和硼替佐米单独和联合作用对U266细胞早期凋亡的影响(%,x±s).
| 组别 | 作用6 h |
作用12 h |
||||
| 凋亡率 | P值 | Q值 | 凋亡率 | P值 | Q值 | |
| 空白对照组 | 2.77±0.25 | 2.90±0.20 | ||||
| 硼替佐米组 | 26.93±3.15 | 0.007 | 28.17±1.56 | 0.010 | ||
| 小檗碱组 | 15.86±1.35 | 0.005 | 20.43±1.45 | 0.020 | ||
| 联合作用组 | 34.60±2.55 | 0.003 | 0.896 | 51.33±0.61 | 0.000 | 1.197 |
注:硼替佐米组:硼替佐米浓度5 nmol/L;小檗碱组:小檗碱20 µmol/L;联合作用组:20 µmol/L小檗碱+5 nmol/L硼替佐米;P值为与空白对照组比较;每孔设3个复孔,实验重复3次
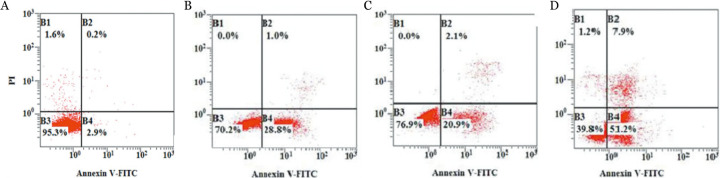
2.小檗碱与硼替佐米单独及联合作用12 h对U266细胞凋亡的影响:结果详见表1、图4。4组数据经方差分析显示P<0.001。进一步采用LSD法进行组间比较,结果显示与空白对照组比较,其他3组的细胞凋亡率均显著增高,差异均有统计学意义(P值均<0.05);小檗碱组与硼替佐米组比较,细胞凋亡率差异有统计学意义(P=0.000);联合作用组较小檗碱组(P=0.000)、硼替佐米组(P=0.010)细胞凋亡率均增高,差异均有统计学意义。两药联合应用时,Q值为1.197,提示联合用药为增强的效果。
图4. 流式细胞术检测硼替佐米联合小檗碱作用12 h后对U266细胞凋亡的影响.
A:空白对照组;B:5 nmol/L硼替佐米作用组;C:20 µmol/L小檗碱作用组;D:20 µmol/L小檗碱和5 nmol/L硼替佐米联合作用组
三、药物对U266细胞caspase-3、-8、-9表达的影响
结果见表2。随着作用时间的增加,caspase-3、-8、-9表达均较对照组有明显增加,差异均有统计学意义。其中caspase-8的表达水平在小檗碱组及联合作用组增加明显,与硼替佐米组比较差异有统计学意义(P<0.05);caspase-9的表达水平在硼替佐米组及联合作用组增加明显,与小檗碱组比较差异有统计学意义(P<0.05)。
表2. ELISA法检测小檗碱和硼替佐米单独和联合作用不同时间对U266细胞caspase-3、8、9活性的影响(ng/ml,x±s).
| 组别 | caspase-3 |
P值 | ||
| 作用0 h | 作用2 h | 作用6 h | ||
| 空白对照组 | 0.282±0.029 | 0.267±0.029 | 0.263±0.016 | 0.649 |
| 5 nmol /L硼替佐米组 | 0.258±0.020 | 0.337±0.023a | 0.600±0.024a | <0.001 |
| 20 µmol /L小檗碱组 | 0.257±0.006 | 0.300±0.013 | 0.482±0.012a | <0.001 |
| 联合作用组 | 0.279±0.020 | 0.427±0.018a | 0.988±0.046a | <0.001 |
| 组别 | caspase-8 |
P值 | ||
| 作用0 h | 作用2 h | 作用6 h | ||
| 空白对照组 | 76.597±5.037 | 73.689±2.580 | 73.688±1.895 | 0.528 |
| 5 nmol /L硼替佐米组 | 84.545±8.831 | 99.748±2.712 | 162.010±3.610b | <0.001 |
| 20 µmol /L小檗碱组 | 78.254±3.744 | 117.314±2.216a | 184.610±4.112a | <0.001 |
| 联合作用组 | 78.665±1.441 | 127.860±4.612a | 334.301±10.961a | <0.001 |
| 组别 | caspase-9 |
P值 | ||
| 作用0 h | 作用2 h | 作用6 h | ||
| 空白对照组 | 0.746±0.021 | 0.805±0.041 | 0.746±0.031 | 0.104 |
| 5 nmol /L硼替佐米组 | 0.773±0.061 | 0.945±0.049b | 1.500±0.281a | 0.004 |
| 20 µmol /L小檗碱组 | 0.787±0.061 | 0.877±0.041 | 1.207±0.028a | <0.001 |
| 联合作用组 | 0.773±0.016 | 1.064±0.035a | 2.170±0.086a | <0.001 |
注:联合作用组:20 µmol/L小檗碱+5 nmol/L硼替佐米;与空白对照组比较,aP<0.01,bP<0.05;每组设3复孔,实验重复3次
四、药物对U266细胞凋亡相关蛋白表达的影响
与空白对照组比较,作用24 h及48 h后,小檗碱组、硼替佐米组和联合作用组细胞的TRADD和FADD表达水平均有所增加,小檗碱组和联合作用组差异有统计学意义(P值均<0.05),硼替佐米组差异无统计学意义(P>0.05)。小檗碱组、硼替佐米组和联合作用组各组间细胞的TRADD和FADD表达水平差异无统计学意义(P值均>0.05)(表3、图5)。
表3. Western blot法检测小檗碱和硼替佐米单独和联合作用对U266细胞凋亡相关蛋白表达的影响(x±s).
| 组别 | 作用24 h |
作用48 h |
||
| TRADD | FADD | TRADD | FADD | |
| 空白对照组 | 0.54±0.01 | 0.41±0.01 | 0.26±0.04 | 0.34±0.01 |
| 5 nmol /L硼替佐米组 | 0.55±0.01 | 0.43±0.01 | 0.28±0.01 | 0.34±0.01 |
| 20 µmol /L小檗碱组 | 0.85±0.03a | 0.75±0.01a | 0.46±0.01a | 0.72±0.03a |
| 联合作用组 | 0.91±0.01a | 0.98±0.01a | 0.70±0.01a | 0.98±0.01a |
注:联合作用组:20 µmol/L小檗碱+5 nmol/L硼替佐米;TRADD:TNF受体相关死亡结构域蛋白;FADD:Fas相关死亡结构域蛋白;与空白对照组比较,P<0.05;每组设3个复孔,实验重复3次
图5. 小檗碱与硼替佐米联合作用24 h及48 h对U266细胞凋亡相关蛋白表达的影响.
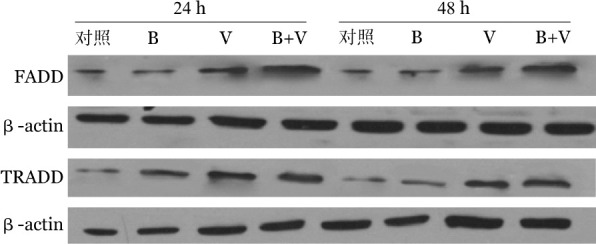
对照:未加药处理的U266细胞;B:20 µmol/L小檗碱处理组;V:5 nmol/L硼替佐米处理组;B+V:20 µmol/L小檗碱+5 nmol/L硼替佐米联合处理组;FADD:Fas相关死亡结构域蛋白;TRADD:TNF受体相关死亡结构域蛋白
讨论
尽管以硼替佐米为代表的新药联合治疗显著改善了MM患者的预后,但迄今尚无法治愈MM,患者终将出现复发、耐药直至死亡[5]。因此,临床上亟需开发新药物、寻找新策略以改善MM患者的治疗现状。
小檗碱是一种天然的生物碱类物质,可从多种医用草药中提取,临床应用已近千年,患者服用后并无明显不良反应[6]。Tegos等[7]研究显示体外培养的高分泌IL-6人食管癌细胞株YES-2细胞经小檗碱处理后细胞IL-6 mRNA表达降低,IL-6分泌明显下降,其抑制作用呈量效、时效依赖性;YES-2细胞的荷瘤裸鼠灌食小檗碱后,裸鼠血清IL-6水平明显下降,同时恶液质状态显著改善。Kim等[8]研究也显示小檗碱可抑制正常巨噬细胞IL-6的分泌,并提出这种抑制作用可能部分通过PPA-γ通路介导。另有研究表明,小檗碱可以通过活化caspase-3诱导人白血病I-3细胞凋亡,促进白血病细胞系HL-60细胞周期阻滞于G2/M期,通过Set9介导的赖氨酸甲基化抑制NF-κB核易位[9]–[11]。但目前尚未见小檗碱联合硼替佐米治疗MM的相关研究报道。
我们的结果显示在特定浓度范围内(低于24 h及48 h IC50值)的硼替佐米单药应用抗MM效应有限。经MTT法验证,5 nmol/L的硼替佐米其单药24 h抑制率仅为(11.23 ± 0.26)%,但与小檗碱(20 µmol/L)联合应用后24 h抑制率上升至(22.91 ± 2.07)%;Annexin Ⅴ/PI流式双染法检测结果证实经小檗碱单药及与硼替佐米联合作用后U266细胞的早期细胞凋亡比例明显升高。5 nmol/L硼替佐米单药6 h细胞早期凋亡率为(6.13±0.07)%,与小檗碱(20 µmol/L)联合作用后6 h细胞早期凋亡率上升至(13.91±0.09)%;经金氏公式验证可显著发挥协同抗MM效应。
在明确了小檗碱与硼替佐米在U266细胞中具有协同促凋亡效应的基础上,我们也探究了两种药物单药及联合作用的凋亡相关机制。我们从细胞凋亡的两种途径,即线粒体途径与死亡受体途径两个方面对不同组别的细胞凋亡机制进行了探究。在死亡受体通路中,目前已知的死亡受体家族成员有五个,包括TNFR、Fas、DR3、DR4、DR5。其中,最典型的死亡受体是Fas,其在介导细胞凋亡过程中可能起着重要的信号传递作用。它的DD与Fas配体(FasL)的同三聚体形式相互交联、结合成簇。之后与相应伙伴蛋白结合,其中,最重要的是FADD。FADD不仅通过其分子中的DD结构与Fas结合;同时,还可通过其死亡效应结构域(DED)与caspase的DED相互作用,TNFR1与TRADD、FADD结合,最终导致caspase-8活化,进而使caspase-3活化,引起细胞凋亡[12]。因此,为明确小檗碱与硼替佐米的协同作用是否与死亡受体外源性通路有关,我们对不同处理组U266细胞的TRADD、FADD蛋白表达水平进行了检测。结果显示,硼替佐米单药对U266细胞的TRADD、FADD的表达水平无明显影响,而小檗碱单药可明显上调TRADD、FADD的表达水平。两药联合作用于U266细胞后,TRADD、FADD表达水平不仅较空白对照组明显增加,且较小檗碱单药作用组也有所增加,说明小檗碱与硼替佐米的协同作用机制之一为使死亡受体外源性通路的活性增强而诱导细胞凋亡。
同时,我们也对不同作用组别中的凋亡相关蛋白caspase-3、caspase-8、caspase-9的活性进行了检测。结果显示硼替佐米作用于U266细胞后caspase-3、caspase-8、caspase-9的活性均显著上升,而小檗碱作用后caspase-9的活性表达未发生显著改变。表明小檗碱诱导的细胞调亡主要为通过死亡受体外源性通路来实现的,硼替佐米则可通过线粒体途径诱导细胞凋亡[13]。而小檗碱联合硼替佐米作用后U266细胞caspase-3、caspase-8、caspase-9均较对照组有明显升高,较之单药组更加显著,提示小檗碱联合硼替佐米在线粒体细胞凋亡途径方面也具有协同作用。
在本研究中,我们证实了小檗碱具有显著的抗MM效应,这可能是通过与死亡受体相关配体结合,启动了外源性细胞凋亡途径,从而诱导细胞凋亡;同时,我们还发现小檗碱联合硼替佐米可协同促进MM细胞凋亡,这种作用可能是通过上调TRADD及FADD蛋白表达水平而实现的。这为临床应用小檗碱联合硼替佐米治疗MM提供了理论依据。
References
- 1.Chen FL, Yang ZH, Liu Y, et al. Berberine inhibits the expression of TNFalpha, MCP-1, and IL-6 in AcLDL-stimulated macrophages through PPARgamma pathway[J] Endocrine. 2008;33(3):331–337. doi: 10.1007/s12020-008-9089-3. [DOI] [PubMed] [Google Scholar]
- 2.Marinova EK, Nikolova DB, Popova DN, et al. Suppression of experimental autoimmune tubulointerstitial nephritis in BALB/c mice by berberine[J] Immunopharmacology. 2000;48(1):9–16. doi: 10.1016/s0162-3109(99)00189-7. [DOI] [PubMed] [Google Scholar]
- 3.Imanshahidi M, Hosseinzadeh H. Pharmacological and therapeutic effects of Berberis vulgaris and its active constituent, berberine[J] Phytother Res. 2008;22(8):999–1012. doi: 10.1002/ptr.2399. [DOI] [PubMed] [Google Scholar]
- 4.Vuddanda PR, Chakraborty S, Singh S. Berberine: a potential phytochemical with multispectrum therapeutic activities[J] Expert Opin Investig Drugs. 2010;19(10):1297–1307. doi: 10.1517/13543784.2010.517745. [DOI] [PubMed] [Google Scholar]
- 5.Suzuki K. Current therapeutic strategy for multiple myeloma[J] Jpn J Clin Oncol. 2013;43(2):116–124. doi: 10.1093/jjco/hys215. [DOI] [PubMed] [Google Scholar]
- 6.Park KS, Kim JB, Bae J, et al. Berberine inhibited the growth of thyroid cancer cell lines 8505C and TPC1[J] Yonsei Med J. 2012;53(2):346–351. doi: 10.3349/ymj.2012.53.2.346. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Tegos G, Stermitz FR, Lomovskaya O, et al. Multidrug pump inhibitors uncover remarkable activity of plant antimicrobials[J] Antimicrob Agents Chemother. 2002;46(10):3133–3141. doi: 10.1128/AAC.46.10.3133-3141.2002. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.Kim JB, Yu JH, Ko E, et al. The alkaloid Berberine inhibits the growth of Anoikis-resistant MCF-7 and MDA-MB-231 breast cancer cell lines by inducing cell cycle arrest[J] Phytomedicine. 2010;17(6):436–440. doi: 10.1016/j.phymed.2009.08.012. [DOI] [PubMed] [Google Scholar]
- 9.Lin CC, Kao ST, Chen GW, et al. Apoptosis of human leukemia HL-60 cells and murine leukemia WEHI-3 cells induced by berberine through the activation of caspase-3[J] Anticancer Res. 2006;26(1A):227–242. [PubMed] [Google Scholar]
- 10.Lin CC, Lin SY, Chung JG, et al. Down-regulation of cyclin B1 and up-regulation of Wee1 by berberine promotes entry of leukemia cells into the G2/M-phase of the cell cycle[J] Anticancer Res. 2006;26(2A):1097–1104. [PubMed] [Google Scholar]
- 11.Hu HY, Li KP, Wang XJ, et al. Set9, NF-κB, and microRNA-21 mediate berberine-induced apoptosis of human multiple myeloma cells[J] Acta Pharmacol Sin. 2013;34(1):157–166. doi: 10.1038/aps.2012.161. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.Letasiová S, Jantová S, Miko M, et al. Effect of berberine on proliferation, biosynthesis of macromolecules, cell cycle and induction of intercalation with DNA, dsDNA damage and apoptosis in Ehrlich ascites carcinoma cells[J] J Pharm Pharmacol. 2006;58(2):263–270. doi: 10.1211/jpp.58.2.0015. [DOI] [PubMed] [Google Scholar]
- 13.Qin JZ, Ziffra J, Stennett L, et al. Proteasome inhibitors trigger NOXA-mediated apoptosis in melanoma and myeloma cells[J] Cancer Res. 2005;65(14):6282–6293. doi: 10.1158/0008-5472.CAN-05-0676. [DOI] [PubMed] [Google Scholar]