Abstract
目的
探讨慢性中性粒细胞白血病(CNL)合并多发性骨髓瘤(MM)的诊断和治疗。
方法
总结2例CNL合并MM患者的临床特征、分子生物学特点,对其诊断、治疗进行回顾性分析。
结果
2例患者均符合CNL合并MM的诊断。例1随着MM达完全缓解,中性粒细胞计数恢复正常;MM复发后,中性粒细胞计数再次升高。例1行CSF3R、SETBP1基因突变检查显示,CSF3R外显子17突变阳性(P733T),外显子14突变阴性;SETBP1基因突变阴性。应用针对MM的方案治疗后,随着MM病情的控制,CNL亦可缓解。
结论
CNL合并MM临床罕见。CSF3R基因突变对于CNL的诊断具有重要意义。CNL合并MM伴CSF3R P733T突变为国际首次报道。针对MM的方案可有效治疗CNL合并MM。
Keywords: 多发性骨髓瘤, 白血病,中性粒细胞,慢性, 基因,CSF3R
Abstract
Objective
To explored the diagnosis and treatment of chronic neutrophilic leukemia (CNL) complicated with multiple myeloma (MM).
Methods
The clinical features and molecular biological characteristics of 2 patients with CNL complicated with MM were summarized, and the diagnosis and treatment of the patients were retrospectively reviewed.
Results
The diagnosis of CNL complicated with MM was established in 2 cases. Case 1 had CSF3R mutation (P733T), but CSF3R-exon 14 mutation and SETBP1 mutation were all negative. The neutrophil count returned to normal when MM was successfully treated in case 1. When the patient relapsed, neutrophil count increased again.
Conclusion
Coexistence of CNL and MM is rare. CSF3R is a very important molecular marker for CNL. To the best of our knowledge, it's the first time to report the coexistence of CNL and MM carried CSF3R mutation (P733T). Chemotherapy regimens for MM may be effective in the treatment of CNL complicated with MM.
Keywords: Multiple myeloma; Leukemia, neutrophilic, chronic; Gene, CSF3R
慢性中性粒细胞白血病(CNL)是一种罕见的慢性骨髓增殖性肿瘤,以成熟中性粒细胞异常增殖为特征,并可与其他骨髓增殖性疾病相互转化或合并存在[1]。多发性骨髓瘤(MM)目前仍是一种无法治愈的恶性浆细胞肿瘤,其主要特征是单克隆浆细胞在骨髓内恶性增殖,并广泛浸润,引起溶骨性损害、贫血、肾衰竭、高钙血症等一系列临床表现[2]。CNL合并MM患者国内鲜有报道[3]–[5]。现报道我院诊治的2例CNL合并MM患者,并结合文献对该疾病的发病机制、诊断及治疗方法进行探讨。
病例资料
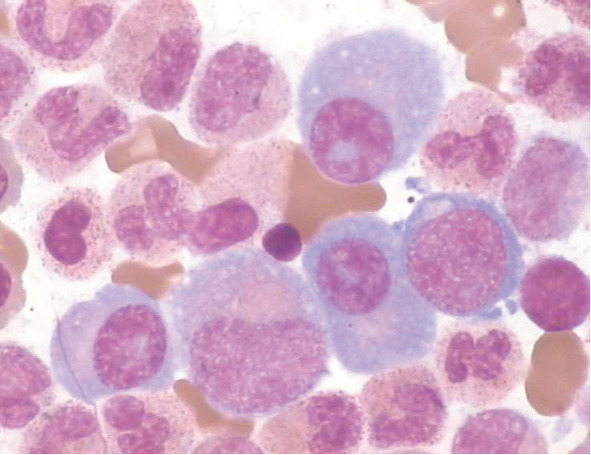
例1,男,58岁。主因“右胸带状疱疹2个月,发现白细胞增高、贫血及脾大1个月余”于2008年9月16日入我院。患者2个月前于外院诊断为带状疱疹,对症治疗后疱疹消退。此期间出现颜面及双下肢水肿。血常规:WBC 47.2×109/L,中性粒细胞占0.894, HGB 86 g/L,PLT 144×109/L。尿常规:尿蛋白(++),尿潜血(+++),RBC 8个/HP。生化检查:球蛋白46 g/L。腹部B超示肝脾大,肝脏肋缘下1.5 cm,脾脏脐下2.0 cm。口服中药后,水肿逐渐消退,但出现面色苍白。起病以来体重减轻约3 kg。入院查体:贫血貌,肝脏肋缘下及剑突下2指可及,质韧,表面光滑,无触痛,脾脏肋缘下甲乙线7 cm,甲丙线8 cm,丁戊线+2 cm,质韧,表面光滑,无触痛。既往史:15年前诊断十二指肠球部溃疡,现已愈。否认家族遗传病史。住院行相关检查:血常规:WBC 36.63×109/L,中性粒细胞占0.894,HGB 65 g/L,PLT 126×109/L。尿常规:尿蛋白(++),尿潜血(++)。24 h尿蛋白定量9.38 g。生化检查:白蛋白37.5 g/L,球蛋白45.9 g/L,Ca2+ 2.2 mmol/L,尿素氮、肌酐正常,尿酸1 143 µmol/L。血清β2微球蛋白13.6 mg/L。血维生素B12 2 535.8 pmol/L。免疫球蛋白定量:IgG 5.06 g/L,IgA 29.90 g/L。血、尿轻链:血κ轻链149.0 mg/L,血λ轻链5.89mg/L,尿κ轻链5 260 mg/L,尿λ轻链7.39 mg/L。血清免疫固定电泳:γ区可见一条单克隆IgAκ伴游离轻链κ成分。尿免疫固定电泳:γ区可见一条单克隆轻链κ成分。髂骨骨髓细胞学检查:骨髓增生极度活跃,粒系占0.705,中幼粒细胞占0.430,各阶段粒细胞易见;红系占0.080;原幼浆细胞占0.130;考虑为MM伴粒系增生骨髓象(图1)。外周血中性晚幼粒细胞占0.01,中性杆状核细胞占0.43,中性分叶核细胞占0.51。胸骨穿刺结果大致相同。中性粒细胞碱性磷酸酶(NAP):阳性率100%,积分316。骨髓流式细胞术检查:髓系原始细胞0.29%,粒细胞92.29%,单核细胞1.53%,浆细胞0.13%,浆细胞表型异常。骨髓活检示:增生极度活跃,异型浆细胞弥漫增生,免疫组化:CD138、CD38、CD56小簇状阳性;考虑MM。电镜:骨髓含大量巨大浆细胞,符合MM。染色体核型分析:46,XY[12]。FISH检测13q14基因缺失阴性。分子生物学检测:BCR-ABL融合基因P210阴性。全身骨骼X射线平扫:腰椎退行性变。超声示:脾脏长27.1 cm,厚8.4 cm,肋缘下15.5 cm×7.3 cm。诊断:①MM IgA κ型(DS分期:ⅢA期,ISS分期:Ⅲ期);②CNL。患者因经济原因,拒绝应用含有硼替佐米的化疗方案。院外先后应用MPTE方案(马法兰4 mg,每日2次,第1~5天;泼尼松40 mg,每日1次,第1~7天;沙利度胺200 mg,睡前顿服,第14~28天;依托泊苷50 mg,每日1次,第14~28天)11个疗程后复查血常规:WBC 7.81×109/L,中性粒细胞占0.716,HGB 121 g/L,PLT 160 × 109/L。骨髓浆细胞占0.050。IgA 3.63 g/L。评价疗效为接近完全缓解(nCR)。随后给予MPT方案7个疗程,仍为nCR。自2011年9月始应用沙利度胺100~150 mg/d维持治疗,2014年11月复查血常规:WBC 64.71×109/L,中性粒细胞占0.944,HGB 121 g/L,PLT 173 × 109/L。骨髓浆细胞占0.115。IgA 24.6 g/L,血κ/λ 4.57,尿κ/λ129。考虑复发。行白血病融合基因分型:JAK2 V617F阴性。融合基因BCR-ABL P190、P210、P230均阴性。染色体:47, XY,+?18[1]/46,XY[19]。染色体荧光原位杂交:P53、RB-1、IgH、CKS1B均阴性。改为TCDA方案(沙利度胺200 mg,睡前顿服,第1~28天;环磷酰胺500 mg,每日1次,第1、8、15天;地塞米松20 mg,每日1次,第1、2、8、9、15、16天;阿克拉霉素500 mg,每日2次,第1、8、15天)1个疗程、TCD方案4个疗程治疗,于2015年7月3日达部分缓解。复查血常规:WBC 25.76× 109/L,中性粒细胞占0.887, HGB 103 g/L, PLT 197× 109/L. IgA 10.4 g/L。现患者继续TCD方案维持治疗中。
图1. 例1的骨髓涂片.
2015年7月12日应用患者2014年11月25日复发时冻存标本提取的DNA行CSF3R、SETBP1基因突变检查(PCR及Sanger测序法),结果显示CSF3R外显子17突变阳性:p.P733T(第733位脯氨酸变为苏氨酸);CSF3R外显子14突变阴性(图2);SET-BP1-SKI突变检测阴性。
图2. 例1 CSF3R外显子17测序结果.
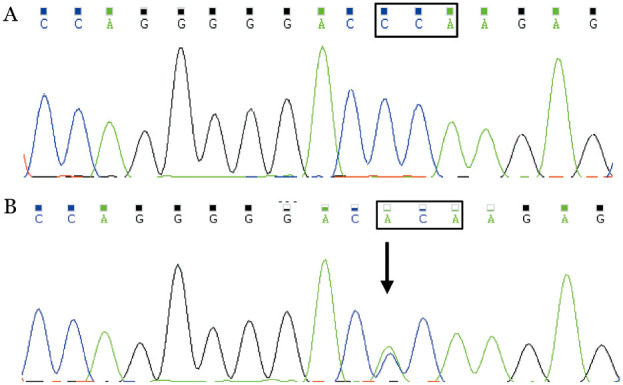
A:野生型;B:例1(箭头所示为突变位点)
例2,男,68岁。主因“发现脾大伴白细胞增高6个月,乏力1周”于2013年8月28日就诊于当地医院。无发热、骨痛及其他不适。既往高血压病史1年,规律口服硝苯地平治疗。住院行相关检查:血常规:WBC 28 × 109/L,HGB、PLT正常。B超示脾大。未在意。其后复查血常规:WBC 43.51×109/L,中性粒细胞占0. 935,HGB 116 g/L,PLT 125 × 109/L。骨髓细胞形态学:粒系占0.795,中晚幼粒细胞比例增高。NAP:阳性率85%,积分255。BCR-ABL融合基因、Ph染色体均阴性。诊断为“CNL”,给予羟基脲、碳酸氢钠、别嘌呤等治疗后,白细胞降至正常,复查腹部B超示脾脏回缩。其后患者自行停药。2014年4月18日复查骨髓细胞形态学:增生明显活跃,粒系占0.625,少数粒细胞中毒性改变,浆细胞比例增高,占0.130,建议临床排除MM。NAP积分150分。2014年5月1日因“乏力半月”再次入院。半年来体重下降10 kg。入院后查血常规:WBC 15.11 × 109/L,RBC 1.90 × 109/L,HGB 65 g/L,PLT 48×109/L。免疫球蛋白定量:IgG 5.89 g/L,IgA 13.40 g/L。血清β2微球蛋白7.89 mg/L。血免疫固定电泳:可见M蛋白带,与IgAλ形成特异性反应带。未行骨骼X线检查。诊断:①MM IgA λ型(DS分期:ⅢA期,ISS分期:Ⅲ期);②CNL。于当地针对MM进行治疗,现已失访。
讨论及文献复习
CNL是一种罕见的骨髓增殖性疾病,目前国际报道的不足200例。20%以上的CNL患者伴有其他肿瘤性疾病,多为MM。两类疾病并存的原因不明,有学者认为MM和CNL共同起源于异常的造血干细胞,其具有分化为髓系和淋巴系的潜能。Böhm等[6]发现在一些CNL患者中存在T淋巴细胞的单克隆性增殖,提示CNL中中性粒细胞的异常克隆性增殖可能起源于比髓系祖细胞分化更早期阶段。有研究发现,有些骨髓瘤细胞表面同时表达单核细胞抗原和浆细胞抗原,并提出单核细胞和浆细胞可能由一个细胞系分化而来[7]。另有学者认为,CNL实际上为MM导致的类白血病反应。骨髓瘤细胞及其产生的异常免疫球蛋白可刺激骨髓基质细胞产生大量的细胞因子,刺激粒细胞的增殖[8]。多数的学者认为中性粒细胞增多是克隆性增殖,而非类白血病反应[9]。CNL与MM的发生没有固定先后顺序,有的患者两病同时发生,有的患者CNL早于MM数月至十余年,有的则相反[9]。本文2例患者符合CNL合并MM的诊断。例1就诊时发现两种疾病同时存在,且分子生物学检测证明中性粒细胞增多为克隆性;例2先诊断为CNL,8个月后诊断为MM。
近年来分子生物学的进展为诊断CNL提供了极具价值的依据,这也是CNL与反应性粒细胞增多等其他疾病相鉴别的关键点。2013年,Maxson等[10]发现89%的CNL患者和44%的不典型慢性髓性白血病(aCML)患者存在CSF3R基因突变。主要突变位点位于近膜区,包括T618I(外显子14 T替代C)和T615A,有的患者还同时存在其他截短突变。Pardanani等[11]对临床疑诊的35例CNL患者、19例aCML患者的CSF3R基因第14~17外显子进行了测序。其中符合WHO诊断标准的CNL 12例,符合WHO诊断标准并伴有单克隆球蛋白(MG)或淋巴系统肿瘤的CNL 5例,疑诊为CNL的17例,符合WHO诊断标准的aCML 9例。12例符合WHO诊断标准的CNL患者和1例疑诊为CNL的患者均存在CSF3R突变,其他伴有MG或淋巴系统肿瘤的CNL、aCML患者CSF3R突变均为阴性。12例符合WHO诊断标准的CNL患者中10例为T618I突变,2例分别为I598I、M696T突变,1例疑诊为CNL的患者为M696T突变。4例CSF3R T618I突变者同时存在SETBP1突变。据此,CSF3R突变在符合WHO诊断标准的CNL的阳性率为100%。Pardanani等[11]同时对符合WHO诊断标准的94例慢性粒-单核细胞白血病(CMML)患者、76例原发性骨髓纤维化(PMF)患者的CSF3R基因第14~17外显子进行了测序,结果均阴性。国内崔亚娟等[12]发现6例确诊为CNL的患者均伴有CSF3R T618I突变,其中1例为CSF3R单独突变,4例合并ASXL1及SETBP1突变,1例合并CALR突变。2例意义未明单克隆免疫球蛋白血症(MGUS)伴CNL患者及4例反应性中性粒细胞增多患者均不伴有上述基因突变。这些结果表明,CSF3R T618I突变是CNL的一个高度特异和敏感的分子标志。因此Tefferi等[13]建议将WHO CNL的主要诊断标准修改为:①WBC>13× 109/L;②中性杆状核和分叶核粒细胞>80%;③有CSF3R T618I或CSF3R其他近跨膜区突变。
SETBP1基因编码蛋白是肿瘤抑制物蛋白磷酸酶2A(PP2A)的负向调节因子[14]。SETBP1的突变并非局限于某个碱基,而是集中在一个短的SKI区域,也就是从Glu858到I1e871的14个氨基酸区域。Pardanani等[11]的研究表明SETBP1基因突变有助于CNL的鉴别诊断。SETBP1突变在按WHO标准诊断的CNL患者中发生率为33%。34例临床疑诊为CNL的患者中6例合并SETBP1突变,其中的4例符合WHO CNL诊断标准。SETBP1突变者生存期短,但由于病例数少,差异没有统计学意义。
虽然多数学者认为CNL合并MM患者中中性粒细胞增多是克隆性增殖,而非类白血病反应[9]。但目前仅Nedeljkovic等[15]报道1例CNL合并MM患者伴有JAK2 V617F突变,从而证实CNL的克隆性。CNL特异性分子标志物的出现为其诊断提供了重要依据。本文例1 CSF3R外显子17突变阳性(P733T),SETBP1基因突变阴性。据我们所知,CNL合并MM伴有CSF3R P733T突变为首例报道,直接证实了CNL的克隆性。但本例CNL合并MM的CSF3R突变位点与文献报道的CNL的CSF3R常见突变位点不同,是否合并MM的CNL患者与其他CNL患者的分子生物学特点有差异,还有待进一步研究。
目前国内外尚无针对CNL合并MM的标准治疗方案。CNL的存在似乎不影响MM的预后,但有的患者可进展为急性髓系白血病,此时预后较差[9],[16]。MM的治疗一般采用新药为主的治疗方案,包括沙利度胺、硼替佐米等;非老年患者可联合造血干细胞移植。CNL的治疗药物包括羟基脲、干扰素等,但很少能获得长期缓解。体外药物试验表明:JAK抑制剂对于CSF3R近膜区突变敏感,对截短突变不敏感;达沙替尼对截短突变敏感[10]。因此对于伴CSF3R突变的CNL患者可应用上述药物。Taiwo等[17]报道了CNL合并轻链型MM的患者,应用羟基脲和硼替佐米/地塞米松后获得CR,WBC和κ/λ比例恢复正常。本文例1应用含有马法兰、沙利度胺的方案治疗后,MM得到控制,中性粒细胞也可降至正常。当MM复发后,中性粒细胞再次明显升高。故我们建议对CNL合并MM的患者应以治疗MM为主。随着MM病情的控制,CNL亦可缓解。
据此,CNL合并MM较罕见,CNL合并MM伴有CSF3R P733T突变为首次报道。治疗MM的方案可有效治疗CNL合并MM。此类患者的发病机制、治疗方案等还有待于进一步研究。
Funding Statement
基金项目:国家自然科学基金(81500098)
Fund program: National Natural Science Foundation of China(81500098)
References
- 1.陈 灏珠, 林 果为. 实用内科学[M] 14版. 北京: 人民卫生出版社; 2013. pp. 2331–2332. [Google Scholar]
- 2.陈 世伦, 于 力, 邱 录贵. 多发性骨髓瘤诊疗常规[M] 北京: 人民卫生出版社; 2012. pp. 1–2. [Google Scholar]
- 3.李 凯丽, 刘 小平, 刘 尚勤, et al. 多发性骨髓瘤合并慢性中性粒细胞白血病一例并文献复习[J] 临床内科杂志. 2014;31(10):703–705. doi: 10.3969/j.issn.1001-9057.2014.10.018. [DOI] [Google Scholar]
- 4.李 玉玲, 李 红, 覃 骏, et al. 慢性中性粒细胞白血病合并多发性骨髓瘤一例并文献复习[J] 白血病·淋巴瘤. 2011;20(5):310–312. doi: 10.3760/cma.j.issn.1009-9921.2011.05.020. [DOI] [Google Scholar]
- 5.和 虹, 钱 林生, 竺 晓凡. 慢性中性粒细胞白血病迭患多发性骨髓瘤一例[J] 临床血液学杂志. 1999;12(2):13–14. [Google Scholar]
- 6.Böhm J, Kock S, Schaefer HE, et al. Evidence of clonality in chronic neutrophilic leukaemia[J] J Clin Pathol. 2003;56(4):292–295. doi: 10.1136/jcp.56.4.292. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Grogan TM, Durie BG, Spier CM, et al. Myelomonocytic antigen positive multiple myeloma[J] Blood. 1989;73(3):763–769. [PubMed] [Google Scholar]
- 8.Dinçol G, Nalçaci M, Doğan O, et al. Coexistence of chronic neutrophilic leukemia with multiple myeloma[J] Leuk Lymphoma. 2002;43(3):649–651. doi: 10.1080/10428190290012218. [DOI] [PubMed] [Google Scholar]
- 9.Standen GR, Jasani B, Wagstaff M, et al. Chronic neutrophilic leukemia and multiple myeloma. An association with lambda light chain expression[J] Cancer. 1990;66(1):162–166. doi: 10.1002/1097-0142(19900701)66:1<162::aid-cncr2820660129>3.0.co;2-z. [DOI] [PubMed] [Google Scholar]
- 10.Maxson JE, Gotlib J, Pollyea DA, et al. Oncogenic CSF3R mutations in chronic neutrophilic leukemia and atypical CML[J] N Engl J Med. 2013;368(19):1781–1790. doi: 10.1056/NEJ-Moa1214514. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.Pardanani A, Lasho TL, Laborde RR, et al. CSF3R T618I is a highly prevalent and specific mutation in chronic neutrophilic leukemia[J] Leukemia. 2013;27(9):1870–1873. doi: 10.1038/leu.2013.122. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.崔 亚娟, 李 冰, 江 倩, et al. 慢性中性粒细胞白血病CSF3R、ASXL1、SETBP1、JAK2 V617F和CALR基因突变研究[J] 中华血液学杂志. 2014;35(12):1069–1073. doi: 10.3760/cma.j.issn.0253-2727.2014.12.005. [DOI] [PubMed] [Google Scholar]
- 13.Tefferi A, Thiele J, Vannucchi AM, et al. An overview on CALR and CSF3R mutations and a proposal for revision of WHO diagnostic criteria for myeloproliferative neoplasms[J] Leukemia. 2014;28(7):1407–1413. doi: 10.1038/leu.2014.35. [DOI] [PubMed] [Google Scholar]
- 14.Minakuchi M, Kakazu N, Gorrin-Rivas MJ, et al. Identification and characterization of SEB, a novel protein that binds to the acute undifferentiated leukemia-associated protein SET[J] Eur J Biochem. 2001;268(5):1340–1351. doi: 10.1046/j.1432-1327.2001.02000.x. [DOI] [PubMed] [Google Scholar]
- 15.Nedeljkovic M, He S, Szer J, et al. Chronic neutrophilia associated with myeloma: is it clonal?[J] Leuk Lymphoma. 2014;55(2):439–440. doi: 10.3109/10428194.2013.809080. [DOI] [PubMed] [Google Scholar]
- 16.Shi J, Ni Y, Li J, et al. Concurrent chronic neutrophilic leukemia blast crisis and multiple myeloma: A case report and literature review[J] Oncol Lett. 2015;9(5):2208–2210. doi: 10.3892/ol.2015.3043. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.Taiwo E, Wang H, Lewis R. Treatment of coexisting chronic neutrophilic leukemia and light chain multiple myeloma with hydroxyurea, bortezomib, and dexamethasone[J] Case Rep Hematol. 2014;2014:869395. doi: 10.1155/2014/869395. [DOI] [PMC free article] [PubMed] [Google Scholar]


