Abstract
目的
探讨不同血小板水平原发性骨髓纤维化(PMF)患者的临床特征及其预后。
方法
对1990年5月1日至2017年4月30日在中国医学科学院血液病医院就诊的1 305例PMF患者进行回顾性分析。
结果
1 305例PMF患者中,重度血小板减少(PLT<50×109/L)、轻度血小板减少[PLT(50~99)×109/L]、无血小板减少患者(PLT≥100×109/L)分别为320例(24.5%)、198例(15.2%)和787例(60.3%)。在血小板计数越低的组别中,HGB<100 g/L患者比例、WBC<4×109/L患者比例和外周血原始细胞≥3%患者比例、异常染色体核型患者比例和预后不良染色体核型患者比例越高(P<0.001,P<0.001,P=0.004,P<0.001,P<0.001),JAK2V617F突变阳性率越低(P<0.001)。血小板计数与脾肿大、HGB、WBC呈正相关(P值均<0.001,相关系数分别为0.131、0.445、0.156),与体质性症状和外周血原始细胞比例呈负相关(P值分别为0.009、0.045,相关系数为−0.096、−0.056)。重度血小板减少、轻度血小板减少、无血小板减少组患者中位生存时间分别为32、67、89个月(P<0.001)。血小板减少程度分组[HR=1.693(95%CI 1.320~2.173),P<0.001]和动态国际预后积分系统(DIPSS)预后分级[HR=2.051(95%CI 1.511~2.784),P<0.001]均为PMF患者独立不良预后因素。
结论
血小板计数越低的PMF患者出现贫血、白细胞减少和外周血原始细胞比例增高的比例越高、临床表现越重、预后越差,临床上应采取更加积极的治疗措施。
Keywords: 原发性骨髓纤维化, 血小板减少, 临床特征, 预后
Abstract
Objective
To evaluate clinical characteristics and prognosis of primary myelofibrosis (PMF) patients with thrombocytopenia in varied degrees.
Methods
Clinical features and survival data of 1 305 Chinese patients with PMF were retrospectively analyzed. The prognostic value of thrombocytopenia in patients with PMF was evaluated.
Results
320 subjects (47%) presented severe thrombocytopenia (PLT<50×109/L), 198 ones (15.2%) mild thrombocytopenia [PLT (50-99)×109/L] and 787 ones (60.3%) without thrombocytopenia (PLT ≥ 100×109/L). The more severe the thrombocytopenia, the higher the proportions of HGB<100 g/L, WBC<4 × 109/L, circulating blasts ≥ 3% , abnormal karyotype and unfavourable cytogenetics (P<0.001, P<0.001, P=0.004, P<0.001 and P<0.001, respectively) were observed in this cohort of patients. The more severe the thrombocytopenia, the lower the proportion of JAK2V617F positive (P<0.001) was also noticed. Platelet count was positively correlated with splenomegaly, HGB and WBC (P<0.001, correlation coefficients were 0.131, 0.445 and 0.156, respectively). Platelet count was negative correlated with constitutional symptoms and circulating blasts (P=0.009, P=0.045, respectively; correlation coefficients were -0.096 and -0.056, respectively). The median survival of patients with severe thrombocytopenia, mild thrombocytopenia and without thrombocytopenia were 32, 67 and 89 months, respectively (P<0.001). Multivariate analysis identified thrombocytopenia in varied degrees (HR=1.693, 95%CI 1.320-2.173, P<0.001) and Dynamic Internation Prognostic Scoring System (DIPSS) prognostic model (HR=2.051, 95% CI 1.511-2.784, P<0.001) as independent risk factors for survival.
Conclusion
PMF patients with severe thrombocytopenia frequently displayed anemia, leucopenia, circulating blasts and short survival, so active treatment measures should be taken especially in these patients.
Keywords: Primary myelofibrosis, Thrombocytopenia, Clinical characteristic, Prognosis
原发性骨髓纤维化(PMF)是一种Ph染色体阴性的骨髓增殖性肿瘤,为一组异质性疾病,临床表现和预后差别极大,部分患者可表现为不同程度的血细胞减少。既往研究表明,无论是在修订的动态国际预后积分系统(DIPSS-Plus)[1]还是我们提出的适用于我国患者的DIPSS-Chinese预后积分系统[2]中,PLT<100×109/L都是不良预后因素之一。本研究对1 305例PMF患者进行回顾性分析,旨在明确不同程度血小板水平患者的临床特征和预后。
病例与方法
1. 病例:1990年5月1日至2017年4月30日在我院就诊的具有完整临床资料及随访记录的1 305例PMF患者纳入研究。所有患者的诊断均符合WHO 2016诊断标准[3]。
2. 研究参数:包括患者性别、年龄等一般资料;症状、体征(可触及的肝、脾肿大)等临床表现;外周血血细胞计数和分类计数、骨髓穿刺涂片细胞形态学检查、骨髓活检病理学检查、染色体核型分析及JAK2V617F基因突变检测等实验室检查结果。
3. 预后评估:分别采用动态国际预后积分系统(DIPSS)[4]和DIPSS-Plus进行预后分组和评估,DIPSS的预后因素[4]包括:年龄>65岁,体质性症状[在诊断PMF时体重较基线下降>10%和(或)不明原因发热和(或)盗汗持续超过1个月],HGB<100 g/L,WBC>25×109/L,外周血原始细胞≥1%;DIPSS-Plus的预后因素除了包括上述5个因素外,还有PLT<100×109/L、需要红细胞输注和预后不良染色体核型[1]。
4. 随访:随访资料来源于住院病历和门诊病历。随访截止日期为2017年12月31日。对随访期间死亡的病例,根据病历记录或电话联系确认。总生存(OS)期按确诊至死亡的时间或随访截止日计算。
5. 统计学处理:应用SPSS 20.0进行数据分析。生存分析采用Kaplan-Meier法,采用Log-rank检验进行单因素分析,采用Cox回归风险模型进行多因素分析。组间率的比较采用卡方检验,两个连续变量的相关性采用Pearson检验,分类变量的相关性采用Spearman检验。双侧检验P<0.05为差异有统计学意义。
结果
1. 临床特征:1 305例PMF患者中,男718例,女587例,中位年龄55(14~89)岁;初诊时血常规(中位数):HGB 87(26~200)g/L,WBC 7.08(0.28~343.89)×109/L,PLT 147(2~2 022)×109/L。688例(52.7%)查体可触及脾肿大,466例(35.7%)伴有体质性症状。592例(45.4%)患者有染色体核型分析结果,其中163例(27.5%)为异常染色体核型,98例(16.6%)为DIPSS-Plus预后不良染色体核型。803例患者进行了JAK2V617F基因突变检测,其中451例(56.2%)患者为JAK2V617F突变阳性。
2. 不同血小板水平PMF患者临床特征比较:1 305例PMF患者按诊断时血小板计数水平分为重度血小板减少(PLT<50×109/L)、轻度血小板减少[PLT(50~99)×109/L]和无血小板减少(PLT≥100×109/L)三组,各组例数分别为320例(24.5%)、198例(15.2%)和787例(60.3%)。三组患者中,年龄>65岁患者比例(P=0.010)、有体质性症状患者比例(P=0.004)和脾肿大患者比例(P<0.001)差异有统计学意义,且在血小板计数越高的组别中,可触及性脾肿大或脾脏左肋缘下≥5 cm患者比例越高(P<0.001)。三组患者中,HGB<100 g/L患者比例、WBC>25×109/L患者比例、WBC<4×109/L患者比例(P<0.001)和外周血原始细胞≥3%患者比例(P=0.004)差异均有统计学意义;血小板计数越低的组别,HGB<100 g/L患者比例、WBC<4×109/L患者比例和外周血原始细胞≥3%患者比例越高。三组患者中,异常染色体核型患者比例、预后不良染色体核型患者比例和JAK2V617F突变阳性率差异均有统计学意义(P<0.001);血小板计数越低的组别,异常染色体核型患者比例和预后不良染色体核型患者比例越高,JAK2V617F突变阳性率越低(表1)。
表1. 不同血小板水平原发性骨髓纤维化患者的临床特征.
| 临床特征 | PLT<50×109/L(320例) | PLT(50~99)×109/L(198例) | PLT≥100×109/L(787例) | 统计量 | P值 |
| 年龄>65岁[例(%)] | 46(14.4) | 39(19.7) | 175(22.2) | 9.077 | 0.010 |
| 性别(男/女,例) | 186/134 | 112/86 | 420/367 | 2.297 | 0.321 |
| 伴体质性症状[例(%)] | 115(35.9) | 91(46.0) | 260(33.0) | 11.293 | 0.004 |
| 有可触及性脾肿大[例(%)] | 126(39.4) | 92(46.3) | 469(59.6) | 40.978 | <0.001 |
| 脾脏肋缘下≥5cm[例(%)] | 88(27.5) | 68(34.3) | 363(46.1) | 36.446 | <0.001 |
| HGB<100g/L[例(%)] | 281(87.8) | 163(82.3) | 361(45.9) | 228.380 | <0.001 |
| WBC>25×109/L[例(%)] | 22(6.9) | 22(11.1) | 126(16.0) | 18.583 | <0.001 |
| WBC<4×109/L[例(%)] | 170(53.1) | 87(43.9) | 133(16.9) | 162.758 | <0.001 |
| 外周血原始细胞≥1%[例(%)] | 68(21.3) | 39(19.7) | 138(17.5) | 2.245 | 0.325 |
| 外周血原始细胞≥3%[例(%)] | 43(13.4) | 21(10.6) | 56(7.1) | 11.198 | 0.004 |
| 异常染色体核型[阳性例数/检查例数(%)] | 61/124(49.2) | 28/83(33.7) | 74/385(19.2) | 42.049 | <0.001 |
| 不良染色体核型[阳性例数/检查例数(%)] | 43/124(34.7) | 15/83(18.1) | 40/385(11.6) | 36.161 | <0.001 |
| JAK2V617F突变[阳性例数/检查例数(%)] | 72/171(42.1) | 58/105(55.2) | 321/527(60.9) | 18.466 | <0.001 |
| DIPSS分组[例(%)] | 99.571 | <0.001 | |||
| 低危 | 20(6.3) | 10(5.1) | 212(26.9) | ||
| 中危-1 | 162(50.6) | 104(52.5) | 356(45.2) | ||
| 中危-2 | 134(41.9) | 81(40.9) | 209(26.2) | ||
| 高危 | 4(1.3) | 3(1.5) | 10(1.3) | ||
| DIPSS-Plus分组[例(%)] | 254.851 | <0.001 | |||
| 低危 | 0(0) | 0(0) | 112(29.1) | ||
| 中危-1 | 7(5.7) | 5(6.0) | 139(36.1) | ||
| 中危-2 | 66(53.2) | 59(71.1) | 127(33.0) | ||
| 高危 | 51(41.1) | 19(22.9) | 7(1.8) |
注:DIPSS:动态国际预后积分系统;DIPSS-Plus:修订的动态国际预后积分系统
3. PMF患者血小板计数与其他临床参数的相关性分析:血小板计数与体质性症状呈负相关(P=0.009,r=−0.096),血小板计数与脾肿大呈正相关(P<0.001,r=0.131);血小板计数与HGB和WBC呈正相关(P值均<0.001,r值分别为0.445、0.156),血小板计数与外周血原始细胞比例呈负相关(P=0.045,r=−0.056)。
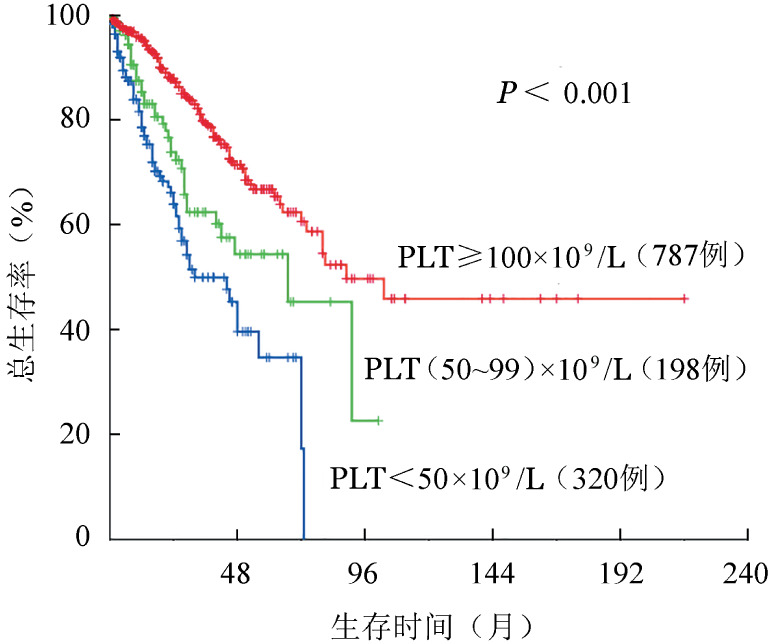
4. 血小板水平的预后意义:PLT<50×109/L组或(50~99)×109/L组与PLT≥100×109/L组比较,无论DIPSS或DIPSS-Plus预后分组,中危-2以上的患者比例均明显增高(P<0.001)(表1)。PLT<50×109/L组、(50~99)×109/L组、PLT≥100×109/L组中位生存时间分别为32、67、89个月(P<0.001)(图1)。对有预后意义的危险因素(年龄>65岁、HGB<100 g/L、WBC>25×109/L、伴体质性症状、外周血原始细胞≥3%、可触及脾肿大、DIPSS-Plus预后不良染色体核型、JAK2V617F突变、不同血小板水平分组和DIPSS预后分级)采用Cox回归风险模型分析,结果显示不同程度血小板减少分组[HR=1.693(95%CI 1.320~2.173),P<0.001]和DIPSS预后分级[HR=2.051(95%CI 1.511~2.784),P<0.001]均为独立的不良预后因素。
图1. 不同血小板水平原发性骨髓纤维化患者的生存曲线.
讨论
PMF是一类异质性疾病,临床表现多样,生存时间从数月到数年不等。对PMF患者进行准确的预后评估是制定合理治疗方案的前提。2009年和2010年,骨髓纤维化研究和治疗国际工作组(IWGMRT)先后提出适用于初诊PMF患者的国际预后积分系统(IPSS)[5]和适用于PMF病程中任一时间点的DIPSS。上述两个预后评估系统都应用年龄、体质性症状、血红蛋白水平、白细胞计数和外周血原始细胞比例进行预后评估。2010年Patnaik等[6]的研究结果表明,PLT<100×109/L亦是PMF患者的独立不良预后因素;2011年Gangat等[1]进一步研究证实了PLT<100×109/L是独立的不良预后因素,并提出了包含血小板计数在内的DIPSS-Plus预后积分系统,该系统目前已被临床广泛用于对PMF患者的预后评估。2012年我们分析了642例中国PMF患者的临床及实验室数据,证实PLT<100×109/L是中国PMF患者的独立预后因素,并据此提出适合中国PMF患者的DIPSS-Chinese预后评估系统[2](除了DIPSS的5个预后因素外,预后因素还包括PLT<100×109/L和无可触及的脾肿大)。由此可见,血小板计数在PMF患者的预后中有重要的作用,有必要对不同程度血小板减少的PMF患者临床特征及其预后进行进一步研究,为临床上不同血小板水平PMF患者的预后判断和治疗提供依据。
Hernández-Boluda等[7]对伴重度血小板减少(PLT<50×109/L)骨髓纤维化患者的临床特征进行了研究,在891例骨髓纤维化患者中,57例(6.4%)诊断时PLT<50×109/L,其中包括16例真性红细胞增多症/原发性血小板增多症后骨髓纤维化患者。在血小板重度减少的骨髓纤维化患者中,年龄>65岁的患者比例和出血事件发生率明显高于非血小板重度减少患者组;血小板重度减少组中,HGB<100 g/L或HGB<80 g/L患者比例、WBC<4×109/L患者比例、外周血原始细胞≥3%患者比例以及3级骨髓纤维化患者比例均明显高于非血小板重度减少组。但两组患者的异常染色体核型发生率和不良预后染色体核型发生率差异无统计学意义;血小板重度减少组IPSS或DIPSS-Plus中危-2和高危的患者比例明显增高,且血小板重度减少组白血病转化的发生率明显高于非血小板重度减少组。上述结果表明,重度血小板减少的骨髓纤维化患者多见于老年患者,更易出现贫血、白细胞减少、外周血原始细胞比例增高和3级骨髓纤维化,且重度血小板减少患者预后更差。
在本研究中,我们将1 305例PMF患者分为重度血小板减少(PLT<50×109/L)、轻度血小板减少[PLT(50~99)×109/L]和无血小板减少(PLT≥100×109/L)三组进行比较研究。结果表明,血小板计数越高的患者出现脾肿大和WBC>25×109/L的比例越高,血小板计数越低的患者出现贫血、WBC<4×109/L和外周血原始细胞≥3%的比例越高;且血小板计数与脾肿大、血红蛋白和白细胞计数呈正相关,与体质性症状和外周血原始细胞比例呈负相关。上述研究结果与国外基本一致,但我们的结果还表明血小板计数越低的患者出现染色体核型异常和不良染色体核型的比例越高,且血小板越低的患者中位生存时间越短,是PMF患者独立的不良预后因素。这一结果有助于我们对伴血小板减少的PMF患者作出合适的预后判断并及早采取适当的治疗措施。
总之,我们的研究结果表明,伴血小板减少的PMF患者具有更严重的临床表现和更差的预后,应该引起高度关注。最新上市的JAK抑制剂芦可替尼主要用于治疗PLT≥50×109/L的骨髓纤维化患者,大多数重度血小板减少的PMF患者不能获益,且往往被排除在一些新药的临床试验之外[8]。大多数血小板减少患者伴有不同程度贫血,应给予积极的血制品输注、红细胞生成素治疗或给予糖皮质激素联合雄激素和免疫调节剂治疗,但所有这些药物均有不足之处,目前尚未进行临床对照试验[9]–[10]。因此,如何更有效地治疗伴血小板减少的PMF患者,有待于进一步研究和探讨。
Funding Statement
基金项目:国家自然科学基金(81530008、81600098、81770129);天津市科技计划(15ZXLCSY00010);中国医学科学院医学与健康科技创新工程(2016-I2M-1-001);协和学者与创新团队发展计划
Fund Program: National Natural Science Foundation of China (81530008, 81600098, 81770129); Tianjin Science and Technology Project (15ZXLCSY00010); Innovation Project of Medical and Health Science and Technology of Chinese Academy of Medical Sciences (2016-I2M-1-001); Program for Peking Union Medical College Scholars and Innovative Research Team
References
- 1.Gangat N, Caramazza D, Vaidya R, et al. DIPSS plus: a refined Dynamic International Prognostic Scoring System for primary myelofibrosis that incorporates prognostic information from karyotype, platelet count, and transfusion status[J] J Clin Oncol. 2011;29(4):392–397. doi: 10.1200/JCO.2010.32.2446. [DOI] [PubMed] [Google Scholar]
- 2.Xu Z, Gale RP, Zhang Y, et al. Unique features of primary myelofibrosis in Chinese[J] Blood. 2012;119(11):2469–2473. doi: 10.1182/blood-2011-11-389866. [DOI] [PubMed] [Google Scholar]
- 3.Arber DA, Orazi A, Hasserjian R, et al. The 2016 revision to the World Health Organization classification of myeloid neoplasms and acute leukemia[J] Blood. 2016;127(20):2391–2405. doi: 10.1182/blood-2016-03-643544. [DOI] [PubMed] [Google Scholar]
- 4.Passamonti F, Cervantes F, Vannucchi AM, et al. A dynamic prognostic model to predict survival in primary myelofibrosis: a study by the IWG-MRT (International Working Group for Myeloproliferative Neoplasms Research and Treatment)[J] Blood. 2010;115(9):1703–1708. doi: 10.1182/blood-2009-09-245837. [DOI] [PubMed] [Google Scholar]
- 5.Cervantes F, Dupriez B, Pereira A, et al. New prognostic scoring system for primary myelofibrosis based on a study of the International Working Group for Myelofibrosis Research and Treatment[J] Blood. 2009;113(13):2895–2901. doi: 10.1182/blood-2008-07-170449. [DOI] [PubMed] [Google Scholar]
- 6.Patnaik MM, Caramazza D, Gangat N, et al. Age and platelet count are IPSS-independent prognostic factors in young patients with primary myelofibrosis and complement IPSS in predicting very long or very short survival[J] Eur J Haematol. 2010;84(2):105–108. doi: 10.1111/j.1600-0609.2009.01373.x. [DOI] [PubMed] [Google Scholar]
- 7.Hernández-Boluda JC, Correa JG, Alvarez-Larrán A, et al. Clinical characteristics, prognosis and treatment of myelofibrosis patients with severe thrombocytopenia[J] Br J Haematol. 2018;181(3):397–400. doi: 10.1111/bjh.14601. [DOI] [PubMed] [Google Scholar]
- 8.Reilly JT, McMullin MF, Beer PA, et al. Use of JAK inhibitors in the management of myelofibrosis: a revision of the British Committee for Standards in Haematology Guidelines for Investigation and Management of Myelofibrosis 2012[J] Br J Haematol. 2014;167(3):418–420. doi: 10.1111/bjh.12985. [DOI] [PubMed] [Google Scholar]
- 9.中华医学会血液学分会白血病淋巴瘤学组. 原发性骨髓纤维化诊断与治疗中国专家共识(2015年版)[J] 中华血液学杂志. 2015;36(9):721–725. doi: 10.3760/cma.j.issn.0253-2727.2015.09.001. [DOI] [Google Scholar]
- 10.Luo X, Xu Z, Li B, et al. Thalidomide plus prednisone with or without danazol therapy in myelofibrosis: a retrospective analysis of incidence and durability of anemia response[J] Blood Cancer J. 2018;8(1):9. doi: 10.1038/s41408-017-0029-4. [DOI] [PMC free article] [PubMed] [Google Scholar]


