Abstract
目的
观察髓过氧化物酶(MPO)在急性髓系白血病(AML)中的表达,探讨其与AML临床特征、基因突变、疗效和预后的关系。
方法
回顾性分析233例初诊AML患者骨髓中原始细胞MPO表达的阳性率,根据MPO表达率不同将其分为MPO低表达组(MPO≤70%)与MPO高表达组(MPO>70%),并对两组患者的临床特征、基因突变、疗效和预后进行比较。
结果
①233例AML患者中MPO低表达组121例(51.9%),MPO高表达组112例(48.1%)。NCCN预后良好组患者多为MPO高表达(χ2=32.773,P<0.001),而MPO低表达与预后不良核型相关(χ2=7.078,P=0.008)。②MPO低表达组DNMT3A基因(χ2=6.905,P=0.009)、RNA剪接复合物相关基因(SF3B1/SRSF2/U2AF1)(χ2=5.246,P=0.022)、RUNX1基因(χ2=4.577,P=0.032)、ASXL1基因(χ2=7.951,P=0.005)及TP53基因(P=0.004)突变发生率明显高于MPO高表达组,而C-KIT基因(χ2=8.936,P=0.003)及CEBPA基因(χ2=12.340,P<0.001)突变更多见于MPO高表达组,尤其CEBPA双位点突变。③MPO低表达组首次诱导治疗缓解(CR1)率为38.8%,MPO高表达组为68.1%,差异有统计学意义(χ2=15.197,P<0.001)。多因素分析显示MPO低表达是影响患者CR1的独立危险因素。④MPO低表达组患者的2年总生存(OS)率及无进展生存(PFS)率均明显低于高表达组(18.0%对89.4%和11.5%对56.7%),差异有统计学意义(χ2分别为15.212和17.016,P值均<0.001)。Cox模型多因素分析显示MPO低表达是影响患者OS及PFS的独立预后不良指标。⑤正常核型AML中,MPO低表达组患者OS和PFS差于MPO高表达组(2年OS率:31.1%对83.7%,χ2=2.895,P=0.089;2年PFS率:18.8%对45.8%,χ2=5.068,P=0.024)。
结论
不同MPO表达的AML具有独特的基因突变谱;MPO低表达是影响AML患者CR1、OS和PFS的独立危险因素,细胞化学染色检测MPO表达可能为评估AML疗效和预后提供一种简单而有效的手段。
Keywords: 白血病,髓样,急性, 髓过氧化物酶, 预后, 基因突变
Abstract
Objective
To analyze the percentage of myeloperoxidase (MPO)-positive acute myeloid leukemia (AML) blast cells, and to explore the correlation of MPO expression with the clinical features, gene alterations, therapeutic response and prognosis of AML.
Methods
The expressions of MPO in BM blasts cells of 233 newly diagnosed AML were retrospectived analyzed, they were divided into two groups using the percentage of MPO-positive blast [low (≤70%) and high (>70%)], clinical features, gene alterations, chemotherapy efficacy and prognosis were compared between the two groups.
Results
①Of the 233 patients, 121(51.9%) were in the low MPO group, and the rest 112(48.1%) in the high MPO group. Favorable-risk group according NCCN guidelines of AML was always MPO-high (χ2=32.773, P<0.001), while MPO-low was closely related to poor-risk (χ2=7.078, P=0.008); ②DNMT3A mutation (χ2=6.905, P=0.009), spliceosome genes mutation (SF3B1/SRSF2/U2AF1) (χ2=5.246, P=0.022), RUNX1 mutation (χ2=4.577, P=0.032), ASXL1 mutation (χ2=7.951, P=0.005) and TP53 mutation (P=0.004) were more likely to be seen in the low MPO group, while C-KIT mutation (χ2=8.936, P=0.003) and CEBPA mutation (χ2=12.340, P<0.001) were more frequent in the high MPO group, especially CEBPA double mutation; ③The rates of first complete remission in the low MPO group were significantly lower than that in the high MPO group (38.8% vs 68.1%, χ2=15.197, P<0.001). Multivariate analysis showed that low MPO positivity significantly affected the CR1 unfavourably. ④The overall survival (OS) and the progression-free survival (PFS) were significantly worse in the low MPO group (18.0% vs 89.4% for OS, and 11.5% vs 56.7% for PFS, P<0.001). Multivariate analysis disclosed that the low number of MPO was significantly unfavourable prognostic factor. ⑤The low MPO group still showed a worse survival even when restricted to the patients with normal karyotype, the OS and the PFS were 31.1% and 18.8% respectively.
Conclusion
AML with different MPO expression percentage had a unique gene mutation spectrum. Low expression of MPO was an independent risk factor for CR1, OS and PFS in AML patients, which may be a simple and highly significant factor for AML patients when evaluating the therapeutic efficacy and prognosis.
Keywords: Lukemia, myeloid, acute; Myeloperoxidase; Prognosis; Mutation
急性髓系白血病(AML)是一种生物学特征和临床异质性很大的疾病,既往的FAB分型系统以骨髓细胞形态学为基础,应用细胞化学染色,结合流式细胞术对AML进行分型诊断。随着基因组学的研究进展,新的WHO分型系统在FAB分型诊断基础上增加了新的预后因素,主要是根据遗传学和分子学的改变对AML进行危险度分层,以便更好地评估预后及指导临床治疗。然而,临床上仍存在部分AML患者无可见的染色体异常改变,且缺乏特征性的基因异常,此类患者多被划为预后中等组,但该群体仍存在不同的治疗反应性和预后差异性。因此,临床亟需其他简便获得的特异性标志物辅助预后判断和指导治疗。
髓过氧化物酶(MPO)又称过氧化物酶,存在于髓系细胞(主要是中性粒细胞和单核细胞)的嗜苯胺蓝颗粒中,是髓系细胞的特异性标志,MPO细胞化学染色以其简便、经济及特异性高等特点在白血病的诊断分型与鉴别诊断中起着至关重要的作用[1]–[3]。然而目前有关MPO与AML分子及遗传学特征、临床疗效和预后相关性的研究国内外少有文献报道,且所得结论存在争议。因此在本研究中,我们对233例初诊AML(M0、M3、M7除外)患者骨髓中原始细胞MPO的表达情况进行回顾性分析,以进一步探讨MPO与AML疗效和预后的相关性。
病例与方法
一、病例
2015年12月至2018年1月我院收治的初诊AML(MPO常为强阳性的M3及MPO为阴性的M0、M7除外)患者233例,所有患者均经形态学、免疫学、遗传学及分子生物学检查并确诊[4]。其中176例患者至少完成1次化疗后评估,可明确首次诱导化疗疗效。
二、白血病相关检查方法
1.MPO细胞化学染色:采用盐酸联苯胺法对骨髓细胞进行染色。计数100个原始细胞中MPO呈阳性反应的细胞,以全部阳性细胞之和计算MPO阳性率。
2.免疫学、遗传学及分子生物学检查:采用4色免疫标记法流式细胞术分析骨髓细胞免疫分型;骨髓染色体核型分析采用R显带法,参照AML NCCN指南(2017 Version3)进行危险度分组;分子生物学检测:融合基因采用实时荧光定量PCR方法;基因突变采用Illumina测序平台进行靶向测序,利用COSMIC、dbSNP、PolyPhen、SIFT等数据库和软件进行生物信息学分析,确定致病性基因突变。
三、治疗方案
诱导化疗采用标准DA(柔红霉素+阿糖胞苷)、IA(去甲氧柔红霉素+阿糖胞苷)、MA(米托蒽醌+阿糖胞苷)或CAG(阿糖胞苷+阿克拉霉素+G-CSF)方案,完全缓解(CR)后给予巩固化疗,方案为原诱导方案、中剂量或大剂量阿糖胞苷;有合适供者的预后中等或不良组患者给予异基因造血干细胞移植。
四、疗效、预后评估及随访
CR、总生存(OS)、无进展生存(PFS)等评估指标的定义参照文献[5]。采用查阅病历或电话的方式随访。随访截止时间为2018年1月31日。
五、统计学处理
X-tile软件(3.6.1版)用于确定MPO高、低表达的临界值[6]。应用SPSS 20.0软件进行统计学分析。组间比较采用t检验、χ2检验或Mann-Whiteny U检验,CR的影响因素采用非条件Logstic回归模型进行单因素及多因素分析,单因素生存分析采用Kaplan-Meier法,组间PFS、OS的比较采用Log-rank检验;采用Cox比例风险回归模型进行多因素分析。均采用双侧检验,P<0.05为差异有统计学意义。
结果
1.患者一般临床特征:基于X-tile确定的最佳临界值,我们将MPO的表达分为低表达(MPO≤70%)和高表达(MPO>70%)两个亚组(P<0.001)。233例患者中MPO低表达组121例(51.9%),MPO高表达组112例(48.1%),患者的一般临床特征分析见表1。MPO高表达组患者中位年龄为46(2~82)岁,较MPO低表达组[中位年龄54(3~92)岁]低(U=−3.293,P=0.001);两组之间FAB分型分布不同(χ2=30.638,P<0.001),其中MPO高表达组中M2患者居多(χ2=25.567,P<0.001),而单核细胞相关白血病M4/M5在MPO低表达组更多(χ2=25.667,P<0.001);两组在NCCN危险分层分布上差异也有统计学意义(χ2=35.641,P<0.001),其中预后良好组患者[AML伴inv(16)(p13q22)/CBFβ-MYH11及t(8;21)(q22;q22)/RUNX1-RUNXT1]多为MPO高表达(χ2=32.773,P<0.001),而MPO低表达与预后不良核型相关(χ2=7.078,P=0.008)。
表1. 233例初诊急性髓系白血病患者临床特征.
| 临床参数 | MPO低表达组(121例) | MPO高表达组(112例) | 统计量 | P值 |
| 性别(例,男/女) | 64/57 | 62/50 | 0.142 | 0.706 |
| 年龄[岁,M(范围)] | 54(3~92) | 46(2~82) | -3.293 | 0.001 |
| WBC[×109/L,M(范围)] | 18.22(0.69~371.58) | 14.86(0.78~429.50) | -0.184 | 0.854 |
| 骨髓原始细胞比例[M(范围)] | 0.612(0.048~0.982) | 0.528(0.100~0.960) | -1.466 | 0.143 |
| FAB分型[例(%)] | 30.638 | 0.000 | ||
| M1 | 3(2.5) | 3(2.7) | ||
| M2 | 60(49.6) | 91(81.2) | ||
| M4 | 33(27.3) | 16(14.3) | ||
| M5 | 24(19.8) | 2(1.8) | ||
| M6 | 0(0) | 0(0) | ||
| 无法分类 | 1(0.8) | 0(0) | ||
| NCCN危险度分层[例(%)] | 35.641 | 0.000 | ||
| 预后良好组 | ||||
| inv(16)(p13q22)/CBFβ-MYH11 | 3(2.5) | 6(5.4) | ||
| t(8;21)(q22;q22)/RUNX1-RUNXT1 | 4(3.3) | 34(30.4) | ||
| 预后中等组 | ||||
| 正常核型 | 79(65.3) | 53(47.3) | ||
| 其他核型 | 13(10.7) | 10(8.9) | ||
| 预后不良组 | 18(14.9) | 5(4.5) | ||
| N/A | 4(3.3) | 4(3.6) |
注:N/A:无或缺失;MPO:髓过氧化物酶
2.基因突变分析:两组患者基因突变分析结果见表2。MPO低表达组DNMT3A基因(χ2=6.905,P=0.009)、RNA剪接复合物相关基因(SF3B1/SRSF2/U2AF1)(χ2=5.246,P=0.022)、RUNX1基因(χ2=4.577,P=0.032)、ASXL1基因(χ2=7.951,P=0.005)及TP53基因(P=0.004)突变发生率较高,而C-KIT基因(χ2=8.936,P=0.003)及CEBPA基因(χ2=12.340,P<0.001)突变更多见于MPO高表达组,尤其CEBPA双位点突变(χ2=8.488,P=0.004)。两组其他基因突变(如FLT3-ITD、NPM1、TET2等)及合并基因突变的数量差异均无统计学意义(P值均>0.05)。
表2. 髓过氧化物酶(MPO)表达与急性髓系白血病基因突变的相关性[例(%)].
| 基因 | MPO低表达组(121例) | MPO高表达组(112例) | 统计量 | P值 |
| FLT3-ITD | 20(16.5) | 19(17.0) | 0.008 | 0.929 |
| NPM1 | 34(28.1) | 22(19.6) | 2.278 | 0.131 |
| C-KIT | 4(3.3) | 16(14.3) | 8.936 | 0.003 |
| CEBPA | 7(5.8) | 24(21.4) | 12.340 | 0.000 |
| CEBPAsm | 6(5.0) | 14(12.5) | 4.215 | 0.040 |
| CEBPAdm | 1(0.8) | 10(8.9) | 8.488 | 0.004 |
| DNMT3A | 16(13.2) | 4(3.6) | 6.905 | 0.009 |
| IDH1 | 11(9.1) | 8(7.1) | 0.295 | 0.587 |
| IDH2 | 8(6.6) | 13(11.6) | 1.770 | 0.183 |
| TET2 | 18(14.9) | 11(9.8) | 1.364 | 0.243 |
| EZH2 | 1(0.8) | 3(2.7) | 0.340 | 0.560 |
| RUNX1 | 9(7.4) | 1(0.9) | 4.577 | 0.032 |
| ASXL1 | 19(15.7) | 5(4.5) | 7.951 | 0.005 |
| TP53 | 9(7.4) | 0(0) | 0.004 | |
| SF | 13(10.7) | 4(3.6) | 5.246 | 0.022 |
| NRAS | 8(6.6) | 15(13.4) | 3.006 | 0.083 |
| CBL | 2(1.7) | 2(1.8) | 0.006 | 0.938 |
| ETV6 | 4(3.3) | 1(0.9) | 0.668 | 0.414 |
注:CEBPA:包括CEBPA单位点突变(CEBPAsm)及双位点突变(CEBPAdm);SF:包括RNA剪接体复合物蛋白编码基因SF3B1、SRSF2及U2AF1
3.疗效分析:共176例患者可评估疗效,MPO低表达组和MPO高表达组首次诱导缓解(CR1)率分别为38.8%(33/85)和68.1%(62/91),差异有统计学意义(χ2=15.197,P<0.001)。首次诱导未达CR者经过再诱导或多次诱导化疗后,128例患者最终达CR,两组CR率分别为50.6%(43/85)和93.4%(85/91),差异有统计学意义(χ2=40.624,P<0.001)。进一步采用非条件Logistic回归模型进行单因素(表3)及多因素分析,结果显示:年龄(≥50岁)[OR=1.973(95% CI 1.032~3.772),P=0.040]、MPO低表达[OR=3.661(95% CI 1.899~7.057),P<0.001]及FLT3-ITD突变[OR=3.287(95% CI 1.259~8.584),P=0.015]是影响患者CR1的独立危险因素。
表3. 影响急性髓系白血病患者首次诱导缓解、总生存和无进展生存的单因素分析.
| 临床参数 | 首次诱导缓解 |
总生存 |
无进展生存 |
|||
| OR(95%CI) | P值 | HR(95%CI) | P值 | HR(95%CI) | P值 | |
| 年龄(≥50岁/<50岁) | 2.370(1.291~4.348) | 0.005 | 2.830(1.330~6.021) | 0.007 | 1.799(1.150~2.815) | 0.010 |
| 性别(男/女) | 1.125(0.620~2.040) | 0.698 | 0.726(0.358~1.472) | 0.375 | 0.989(0.634~1.541) | 0.959 |
| WBC(≥20×109/L/<20×109/L) | 1.156(0.636~2.102) | 0.634 | 0.903(0.437~1.865) | 0.783 | 1.064(0.682~1.659) | 0.784 |
| 骨髓原始细胞比例 | 1.005(0.992~1.019) | 0.421 | 1.004(0.989~1.021) | 0.589 | 1.007(0.997~1.017) | 0.197 |
| NCCN危险分层预后不良 | 1.886(0.641~5.551) | 0.250 | 2.761(1.129~6.751) | 0.026 | 1.301(0.626~2.706) | 0.481 |
| MPO(≤70%/>70%) | 3.369(1.812~6.264) | 0.000 | 4.281(1.906~9.619) | 0.000 | 2.403(1.514~3.814) | 0.000 |
| FAB分型(M1/4/5/M2) | 2.087(1.117~3.899) | 0.019 | 1.140(0.552~2.353) | 0.724 | 1.409(0.902~2.200) | 0.132 |
| FLT3-ITD | 2.889(1.174~7.106) | 0.021 | 3.428(1.557~7.545) | 0.002 | 1.718(0.977~3.021) | 0.060 |
| NPM1 | 1.595(0.785~3.242) | 0.197 | 2.023(0.913~4.481) | 0.083 | 1.591(0.968~2.612) | 0.067 |
| CEBPA | 0.378(0.150~0.953) | 0.039 | 0.186(0.025~1.364) | 0.098 | 0.484(0.222~1.053) | 0.067 |
| C-KIT | 0.359(0.111~1.162) | 0.087 | 0.347(0.047~2.553) | 0.298 | 0.687(0.277~1.699) | 0.416 |
| DNMT3A | 1.189(0.399~3.545) | 0.756 | 1.603(0.480~5.357) | 0.443 | 1.568(0.752~3.266) | 0.230 |
| TP53 | 1.788(0.291~10.976) | 0.530 | 5.296(1.225~22.895) | 0.026 | 2.293(0.715~7.354) | 0.163 |
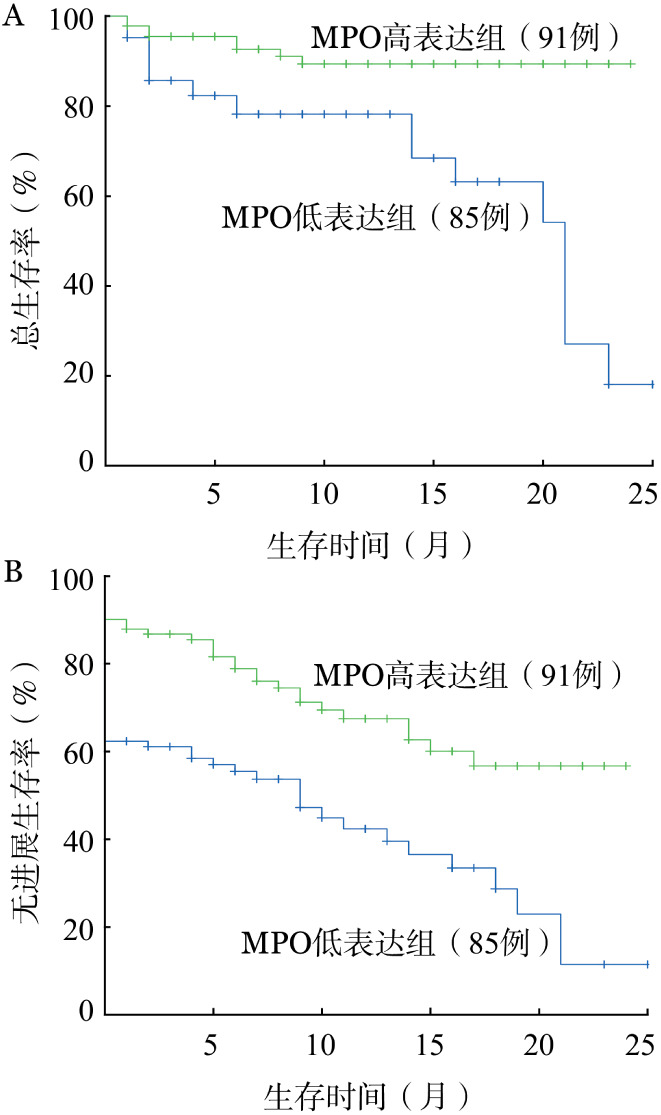
4.生存分析:176例AML患者2年OS率、PFS率分别为54.6%和34.9%,其中MPO低表达组和高表达组的2年OS率分别为18.0%、89.4%,2年PFS率分别为11.5%、56.7%,差异有统计学意义(χ2分别为15.212和17.016,P值均<0.001)(图1)。其中<60岁AML患者127例,MPO低表达组与高表达组的2年OS率分别为12.5%、93.2%,2年PFS率分别为7.8%、68.0%,差异有统计学意义(χ2分别为12.648和16.929,P值均<0.001);≥60岁AML患者49例,MPO低表达组与高表达组的2年OS率及PFS率差异均无统计学意义(33.8%对76.8%,24.1%对31.0%,χ2分别为2.692和1.903,P值均>0.05)。单因素生存分析结果见表3,Cox回归模型多因素分析显示:FLT3-ITD突变[HR=4.169(95%CI 1.833~9.482),P=0.001]、高龄[HR=2.346(95%CI 1.101~4.997),P=0.027]及MPO低表达[HR=4.643(95%CI 2.034~10.599),P<0.001]的AML患者OS更差。同样,MPO低表达[HR=2.410(95%CI 1.500~3.874),P<0.001]也是影响AML患者PFS的独立危险因素。在<60岁年龄组,MPO低表达对预后的不良影响更加显著[OS:HR=6.473(95%CI 2.109~19.869),P=0.001及PFS:HR=3.369(95%CI 1.817~6.248),P<0.001]。
图1. 髓过氧化物酶(MPO)表达对急性髓系白血病患者总生存(A)和无进展生存(B)的影响.
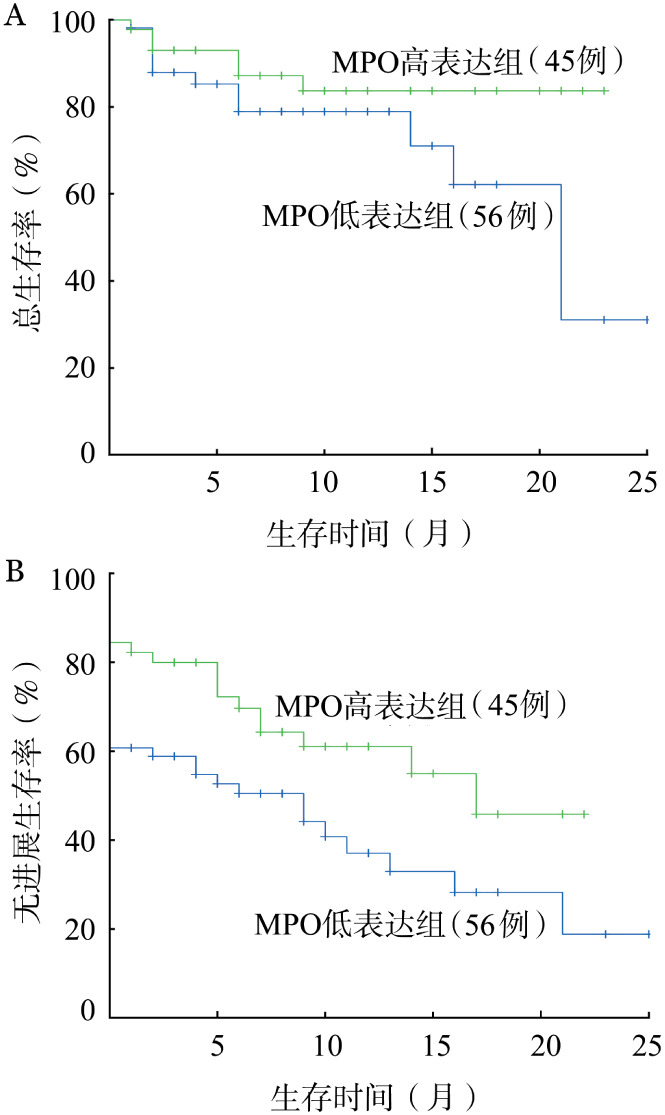
101例正常核型AML患者中,MPO低表达组OS和PFS较MPO高表达组更差[2年OS率:31.1%对83.7%,χ2=2.895,P=0.089;2年PFS率:18.8%对45.8%,χ2=5.068,P=0.024](图2)。无论<60岁或≥60岁年龄组正常核型AML,MPO低表达组的2年OS率均更低(χ2=9.179,P=0.002;χ2=5.671,P=0.017),且<60岁正常核型AML患者中两组PFS差异也具有统计学意义(χ2=15.235,P<0.001)。Cox多因素分析显示:MPO低表达是影响正常核型AML患者OS和PFS的独立预后不良因素[HR=3.002(95%CI 1.097~8.220),P=0.032;HR= 2.072(95%CI 1.150~3.736),P=0.015],尤其对正常核型<60岁AML患者更是如此[OS:HR=6.094(95%CI 1.620~22.923),P=0.008;PFS:HR=3.257(95%CI 1.673~6.341),P=0.001]。
图2. 髓过氧化物酶(MPO)表达对正常核型急性髓系白血病患者总生存(A)和无进展生存(B)的影响.
讨论
有关MPO表达与AML疗效和预后的相关性,国内外少有文献报道,且所得结论存在争议。一项ECOG研究[7]发现在AML-M1患者中,MPO低表达组CR率明显低于MPO高表达组;Advani等[8]的研究发现MPO低表达是影响初诊AML患者CR和无病生存的唯一独立危险因素;然而,也有研究认为MPO与AML患者的CR、无事件生存(EFS)和OS均不相关[9],甚至有的研究得出相反的结论[10]。
我们的研究结果显示,MPO表达与FAB分型相关,其中MPO高表达组中M2患者居多,而MPO低表达组M4/M5更多见。将所有AML患者根据NCCN指南进行危险度分层后发现MPO在三组中表达存在差异:预后良好组多为MPO高表达,而MPO低表达与预后不良核型相关。上述结果与Roberson等[9]和Kamijo等[11]的研究相似。
根据MPO表达的不同对初诊AML进行基因突变分析,我们发现MPO高表达组C-KIT及CEBPA基因突变更常见,尤其CEBPA双位点突变,而MPO低表达组DNMT3A及ASXL1基因突变比例较高,尤其所有9例TP53基因突变者均为MPO低表达。Tominaga-Sato等[12]在60例初诊正常核型AML患者中的研究发现CEBPA双位点突变与MPO高表达相关;Kamijo等[11]对164例初诊AML患者进行51种基因的靶向测序发现:MPO高表达组AML更易发生KIT基因及CEBPA基因双位点突变,而DNMT3A、TP53基因更常见于MPO低表达组,与本研究结论一致。除此之外,本研究我们还发现MPO低表达与RNA剪接复合物相关基因(SF3B1/SRSF2/U2AF1)及RUNX1基因突变相关(P值分别为0.022和0.032)。伴RNA剪接复合物相关基因突变的AML患者在Papaemmanuil等[13]的研究中被单独归为伴有染色质和(或)剪接调控子基因突变的AML,此类患者多为老年,初诊时白细胞及幼稚细胞较少,且对化疗反应不敏感、复发率高,预后差。RUNX1基因突变与AML不良预后相关,Mendler等[14]研究显示正常核型AML中RUNX1基因突变者极少伴随预后良好基因NPM1及CEBPA突变,其CR、OS及EFS率较RUNX1野生型者更低。
临床疗效方面,Kamijo等[10]的研究显示MPO高表达组诱导缓解率更高(86.0%对68.4%,P=0.013);Matsuo等[3]研究发现MPO低表达组患者的CR率明显低于高表达组(64.1%对85.4%,P=0.001),并且多因素分析MPO低表达仍然是影响CR的独立危险因素。我们的研究结果与其一致。以上结果提示:临床可根据初诊时MPO的表达来快速区分具有诱导化疗失败高风险的AML患者,以便对此类患者尽早给予强化治疗干预。MPO高表达与高的CR率相关可能有以下原因:MPO高表达可以增加原幼细胞对化疗药物如阿糖胞苷的敏感性[15];原幼细胞中MPO mRNA表达可以反映与化疗敏感性和预后相关的遗传学特征:MPO高表达多为预后良好核型AML,而MPO低表达与预后不良核型及伴多系病态造血的AML相关[16]。
生存分析结果显示,MPO高表达组OS及PFS率均明显优于MPO低表达组。Cox模型多因素分析证实MPO低表达是影响患者OS及PFS的独立预后不良因素。这与Matsuo等[3]及Advani等[8]的研究结果一致。为进一步明确MPO表达的预后价值,我们对其中的101例正常核型AML患者进行亚组分析,发现MPO低表达降低了正常核型AML患者的OS和PFS率。Matsuo等[3]的研究也证实即使在预后中危组和正常核型组AML,MPO低表达均预示不良的OS和PFS,而MPO高表达的正常核型AML甚至达到了与预后良好核型组相似的OS。MPO低表达对AML预后的不良影响尤其体现在<60岁年龄组患者,MPO低表达是影响该人群、尤其该人群中正常核型AML患者OS和PFS的独立危险因素。然而,MPO表达在老年AML中的预后价值可能有限,究其原因,可能与老年AML独特的生物学特性如遗传及分子学预后不良因素比例高、化疗耐受性差、多药耐药及治疗相关病死率高等相关。
综上所述,AML患者MPO表达率不同,其基因突变谱亦不相同;MPO表达对评估初诊AML疗效与预后具有重要意义。细胞化学染色检测MPO表达可能作为判断AML预后及指导临床治疗决策的一种简便易行的手段。
Funding Statement
基金项目:河南省医学科技攻关项目(201403186)
Fund program: Key Program of Medical Technologies of Henan Province (201403186)
References
- 1.Bennett JM, Catovsky D, Daniel MT, et al. Proposed revised criteria for the classification of acute myeloid leukemia. A report of the French-American-British Cooperative Group[J] Ann Intern Med. 1985;103(4):620–625. doi: 10.7326/0003-4819-103-4-620. [DOI] [PubMed] [Google Scholar]
- 2.Arber DA, Orazi A, Hasserjian R, et al. The 2016 revision to the World Health Organization classification of myeloid neoplasms and acute leukemia[J] Blood. 2016;127(20):2391–2405. doi: 10.1182/blood-2016-03-643544. [DOI] [PubMed] [Google Scholar]
- 3.Matsuo T, Kuriyama K, Miyazaki Y, et al. The percentage of myeloperoxidase-positive blast cells is a strong independent prognostic factor in acute myeloid leukemia, even in the patients with normal karyotype[J] Leukemia. 2003;17(8):1538–1543. doi: 10.1038/sj.leu.2403010. [DOI] [PubMed] [Google Scholar]
- 4.中华医学会血液学分会白血病淋巴瘤学组. 成人急性髓系白血病(非急性早幼粒细胞白血病)中国诊疗指南(2017年版)[J] 中华血液学杂志. 2017;38(3):177–182. doi: 10.3760/cma.j.issn.0253-2727.2017.03.001. [DOI] [Google Scholar]
- 5.Cheson BD, Bennett JM, Kopecky KJ, et al. Revised recommendations of the International Working Group for Diagnosis, Standardization of Response Criteria, Treatment Outcomes, and Reporting Standards for Therapeutic Trials in Acute Myeloid Leukemia[J] J Clin Oncol. 2003;21(24):4642–4649. doi: 10.1200/JCO.2003.04.036. [DOI] [PubMed] [Google Scholar]
- 6.Camp RL, Dolled-Filhart M, Rimm DL. X-tile: a new bio-informatics tool for biomarker assessment and outcome-based cut-point optimization[J] Clin Cancer Res. 2004;10(21):7252–7259. doi: 10.1158/1078-0432.CCR-04-0713. [DOI] [PubMed] [Google Scholar]
- 7.Matsuo T, Cox C, Bennett JM. Prognostic significance of myeloperoxidase positivity of blast cells in acute myeloblastic leukemia without maturation (FAB: M1): an ECOG study[J] Hematol Pathol. 1989;3(4):153–158. [PubMed] [Google Scholar]
- 8.Advani SH, Hegde UP, Iyer RS, et al. Prognostic significance of myeloperoxidase containing blast cells in acute myelogenous leukaemia[J] Indian J Med Res. 1993;98:8–14. [PubMed] [Google Scholar]
- 9.Roberson JR, Onciu M, Pounds S, et al. Prognostic significance of myeloperoxidase expression in childhood acute myeloid leukemia[J] Pediatr Blood Cancer. 2008;50(3):542–548. doi: 10.1002/pbc.21258. [DOI] [PubMed] [Google Scholar]
- 10.Suĭć M, Boban D, Marković-Glamocak M, et al. Prognostic significance of cytochemical analysis of leukemic M2 blasts[J] Med Oncol Tumor Pharmacother. 1992;9(1):41–45. doi: 10.1007/BF02989652. [DOI] [PubMed] [Google Scholar]
- 11.Kamijo R, Itonaga H, Kihara R, et al. Distinct gene alterations with a high percentage of myeloperoxidase-positive leukemic blasts in de novo acute myeloid leukemia[J] Leuk Res. 2018;65:34–41. doi: 10.1016/j.leukres.2017.12.006. [DOI] [PubMed] [Google Scholar]
- 12.Tominaga-Sato S, Tsushima H, Ando K, et al. Expression of myeloperoxidase and gene mutations in AML patients with normal karyotype: double CEBPA mutations are associated with high percentage of MPO positivity in leukemic blasts[J] Int J Hematol. 2011;94(1):81–89. doi: 10.1007/s12185-011-0883-y. [DOI] [PubMed] [Google Scholar]
- 13.Papaemmanuil E, Gerstung M, Bullinger L, et al. Genomic classification and prognosis in acute myeloid leukemia[J] N Engl J Med. 2016;374(23):2209–2221. doi: 10.1056/NEJMoa1516192. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Mendler JH, Maharry K, Radmacher MD, et al. RUNX1 mutations are associated with poor outcome in younger and older patients with cytogenetically normal acute myeloid leukemia and with distinct gene and MicroRNA expression signatures[J] J Clin Oncol. 2012;30(25):3109–3118. doi: 10.1200/JCO.2011.40.6652. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.Sawayama Y, Miyazaki Y, Ando K, et al. Expression of myeloperoxidase enhances the chemosensitivity of leukemia cells through the generation of reactive oxygen species and the nitration of protein[J] Leukemia. 2008;22(5):956–964. doi: 10.1038/leu.2008.8. [DOI] [PubMed] [Google Scholar]
- 16.Taguchi J, Miyazaki Y, Tsutsumi C, et al. Expression of the myeloperoxidase gene in AC133 positive leukemia cells relates to the prognosis of acute myeloid leukemia[J] Leuk Res. 2006;30(9):1105–1112. doi: 10.1016/j.leukres.2005.12.012. [DOI] [PubMed] [Google Scholar]


