Abstract
目的
探讨酪氨酸激酶抑制剂(TKI)时代,慢性髓性白血病(CML)病程演进与细胞遗传学的关系。
方法
应用骨髓细胞短期培养法,对387例初诊CML患者行染色体G显带技术核型分析,结合ABL激酶区点突变检测分析细胞遗传学变化与CML病程演进的关系。
结果
间接荧光原位杂交(FISH)技术检测387例CML患者BCR-ABL融合基因阳性,其中Ph+CML占94.1%(364/387),Ph− CML占5.9%(23/387);标准易位t(9; 22)(q34;q11)320例(87.9%),变异易位5例(1.4%),初诊Ph+合并额外染色体异常(ACA)39例(10.7%)。合并ACA中“主要路径”异常22例(56.4%),“次要路径”异常15例(38.5%),−Y异常2例(5.1%)。23.4%(71/303)标准易位患者在TKI治疗中出现ACA,主要为染色体数目异常,此类患者疾病进展比例高(χ2=168.21,P<0.001)、更易合并点突变(χ2=29.04,P<0.001)。初诊CML慢性期合并ACA患者与标准易位患者相比,有较低的无事件生存(EFS)及无病生存(DFS)率(P值分别为0.037和0.003),但总生存(OS)率差异无统计学意义(P=0.209)。CML慢性期患者TKI治疗过程中出现ACA者与无ACA者相比,OS、EFS、DFS率均降低(P值均<0.001)。进展期合并ACA患者长期生存率下降(P=0.086)。
结论
CML在病程演进中往往合并ACA,此类患者更易发生不良事件或疾病进展,在TKI治疗过程中规律、及时行染色体核型分析及点突变检测对疗效评估及预后判断具有重要意义。
Keywords: 白血病,髓系,慢性,BCR-ABL阳性, 费城染色体, 额外染色体异常, 点突变
Abstract
Objective
To analyze the association of cytogenetic abnormalities with the prognosis of chronic myeloid leukemia (CML) patients in tyrosine kinase inhibitors (TKI) era.
Methods
Karyotype analysis of chromosome G-banding was carried out in 387 newly diagnosed CML patients by short-term culture of bone marrow cells. The correlation of cytogenetic abnormalities and CML progression was explored in combination with ABL tyrosine point mutations.
Result
Of 387 patients with positive BCR-ABL fusion gene assayed by fluorescence in situ hybridization (FISH) technique, 94.1% (364/387) patients were Ph positive and 5.9% (23/387) Ph negative; 320 patients (87.9%) had a translocation t(9;22) (q34;q11) and 5 (1.4%) a variant translocation t (v;22). Additional cytogenetic aberrations (ACA) at diagnosis were found in 10.7% (39/387) Ph+ patients, major route ACA in 22 (56.4%) cases and minor route ACA in 15 (38.5%) cases and 2 patients (5.1%) lacked the Y chromosome (−Y); 23.4% (71/303) patients occurred ACA during TKI treatment and the most frequent abnormalities were abnormal chromosome numbersd, which were likely associated with high proportion of disease progression (χ2=168.21, P<0.001) and ABL tyrosine point mutations (χ2=29.04, P<0.001). Newly diagnosed CML-CP patients with t(9;22) (q34;q11) had a longer event-free survival (EFS) and disease-free survival (DFS) rates than that of patients with ACA (P=0.037; P=0.003), while the overall survival (OS) had no significant differences (P=0.209). As for CML-CP patients that occurred ACA during TKI therapy would have a marked low OS, EFS and DFS (all P<0.001) compared with no ACA occurred patients. Survival of advanced patients that occurred ACA were dramatically reduced.
Conclusion
ACA often emerged during the disease progress in CML patients, regular and timely detection of chromosomes karyotype and ABL tyrosine point mutations during TKI treatment was important for therapeutic evaluation, progress and prognosis of CML.
Keywords: Leukemia, myelogenous, chronic, BCR-ABL positive; Philadelphia chromosome; Additional cytogenetic aberrations; Point mutations
慢性髓性白血病(CML)是一种起源于造血干细胞的血液系统恶性疾病,Ph染色体[t(9;22)(q34;q11)]是其特征性细胞遗传学标志,存在于90%~95%CML患者中[1]。额外染色体异常(ACA)是CML病程演进中出现的额外或多重细胞遗传学改变[2]。ACA在初诊CML慢性期患者中的发生率为5%~10%,在急变期患者中则上升至60%~80%,往往预示疾病进展[1],[3]。以伊马替尼为代表的酪氨酸激酶抑制剂(TKI)的广泛应用,使绝大多数CML慢性期患者的生存和生活质量得到改善。TKI治疗过程中,ACA的出现与CML耐药及病程演进密切相关[4]。我们通过回顾性分析我院387例CML患者在TKI治疗过程中的细胞遗传学及ABL激酶区点突变资料,旨在分析细胞遗传学变化与CML病程演变的关系。
病例与方法
1.病例资料:2007年1月至2014年12月于我院血液科就诊的387例应用TKI治疗的CML患者纳入研究。间接荧光原位杂交(FISH)技术检测BCR-ABL融合基因均为阳性。其中男254例(65.6%),女133例(34.4%),中位年龄36(15~80)岁。中位随访时间42.5(2.0~120.5)个月。CML的诊断、分期及疗效评价参照《血液病诊断及疗效标准》[5]。
2.染色体核型分析:染色体制备采用骨髓细胞直接法或24 h短期培养法,常规染色体G显带技术分析核型,所有标本分析细胞数至少为20个。核型异常参照《人类细胞遗传学国际命名体制(2013)》的有关规定进行描述。ACA中,常见异常如+8、+Ph[+der(22)t(9; 22)(q34; q11)]、等臂17[ⅰ(17)(q10)]、+19及ider(22)(q10)t(9; 22)(q34;q11)称为“主要路径”异常[3]。其他少见的染色体异常称为“次要路径”异常。
3.FISH法检测BCR-ABL基因:融合基因探针(双色双融合探针)购自美国Abbott公司,BCR探针显绿色荧光信号,ABL探针显红色信号。实验步骤参照产品说明书。在荧光显微镜下,同一视野下采用两种滤片分别观察杂交信号。每例患者标本用计算机成像系统分析间期细胞200个。
4.ABL激酶区点突变检测:采集外周血或骨髓标本,以EDTA抗凝,用淋巴细胞分离液分离单个核细胞,采用TRIzol试剂提取总RNA。逆转录合成体系及PCR试剂购自日本TaKaRa公司,具体步骤参见产品说明书。巢式PCR扩增ABL激酶区第237~486位氨基酸片段,终产物864 bp,对PCR产物进行10 g/L琼脂糖凝胶电泳分析。阳性结果送至上海英骏生物技术有限公司进行分析,测序结果应用chroma软件分析。
5.疗效分析:总生存(OS)时间指自接受治疗开始至患者死亡或随访终止;无事件生存(EFS)时间指自接受治疗开始,至进展为加速期或急变期,发生血液学或细胞遗传学复发,任何原因导致TKI停药、死亡或随访终止等事件发生日期为止;无病生存(DFS)时间指从获得完全缓解到复发或死亡或末次随访之日。
6.统计学处理:采用SPSS 18.0软件进行统计学分析,两组之间均数比较应用独立样本t检验;率的比较采用χ2检验或Fisher确切概率法。生存分析采用Kaplan-Meier法,两组之间比较采用Log-rank检验。P<0.05为差异有统计学意义。
结果
一、初诊CML患者合并ACA情况及其对生存的影响
1.初诊CML患者染色体核型特征:387例初诊CML患者,慢性期352例(90.9%),加速期8例(2.1%),急变期27例(7.0%)。Ph+CML 364例(94.1%),Ph−CML 23例(5.9%)。Ph+CML中,标准易位t(9; 22)(q34;q11)320例(87.9%);变异易位5例(1.4%),均为复杂变异易位;Ph+CML合并ACA 39例(10.7%)。Ph−CML患者中,17例(73.9%)为正常核型,Ph−合并其他染色体异常者6例(26.1%)。39例初诊Ph+CML合并ACA患者中,−Y者2例(5.1%),−Y以外的染色体异常37例,其中,“主要路径”异常22例(56.4%),包括:der(22)t(9; 22)(q34;q11)10例,+8 7例,i(17q)3例,+Ph 2例;“次要路径”异常15例(38.5%),包括:平衡易位6例,复杂变异3例,−7、+17各1例,其他染色体结构异常4例。
2.ACA伴ABL激酶区点突变情况:39例初诊合并ACA及5例变异易位患者中,慢性期24例,进展期20例;1例慢性期、6例进展期患者放弃治疗。可随访的患者37例,7例进展期患者在初诊时行ABL激酶区点突变检测,3例点突变阳性,包括E459K、C475Y、M351T各1例。
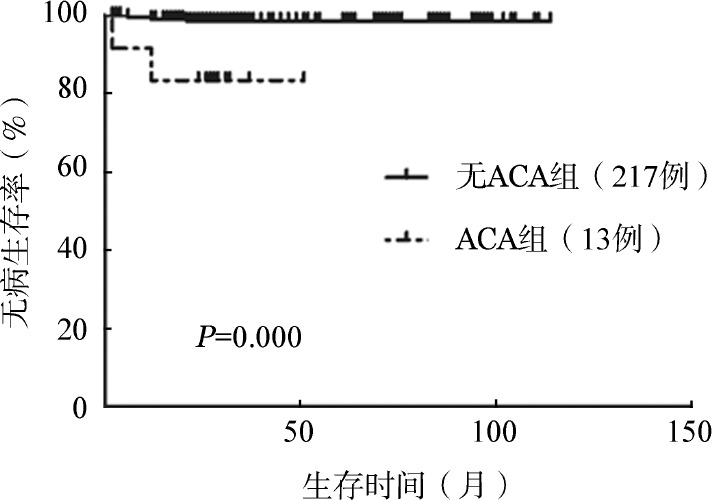
3.初诊CML合并ACA对生存的影响:接受随访的标准易位患者320例,其中慢性期305例,进展期15例;合并ACA患者37例,其中慢性期23例,进展期14例。慢性期患者与进展期患者相比,ACA发生率差异有统计学意义(7.3%对57.1%,χ2=73.971,P<0.001)。慢性期患者诊断时基本特征见表1,标准易位组与合并ACA组相比性别、年龄、WBC、PLT、EUTOS评分差异均无统计学意义(P值均>0.05)。两组完全血液学反应(CHR)率分别为97.7%和95.7%(Fisher确切概率法,P=0.445),治疗12个月时完全细胞遗传学反应(CCyR)率分别为77.4%和65.2%(χ2=1.760,P=0.185),差异均无统计学意义。累计总的CCyR率分别为88.5%和73.9%(χ2=4.175,P=0.041),累计总的主要分子学反应(MMR)率分别为84.6%和65.2%(χ2=5.751,P=0.016),差异有统计学意义。进一步比较两组长期生存,累计3年OS率分别为93.9%和87.1%(P=0.209);累计3年EFS率分别为71.1%和53.6%(P=0.037);累计3年DFS率分别为81.0%和62.5%(P=0.003)(图1,图2,图3)。
表1. Ph+慢性髓性白血病慢性期患者诊断时基本临床特征.
| 病例特征 | 标准易位组(305例) | 合并ACA组(包含变异易位)(24例) | 检验值 | P值 |
| 性别[例(%)] | 0.308a | 0.579 | ||
| 男 | 199(65.2) | 17(70.8) | ||
| 女 | 106(34.8) | 7(29.2) | ||
| 年龄[岁,M(范围)] | 36(16~69) | 35(11~70) | 0.283b | 0.782 |
| WBC[×109/L,M(范围)] | 212.94(5.49~808.00) | 193.97(8.40~513.66) | 0.338b | 0.734 |
| PLT[×109/L,M(范围)] | 611(91~3 065) | 416(24~1 226) | 0.945b | 0.264 |
| EUTOS评分[例(%)] | 0.263c | |||
| 低 | 278(91.1) | 20(83.3) | ||
| 高 | 27(8.9) | 4(16.7) |
注:a为χ2值,b为t值,c采用Fisher确切概率法
图1. 慢性髓性白血病慢性期患者标准易位和合并额外染色体异常(ACA)组总生存比较.
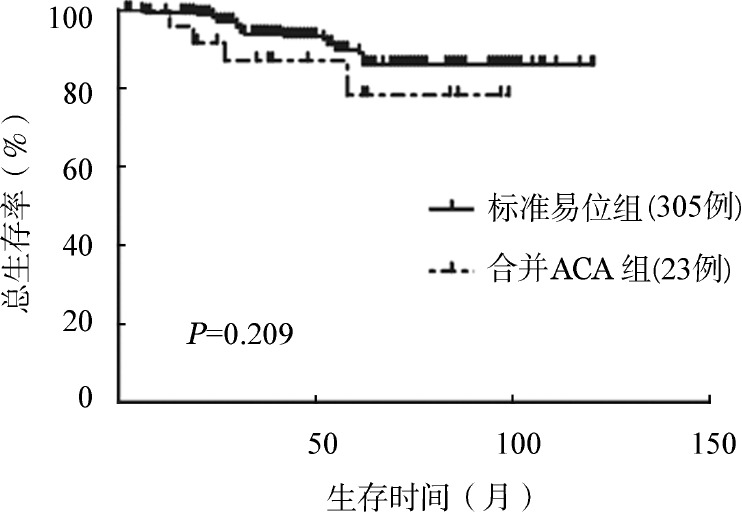
图2. 慢性髓性白血病慢性期患者标准易位和合并额外染色体异常(ACA)组无事件生存比较.
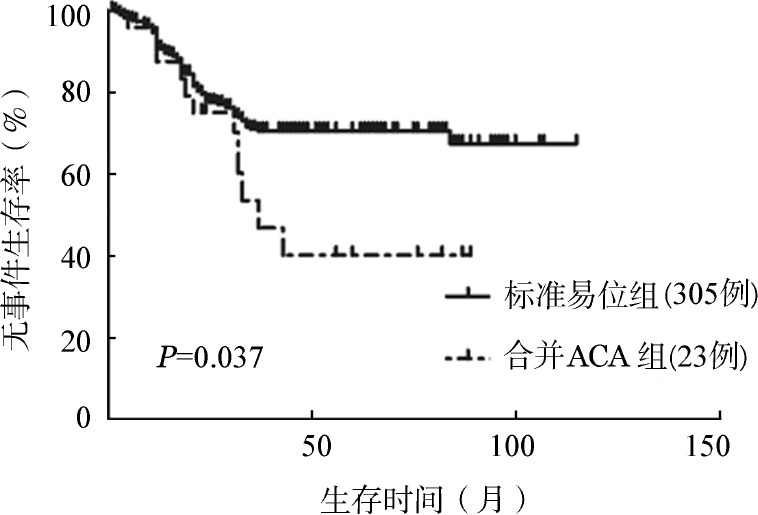
图3. 慢性髓性白血病慢性期患者标准易位和合并额外染色体异常(ACA)组无病生存比较.
进展期患者(标准易位15例,合并ACA 14例)中,8例加速期患者选择转换TKI治疗,4例在治疗过程中进展为急变期,中位时间5(2~11)个月。21例急变期患者,1例放弃治疗,2例患者因严重肺部感染而死亡,9例选择异基因造血干细胞移植(allo-HSCT),5例(55.6%)在移植后12个月处于CCyR状态;另外9例未接受移植患者,在治疗后2年内因疾病进展或严重并发症而死亡。
二、TKI治疗CML过程中ACA的发生情况及对生存的影响
1.TKI治疗CML过程中ACA发生类型和频率:320例初诊标准易位患者,17例失访;随访的303例患者中,232例(76.6%,慢性期217例,进展期15例)无ACA发生,71例(23.4%)出现ACA。出现ACA患者中CML慢性期占18.3%(13例),类型包括:−Y(2例)、−17(3例)、−6(2例)、−5(1例)、变异易位(3例)、+8(2例);CML进展期占81.7%(58例),类型包括:复杂变异(11例)、−Y(8例)、−17(6例)、−5(8例)、+Ph(6例)、+8(5例)、−7(5例)、−6(4例)、der(22)t(9; 22)(q34;q11)(3例)、−21(2例)。仍处于慢性期患者与出现疾病进展患者相比,ACA发生率差异有统计学意义(5.7%对79.5%,χ2=168.213,P<0.001)。ACA患者与无ACA患者相比,前者更易出现疾病进展(81.7%对6.5%,χ2=168.21,P<0.001)。
2.ACA伴ABL激酶区点突变情况:71例TKI治疗过程中出现ACA的患者中,5例进展期患者放弃治疗;3例合并脑出血、多器官功能衰竭死亡;随访的63例患者(慢性期13例,进展期50例),29例(46.0%)ABL激酶区点突变检测阳性,其中慢性期5例(38.5%),进展期24例(48.0%)。慢性期患者与进展期患者相比,突变发生率差异无统计学意义(χ2=0.378,P=0.539)。232例无ACA患者,34例(14.7%)合并ABL激酶区点突变,与ACA组相比,突变发生率差异有统计学意义(χ2=29.04,P<0.001)。
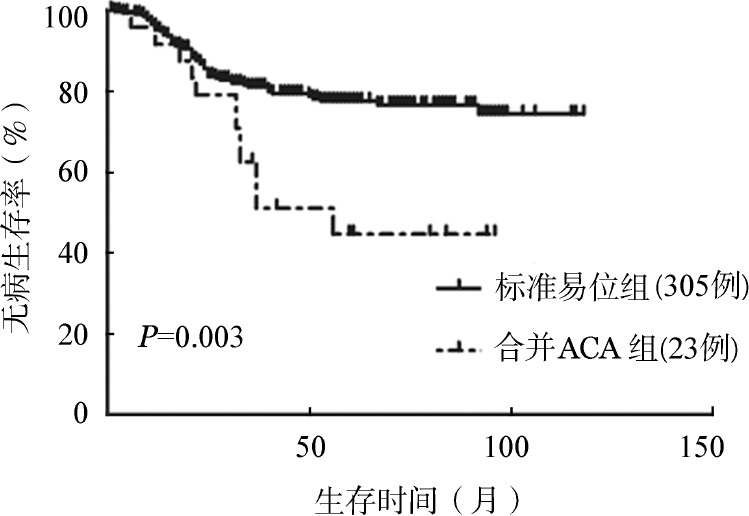
3.TKI治疗CML过程中出现的ACA对生存的影响:可随访的63例治疗过程中出现ACA患者中,13例慢性期患者应用TKI治疗,治疗12个月后9例(69.2%)获得CCyR,与217例TKI治疗过程中无ACA的慢性期患者相比,两组CCyR率差异无统计学意义(69.2%对78.8%,Fisher确切概率法,P=0.487)。进一步比较两组长期生存,累计3年OS率分别为84.6%和98.9%(P<0.001),累计3年EFS率分别为41.7%和92.9%(P<0.001),累计3年DFS率分别为83.3%和98.5%(P<0.001),差异均有统计学意义(图4,图5,图6)。
图4. 慢性髓性白血病慢性期患者酪氨酸激酶抑制剂治疗过程中出现与未出现额外染色体异常(ACA)组总生存(OS)比较.

图5. 慢性髓性白血病慢性期患者酪氨酸激酶抑制剂治疗过程中出现与未出现额外染色体异常(ACA)组无事件生存比较.
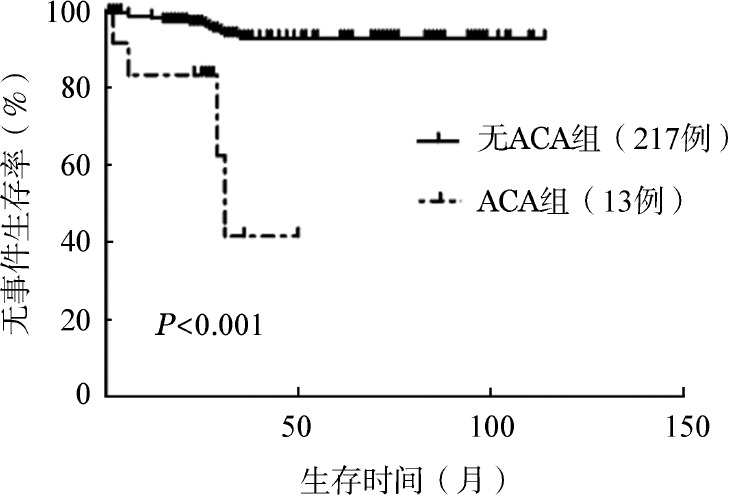
图6. 慢性髓性白血病慢性期患者酪氨酸激酶抑制剂治疗过程中出现与未出现额外染色体异常(ACA)组无病生存比较.
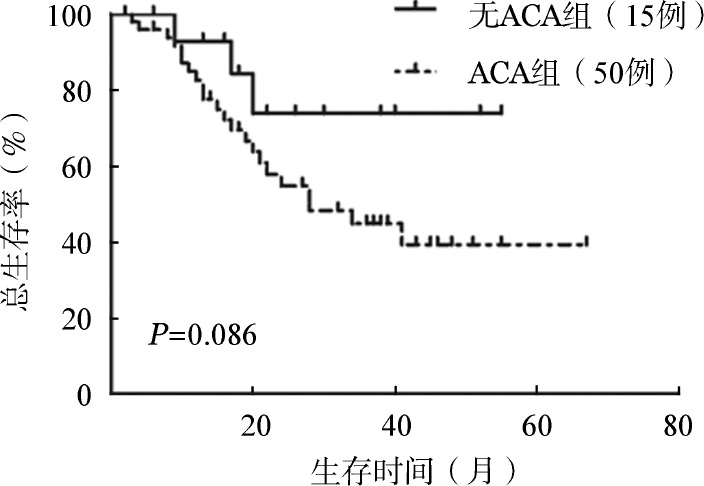
50例进展期且治疗过程中出现ACA患者,26例接受allo-HSCT,24例采用TKI联合化疗或转换TKI治疗,15例(30.0%)在治疗12个月时获得CCyR,与15例进展期无ACA患者相比,两组CCyR率差异无统计学意义(30.0%对46.7%,χ2=1.431,P=0.232)。进一步比较两组长期生存,进展期出现ACA患者累计OS率更低(39.3%对73.9%,P=0.086)(图7)。
图7. 慢性髓性白血病接受酪氨酸激酶抑制剂治疗患者进展期出现与未出现额外染色体异常(ACA)组总生存比较.
讨论
以伊马替尼为代表的TKI推广及allo-HSCT方案的优化应用,将CML变为一种可长期管理的慢性疾病,但仍有部分患者难以从目前的治疗中获益。越来越多的研究证实,ACA的出现与CML病程的进展密切相关,如何尽早优化此类患者的治疗方案,成为目前国内外学者研究的焦点。CML病程中,初诊CML合并ACA者常见“主要路径”异常改变。本研究中,387例初诊CML患者,Ph+CML占94.1%,合并ACA者占10.7%,其中“主要路径”异常占56.4%。与文献[6]报道相一致。另外,23.4%的标准易位患者在治疗过程中出现ACA,CML慢性期患者主要为染色体数目异常,进展期患者除染色体数目改变外,更易伴“主要路径”异常及复杂核型异常。与文献[7]报道相比,本组患者治疗过程中ACA的发生率较高,且复杂变异、−17、−5、−6、−7等“次要路径”异常显示较高频率,分析其原因可能与部分患者在接受TKI治疗过程中存在治疗依从性差相关。因此,治疗过程中对患者加强教育,提高依从性,对CML患者诊疗及预后具有重要意义。
CML慢性期进展到加速或急变期往往对TKI反应欠佳[8]–[10],对于这类患者,尽管选择转换二代TKI或TKI联合化疗能够使部分患者再次获得治疗反应,但大部分患者很快再次出现疾病进展[9],[11]–[13],allo-HSCT仍然是目前唯一治愈CML的方案[14]–[15]。2013年欧洲白血病指南指出,初诊CML合并ACA,尤其是“主要路径”异常往往提示不良预后,但目前的研究不足以提供针对性的治疗计划[3]。近来研究报道,唯有“主要路径”提示不良预后,其他ACA改变,不需要更换治疗方案[6],[16]。本研究中,初诊CML慢性期患者,合并ACA者与标准易位者相比,累计3年OS率差异无统计学意义(P=0.209);但前者EFS及DFS率显著降低(P值分别为0.037和0.003),进展期合并ACA者长期生存率下降。与文献[4],[17]报道相一致。对于治疗过程中出现的ACA,Lee等[17]认为,除-7异常外其他染色体改变不需要更改治疗策略;2013年欧洲白血病指南指出,治疗过程中出现“主要路径”异常是证实疾病进展的标志。我们的研究中,治疗过程中出现ACA者,疾病进展率高(χ2=168.21,P<0.001),CML慢性期治疗过程中出现ACA者与无ACA者相比,前者OS、EFS、DFS率显著降低(P值均<0.001));进展期治疗过程中出现ACA者总生存率显著下降,预后较无ACA者差(P=0.086),与文献[18]报道一致。由此可知,初诊或是治疗过程中出现ACA者,更易发生不良事件或疾病进展,随访中需增加病情监测频率,必要时更改治疗策略。
ABL激酶区点突变是CML病程中导致患者复发耐药、治疗失败的重要危险因素,直接影响CML生存和预后[19]–[20]。本研究进一步分析ABL激酶区点突变与ACA的关系,结果显示初诊合并ACA者行点突变检测阳性率较高,我们推测,部分患者在初诊时可能已存在点突变,成为影响TKI疗效的隐匿因素,对初诊合并ACA患者行ABL激酶区点突变检测可能能为临床治疗提供指导。但本研究初诊ACA患者检测ABL激酶区点突变病例数少,尚需更多的临床数据予以证实。我们的研究结果显示,治疗过程中出现ACA者46.0%ABL激酶区点突变检测阳性,CML慢性期与进展期相比,点突变发生率差异无统计学意义(χ2=0.378,P=0.539)。与文献[21]报道相比,本组患者突变率高,可能与研究对象为ACA患者相关。进一步比较ACA与无ACA者点突变发生率,前者更易合并点突变(χ2=29.04,P=0.000),提示细胞遗传学不稳定者可能更易出现ABL激酶区点突变改变。因此,对于这类患者,积极行点突变检测对治疗方案的选择及预后判断同样具有极其重要的作用。
综上所述,CML在病程演进中往往合并ACA,此类患者更易出现不良事件或疾病进展,对患者加强教育,提高依从性,治疗过程中严格按照诊疗监测指南[22]行细胞遗传学监测,以及TKI反应欠佳或治疗失败时及时行染色体核型分析及ABL激酶区点突变检测对疾病治疗及预后具有极其重要的作用。
Funding Statement
基金项目:广东省医学科研基金(2015124162336427)
Fund program: Guangdong Province Medical Research Foundation(2015124162336427)
References
- 1.Sokal JE, Gomez GA, Baccarani M, et al. Prognostic significance of additional cytogenetic abnormalities at diagnosis of Philadelphia chromosome-positive chronic granulocytic leukemia[J] Blood. 1988;72(1):294–298. [PubMed] [Google Scholar]
- 2.Marktel S, Marin D, Foot N, et al. Chronic myeloid leukemia in chronic phase responding to imatinib: the occurrence of additional cytogenetic abnormalities predicts disease progression[J] Haematologica. 2003;88(3):260–267. [PubMed] [Google Scholar]
- 3.Baccarani M, Deininger MW, Rosti G, et al. European LeukemiaNet recommendations for the management of chronic myeloid leukemia: 2013[J] Blood. 2013;122(6):872–884. doi: 10.1182/blood-2013-05-501569. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.Luatti S, Castagnetti F, Marzocchi G, et al. Additional chromosomal abnormalities in Philadelphia-positive clone: adverse prognostic influence on frontline imatinib therapy: a GIMEMA Working Party on CML analysis[J] Blood. 2012;120(4):761–767. doi: 10.1182/blood-2011-10-384651. [DOI] [PubMed] [Google Scholar]
- 5.张 之南, 沈 悌. 血液病诊断及疗效标准[M] 天津: 天津科学技术出版社; 1991. p. 173. [Google Scholar]
- 6.Fabarius A, Kalmanti L, Dietz CT, et al. Impact of unbalanced minor route versus major route karyotypes at diagnosis on prognosis of CML[J] Ann Hematol. 2015;94(12):2015–2024. doi: 10.1007/s00277-015-2494-9. [DOI] [PubMed] [Google Scholar]
- 7.Crisan AM, Coriu D, Arion C, et al. The impact of additional cytogenetic abnormalities at diagnosis and during therapy with tyrosine kinase inhibitors in Chronic Myeloid Leukaemia[J] J Med Life. 2015;8(4):502–508. [PMC free article] [PubMed] [Google Scholar]
- 8.Kantarjian HM, Cortes J, O'Brien S, et al. Imatinib mesylate (STI571) therapy for Philadelphia chromosome-positive chronic myelogenous leukemia in blast phase[J] Blood. 2002;99(10):3547–3553. doi: 10.1182/blood.v99.10.3547. [DOI] [PubMed] [Google Scholar]
- 9.Palandri F, Castagnetti F, Testoni N, et al. Chronic myeloid leukemia in blast crisis treated with imatinib 600 mg: outcome of the patients alive after a 6-year follow-up[J] Haematologica. 2008;93(12):1792–1796. doi: 10.3324/haematol.13068. [DOI] [PubMed] [Google Scholar]
- 10.Sawyers CL, Hochhaus A, Feldman E, et al. Imatinib induces hematologic and cytogenetic responses in patients with chronic myelogenous leukemia in myeloid blast crisis: results of a phase II study[J] Blood. 2002;99(10):3530–3539. doi: 10.1182/blood.v99.10.3530. [DOI] [PubMed] [Google Scholar]
- 11.Karbasian EM, Morris EL, Dutcher JP, et al. Blastic phase of chronic myelogenous leukemia[J] Curr Treat Options Oncol. 2006;7(3):189–199. doi: 10.1007/s11864-006-0012-y. [DOI] [PubMed] [Google Scholar]
- 12.Saglio G, Hochhaus A, Goh YT, et al. Dasatinib in imatinib-resistant or imatinib-intolerant chronic myeloid leukemia in blast phase after 2 years of follow-up in a phase 3 study: efficacy and tolerability of 140 milligrams once daily and 70 milligrams twice daily[J] Cancer. 2010;116(16):3852–3861. doi: 10.1002/cncr.25123. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.Bennour A, Saad A, Sennana H. Chronic myeloid leukemia: Relevance of cytogenetic and molecular assays[J] Crit Rev Oncol Hematol. 2016;97:263–274. doi: 10.1016/j.critrevonc.2015.08.020. [DOI] [PubMed] [Google Scholar]
- 14.中华医学会血液学分会. 中国慢性髓性白血病诊断与治疗指南(2013年版)[J] 中华血液学杂志. 2013;34(5):464–470. doi: 10.3760/cma.j.issn.0253-2727.2014.08.030. [DOI] [Google Scholar]
- 15.刘 启发, 许 娜. TKI时代异基因造血干细胞移植在慢性髓系白血病中的地位[J] 临床血液学杂志. 2015;28(5):741–744. doi: 10.13201/j.issn.1004-2806.2015.09.002. [DOI] [Google Scholar]
- 16.Fabarius A, Leitner A, Hochhaus A, et al. Impact of additional cytogenetic aberrations at diagnosis on prognosis of CML: long-term observation of 1151 patients from the randomized CML Study IV[J] Blood. 2011;118(26):6760–6768. doi: 10.1182/blood-2011-08-373902. [DOI] [PubMed] [Google Scholar]
- 17.Lee SE, Choi SY, Bang JH, et al. The long-term clinical implications of clonal chromosomal abnormalities in newly diagnosed chronic phase chronic myeloid leukemia patients treated with imatinib mesylate[J] Cancer Genet. 2012;205(11):563–571. doi: 10.1016/j.cancergen.2012.09.003. [DOI] [PubMed] [Google Scholar]
- 18.Chen Z, Cortes JE, Jorgensen JL, et al. Differential impact of additional chromosomal abnormalities in myeloid vs lymphoid blast phase of chronic myelogenous leukemia in the era of tyrosine kinase inhibitor therapy[J] Leukemia. 2016;30(7):1606–1609. doi: 10.1038/leu.2016.6. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.Nardi V, Azam M, Daley GQ. Mechanisms and implications of imatinib resistance mutations in BCR-ABL[J] Curr Opin Hematol. 2004;11(1):35–43. doi: 10.1097/00062752-200401000-00006. [DOI] [PubMed] [Google Scholar]
- 20.Soverini S, de Benedittis C, Mancini M, et al. Mutations in the BCR-ABL1 Kinase Domain and Elsewhere in Chronic Myeloid Leukemia[J] Clin Lymphoma Myeloma Leuk. 2015;15 Suppl:S120–128. doi: 10.1016/j.clml.2015.02.035. [DOI] [PubMed] [Google Scholar]
- 21.Elias MH, Baba AA, Azlan H, et al. BCR-ABL kinase domain mutations, including 2 novel mutations in imatinib resistant Malaysian chronic myeloid leukemia patients-Frequency and clinical outcome[J] Leuk Res. 2014;38(4):454–459. doi: 10.1016/j.leukres.2013.12.025. [DOI] [PubMed] [Google Scholar]
- 22.中华医学会血液学分会实验诊断学组, 中国慢性髓性白血病联盟专家组. 中国慢性髓性白血病诊疗监测规范(2014年版)[J] 中华血液学杂志. 2014;35(8):781–784. doi: 10.3760/cma.j.issn.0253-2727.2014.08.030. [DOI] [Google Scholar]


