Abstract
目的
探讨JAK2抑制剂Ruxolitinib对JAK2V617F突变阳性的骨髓增殖性肿瘤(MPN)细胞内基质金属蛋白酶(MMP)调控的影响。
方法
①收集2012年1月到2015年12月保定市第一医院收治的40例未经治疗的JAK2V617F阳性MPN患者,以15名健康志愿者为对照组。免疫组化法检测两组骨髓活检组织中磷酸化JAK2(p-JAK2)、基质金属蛋白酶2(MMP-2)、MMP-9的表达水平。选取JAK2V617F阳性MPN患者骨髓细胞,体外应用Ruxolitinib干预,测定干预前后细胞迁移力和MMP-2、MMP-9表达。②不同浓度Ruxolitinib(0、50、100、250、500、1 000 nmol/L)作用于人红白血病细胞株HEL细胞不同时间后CCK-8检测细胞活力,Tanswell小室检测细胞迁移,荧光定量PCR检测JAK2、MMP-2、MMP-9 mRNA水平变化,Western blot检测p-JAK2、MMP-2、MMP-9蛋白表达。
结果
①MPN组p-JAK2、MMP-2、MMP-9蛋白表达均高于对照组[(78.56±24.55)%对(41.59±17.29)%、(48.25±18.74)%对(22.79±13.89)%、(53.29±19.28)%对(15.56±14.96)%,P值均<0.05]。Spearman相关分析显示MMP-2、MMP-9蛋白水平与JAK2V617F突变量呈正相关(r=0.526, P=0.001;r=0.543, P=0.001)。②Ruxolitinib能够呈时间和剂量依赖性抑制HEL细胞增殖。③迁移实验结果显示5 nmol/L Ruxolitinib作用MPN原代细胞及HEL细胞24 h后迁移至下室细胞数均少于无Ruxolitinib组(154.7±27.5对320.3±67.3,t=13.47,P=0.001;70.7±10.5对135.3±16.7,t=13.89,P=0.001)。④JAK2、MMP-2、MMP-9 mRNA及蛋白表达随Ruxolitinib剂量增加而降低。
结论
Ruxolitinib通过调控JAK2信号通路抑制MMP-2、MMP-9表达而抑制MPN细胞迁移能力。
Keywords: 骨髓增殖性肿瘤, Ruxolitinib, 基质金属蛋白酶2, 基质金属蛋白酶9, 细胞迁移分析
Abstract
Objective
To investigate the regulation of JAK2 tyrosine kinase inhibitor ruxolitinib on extracellular matrix metalloproteinase (MMP in JAK2V617F positive myeloproliferative neoplasms (MPN) cells.
Methods
①Forty cases of newly diagnosed JAK2V617F positive MPN patients and 15 healthy volunteers as control in Baoding No.1 Hospital between January 2012 and December 2015 were enrolled in this study. JAK2V617F/JAK2 ratio was detected by real-time-PCR; the expression levels of phosphorylation protein tyrosine kinase 2 (p-JAK2), MMP-2 and MMP-9 in pathological tissues of bone marrow were detected by immunohistochemistry. The bone marrow cells of JAK2V617F positive MPN patients were treated with ruxolitinib, then the migration ability and MMP-2, MMP-9 gene and protein expression levels were detected. ②The human erythroleukemia cell line HEL cells were treated with different concentrations of ruxolitinib (0, 50, 100, 250, 500, 1 000 nmol/L). The cell viability was detected by CCK-8 test; cell migration ability was tested by transwell chambers. The mRNA expression levels of JAK2, MMP-2 and MMP-9 were detected by real-time-PCR. The protein expression levels of p-JAK2, MMP-2 and MMP-9 were detected by Western blot.
Results
①The expression levels of p-JAK2, MMP-2 and MMP-9 in the newly diagnosed group were significantly higher than control group respectively [(78.56±24.55) % vs (41.59±17.29) %, P<0.05; (48.25±18.74) % vs (22.79±13.89) %, P<0.05; (53.29±19.28) % vs (15.56±14.96) %, P<0.05]. Spearman correlation analysis showed the positive correlation of MMP-2 and MMP-9 protein expression levels with JAK2V617F mutation (r=0.526, P=0.001; r=0.543, P=0.001). ②The proliferation of HEL cells was inhibited by different concentrations of ruxolitinib in time and dose dependent manner. ③Cell migration test showed the number of cells leaked to the low chamber in MPN patients bone marrow cells and HEL cells treated with 5 nmol/L of ruxolitinib group were significantly lower than that without ruxolitinib treatment after 24 h [(154.7±27.5) vs (320.3±67.3), t=13.47, P<0.05; (70.7±10.5) vs (135.3±16.7), t=13.89, P<0.05]. The mRNA and protein expression levels of JAK2, MMP-2 and MMP-9 decreased with the increased concentration of ruxolitinib.
Conclusion
Ruxolitinib inhibits MPN cell migration and expression of MMP-2 and MMP-9 via JAK2 signal pathway.
Keywords: Myeloproliferative neoplasms, Ruxolitinib, Matrix metalloproteinase 2, Matrix Metalloproteinase 9, Cell migration assays
骨髓增殖性肿瘤(MPN)是一类起源于造血干细胞、以骨髓一系或多系血细胞异常增殖为特点的血液系统恶性疾病。90%~95%的真性红细胞增多症(PV)及50%的原发性血小板增多症(ET)、原发性骨髓纤维化(PMF)患者存在JAK激酶2(JAK2)V617F点突变[1]–[2]。JAK2V617F突变导致JAK2持续激活,活化细胞因子受体-JAK2-STAT5信号通路,引起细胞增殖和凋亡受抑,导致疾病的发生。Ruxolitinib是选择性JAK1/2抑制剂[3],通过竞争性抑制JAK1/2激酶结构域、催化亚基上ATP结合位点起到对JAK活性的抑制作用,从而导致STAT-3/5、Akt和ERK磷酸化水平的下降[4]。基质金属蛋白酶(MMP)参与肿瘤细胞的侵袭和迁移过程,介导包括基底膜在内的细胞外基质(extracellular matrixc, ECM)的降解,还参与调控肿瘤血管生成,影响细胞黏附分子的功能以及调控肿瘤细胞的生长。目前研究表明,MMP-2及MMP-9在MPN中存在不同程度的表达[5],而Ruxolitinib对MPN细胞MMP表达调控的影响未见报道。本研究观察JAK2抑制剂Ruxolitinib对MPN细胞增殖、凋亡及迁移能力的影响并探讨其作用机制,为MPN的临床治疗提供新的药物和治疗靶点。
材料与方法
1.病例:2012年1月至2015年12月保定市第一医院收治的40例JAK2V617F突变阳性且排除MPLW515K/L及CALR突变的初诊MPN患者纳入研究(MPN组),男18例、女22例,中位年龄59(34~72)岁,PV 13例,ET 10例,PMF 17例,诊断均符合文献[6]。以15名健康志愿者作为对照组,其中男8名、女7名,中位年龄55(38~73)岁。本研究获得保定市第一医院伦理委员会批准。患者均知情同意。
2.标本采集:采集MPN患者及健康志愿者骨髓标本2~5 ml;在无菌的塑料离心管中加入淋巴细胞分离液,提取骨髓单个核细胞,部分用于细胞培养,部分冻存备用。
3.细胞培养:人红白血病细胞株HEL细胞购自中国科学院上海生命科学研究院细胞资源中心。原代骨髓单个核细胞和HEL细胞在含10%胎牛血清(FBS)的RPMI 1640培养液、37 °C、5%CO2条件下培养。
4.主要试剂与仪器:CCK-8试剂盒购自日本同仁化学研究所。p-JAK2、MMP-2、MMP-9单克隆抗体购自美国Santa Cruz公司。基因组RNA提取试剂盒购自北京博迈德生化科技有限公司,引物序列根据美国国立生物技术信息中心(NCBI)公布的相应基因序列设计,由北京赛百胜生物公司合成。Ruxolitinib购自瑞士诺华公司。ABI 7500荧光定量PCR仪购自美国Applied Biosystems公司。
5.实时荧光定量PCR:分组收集细胞,RNA提取试剂盒提取总RNA,逆转录合成cDNA。实时荧光定量PCR引物序列及探针:JAK2上游引物:5′-CAGCAAGTATGATGAGCAAGCTTT-3′,下游引物:5′-TGAACCAGAATATTCTCGTCTCCAC-3′;MGB荧光探针5′-FAM-TCACAAGCATTTGGTTTT-MGB-3′;JAK2V617F下游引物:5′-CCAGAATATTCTCGTCTCCACTGAA-3′。MMP-2上游引物:5′-TGCGACCACAGCCAACTACAG-3′,下游引物:5′-GGTGCCAAGGTCAATGTCCAGG-AG-3′(241 bp);MMP-9上游引物:5′-GGCACCCACACCACAACATCACCTAT-3′,下游引物:5′-AGGGACCACAACTCGTCATCGT-3′(289 bp);β-actin上游引物:5′-GCGGACATCCGCAAAGAC-3′,下游引物:5′-AAAGGGTGTAACGCAACTAA-3′(302 bp)。反应体系25 µl,反应条件:50 °C 2 min,95 °C10 min,1个循环;95 °C15 s,60 °C 1 min,40个循环,同时设空白对照组。根据标准品计算JAK2和JAK2V617F的绝对拷贝数量。将JAK2V617F/JAK2比值定义为JAK2V617F突变量。根据公式(ΔCt=Ct目的基因−Ctβ-actin和ΔΔCt=2−ΔCt)计算相应基因的相对表达量。各组实验重复3次,结果取均值。
6.免疫组织化学染色法检测骨髓组织p-JAK2、MMP-2、MMP-9蛋白表达:组织蜡块切片、烤片、脱蜡、抗原修复后加3%过氧化氢(阻断内源性过氧化氢酶的活性),磷酸盐缓冲液(PBS)冲洗,加入一抗(p-JAK2、MMP-2、MMP-9,工作浓度为1∶100)4 °C过夜,PBS洗3次,每次5 min,滴加Elivision plus试剂盒中试剂A(增强剂)、试剂B(酶标羊抗鼠/兔IgG聚合物),PBS冲洗后,加二氨基联苯氨(DAB)显色,苏木素复染,0.1%盐酸分化,自来水冲洗,切片经梯度酒精脱水干燥,中性树胶封片。以胞膜、胞质或胞核中出现棕黄色颗粒为阳性判断标准,在高倍镜视野下计数阳性细胞比例。
7.CCK-8法检测细胞活力:收集对数生长期细胞用于实验。①实验组:取细胞悬液100 µl接种于96孔板(细胞密度为5×103 ml),边缘孔用无菌水或PBS填充,加入不同浓度Ruxolitinib(50、100、250、500、1 000 nmol/L)。②空白组:加入100 µl培养基及不同浓度Ruxolitinib(50、100、250、500、1 000 nmol/L),不加细胞。③对照组:加入100 µl细胞,不加Ruxolitinib。每组设5个平行孔。分别于0、24、48、72 h后加入CCK-8溶液10 µl,4 h后酶标仪测定450 nm处吸光度(A)值,按以下公式计算细胞活力并绘制细胞生长曲线。
8.Transwell迁移实验观察5 nmol/L Ruxolitinib对HEL细胞迁移的影响:选取无FBS细胞100 µl(细胞数5×104),加入Transwell小室上室,加或不加5 nmol/L Ruxolitinib,下室加入含10%FBS RPMI1640培养基,24 h后显微镜下计数迁移至下室的细胞。
9.Western blot检测p-JAK2、MMP-2、MMP-9蛋白表达:收集各组细胞(每组1×107),加入200 µl预冷蛋白裂解液和2 µl苯甲基磺酰氟(PMSF),4 °C裂解1 h,考马斯亮蓝试剂盒检测上清液蛋白浓度。配制10%的分离胶和12%的浓缩胶,取蛋白样品加入上样缓冲液混匀,充分蛋白变性,电泳。转移到硝酸纤维素膜,经50 g/L脱脂奶粉37 °C孵育2 h,加一抗,4 °C孵育过夜。TTBS缓冲液漂洗,加入二抗,37 °C孵育2 h,再次漂洗后行化学染色检测。
10.统计学处理:所有数据采用SPSS 19.0软件分析,计量资料以x±s表示,两组均数间的比较采用t检验,多组均数比较采用方差分析,两两比较采用q检验。Spearman等级相关分析各变量之间的相关性。以P<0.05为差异有统计学意义。
结果
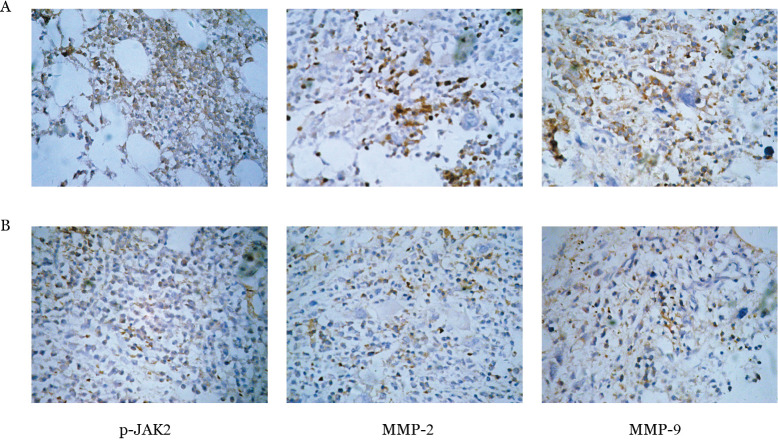
1.MPN组及对照组p-JAK2、MMP-2、MMP-9蛋白表达:MPN组p-JAK2、MMP-2、MMP-9蛋白表达水平均高于对照组(P<0.05)。详见表1、图1。
表1. 初诊骨髓增殖性肿瘤(MPN)患者及对照组p-JAK2、MMP-2、MMP-9蛋白表达(%,x±s).
| 组别 | 例数 | p-JAK2 | MMP-2 | MMP-9 |
| MPN组 | 40 | 78.56±24.55 | 48.25±20.74 | 53.29±19.28 |
| 对照组 | 15 | 41.59±17.29 | 22.79±13.89 | 15.56±14.96 |
| t值 | 5.342 | 4.387 | 7.668 | |
| P值 | <0.001 | <0.001 | <0.001 | |
注:p-JAK2:磷酸化JAK激酶2;MMP-2:基质金属蛋白酶2;MMP-9:基质金属蛋白酶9
图1. 免疫组织化学染色法检测骨髓增殖性肿瘤(MPN)患者(A)和对照组(B)骨髓组织磷酸化JAK激酶2(p-JAK2)、基质金属蛋白酶2(MMP-2)、MMP-9表达(高倍镜).
2.JAK2V617F突变量与骨髓组织MMP-2、MMP-9蛋白表达的相关性:Spearman等级相关分析显示MPN患者的JAK2V617F突变量和MMP-2、MMP-9蛋白表达呈正相关(r=0.526,P=0.001;r=0.543,P=0.001)。40例JAK2V617F突变阳性MPN患者中,JAK2V617F突变量<50%、≥50%分别为22、18例。JAK2V617F突变量<50%组p-JAK2、MMP-2、MMP-9蛋白表达水平均低于≥50%组(P<0.05),详见表2。
表2. JAK2V617F突变对JAK2V617F突变阳性MPN患者骨髓组织p-JAK2、MMP-2、MMP-9蛋白表达的影响(%,x±s).
| 组别 | 例数 | p-JAK2 | MMP-2 | MMP-9 |
| JAK2V617F突变量<50% | 22 | 72.84±17.57 | 41.20±17.21 | 47.38±17.36 |
| JAK2V617F突变量≥50% | 18 | 85.56± 20.56 | 56.87±23.32 | 60.51±19.65 |
| t值 | 2.111 | 2.444 | 2.243 | |
| P值 | 0.041 | 0.019 | 0.031 | |
注:MPN:骨髓增殖性肿瘤;p-JAK2:磷酸化JAK激酶2;MMP-2:基质金属蛋白酶2;MMP-9、基质金属蛋白酶9
3.CCK-8法检测不同浓度Ruxolitinib对HEL细胞活力的影响:24、48、72 h作用时间组HEL细胞活力随Ruxolitinib浓度增大而逐渐下降(P<0.001),不同浓度Ruxolitinib处理组HEL细胞活力随作用时间延长而逐渐下降(P<0.001),表明Ruxolitinib能够呈时间和剂量依赖性抑制HEL细胞增殖。详见表3。
表3. 不同浓度Ruxolitinib对HEL细胞活力的影响(%,x±s).
| Ruxolitinib 浓度 | 样本数 | 细胞活力 |
||||
| 24 h | 48 h | 72 h | F值 | P值 | ||
| 50 nmol /L | 3 | 76.10±3.09 | 70.14±3.39 | 55.83±3.43 | 29.77 | <0.001 |
| 100 nmol /L | 3 | 66.04±3.14 | 59.71±3.34 | 47.63±3.12 | 25.61 | <0.001 |
| 250 nmol /L | 3 | 60.06±2.71 | 52.80±2.61 | 36.43±2.98 | 57.24 | <0.001 |
| 500 nmol /L | 3 | 59.27±2.86 | 43.30±2.96 | 31.05±2.78 | 73.05 | <0.001 |
| 1 000 nmol /L | 3 | 57.86±2.32 | 38.56±2.15 | 14.48±2.86 | 233.78 | <0.001 |
| F值 | 21.03 | 56.14 | 81.86 | |||
| P值 | <0.001 | <0.001 | <0.001 | |||
4.Ruxolitinib对MPN原代细胞及HEL细胞迁移的影响:5 nmol/L Ruxolitinib作用MPN原代细胞24 h后迁移至下室细胞数少于无Ruxolitinib的空白组(154.7±27.5对320.3±44.3,t=13.47,P=0.001)。5 nmol/L Ruxolitinib处理HEL细胞24 h后迁移至下室细胞数少于无Ruxolitinib对照组(70.7±10.5对135.3±16.7,t= 13.89,P=0.001)。
5.Ruxolitinib对HEL细胞JAK2、MMP-2、MMP-9基因mRNA表达的影响:Ruxolitinib处理HEL细胞48 h后,JAK2、MMP-2、MMP-9 mRNA表达水平均随Ruxolitinib浓度的增加而逐渐减低(P<0.001)。详见表4。
表4. 不同浓度Ruxolitinib处理HEL细胞48 h后JAK2、MMP-2、MMP-9基因mRNA相对表达量(x±s,n=3).
| Ruxolitinib 浓度 | JAK2 | MMP-2 | MMP-9 |
| 0 nmol /L | 0.431±0.043 | 0.397±0.031 | 0.321±0.032 |
| 50 nmol /L | 0.362±0.032 | 0.362±0.030 | 0.252±0.025 |
| 100 nmol /L | 0.254±0.031 | 0.235±0.023 | 0.245±0.024 |
| 250 nmol /L | 0.181±0.022 | 0.188±0.018 | 0.215±0.025 |
| 500 nmol /L | 0.143±0.022 | 0.155±0.010 | 0.155±0.018 |
| 1 000 nmol /L | 0.099±0.011 | 0.098±0.009 | 0.098±0.009 |
| F值 | 61.77 | 86.82 | 33.90 |
| P值 | <0.001 | <0.001 | <0.001 |
注:JAK2:JAK激酶2;MMP-2:基质金属蛋白酶2;MMP-9:基质金属蛋白酶9
6.Western blot检测Ruxolitinib对MPN原代细胞p-JAK2、MMP-2、MMP-9蛋白表达的影响:250 nmol/L Ruxolitinib作用48 h能明显抑制MPN原代细胞p-JAK2、MMP-2、MMP-9表达。详见表5。
表5. Western blot检测250 nmol/L Ruxolitinib对骨髓增殖性肿瘤原代细胞p-JAK2、MMP-2、MMP-9表达的影响(x±s).
| 组别 | 样本数 | p-JAK2 | MMP-2 | MMP-9 |
| 未应用 Ruxolitinib | 3 | 1.55±0.34 | 1.42±0.31 | 1.33±0.29 |
| 应用 Ruxolitinib | 3 | 0.83±0.16 | 0.72±0.13 | 0.68±0.13 |
| t值 | 4.284 | 4.656 | 4.573 | |
| P值 | 0.003 | 0.002 | 0.002 | |
注:p-JAK2:磷酸化JAK激酶2;MMP-2:基质金属蛋白酶2;MMP-9、基质金属蛋白酶9
7.Ruxolitinib对HEL细胞p-JAK2、MMP-2、MMP-9蛋白表达的影响:不同浓度Ruxolitinib处理HEL细胞48 h,随着Ruxolitinib浓度的增加p-JAK2、MMP-2、MMP-9蛋白表达水平逐渐减低(P<0.001)。详见表6、图2。
表6. Western blot检测不同浓度Ruxolitinib对HEL细胞p-JAK2、MMP-2、MMP-9表达的影响(x±s,n=3).
| Ruxolitinib 浓度 | p-JAK2 | MMP-2 | MMP-9 |
| 0 nmol /L | 1.52±0.12 | 0.53±0.04 | 0.78±0.06 |
| 50 nmol /L | 1.21.±0.10 | 0.42±0.03 | 0.65±0.04 |
| 100 nmol /L | 1.12±0.09 | 0.31±0.03 | 0.54±0.04 |
| 250 nmol /L | 0.98±0.07 | 0.27±0.02 | 0.30±0.02 |
| 500 nmol /L | 0.45±0.04 | 0.23±0.01 | 0.27±0.02 |
| 1 000 nmol /L | 0.15±0.01 | 0.19±0.01 | 0.23±0.01 |
| F值 | 119.71 | 73.40 | 121.32 |
| P值 | <0.001 | <0.001 | <0.001 |
注:p-JAK2:磷酸化JAK激酶2;MMP-2:基质金属蛋白酶2;MMP-9:基质金属蛋白酶9
图2. Western blot检测不同浓度Ruxolitinib对HEL细胞p-JAK2、MMP-2、MMP-9表达的影响.
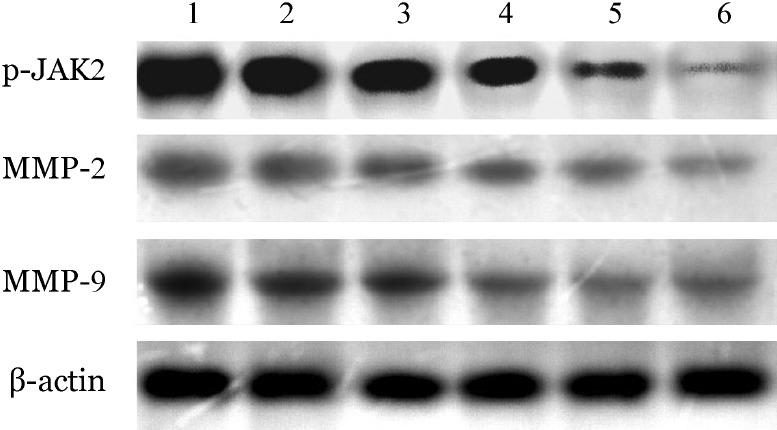
1~6分别为0、50、100、250、500、1 000 nmol/L Ruxolitinib 组。p-JAK2:磷酸化Janus 激酶2;MMP-2:基质金属蛋白酶2;MMP-9、基质金属蛋白酶9
讨论
费城染色体阴性MPN患者中存在JAK2V617F、JAK2基因第12号外显子、MPL基因第10号外显子及CALR基因突变,JAK2V617F突变发生率最高。JAK2V617F突变导致酪氨酸激酶过度活化从而持续激活JAK/STAT信号通路,引起细胞过度增殖[7]。JAK-STAT通路参与细胞增殖、分化和凋亡以及免疫调节等多种反应,在细胞因子受体介导的信号通路中起核心作用[8]。
Ruxolitinib是一种高选择性的JAK1/JAK2激酶抑制剂[9],通过抑制JAK/STAT信号通路的磷酸化而发挥作用,能够明显逆转MPN患者脾脏肿大,并改善患者生存质量,没有脾脏肿大的患者也可明显获益[10]。既往研究表明,不同浓度Ruxolitinib可使JAK2V617F阳性Ba-F3细胞增殖明显受抑[11]。Ruxolitinib作用JAK2V617F阳性HEL细胞后,线粒体膜电位呈剂量依赖性减低,caspase3/7蛋白活性逐渐减低,从而诱导凋亡[12]。本研究结果显示Ruxolitinib作用于JAK2V617F阳性HEL细胞后,随着浓度的增加和时间的延长,细胞活力明显受到抑制。
肿瘤细胞的侵袭与迁移是一种复杂的过程,涉及肿瘤细胞运动、黏附、细胞外基质的降解等。研究显示Ruxolitinib通过抑制JAK2突变,抑制骨髓增殖性肿瘤VEGF等血管新生因子表达,进而抑制其血管新生[13]。MMP通过降解骨髓基质促进血管生成,改变与HSC动员和黏附有关的细胞因子、黏附分子的表达和功能,调控HSC的增殖分化,参与恶性血液病的发生和发展。白血病、淋巴瘤、多发性骨髓瘤、骨髓增生异常综合征等多种血液病存在MMP异常表达[14]–[15],在MPN中亦存在MMP表达上调[5]。本研究结果表明,JAK2V617F阳性MPN细胞中存在p-JAK2、MMP-2、MMP-9的高表达,同时MPN患者的JAK2V617F突变量与MMP-2、MMP-9表达呈正相关。Ruxolitinib作用于JAK2V617F阳性MPN细胞48 h后,JAK2 mRNA和p-JAK2蛋白水平呈剂量依赖性降低,MMP-2、MMP-9表达亦降低。Transwell小室迁移实验结果表明Ruxolitinib作用细胞24 h后,进入下室的细胞明显减少。本研究表明下调肿瘤细胞的MMP-2、MMP-9表达水平可抑制肿瘤细胞的转移,可能Ruxolitinib通过抑制JAK-STAT信号通路活化,干扰下游靶基因与MMP-2、MMP-9启动基因结合,下调MMP-2、MMP-9表达,从而抑制肿瘤细胞的侵袭及迁移。
本研究结果表明,在JAK2V617F阳性细胞中存在MMP-2与MMP-9高表达,同时与JAK2V617F突变量密切相关,Ruxolitinib能够抑制JAK2V617F阳性MPN患者原代细胞及HEL细胞迁移,并通过抑制JAK2介导的信号通路抑制肿瘤细胞MMP-2、MMP-9表达,进而抑制MPN细胞迁移,为靶向治疗JAK2V617F阳性MPN提供了理论依据。
Funding Statement
基金项目:河北省科学技术研究与发展计划项目(162777120D)
Fund Program: Hebei province science and technology research and development projects(162777120D)
References
- 1.Constantinescu SN, Girardot M, Pecquet C. Mining for JAK-STAT mutations in cancer[J] Trends Biochem Sci. 2008;33(3):122–131. doi: 10.1016/j.tibs.2007.12.002. [DOI] [PubMed] [Google Scholar]
- 2.Irino T, Uemura M, Yamane H, et al. JAK2 V617F-dependent upregulation of PU.1 expression in the peripheral blood of myeloproliferative neoplasm patients[J] PLoS One. 2011;6(7):e22148. doi: 10.1371/journal.pone.0022148. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.Yacoub A, Odenike O, Verstovsek S. Ruxolitinib: long-term management of patients with myelofibrosis and future directions in the treatment of myeloproliferative neoplasms[J] Curr Hematol Malig Rep. 2014;9(4):350–359. doi: 10.1007/s11899-014-0229-y. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.Li WQ, Dehnade F, Zafarullah M. Oncostatin M-induced matrix metalloproteinase and tissue inhibitor of metalloproteinase-3 genes expression in chondrocytes requires Janus kinase/STAT signaling pathway[J] J Immunol. 2001;166(5):3491–3498. doi: 10.4049/jimmunol.166.5.3491. [DOI] [PubMed] [Google Scholar]
- 5.Sag SO, Gorukmez O, Ture M, et al. MMP2 gene-735 C/T and MMP9 gene -1562 C/T polymorphisms in JAK2V617F positive myeloproliferative disorders[J] Asian Pac J Cancer Prev. 2015;16(2):443–449. doi: 10.7314/apjcp.2015.16.2.443. [DOI] [PubMed] [Google Scholar]
- 6.张 之南, 沈 悌. 血液病诊断及疗效标准[M] 3版. 北京: 科学出版社; 2007. p. 19. [Google Scholar]
- 7.付 建珠, 徐 倩, 赵 亚玲, et al. 干扰素抑制JAK2V617F阳性骨髓增殖性肿瘤血管新生的机制[J] 中华医学杂志. 2015;95(46):3727–3732. doi: 10.3760/cma.j.issn.0376-2491.2015.46.002. [DOI] [PubMed] [Google Scholar]
- 8.Rampal R, Al-Shahrour F, Abdel-Wahab O, et al. Integrated genomic analysis illustrates the central role of JAK-STAT pathway activation in myeloproliferative neoplasm pathogenesis[J] Blood. 2014;123(22):e123–133. doi: 10.1182/blood-2014-02-554634. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.Harrison C, Kiladjian JJ, Al-Ali HK, et al. JAK inhibition with ruxolitinib versus best available therapy for myelofibrosis[J] N Engl J Med. 2012;366(9):787–798. doi: 10.1056/NEJMoa1110556. [DOI] [PubMed] [Google Scholar]
- 10.Benjamini O, Jain P, Estrov Z, et al. Therapeutic effects of ruxolitinib in patients with myelofibrosis without clinically significant splenomegaly[J] Blood. 2012;120(13):2768–2769. doi: 10.1182/blood-2012-07-446849. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.Quintás-Cardama A, Vaddi K, Liu P, et al. Preclinical characterization of the selective JAK1/2 inhibitor INCB018424: therapeutic implications for the treatment of myeloproliferative neoplasms[J] Blood. 2010;115(15):3109–3117. doi: 10.1182/blood-2009-04-214957. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.徐 倩, 刘 贵敏, 谷 蕾, et al. Ruxolitinib对人红白血病HEL细胞增殖、凋亡作用的研究[J] 第二军医大学学报. 2016;37(1):52–58. doi: 10.16781/j.0258-879x.2016.01.0052. [DOI] [Google Scholar]
- 13.Boveri E, Passamonti F, Rumi E, et al. Bone marrow microvessel density in chronic myeloproliferative disorders: a study of 115 patients with clinicopathological and molecular correlations[J] Br J Haematol. 2008;140(2):162–168. doi: 10.1111/j.1365-2141.2007.06885.x. [DOI] [PubMed] [Google Scholar]
- 14.Kamiguti AS, Lee ES, Till KJ, et al. The role of matrix metalloproteinase 9 in the pathogenesis of chronic lymphocytic leukaemia[J] Br J Haematol. 2004;125(2):128–140. doi: 10.1111/j.1365-2141.2004.04877.x. [DOI] [PubMed] [Google Scholar]
- 15.Janowska-Wieczorek A, Majka M, Marquez-Curtis L, et al. Bcr-abl-positive cells secrete angiogenic factors including matrix metalloproteinases and stimulate angiogenesis in vivo in Matrigel implants[J] Leukemia. 2002;16(6):1160–1166. doi: 10.1038/sj/leu/2402486. [DOI] [PubMed] [Google Scholar]