Abstract
Antecedentes
No se ha reportado plenamente la evolución clínica de los pacientes críticos de COVID-19 durante su ingreso en la unidad de cuidados intensivos (UCI), incluyendo las complicaciones médicas e infecciosas y terapias de soporte, así como su asociación con la mortalidad en UCI.
Objetivo
El objetivo de este estudio es describir las características clínicas y la evolución de los pacientes ingresados en UCI por COVID-19 y determinar los factores de riesgo de la mortalidad en UCI de dichos pacientes.
Métodos
Estudio prospectivo, multicéntrico y de cohorte, que incluyó a los pacientes críticos de COVID-19 ingresados en 30 UCI de España y Andorra. Se incluyó a los pacientes consecutivos del 12 de marzo al 26 de mayo del 2020 si habían fallecido o habían recibido el alta de la UCI durante el periodo de estudio. Se reportaron los datos demográficos, los síntomas, los signos vitales, los marcadores de laboratorio, las terapias de soporte, terapias farmacológicas y las complicaciones médicas e infecciosas, realizándose una comparación entre los pacientes fallecidos y los pacientes dados de alta.
Resultados
Se incluyó a un total de 663 pacientes. La mortalidad general en UCI fue del 31% (203 pacientes). Al ingreso en UCI los no supervivientes eran más hipoxémicos (SpO2 con mascarilla de no reinhalación, de 90 [RIC 83-93] vs. 91 [RIC 87-94]; p < 0,001] y con mayor puntuación en la escala SOFA-Evaluación de daño orgánico secuencial (SOFA, 7 [RIC 5-9] vs. 4 [RIC 3-7]; p <0,001]). Las complicaciones fueron más frecuentes en los no supervivientes: síndrome de distrés respiratorio agudo (SDRA) (95% vs. 89%; p = 0,009), insuficiencia renal aguda (IRA) (58% vs. 24%; p < 10–6), shock (42% vs. 14%; p < 10–13) y arritmias (24% vs. 11%; p < 10–4). Las superinfecciones respiratorias, infecciones del torrente sanguíneo y los shock sépticos fueron más frecuentes en los no supervivientes (33% vs. 25%; p = 0,03, 33% vs. 23%; p = 0,01 y 15% vs. 3%, p = 10–7, respectivamente). El modelo de regresión multivariable reflejó que la edad estaba asociada a la mortalidad y que cada año incrementaba el riesgo de muerte en un 1% (IC del 95%: 1-10, p = 0,014). Cada incremento de 5 puntos en la escala APACHE II predijo de manera independiente la mortalidad (odds ratio [OR]: 1,508 [1,081, 2,104], p = 0,015). Los pacientes con IRA (OR: 2,468 [1,628, 3,741], p < 10–4)], paro cardiaco (OR: 11,099 [3,389, 36,353], p = 0,0001] y shock séptico [OR: 3,224 [1,486, 6,994], p= 0,002) tuvieron un riesgo de muerte incrementado.
Conclusiones
Los pacientes mayores de COVID-19 con puntuaciones APACHE II más altas al ingreso, que desarrollaron IRA en grados ii o iii o shock séptico durante la estancia en UCI tuvieron un riesgo de muerte incrementado. La mortalidad en UCI fue del 31%.
Abstract
Background
The clinical course of COVID-19 critically ill patients, during their admission in the intensive care unit (UCI), including medical and infectious complications and support therapies, as well as their association with in-ICU mortality has not been fully reported.
Objective
This study aimed to describe clinical characteristics and clinical course of ICU COVID-19 patients, and to determine risk factors for ICU mortality of COVID-19 patients.
Methods
Prospective, multicentre, cohort study that enrolled critically ill COVID-19 patients admitted into 30 ICUs from Spain and Andorra. Consecutive patients from March 12th to May 26th, 2020 were enrolled if they had died or were discharged from ICU during the study period. Demographics, symptoms, vital signs, laboratory markers, supportive therapies, pharmacological treatments, medical and infectious complications were reported and compared between deceased and discharged patients.
Results
A total of 663 patients were included. Overall ICU mortality was 31% (203 patients). At ICU admission non-survivors were more hypoxemic [SpO2 with non-rebreather mask, 90 (IQR 83 to 93) vs. 91 (IQR 87 to 94); P<.001] and with higher sequential organ failure assessment score [SOFA, 7 (IQR 5 to 9) vs. 4 (IQR 3 to 7); P<.001]. Complications were more frequent in non-survivors: acute respiratory distress syndrome (ARDS) (95% vs. 89%; P=.009), acute kidney injury (AKI) (58% vs. 24%; P<10-16), shock (42% vs. 14%; P<10-13), and arrhythmias (24% vs. 11%; P<10-4). Respiratory super-infection, bloodstream infection and septic shock were higher in non-survivors (33% vs. 25%; P=.03, 33% vs. 23%; P=.01 and 15% vs. 3%, P=10-7), respectively. The multivariable regression model showed that age was associated with mortality, with every year increasing risk-of-death by 1% (95%CI: 1 to 10, P=.014). Each 5-point increase in APACHE II independently predicted mortality [OR: 1.508 (1.081, 2.104), P=.015]. Patients with AKI [OR: 2.468 (1.628, 3.741), P<10-4)], cardiac arrest [OR: 11.099 (3.389, 36.353), P=.0001], and septic shock [OR: 3.224 (1.486, 6.994), P=.002] had an increased risk-of-death.
Conclusions
Older COVID-19 patients with higher APACHE II scores on admission, those who developed AKI grades ii or iii and/or septic shock during ICU stay had an increased risk-of-death. ICU mortality was 31%.
Introducción
El 31 de diciembre del 2019, la oficina china de la Organización Mundial de la Salud (OMS) reportó una serie de casos de neumonía de origen desconocido en la ciudad de Wuhan, China1. El 11 de febrero del 2020 se identificó el agente causante de la enfermedad, denominada enfermedad por coronavirus 2019 (COVID-19), un nuevo tipo de coronavirus denominado síndrome respiratorio agudo severo por coronavirus 2 (SARS-CoV-2). El 13 de marzo del 2020, 3 meses después del primer caso, y coincidiendo con la llegada de los primeros casos a las unidades de Cuidados Intensivos (UCI) españolas, se realizó la declaración de pandemia.
Dentro del espectro clínico de los pacientes infectados por COVID-19, algunos desarrollan una neumonía vírica con hipoxemia severa e infiltrados pulmonares característicos que pueden evolucionar a síndrome de distrés respiratorio agudo (SDRA), la forma más grave de insuficiencia respiratoria aguda2. El escenario de la pandemia llevó al límite los recursos de muchas UCI en diferentes países a nivel mundial. Los datos retrospectivos procedentes de China, Italia y Estados Unidos describieron las características clínicas de los pacientes críticos, los factores pronósticos para SDRA o muerte, así como las estrategias ventilatorias comúnmente utilizadas3, 4, 5, 6, 7, 8, 9. Como se ha reflejado, muchos de estos pacientes presentan una situación clínica extremadamente grave, asociada a menudo a disfunciones orgánicas no respiratorias, o exhibiendo superinfecciones secundarias. Sin embargo, hasta la fecha, no se ha reportado prospectivamente la evolución clínica, incluyendo complicaciones médicas o terapias de soporte en los pacientes de UCI. El presente estudio describe prospectivamente la evolución clínica, el tratamiento recibido, los resultados y los factores de riesgo de mortalidad en UCI de los pacientes críticos de COVID-19 ingresados en diferentes UCI del territorio español.
Métodos
Diseño del estudio
Estudio prospectivo, multicéntrico, observacional y de cohorte, que incluyó a pacientes críticos con COVID-19 ingresados en 30 UCI en España y Andorra (los centros participantes se relacionan en el anexo 1). El estudio fue aprobado por el Comité de Ética de referencia de Euskadi, España. La necesidad de un consentimiento informado de los participantes fue considerada por cada centro participante. El estudio siguió las directrices establecidas en Strengthening the Reporting of Observational Studies in Epidemiology (STROBE) para estudios observacionales de cohortes10.
Población de estudio y recopilación de los datos
Los datos de las historias médicas electrónicas de los pacientes fueron recabados por parte de los facultativos especializados en cuidados críticos, conforme a un protocolo común previamente estandarizado. Cada investigador tenía un nombre de usuario y contraseña personal e introdujo los datos en un sistema de adquisición de datos online específicamente prediseñado (CoVid19.ubikare.io). La confidencialidad del paciente se protegió asignando un código de paciente anónimo. Se incluyó en la base de datos a todos los pacientes consecutivos de COVID-19 desde el 12 de marzo hasta el 16 de mayo del 2020 si cumplían los criterios siguientes: 1) ≥ 18 años de edad, y 2) infección por SARS-CoV-2 confirmada mediante muestra del tracto respiratorio. Los criterios de exclusión fueron: 1) pacientes sin infección por SARS-CoV-2 conforme a las directrices de la OMS11, y 2) pacientes que no habían cumplido los resultados de muerte o alta de UCI a día 26 de mayo del 2020.
Los datos registrados incluyeron: datos demográficos, síntomas al ingreso en UCI, signos vitales, marcadores de laboratorio (analítica, coagulación, bioquímica), terapias de soporte de cuidados críticos (ventilación mecánica [VM], terapia de reemplazo renal, oxigenación de membrana extracorpórea, etc.), terapias farmacológicas, complicaciones médicas durante la estancia (las definiciones se incluyen en el anexo 2, material adicional), cronología de la enfermedad (tiempo transcurrido desde la aparición de los síntomas y desde el ingreso hospitalario hasta el ingreso en UCI, hasta la iniciación de soporte respiratorio, y hasta el inicio de complicaciones, así como duración de la estancia en UCI). También se reportaron las puntuaciones de las escalas Sequential Organ Failure Assessment (Evaluación de fallo orgánico secuencial [SOFA]) y APACHE II, así como los resultados a 26 de mayo del 2020.
Definimos la base de referencia como el primer día de estancia en UCI, recabándose una serie de datos ese mismo día. También reunimos toda la información diaria y reportamos los «peores» valores durante el periodo en UCI (máximo o mínimo, dependiendo de la variable). Nuestro cuaderno de recogida de datos recopiló los datos a diario, desde el ingreso en la UCI hasta el alta o la muerte, lo que sucediese primero. También nos permitió recabar retrospectivamente los datos anteriores al ingreso en la UCI, incluyendo los síntomas al ingreso o la terapia farmacológica recibida. Antes de analizar los datos, 2 investigadores independientes y un estadístico realizaron un cribado de datos erróneos frente a rangos estandarizados y contactaron con los investigadores locales en caso de valores dudosos.
Medidas y resultados
El objetivo de este estudio fue describir las características clínicas y la evolución de los pacientes de COVID-19 ingresados en una UCI y determinar los factores de riesgo de mortalidad en UCI de dichos pacientes.
Análisis estadístico
Para este estudio no se calculó un tamaño de muestra predefinido. Las variables descriptivas se expresan como porcentaje, media y desviación estándar (DE), o mediana y rango intercuartílico (RIC), según lo adecuado para cada variable. Para comparar las variables entre los grupos, se utilizaron la prueba t de Student o de Mann-Whitney para las variables numéricas y la prueba de la χ2 o la exacta de Fisher para las variables categóricas. No se imputaron los datos ausentes. Los análisis se realizaron sobre la base de un caso completo. Todas las pruebas fueron bilaterales, considerándose estadísticamente significativo un valor p < 0,05. Además, para explorar los factores de riesgo asociados a la mortalidad en la UCI, se calcularon modelos de regresión logística multivariable. En el análisis univariante se incluyeron los parámetros con valor p inferior a 0,1, excluyéndose las variables con más del 30% de datos ausentes. Se realizaron 2 análisis diferentes: 1) investigamos factores basales, tales como datos demográficos, comorbilidades, síntomas y signos vitales, marcadores de laboratorio, y puntuaciones de severidad al ingreso, y 2) exploramos los factores relacionados con la evolución clínica, que incluyeron complicaciones médicas e infecciosas, y marcadores de laboratorio. Seudo-R se presenta como medida de idoneidad del modelo. Todos los análisis se realizaron utilizando STATA versión 16.
Resultados
Características
A lo largo de un periodo de 80 días (entre el 12 de marzo y el 26 de mayo del 2020), se ingresó en 30 UCI de España y Andorra a 663 pacientes con resultado definitivo de alta de UCI o muerte. La inclusión de pacientes sigue en curso y, a 26 de mayo del 2020, 297 (30%) pacientes permanecen en la UCI y, por tanto, no han sido incluidos en el análisis. Los datos demográficos, las comorbilidades y las terapias farmacológicas previos de los pacientes se reflejan en la tabla 1 . La estancia media de días desde el inicio de los síntomas hasta el ingreso hospitalario en UCI fue de 7 (RIC 5-9) y 9 (RIC 7-13), respectivamente, sin diferencias entre supervivientes y no supervivientes (tabla 1). Fiebre (83%) y disnea (71%) fueron los síntomas más frecuentes durante el ingreso en la UCI. Entre otros síntomas, no se encontraron diferencias entre supervivientes y no supervivientes. Al ingreso en la UCI, los no supervivientes estaban más enfermos, según reflejan las diferencias sustanciales encontradas en las puntuaciones de severidad (APACHE II, 17 [RIC 13-21] vs. 11 [RIC 8-15]; p < 0,001 y SOFA 7 [RIC 5-9] vs. 4 [RIC 3-7]; p < 0,001). La gasometría arterial durante el ingreso en UCI reflejó que el SDRA severo (PaO2/FiO2 < 100 mmHg) era más frecuente en los no supervivientes (43% vs. 28%; p = 0,006] (tabla 1). El modelo de regresión multivariable reflejó que la edad avanzada estaba asociada a un mayor riesgo de mortalidad en UCI (OR 1,05 [intervalo de confianza [IC] del 95%: 1,011-1,099), p = 0,014) y que por cada incremento de 5 puntos en la escala APACHE II el riesgo de mortalidad se incrementaba en un 51% (OR 1,508 [1,081, 2,104], p = 0,015] (tabla 2 ). Los peores valores durante el ingreso, así como su relación con la mortalidad en la UCI, se presentan en las tablas S1 y S2.
Tabla 1.
Datos demográficos, comorbilidades, terapia farmacológica, síntomas, escalas, signos vitales y marcadores de laboratorio al ingreso
| Total | Supervivientes | No supervivientes | Valor p | |
|---|---|---|---|---|
| (n = 663) | (n = 460) | (n = 203) | ||
| Datos demográficos y comorbilidades de los pacientes | ||||
| Edad, años | 64 (56-72)/661 | 62 (53-71)/458 | 68 (62-73)/203 | < 10–9 |
| Mujeres | 219/660 (33,18%) | 150/459 (32,68%) | 69/201 (34,33%) | 0,720 |
| Índice de masa corporal, kg/m2 | 28,3 (25,5-32,2)/554 | 28,6 (25,7-32,4)/398 | 27,7 (25,3-31,6)/ 156 | 0,466 |
| Hipertensión arterial | 329/663 (49,62%) | 214/460 (46,52%) | 115/203 (56,65%) | 0,018 |
| Diabetes mellitus | 151/663 (22,78%) | 90/460 (19,57%) | 61/203 (30,05%) | 0,004 |
| Insuficiencia cardiaca crónica | 9/663 (1,36%) | 3/460 (0,65%) | 6/203 (2,96%) | 0,027 |
| Enfermedad renal crónica | 38/663 (5,73%) | 20/460 (4,35%) | 18/203 (8,87%) | 0,029 |
| Asma | 17/663 (2,56%) | 13/460 (2,83%) | 4/203 (1,97%) | 0,605 |
| EPOC | 28/663 (4,22%) | 19/460 (4,13%) | 9/203 (4,43%) | 0,836 |
| Dislipidemia | 90/663 (13,57%) | 55/460 (11,96%) | 35/203 (17,24%) | 0,084 |
| Neoplasia | 23/663 (3,47%) | 11/460 (2,39%) | 12/203 (5,91%) | 0,035 |
| Terapia farmacológica | ||||
| Antihipertensivos | 300/663 (45,25%) | 199/460 (43,26%) | 101/203 (49,75%) | 0,128 |
| Fármacos hipoglucemiantes | 94/663 (14,18%) | 57/460 (12,39%) | 37/203 (18,23%) | 0,053 |
| Fármacos antiplaquetarios | 84/663 (12,67%) | 51/460 (11,09%) | 33/203 (16,26%) | 0,076 |
| Anticoagulantes | 51/663 (7,69%) | 30/460 (6,52%) | 21/203 (10,34%) | 0,113 |
| Broncodilatadores | 166/663 (25,04%) | 107/460 (23,26%) | 59/203 (29,06%) | 0,120 |
| Fármacos para reducción de lípidos | 44/663 (6,64%) | 30/460 (6,52%) | 14/203 (6,90%) | 0,866 |
| Reemplazo de hormona tiroidea | 62/663 (9,35%) | 45/460 (9,78%) | 17/203 (8,37%) | 0,665 |
| Inmunosupresores | 24/663 (3,62%) | 13/460 (2,83%) | 11/203 (5,42%) | 0,115 |
| Corticoides | 30/663 (4,52%) | 14/460 (3,04%) | 16/203 (7,88%) | 0,008 |
| Cronología (días desde el inicio de los síntomas) | ||||
| Hasta el ingreso hospitalario | 7 (5-9)/654 | 7 (5-9)/455 | 7 (4-9)/199 | 0,693 |
| Hasta el ingreso en UCI | 9 (7-13)/653 | 9 (7-12)/454 | 10 (7-13)/199 | 0,873 |
| Síntomas | ||||
| Fiebre | 551/663 (83,11%) | 380/460 (82,61%) | 171/203 (84,24%) | 0,654 |
| Tos | 401/663 (60,48%) | 284/460 (61,74%) | 117/203 (57,64%) | 0,343 |
| Disnea | 477/663 (71,95%) | 324/460 (70,43%) | 153/203 (75,37%) | 0,223 |
| Mialgia | 109/663 (16,44%) | 80/460 (17,39%) | 29/203 (14,29%) | 0,364 |
| Cefalea | 47/663 (7,09%) | 34/460 (7,39%) | 13/203 (6,40%) | 0,744 |
| Rinorrea | 8/663 (1,21%) | 5/460 (1,09%) | 3/203 (1,48%) | 0,706 |
| Vómitos | 54/663 (8,14%) | 35/460 (7,61%) | 19/203 (9,36%) | 0,445 |
| Artralgia | 39/663 (5,88%) | 31/460 (6,74%) | 8/203 (3,94%) | 0,209 |
| Dolor torácico | 53/663 (7,99%) | 39/460 (8,48%) | 14/203 (6,90%) | 0,538 |
| Incremento de la producción de esputos | 77/663 (11,61%) | 48/460 (10,43%) | 29/203 (14,29%) | 0,188 |
| Anosmia | 28/663 (4,22%) | 22/460 (4,78%) | 6/203 (2,96%) | 0,402 |
| Faringodinia | 23/663 (3,47%) | 15/460 (3,26%) | 8/203 (3,94%) | 0,650 |
| Diarrea | 76/663 (11,46%) | 51/460 (11,09%) | 25/203 (12,32%) | 0,692 |
| Fatiga | 24/663 (3,62%) | 15/460 (3,26%) | 9/203 (4,43%) | 0,500 |
| Escalas | ||||
| APACHE II | 12 (9-17)/458 | 11 (8-15)/332 | 17 (13-21)/126 | <10-15 |
| SOFA | 5 (3-7)/446 | 4 (3-7)/327 | 7 (5-9)/119 | <10-8 |
| Signos vitales | ||||
| Temperatura, °C | 36,7 (36,0-37,5)/568 | 36,7 (36,0-37,5)/402 | 36,7 (36,0-37,5)/166 | 0,988 |
| Presión arterial media, mmHg | 86,7 (78,0-96,7)/566 | 87,3 (78,7-96,7)/397 | 84,0 (74,3-94,3)/169 | 0,058 |
| Frecuencia cardiaca, lpm | 83 (72-96)/576 | 82 (71-95)/404 | 86 (75-100)/172 | 0,044 |
| SpO2, % | 91 (86-94)/566 | 91 (87-94)/396 | 90 (83-93)/170 | < 0,001 |
| Frecuencia respiratoria, rpm | 25 (20-30)/539 | 25 (20-30)/381 | 26 (20-31)/158 | 0,077 |
| Gasometría arterial | ||||
| PaO2/FiO2 < 100 | 167/517 (32,30%) | 104/370 (28,11%) | 63/147 (42,86%) | 0,006 |
| PaO2/FiO2 100-200 | 241/517 (46,62%) | 182/370 (49,19%) | 59/147 (40,14%) | |
| PaO2/FiO2 > 200 | 109/517 (21,08%) | 84/370 (22,70%) | 25/147 (17,01%) | |
| Ratio ventilatoria | 1,94 (1,51-2,61)/207 | 1,93 (1,52-2,61)/139 | 1,94 (1,46-2,66)/68 | 0,746 |
| Hallazgos de laboratorio | ||||
| Ferritina, ng/ml | 1265 (598-1960)/285 | 1174 (553-1882)/227 | 1480 (918-2358)/58 | 0,010 |
| Dímero D, ng/ml | 1017 (600-2300)/477 | 940 (576-2030)/348 | 1599 (697-3810)/129 | 0,002 |
| PCR, mg/dl | 20,7 (8,8-92,0)/569 | 20,2 (8,5-86,6)/410 | 21,8 (9,5-112,0)/159 | 0,234 |
| Leucocitos, 103/μl | 7,76 (5,75-11,16)/593 | 7,67 (5,60-10,90)/417 | 8,30 (5,95-11,95)/176 | 0,173 |
| Recuento de linfocitos por μl | 0,69 (0,41-0,94)/595 | 0,70 (0,46-1,00)/422 | 0,60 (0,40-0,90)/173 | 0,083 |
| Ratio PCR/linfocitos | 34,9 (13,0-108,9)/564 | 31,2 (12,9-101,3)/405 | 42,1 (13,5-143,7)/159 | 0,119 |
| IL-6, pg/ml | 107 (40-225)/79 | 96 (38-203)/59 | 144 (82-493)/20 | 0,063 |
| LDH, U/l | 432 (348-536)/633 | 404 (339-514)/384 | 487 (393-643)/152 | < 10–6 |
| Procalcitonina, ng/ml | 0,20 (0,10-0,56)/422 | 0,18 (0,09-0,50)/305 | 0,28 (0,13-0,86)/117 | < 0,001 |
| Plaquetas, 1.000/mm3 | 220 (164-298)/601 | 224 (165-302)/405 | 214 (156-284)/176 | 0,312 |
| Bilirrubina, mg/dl | 0,65 (0,42-0,98)/522 | 0,61 (0,40-0,93)/379 | 0,70 (0,42-1,00)/143 | 0,535 |
| TGP, U/l | 38 (25-63)/580 | 38 (26-63)/414 | 37 (25-59)/166 | 0,514 |
| Creatinina, mg/dl | 0,85 (0,69-1,13)/592 | 0,83 (0,67-1,04)/421 | 0,96 (0,72-1,42)/171 | < 10–4 |
| Urea, mg/dl | 40 (29-57)/436 | 36 (26-50)/295 | 47 (35-69)/141 | < 10–8 |
| Troponina, ng/ml | 12,3 (5,0-28,0)/319 | 11,0 (4,7-22,7)/233 | 15,9 (5,8-53,0)/86 | 0,006 |
| NT-proBNP, pg/ml | 456 (125-1206)/87 | 326 (123-896)/54 | 603 (288-1638)/33 | 0,034 |
| Hematocrito, % | 39,0 (35,7-43,0)/560 | 39,1 (36,0-43,0)/394 | 38,5 (35,0-42,0)/166 | 0,041 |
| Lactato, mmol/l | 1,50 (1,11-2,00)/402 | 1,41 (1,10-1,83)/286 | 1,67 (1,21-2,20)/116 | 0,002 |
Los datos se expresan como mediana (rango intercuartílico) o recuento (porcentaje). Para las variables numéricas, se presentan los recuentos totales para cada casilla. Los valores p se calcularon con la prueba de Mann-Whitney para las variables numéricas y la prueba exacta de Fisher para las variables categóricas.
APACHE: Acute Physiology and Chronic Health disease Classification System; EPOC: enfermedad pulmonar obstructiva crónica; IL-6: interleucina-6; LDH: lactato deshidrogenasa; mg/ml: miligramo por mililitro; μl: microlitro; mmol/l: milimoles por litro; ng/ml: nanogramo por mililitro; NT-proBNP: prohormona N-terminal del péptido natriurético cerebral; PaO2/FiO2: ratio presión parcial de oxígeno arterial/fracción de oxígeno inspiratorio; PCR: proteína C reactiva; pg/ml: picogramo por mililitro; SOFA: evaluación de fallo orgánico secuencial; SpO2: saturación de oxihemoglobina periférica; TGP: transaminasa glutámico-pirúvica; U/l: unidades por litro.
Tabla 2.
Factores de riesgo asociados a la mortalidad en UCI-regresión logística multivariable
| Factores de riesgo basales para la mortalidad en UCI (N = 270) | ||
|---|---|---|
| Variables | OR multivariante (IC del 95%) | Valor p |
| Edad, años | 1,054 (1,011, 1,099) | 0,014 |
| SOFA | 1,099 (0,947, 1,275) | 0,215 |
| APACHE II por incremento de 5 puntos | 1,508 (1,081, 2,104) | 0,015 |
| Diabetes mellitus | 1,831 (0,428, 7,838) | 0,415 |
| Enfermedad renal crónica | 0,914 (0,226, 3,691) | 0,900 |
| Neoplasia | 1,866 (0,360, 9,678) | 0,458 |
| Uso crónico de corticoides | 3,030 (0,573, 16,027) | 0,192 |
| Fármacos antiplaquetarios | 1,175 (0,422, 3,270) | 0,758 |
| Disnea | 0,716 (0,216, 2,368) | 0,584 |
| Presión arterial media, mmHg | 1,005 (0,981, 1,029) | 0,706 |
| PaO2/FiO2 < 100 | 1 (Ref.) | – |
| PaO2/FiO2 100-200 | 0,629 (0,293, 1,350) | 0,234 |
| PaO2/FiO2 > 200 | 0,659 (0,203, 2,139) | 0,488 |
| Ratio ventilatoria | 1,072 (0,591, 1,946) | 0,819 |
| Recuento linfocitario por ml | 1,038 (0,570, 1,889) | 0,903 |
| Ratio PCR/linfocitos | 1,001 (0,998, 1,004) | 0,625 |
| Creatinina, mg/dl | 2,560 (0,842, 7,784) | 0,097 |
| Hematocrito, % | 0,964 (0,873, 1,066) | 0,477 |
| Incremento de dímero D por 100 ng/ml | 0,997 (0,982, 1,011) | 0,644 |
| Seudo-R2 global 0,277 | ||
| Complicaciones asociadas a la mortalidad en UCI (N = 660) | ||
| Edad, años | 1,049 (1,029, 1,069) | < 0,0001 |
| SDRA | 1,504 (0,683, 3,309) | 0,3106 |
| Shock | 2,150 (1,347, 3,432) | 0,0013 |
| Hemorragia | 0,521 (0,247, 1,096) | 0,0856 |
| Paro cardiaco | 11,099 (3,389, 36,353) | 0,0001 |
| Insuficiencia cardiaca | 2,670 (0,959, 7,428) | 0,0600 |
| Arritmias | 1,288 (0,753, 2,202) | 0,3553 |
| Accidente cerebrovascular isquémico | 3,516 (0,962, 12,856) | 0,0573 |
| Insuficiencia renal aguda | 2,468 (1,628, 3,741) | <0,0001 |
| Coinfección respiratoria | 1,119 (0,712, 1,757) | 0,6260 |
| Neumonía | 0,979 (0,462, 2,076) | 0,9557 |
| Bacteriemia | 1,271 (0,803, 2,010) | 0,3057 |
| Shock séptico | 3,224 (1,486, 6,994) | 0,0030 |
| Seudo-R2 global 0,207 | ||
Se presentan 2 modelos de regresión logística multivariable: el primero de ellos utilizando factores predictivos del ingreso en UCI y el segundo utilizando las complicaciones como factores predictivos.
APACHE: Acute Physiology and Chronic Health disease Classification System; mg/ml: miligramo por mililitro; ng/ml: nanogramo por mililitro; OR: odds ratio; PaCO2: presión parcial de dióxido de carbono; PaO2/FiO2: ratio presión parcial de oxígeno arterial/fracción de oxígeno inspirado; PCR: proteína C reactiva; SDRA: síndrome de distrés respiratorio agudo; SOFA: evaluación de fallo orgánico secuencial; SpO2: saturación de oxihemoglobina periférica; UCI: unidad de cuidados intensivos.
Hallazgos de laboratorio
Los marcadores inflamatorios importantes eran significativamente más altos en los no supervivientes al ingreso en la UCI (tabla 1): ferritina (1.480 [RIC: 918-2.358] vs. 1.174 [RIC: 553-1.882]; p = 0,010), dímero D (1.599 [697-3.810] vs. 940 [RIC: 576-2.030]; p = 0,002), procalcitonina (PCT) (0,28 [RIC: 0,13- 0,86] vs. 0,18 [RIC: 0,09-0,50]; p < 0,001) y lactato deshidrogenasa (487 [RIC: 393-643] vs. 404 [RIC: 339-514]; p < 0,001). Los valores de troponina de alta sensibilidad i (16 [RIC: 5-53] vs. 11 [RIC: 4-22]; p = 0,006], prohormona N-terminal del péptido natriurético cerebral (603 [RIC: 288-1.638] vs. 326 [RIC: 123-896]; p = 0,034), lactato (1,6 [RIC: 1,1-2,2] vs. 1,4 [RIC: 1,1-1,8]; p = 0,002) y creatinina (0,96 [RIC: 0,72-1,42] vs. 0,83 [RIC: 0,67-1,04]; p < 0,001) fueron también significativamente más altos en los no supervivientes. El mismo hallazgo fue observado entre supervivientes y no supervivientes en cuanto a los peores valores máximos para cada marcador de laboratorio (tabla S1). El modelo de regresión multivariable reflejó que, durante la estancia en la UCI, los valores de PCT (OR 1,06; IC del 95%: 1,01-1,11, p = 0,010) y plaquetas (OR 0,97; IC del 95%: 0,993-1,000, p = 0,045) estuvieron asociados a un mayor riesgo de muerte (tabla S2).
Soporte respiratorio y estrategias complementarias
En 199 de los 667 pacientes se eligió oxigenoterapia de alto flujo por cánula nasal (HFNT) o ventilación no invasiva (VNI) como primera opción terapéutica para soporte respiratorio, siendo HFNT (165, 24%) más común que VNI (34, 5,1%). Además, se utilizó HFNT como primera línea de tratamiento para soporte respiratorio en el 30% de los supervivientes y en solo el 11% de los no supervivientes (p < 0,001). Se necesitó soporte respiratorio invasivo en 494 (74%) pacientes, siendo necesario en 182 de los 203 no supervivientes (89%), lo cual fue significativamente superior (p < 0,001) que en los supervivientes (312, 67%). Los 19 no supervivientes que no recibieron soporte respiratorio tenían orden de no intubar. El tiempo medio desde el inicio de los síntomas y el ingreso hospitalario hasta la VM fue de 10 días (RIC: 8-14) y 3 (RIC:1-6), respectivamente, sin diferencias entre supervivientes y no supervivientes (tabla 3 ). En cuanto a las terapias complementarias, la maniobra de reclutamiento pulmonar fue la más común, aplicándose en el 78% de los pacientes, sin diferencias entre supervivientes y no supervivientes. También se utilizaron a menudo otras terapias, tales como el posicionamiento prono y el uso de bloqueantes neuromusculares (395 [62%] y 326 [69%], respectivamente), más frecuentemente aplicadas en los pacientes fallecidos (145 [76%] vs. 250 [56%]; p < 0,001 y 135 [80%] vs. 191 [62%]; p < 0,001] (tabla 3).
Tabla 3.
Ventilación, terapias complementarias y tratamiento farmacológico durante la estancia en UCI
| Total | Supervivientes | No supervivientes | Valor P | |
|---|---|---|---|---|
| (n = 663) | (n = 460) | (n = 203) | ||
| Modos de ventilación | ||||
| Ventilación mecánica | 494/663 (74,51%) | 312/460 (67,83%) | 182/203 (89,66%) | < 10–9 |
| Ventilación mecánica como 1.ª intención | 419/663 (63,20%) | 259/460 (56,30%) | 160/203 (78,82%) | < 10–7 |
| Días desde el inicio de los síntomas hasta la ventilación mecánica | 10 (8-14)/488 | 10 (7-14)/308 | 11 [8-15]/ 180 | 0,108 |
| Días desde el ingreso hospitalario hasta la ventilación mecánica | 3 (1-6)/494 | 3 (1-6)/312 | 4 [1-7] /182 | 0,097 |
| HFNT como 1.a intención | 165/663 (24,89%) | 142/460 (30,87%) | 23/203 (11,33%) | < 10–7 |
| HFNT tras extubación | 112/419 (26,73%) | 103/259 (39,77%) | 9/160 (5,62%) | < 10–15 |
| VNI como 1.a intención | 34/663 (5,13%) | 22/460 (4,78%) | 12/203 (5,91%) | 0,568 |
| VNI tras extubación | 27/419 (6,44%) | 25/259 (9,65%) | 2/160 (1,25%) | < 0,001 |
| Terapias complementarias | ||||
| Maniobras de reclutamiento | 296/375 (78,93%) | 194/241 (80,50%) | 102/134 (76,12%) | 0,355 |
| Posicionamiento prono | 395/635 (62,20%) | 250/445 (56,18%) | 145/190 (76,32%) | < 10–5 |
| BNM | 326/472 (69,07%) | 191/305 (62,62%) | 135/167 (80,84%) | < 10–4 |
| ECMO | 15/647 (2,32%) | 6/453 (1,32%) | 9/194 (4,64%) | 0,019 |
| Eliminación extracorporeal de CO2 | 10/647 (1,55%) | 1/453 (0,22%) | 9/194 (4,64%) | < 0,001 |
| Reemplazo renal | 60/647 (9,27%) | 18/453 (3,97%) | 42/194 (21,65%) | < 10–10 |
| Terapias farmacológicas | ||||
| Lopinavir/ritonavir | 432/663 (65,16%) | 302/460 (65,65%) | 130/203 (64,04%) | 0,724 |
| Hidroxicloroquina | 597/663 (90,05%) | 418/460 (90,87%) | 179/203 (88,18%) | 0,324 |
| Remdesivir | 19/663 (2,87%) | 16/460 (3,48%) | 3/203 (1,48%) | 0,208 |
| Interferón | 168/663 (25,34%) | 106/460 (23,04%) | 62/203 (30,54%) | 0,043 |
| Tocilizumab | 282/663 (42,53%) | 195/460 (42,39%) | 87/203 (42,86%) | 0,932 |
| Azitromicina | 496/663 (74,81%) | 354/460 (76,96%) | 142/203 (69,95%) | 0,065 |
| Corticoides | 506/663 (76,32%) | 353/460 (76,74%) | 153/203 (75,37%) | 0,693 |
| Antibióticos profilácticos | 604/663 (91,10%) | 419/460 (91,09%) | 185/203 (91,13%) | 0,999 |
| Anticoagulación | 106/663 (15,99%) | 59/460 (12,83%) | 47/203 (23,15%) | 0,001 |
| Fármacos vasoactivos | 436/663 (65,76%) | 273/460 (59,35%) | 163/203 (80,30%) | < 10–7 |
Los datos se expresan como mediana (rango intercuartílico) o recuento (porcentaje). Para las variables numéricas, se presentan los recuentos totales para cada casilla. Los valores p se calcularon con la prueba de Mann-Whitney para las variables numéricas y la prueba exacta de Fisher para las variables categóricas.
BNM: bloqueantes neuromusculares; CO2: dióxido de carbono; ECMO: oxigenación de membrana extracorpórea; HFNT: oxigenoterapia de alto flujo por cánula nasal; VNI: ventilación no invasiva.
Terapia farmacológica
Los tratamientos administrados se muestran en la tabla 3. No observamos diferencias en cuanto a terapia farmacológica entre supervivientes y no supervivientes, excepto en lo que se refiere al uso de fármacos vasoactivos (273 [59%] vs. 183 [80%]; p < 0,001) (tabla 3). Entre los antivirales utilizados, destacó el uso de hidroxicloroquina, administrada a 597 (90%) pacientes. El uso de remdesivir 19 (3%) fue anecdótico. En cuanto a antiinflamatorios, se administraron a menudo corticoides 506 (76%) y tocilizumab 282 (42%). Debe resaltarse que se utilizaron dosis totales anticoagulantes de heparina en 106 (15%) de los pacientes, siendo más utilizados en pacientes fallecidos (23% vs. 13%, p < 0,001).
Complicaciones médicas e infecciosas
Las complicaciones se reflejan en la tabla 4 . El SDRA fue la complicación más comúnmente diagnosticada en 597 (90%) pacientes, seguido de insuficiencia renal aguda (IRA) (227; 34%). Complicaciones menos comunes, pero clínicamente relevantes, fueron shock (150; 23%), arritmias (97; 15%) y embolia pulmonar (72; 11%). Algunas de ellas fueron más frecuentes en los no supervivientes, tales como SDRA (95% vs. 89%; p = 0,009), IRA (58% vs. 24%; p < 10–16), shock (42% vs. 14%; p < 10–13) y arritmias (24% vs. 11%; p < 10–4). También fueron más frecuentes en los no supervivientes las superinfecciones respiratorias, bacteriemias y los shocks sépticos (33% vs. 25%; p = 0,03, 33% vs. 23%; p = 0,01 y 15% vs. 3%, p = 10–7), respectivamente. Sin embargo, la embolia pulmonar no reflejó diferencias entre los grupos (12% vs. 10%, p = 0,59). La superinfección respiratoria bacteriana/fúngica (176; 26%) y la bacteriemia (172; 25%) fueron muy frecuentes y destacaron entre el resto de infecciones reportadas. Ambas complicaciones, junto con el shock séptico, fueron más frecuentes en los no supervivientes (33% vs. 25%; p = 0,029, 33% vs. 23%; p = 0,010 y 15% vs. 3%, p < 0,0001). Los pacientes con IRA (OR: 2,468 [1,628, 3,741], p < 10–4), paro cardiaco (OR: 11,099 [3,389, 36,353], p = 0,0001) y shock séptico (OR: 3,224 [1,486, 6,994], p = 0,002] tuvieron un riesgo incrementado de muerte (tabla 4).
Tabla 4.
Complicaciones y resultados en UCI
| Total | Supervivientes | No supervivientes | Valor p | |
|---|---|---|---|---|
| (n = 663) | (n = 460) | (n = 203) | ||
| Complicaciones médicas | ||||
| SDRA | 601/663 (90,65%) | 408/460 (88,70%) | 193/203 (95,07%) | 0,009 |
| Shock | 150/663 (22,62%) | 65/460 (14,13%) | 85/203 (41,87%) | < 10–13 |
| Hemorragia | 52/663 (7,84%) | 35/460 (7,61%) | 17/203 (8,37%) | 0,755 |
| Tromboembolia | 72/663 (10,86%) | 48/460 (10,43%) | 24/203 (11,82%) | 0,590 |
| Paro cardiaco | 26/663 (3,92%) | 4/460 (0,87%) | 22/203 (10,84%) | < 10–8 |
| Insuficiencia cardiaca | 22/663 (3,32%) | 8/460 (1,74%) | 14/203 (6,90%) | 0,001 |
| Arritmias | 97/663 (14,63%) | 49/460 (10,65%) | 48/203 (23,65%) | < 10–4 |
| Accidente cerebrovascular isquémico | 12/663 (1,81%) | 5/460 (1,09%) | 7/203 (3,45%) | 0,053 |
| IRA | 227/663 (34,24%) | 109/460 (23,70%) | 118/203 (58,13%) | < 10–16 |
| Elevación de enzimas hepáticas | 324/663 (48,87%) | 226/460 (49,13%) | 98/203 (48,28%) | 0,866 |
| Complicaciones neurológicas no específicas | 33/663 (4,98%) | 28/460 (6,09%) | 5/203 (2,46%) | 0,053 |
| Neumotórax | 33/663 (4,98%) | 24/460 (5,22%) | 9/203 (4,43%) | 0,847 |
| Extubación fallida | 34/663 (5,13%) | 19/460 (4,13%) | 15/203 (7,39%) | 0,087 |
| Hiperglucemia | 156/663 (23,53%) | 102/460 (22,17%) | 54/203 (26,60%) | 0,234 |
| Complicaciones infecciosas | ||||
| Superinfección respiratoria | 180/663 (27,15%) | 113/460 (24,57%) | 67/203 (33,00%) | 0,029 |
| Neumonía | 42/663 (6,33%) | 27/460 (5,87%) | 15/203 (7,39%) | 0,490 |
| Bacteriemia | 174/663 (26,24%) | 107/460 (23,26%) | 67/203 (33,00%) | 0,010 |
| Infección del tracto urinario | 79/663 (11,92%) | 54/460 (11,74%) | 25/203 (12,32%) | 0,897 |
| Shock séptico | 42/663 (6,33%) | 12/460 (2,61%) | 30/203 (14,78%) | < 10–7 |
| Resultados | ||||
| Duración de estancia en UCI | 12 ([6-21)/663 | 12 (6-21)/460 | 13 (6-20)/203 | 0,561 |
| Días de ventilación | 13 (7-21)/494 | 12 (7-20)/312 | 15 (8-22)/182 | 0,009 |
| Días sin ventilación | 8 (0-20)/663 | 16 (7-22)/460 | 0 (0-0)/203 | < 10–67 |
| Fallos de destete | 33/663 (6,68%)/494 | 22/312 (7,05%) | 11/182 (6,04%) | 0,713 |
| Días desde los síntomas hasta el alta de UCI o muerte | 24 (12-42)/662 | 24 (12-42] /459 | 26 (12-40)/203 | 0,591 |
Los datos se expresan como mediana (rango intercuartílico) o recuento (porcentaje). Para las variables numéricas, se presentan los recuentos totales para cada casilla. Los valores p se calcularon con la prueba de Mann-Whitney para las variables numéricas y la prueba exacta de Fisher para las variables categóricas.
Los días de ventilación incluyen únicamente a los pacientes que recibieron ventilación mecánica.
SDRA: síndrome de distrés respiratorio agudo; UCI: Unidad de Cuidados Intensivos; IRA: insuficiencia renal aguda, hace referencia a los estadios ii o iii de la clasificación Kidney Disease: Improving Global Outcomes (KDIGO).
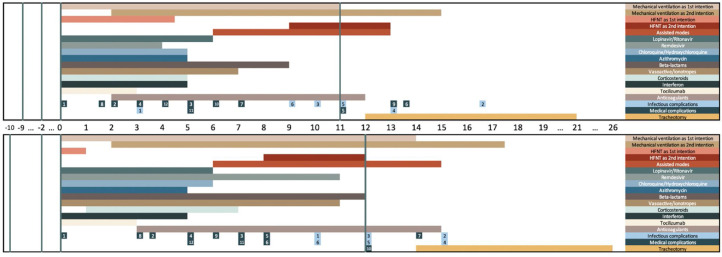
La cronología de las complicaciones y tratamientos se refleja en la figura 1 y la figura S1.
Figura 1.
Cronología de los tratamientos y complicaciones durante la estancia en UCI para pacientes dados de alta (gráfico superior) y fallecidos (gráfico inferior). La parte superior del gráfico representa los pacientes dados de alta. La parte inferior del gráfico representa los pacientes fallecidos. El día 0 es el día de ingreso en UCI. Las líneas verticales representan el día de inicio de los síntomas, el día de ingreso hospitalario, el día de ingreso en UCI (día 0) y el día del alta (gráfico superior) o muerte (gráfico inferior). Cada barra horizontal representa el día medio de inicio y el día medio de finalización de cada tratamiento entre los pacientes tratados. Las complicaciones se representan como el día medio de inicio entre los pacientes con complicaciones.
Complicaciones infecciosas: 1: shock séptico; 2: neumonía; 3: bacteriemia; 4: infección urinaria; 5: coinfección respiratoria; 6: otras complicaciones infecciosas.Complicaciones médicas: 1: SDRA; 2: insuficiencia renal aguda; 3: arritmias; 4: shock; 5: hemorragia; 6: complicaciones neurológicas no específicas; 7: tromboembolia; 8: insuficiencia cardiaca; 9: paro cardiaco; 10: accidente cerebrovascular isquémico; 11: elevación de enzimas hepáticas; 12: hiperglucemia. UCI: Unidad de Cuidados Intensivos HFNT: Oxigenoterapia del alto flujo.
Resultados
La mortalidad global en UCI fue del 31% (203 pacientes). La estancia media en la UCI fue de 12 (6-21) días, sin diferencias entre supervivientes y no supervivientes 12 (6-21) vs. 13 (6-20); p = 0,56.
Discusión
En este estudio prospectivo de cohorte nacional, realizado en pacientes críticos de COVID-19, los varones mayores con comorbilidades prevalentes tales como hipertensión, obesidad y diabetes fueron predominantes, lo cual está en línea con los estudios previos3, 4, 5, 6, 7, 8, 9. Los no supervivientes estaban más enfermos, según reflejan las puntuaciones de las escalas APACHE II y SOFA y los parámetros basales de oxigenación, así como el alto uso de VM. Sin embargo, en el análisis multivariable, utilizando los datos recabados como referencia, solo la edad y APACHE II permanecieron como factores predictivos de la mortalidad en UCI, dificultando por tanto la predicción basal de la mortalidad. De hecho, un número significativo de los pacientes que recibieron VM podrían haber recibido el alta exitosa de UCI tras 2 semanas de ingreso. La mortalidad global en UCI fue del 31%, lo cual es similar a los reportes de SDRA no producido por COVID-1912.
Se registraron una gran variedad de complicaciones. IRA estadio ii o iii se situó entre las más comunes, diagnosticándose en una de cada 3 pacientes, asociándose a un mayor riesgo de mortalidad. El 50% de los pacientes que presentaban esta complicación fallecieron en la UCI, un valor que se elevó al 70% cuando se precisaron técnicas de reemplazo renal. En el análisis multivariable, IRA estadio ii-iii confirió una odds ratio de 1,9 para la mortalidad en la UCI. Considerando que la predicción de la mortalidad como referencia fue débil y que esta complicación apareció a menudo de forma temprana, IRA podría representar un intensificador para caracterizar realísticamente el cuadro clínico de un paciente individual de COVID-19. Las complicaciones cardiacas tuvieron una prevalencia similar a los estudios previos, sin diferencias entre los grupos3, 9. Además, la embolia pulmonar, aunque fue frecuente, no incrementó el riesgo de muerte. La embolia pulmonar es una complicación difícil de confirmar, ya que se precisa una prueba radiológica. Se desconoce si esta última subestimó la incidencia de los casos más graves. De hecho, los no supervivientes recibieron frecuentemente el doble de anticoagulación, hecho que podría haberse desencadenado por los altos niveles de dímero D en este subgrupo. Sin embargo, ni los dímeros D basales o máximos predijeron de manera independiente la mortalidad en esta cohorte, hallazgo que es diferencial con respecto a otros estudios. Nuestros resultados refuerzan la necesidad de caracterizar mejor este fenómeno y de abordar debidamente el efecto de utilizar anticoagulación terapéutica profiláctica en los pacientes más graves, lo cual fue común en nuestra cohorte, una estrategia no exenta de complicaciones potenciales. Aunque la tasa de hemorragia no era significativamente diferente entre los grupos, nuestra metodología no nos permite afirmar si esta estrategia podría considerarse segura o efectiva en esta población. Por último, el 26% de los pacientes fueron diagnosticados de superinfección respiratoria y el 25% de bacteriemia, ambas prevalentes en los no supervivientes. Cuando dichas complicaciones evolucionaron a shock séptico, la odds ratio de mortalidad se triplicó.
En cuanto a los marcadores de laboratorio, únicamente el máximo nivel de PCT y el recuento plaquetario fueron predictivos de la mortalidad en el análisis multivariante. Los niveles máximos de interleucina-6 fueron superiores en los no supervivientes, pero los niveles máximos se alejaron de los descritos en el síndrome de tormenta de citocinas13, una entidad que han utilizado muchos investigadores para defender el uso de la terapia antiinflamatoria14, 15. En esta misma línea, los niveles de ferritina fueron también muy inferiores a los previamente reportados en las formas graves de linfohistiocitosis hemofagocítica (LHH), lo cual sugiere que estos 2 procesos no desempeñan un papel significativo en el resultado de los pacientes con COVID-1916. A pesar de ello, ambos grupos recibieron a menudo terapia farmacológica, administrándose esteroides a 3 de 4 pacientes, y tocilizumab a prácticamente el 40%, sin diferencias entre grupos. En nuestra opinión, esto es altamente preocupante, dada la escasez de datos sobre la eficacia y la seguridad de estos tratamientos.
Este estudio tiene diversos puntos fuertes. En primer lugar, este estudio multicéntrico aportó una descripción altamente detallada del cuadro clínico de los pacientes de COVID-19 en la UCI, tras incluir a 663 pacientes con datos completos de resultados. En segundo lugar, a nuestro mejor entender, se trata del primer estudio que explora prospectivamente la asociación entre las características al ingreso y la mortalidad en UCI, así como la asociación entre la evolución clínica en UCI y el riesgo de muerte. Sin embargo, reconocemos ciertas limitaciones. En primer lugar, los estudios observacionales, especialmente de naturaleza multicéntrica, tienden a inducir errores al recabar los datos. Por tal motivo, se suministró un manual conciso a todos los investigadores al inicio del estudio. De igual modo, 2 investigadores revisaron la precisión de los datos y descartaron los valores ocasionales no fiables. En segundo lugar, es plausible que, debido a la carga de los cuidados experimentada por los facultativos participantes durante el periodo de estudio, algunos de los pacientes ingresados en la UCI no hubieran sido incluidos en la base de datos. Sin embargo, dada la naturaleza del registro, consideramos que no se favoreció un sesgo de selección. En tercer lugar, en el momento de este análisis, como esta información no estaba inicialmente recabada, carecíamos de datos sobre los diferentes tratamientos farmacológicos administrados antes del ingreso en la UCI. Por último, en el momento del análisis, 297 (30%) pacientes no tenían resultado definitivo con respecto al alta de UCI o la muerte y, por tanto, no fueron incluidos en el análisis.
Conclusiones
Los pacientes críticos de COVID-19 presentan a menudo insuficiencia respiratoria aguda con alta mortalidad en UCI, lo cual es similar a otros casos de SDRA no producido por COVID. La IRA y el shock séptico son comunes y confieren un riesgo incrementado de mortalidad.
Declaraciones
Aprobación ética y consentimiento de participación
El estudio fue aprobado por el Comité de Ética de Euskadi, España. La necesidad de consentimiento informado de los participantes fue considerada por cada centro participante.
Consentimiento para publicación
No aplicable.
Disponibilidad de los datos y materiales
Pueden solicitarse razonablemente los conjuntos de datos utilizados o analizados durante el presente estudio al autor de correspondencia.
Autoría
RMA participó en las cuestiones de investigación y fue el responsable de la redacción del documento.
CA participó en las cuestiones de investigación, contribuyó al análisis de los datos y corrigió el documento.
AG fue el responsable del análisis de los datos y corrigió el documento final.
EA fue el responsable del diseño del conjunto de datos, participó en las cuestiones de investigación y corrigió el documento final.
CF y MH participaron en la generación de las cuestiones de investigación, contribuyeron al análisis de los datos y corrigieron el documento. Tuvieron pleno acceso a todos los datos de estudio y asumen la responsabilidad de la integridad de los datos y la precisión del análisis de los mismos.
Financiación
La colaboración de un escritor médico ha sido financiada por MSD España. Merck y Sharp no han participado en el diseño, la elaboración, el análisis y las conclusiones del estudio.
Conflicto de intereses
C. Ferrando, C. Aldecoa, F. Ramasco, G. Tamayo y E. Maseda son miembros del Comité Editorial de la REDAR. No han participado en el proceso de revisión del manuscrito.
Footnotes
Se puede consultar material adicional a este artículo en su versión electrónica disponible en doi:10.1016/j.redar.2020.07.003.
Anexo 1. Integrantes de UCI españolas para COVID-19
Hospital Clínic de Barcelona, Department of Anesthesiology and Critical Care: Carlos Ferrando, Graciela, Martínez-Pallí, Jordi Mercadal, Guido Muñoz, Ricard Mellado, Adriana Jacas, Marina Vendrell, Gerard Sánchez-Etayo, Amalia Alcón, Isabel Belda, Mercé Agustí, Albert Carramiñana, Isabel Gracia, Miriam Panzeri, Irene León, Jaume Balust, Ricard Navarro, María José Arguís, Maria José Carretero, Cristina Ibáñez, Juan Perdomo, Antonio López, Manuel López, Tomás Cuñat, Marta Ubré, Antonio Ojeda, Andrea Calvo, Eva Rivas, Paola Hurtado, Roger Pujol, Nuria Martín, Javier Tercero, Pepe Sanahuja, Marta Magaldi, Miquel Coca, Elena del Rio, Julia Martínez-Ocon, Paula Masgoret, Angel Caballero, Raquel Risco, Lidia Gómez, Nicolás de Riva, Ana Ruiz, Beatriz, Tena, Sebastián Jaramillo, Jose María Balibrea, Francisco Borja de Lacy, Ana Otero, Ainitze Ibarzabal, Raquel Bravo, Anna Carreras, Daniel Martín-Barreda, Alfonso Jesús Alias, Mariano Balaguer, Jorge Aliaga, Alex Almuedo, Joan Ramón Alonso, Rut Andrea, Gerard Sergi Angelès, Marilyn Arias, Fátima Aziz, Joan Ramon Badía, Enric Barbeta, Toni Torres, Guillem Batiste, Pau Benet, Xavi Borrat, María Borrell, Ernest Bragulat, Inmaculada Carmona, Manuel Castellà, Pedro Castro, Joan Ceravalls, Oscar Comino, Claudia Cucciniello, Clàudia De Deray, Oriol De Diego, Paula De la Matta, Marta Farrero, Javier Fernández, Sara Fernández, Anna Fernández, Miquel Ferrer, Ana Fervienza, María Tallo Forga, Daniel Forné, Clàudia Galán, Andrea Gomez, Eduard Guasch, Maria Hernández- Tejero, Beltrán Jiménez, Pere Leyes, Teresa López, José Antonio Martínez, Jose Muñoz, Ricard Navarro, Josep Maria Nicolás, José Tomás Ortiz, Anna Peiró, Manuel Pérez, Esteban Poch, Margarida Pujol, Eduard Quintana, Bartomeu Ramis, Enric Reverter, Irene Rovira, Pablo Ruiz, Elena Sandoval, Stefan Schneider, Oriol Sibila, Carla Solé, Alex Soriano, Dolors Soy, M. Suárez, Adrián Téllez, Néstor David Toapanta, Antoni Torres, Xavier Urra.
Hospital Universitario Río Hortega: César Aldecoa, Alicia Bordell, Silvia Martín, Judith Andrés.
Hospital Universitario Cruces: Alberto Martínez Ruiz, Gonzalo Tamayo Medel, Iñaki Bilbao Villasante, Fernando Iturri Clavero, Covadonga Peralta Álvarez, Julia T. Herrera, Andrea García Trancho, Iñaki Sainz Mandiola, Carmen Ruano Suarez, Angela Ruiz Bocos, Eneritz Urrutia Izagirre, Pablo Ortiz de Urbina Fernández, Naiara Apodaka, Leire Prieto Molano, Eunate Ganuza, Iratxe Vallinas, Karmele de Orte, Celia González Paniagua, Gemma Ortiz, Mireia Pérez, Marta López, Estíbaliz Bárcena, Erik Urutxurtu, Maria Jesús Maroño, Blanca Escontrela. Aitziber Ereñozaga, Deiene Lasuen, Ainhoa Zabal, Ane Guereca.
Hospital del Mar: Ramón Adalia, Luigi Zattera, Irina Adalid Hernandez, Leire Larrañaga Altuna, Aina Serrallonga Castells, Adriana Vilchez Garcia, María Núñez, Lorena Román.
Hospital General Universitario De Ciudad Real: Francisco Javier Redondo Calvo, Ruben Villazala González, Victor Baladron González, Patricia Faba, Omar Montenegro, Natalia Bejarano Ramírez.
Complejo Asistencial Universitario León: Sergio Marcos Contreras, Alejandro Garcia Rodríguez, Saleta Rey Vázquez, Cristina Garcia Pérez, Eva Higuera Miguelez, Irene Pérez Blanco, David García Rivera.
Hospital Urduliz: Ane Martín de la Fuente, Marta Pardo, Vanessa Rodriguez, Unai Bengoetxea.
Hospital Universitario de la Princesa: Fernando Ramasco, Sheila Olga Santidrián Bernal, Alvar Santa Cruz Hernando.
Hospital Povisa: Beatriz Domínguez, Ana Vázquez Lima.
Hospital Ramón y Cajal: Ángel Candela, Ismael A Acevedo Bambaren, Maria Isabel Albala Blanco, Paloma Alonso Montoiro, Fernando Álvarez Utrera, Juan Avellanosa Esteruelas, Amal Azzam López, Alberto José Balvis Balvis, María Beltrán Martín, Jacobo Benatar Haserfaty, Alberto Berruezo Camacho, Laura Betolaza Weimer, Maria del Mar Carbonell Soto, Cristina Carrasco Seral, Cristina Cerro Zaballos, Elizabeth Claros Llamas, Pilar Coleta Orduna, Ingrid P. Cortes Forero, Pascual Agustín, Crespo Aliseda, María Angélica de Pablo Pajares, Yolanda Díez Remesal, Trinidad Dorado Díaz, Noemí Echevarría Blasco, María Elena Elías Martín, Javier Felices Triviño, Natalia Fernández López, Cristina Fernández Martín, Natalia Ferreiro Pozuelo, Luis Gajate Martín, Clara Gallego Santos, Diego Gil Mayo, María Gómez Rojo, Claudia González Cibrián, Elena Herrera López, Borja Hinojal Olmedillo, Berta Iglesias Gallego, Sassan Khonsari, María Nuria Mane Ruiz, María Manzanero Arroyo, Ana María Mariscal Ortega, Sara Martín Burcio, María del Carmen Martín González, Ascensión Martín Grande, Jose Juan Martín López, Cecilia Martín Rabes, Marcos Martínez Borja, Nilda Martínez Castro, Adolfo Martínez Pérez, Snejana Matcan, Cristina Medrano Viñas, Lisset Miguel Herrera, Adrián Mira Betancur, María Montiel Carbajo, Javier Moya Moradas, Lorena Muñoz Pérez, Mónica Nuñez Murias, Eva Ordiales González, Óscar Ordoñez Recio, Miguel Ángel Palomero Rodriguez, Diego Parise Roux, Lucia Pereira Torres, David Pestaña Lagunas, Juana María Pinto Corraliza, Marian Prieto Rodrigo, Inmaculada Rodriguez Diaz-Regaño, David Rodriguez Esteban, Víctor Rojas Pernia, Álvaro Ruigómez Saiz, Bárbara Saavedra Villarino, Noemí Samaranch Palero, Gloria Santos Pérez, Jaume Serna Pérez, Ana Belén Serrano Romero, Jesús Tercero López, Carlos Tiscar García, Marta de la Torre Concostrina, Eva María Ureta Mesa, Eva Velasco Olarte, Judith Villahoz Martínez, Raúl Villalaba Palacios, Gema Villanueva García, Cristina Vogel de Medeiros.
Hospital Universitario Severo Ochoa: Soraya Gholamian Ovejero, Marta Vicente Orgaz, Patricia Lloreda Herradon, Cristina Crespo Gómez.
Hospital Universitario de Gran Canaria Dr. Negrín: Tatiana Sarmiento-Trujillo.
Hospital de Terrassa: Noemí García Medina, María Martínez García, Carles Espinós Ramírez, Nabil Mouhaffel Rivero, Jose Antonio Bernia Gil.
Hospital Central de la Cruz Roja San José y Santa Adela: Sonsoles Martín.
Hospital de la Santa Creu i Sant Pau: María Victoria Moral, Josefina Galán, Pilar Paniagua, Sergio Pérez, Albert Bainac, Ana Arias, Elsa Ramil, Jorge Escudero.
Clínica Universidad de Navarra: Pablo Monedero, Carmen Cara, Andrea Lara, E. Mendez Martínez, Jorge Mendoza, Íñigo Rubio Baines. Medicina Preventiva y Salud Pública: Alfredo Gea, Alejandro Montero.
Hospital Universitario Dr. Peset Aleixandre: Rocío Armero Ibañez, Juan Vicente Llau Pitarch, Fernando Rauer Alcover, Cristina Álvarez Herreros, Cyntia Sánchez Martín, Lucía López Ocáriz Olmos, Marta Navas Moruno.
Complejo Hospitalario Universitario de Cáceres: Fernando García Montoto. MF. Mirón Rodriguez, Laura Fuentes Coco, Cristina Hernández Gamito, Antonio Barba Orejudo, Luis Gerardo Smith Vielma, Yasmina González Marín, Francisco de Borja Amador Penco, Marta Donoso Domínguez, Silvia Esquivel Ramírez.
Hospital Clínico Universitario de Valencia: José Antonio Carbonell, Berta Monleón López, Sara Martínez-Castro, Gerardo Aguilar.
Hospital Universitario a Coruña: María Gestal, Pablo Casas, Angel Outeiro Rosato, Andrea Naveiro Pan, María Alonso Portela, Adrián García Romar, Eva Mosquera Rodríguez, Diego Ruanova Seijo, Pablo Rama Maceiras.
Complexo Universitario de Ferrol: Francisco Castro-Ceoane, Esther Moreno López.
Hospital Clínico Universitario Lozano Blesa: Sergio Gil, Julia Guillén Antón, Patricia García-Consuegra Tirado, Aurora Callau Calvo, Laura Forés Lisbona, María Carbonell Romero, Belén Albericio Gil, Laura Pradal Jarne, María Soria Lozano, Diego Loscos López, Andrea Patiño Abarca.
Universal Doctors: Jordi Serrano.
UBIKARE: Javier Pérez-Asenjo, Ángel Díez-Domínguez, Ion Zubizarreta, Jon Ramos, Iosu Fernández.
Hospital Universitario La Paz: Emilio Maseda, Alejandro Suárez de la Rica, Javier Veganzones, Itziar Insausti, Javier Sagra, Sofía Díaz Carrasco, Ana Montero Feijoo, Julio Yagüe.
Hospital Universitario Gregorio Marañon: Ignacio Garutti.
Hospital San Joan Despí Moises Broggi: Eva Bassas Parga, Carmen Deiros Garcia, Elisenda Pujol Rosa, Ana Tejedor Navarro, Roser Font Gabernet, Maria José Bernat, Meritxell Serra Valls, Cristina Cobaleda Garcia-Bernalt, Jesus Fernanz Anton, Adriana Aponte Sierra, Lucia Gil Gomez, Olaia Guenaga Vaqueiro, Susana Hernandez Marin, Laura Pardo Pinzon, Sira Garcia Aranda, Carlos Briones Orejuela, Edgar Cortes Sanchez, Alejandro Romero Fernandez, Esther Fernández Sanjosé, Patricia Iglesias Garsabal, Guillermo Isidro Lopez, Ana Vicol, Sara Espejo Malagon, Maria Sanabra Loewe, Laura Grau Torradeflo, Lourdes Blanco Alcaide, Gloria Buenaventura Sanclemente, Pere Serra Pujol, Gustavo Cuadros Mendoza, Miroslawa Konarska, Fedra Bachs Almenara, Agnieszka Golska, Aleix Carmona Blesa, Arantxa Mas Serra.
Hospital Universitario Infanta Leonor: Javier Ripollés Melchor, Ana Nieto Moreno, Káteri Chao Novo, Sandra Gadín López, Elena Nieto Moreno, Bérénice Gutiérrez Tonal, Elena Lucena de Pablo, Barbara Algar Yañez, Beatriz Vázquez Rivero, Beatriz Nozal Mateo, Marina de Retes, Norma Aracil Escoda, Cristina Gallardo Mayo, Rosa Sanz González, Alicia Ruiz Escobar, Maria Laura Pelegrina López, Marina Valenzuela Peña, David Stolle Dueñas, Ane Abad Motos, Alfredo Abad-Gurumeta, Ana Tirado Errazquin, Elena Sáez Ruiz, Nerea Gómez Perez, Francisco de Borja Bau González.
Hospital sanitas CIMA: Cesar Morcillo Serra, Jessica Souto Higueras.
Hospital Universitario y Politécnico La Fé: Rosario Vicente, Raquel Ferrandis, Silvia Polo Martín, Azucena Pajares Moncho, Ignacio Moreno Puigdollers, Juan Pérez Artacho Cortés, Ana Moret Calvo, Ana Pi Peña, María Catalán Fernández.
Complexo hospitalario Universitario de Pontevedra: Marina Varela.
Hospital Arnau de Vilanova: María Isabel Forés Chiva.
Hospital General de Alicante: A. Javier Agulló.
Hospital Universitario Infanta Sofía: Antonio Pérez Ferrer.
Hospital Universitario San Juan de Alicante: Maria Galiana.
Hospital Nuestra Señora de Meritxell SAAS: Antoni Margarit, Válerie Mourre del Rio, Eva Heras Muxella, Anna Vidal.
Anexo. Material adicional
Bibliografía
- 1.Disponible en: https://www.who.int/news-room/detail/30-01-2020-statement-on-the-second-meeting-of-the-international-health-regulations-(2005)-emergency-committee-regarding-the-outbreak-of-novel-coronavirus-.(2019-ncov).
- 2.Siddiqi H.K., Mandeep R.M. COVID-19 illness in native immunosuppressed states: A clinical therapeutical staging proposal. J Heart Lung Transplant. 2020;39:405–407. doi: 10.1016/j.healun.2020.03.012. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.Zhou F., Yu T., Du R., Fan G., Liu Y., Liu Z. Clinical course and risk factors for mortality of adult inpatients with COVID-19 in Wuhan China: A retrospective cohort study. Lancet. 2020;395:1054–1062. doi: 10.1016/S0140-6736(20)30566-3. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.Grasselli G., Zangrillo A., Zanella A., Antonelli M., Cabrini L., Castelli A. Baseline characteristics and outcomes of 1591 patients infected with SARS-CoV-2 admitted to ICUs of the Lombardy region Italy. JAMA. 2020;323:1574–1581. doi: 10.1001/jama.2020.5394. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Richardson S., Hirsch J.S., Narasimhan M., Crawford J.M., McGinn T., Davison K.W. Presenting characteristics, comorbidities, and outcomes among 5700 patients hospitalized with COVID-19 in the New York city area. JAMA. 2020;22:e206775. doi: 10.1001/jama.2020.6775. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Wu C., Chen X., Cai Y., Xia J., Zhou X., Xu S. Risk factors associated with acute respiratory distress syndrome and deaths in patients with coronavirus disease 2019 pneumonia in Wuhan, China. JAMA Intern Med. 2020;13:e200994. doi: 10.1001/jamainternmed.2020.0994. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Feng Y., Ling Y., Bai T., Xie Y., Huang J., Li J. COVID-19 with different severity: A multicenter study of clinical features. Am J Respir Crit Care Med. 2020;201:1380–1388. doi: 10.1164/rccm.202002-0445OC. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.Chen T., Wu D., Chen H., Yan W., Yang D., Chen G. Clinical characteristics of 113 deceased patients with coronavirus disease 2019: Retrospective study. BMJ. 2020;368:m1091. doi: 10.1136/bmj.m1091. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.Yu A., Xu D., Fu S., Zhang J., Yang X., Xu L. Patients with COVID-19 in 19 ICUs in Wuhan China: A cross-sectional study. Crit Care. 2020;24:219. doi: 10.1186/s13054-020-02939-x. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.Von Elm E., Altman D.G., Egger M., Pocock S.J., Gotzsche P.C., Vanderbrouche J.P., STROBE Initiative Strengthening the Reporting of Observational Studies in Epidemiology (STROBE) statement: Guidelines for reporting observational studies. BMJ. 2007;335:806–808. doi: 10.1136/bmj.39335.541782.AD. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.WHO. Clinical management of severe acute respiratory infection when novel coronavirus (nCoV) infection is suspected: Interim guidance, 25 January 2020. Published January 25, 2020 [consultado 15 Abril 2020]. Disponible en: https://apps.who.int/iris/handle/10665/330854
- 12.Bellani G., Laffey J.G., Pham T., Fan E., Brochard L., Esteban A. Epidemiology, patterns of care, and mortality for patients with acute respiratory distress syndrome in intensive care units in 50 countries. JAMA. 2016;315:788–800. doi: 10.1001/jama.2016.0291. [DOI] [PubMed] [Google Scholar]
- 13.Maude S.L., Frey N., Shaw P.A., Aplenc R., Barrett D., Bunin N. Chimeric antigen receptor T cells for sustained remissions in leukemia. N Engl J Med. 2014;371:1507–1517. doi: 10.1056/NEJMoa1407222. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Mehta P., McAuley D.F., Brown M., Sanchez E., Tattersall R.S., Manson J.J., HLH Across Specialty Collaboration, UK COVID-19: Consider cytokine storm syndromes and immunosuppression. Lancet. 2020;385:1033–1034. doi: 10.1016/S0140-6736(20)30628-0. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.Toniati P., Piva S., Cattalini M., Garrafa E., Regola F., Castelli F. Tocilizumab for the treatment of severe COVID-19 pneumonia with hyperinflammatory syndrome and acute respiratory failure: A single center study of 100 patients in Brescia Italy. Autoimmun Rev. 2020;3:68–1025. doi: 10.1016/j.autrev.2020. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.Abou Shaar R., Eby C.S., Otrock Z.K. Serum ferritin trends are associated with survival in adult hemophagocytic lymphohistiocytosis. Blood. 2017;130(Suppl 1) doi: 10.1182/blood.V130.Suppl_1.2272.2272. 2272-2272. [DOI] [Google Scholar]
Associated Data
This section collects any data citations, data availability statements, or supplementary materials included in this article.