Abstract
目的
探讨异基因造血干细胞移植(allo-HSCT)前巩固化疗对第1次形态学完全缓解且微小残留病阴性(CR1/MRD−)中/高危急性髓系白血病(AML)患者预后的影响。
方法
对2010年1月至2019年3月在CR1/MRD−状态下接受allo-HSCT的155例中/高危AML(不含急性早幼粒细胞白血病)患者进行回顾性分析。
结果
全部155例患者中,102例获得CR1/MRD−后接受移植前巩固化疗(巩固组),53例获得CR1/MRD−后直接行allo-HSCT(非巩固组),两组中位年龄分别为39(18~56)岁、38(19~67)岁。巩固组、非巩固组移植后5年总生存率分别为(59.3±7.5)%、(62.2±6.9)%(P=0.919),无复发生存率分别为(53.0±8.9)%、(61.6±7.0)%(P=0.936),累积复发率分别为(21.9±5.4)%、(18.3±6.0)%(P=0.942),非复发死亡率分别为(22.4±4.3)%、(28.4±6.5)%(P=0.464)。多因素分析显示,移植前是否接受巩固化疗及其疗程(<2个/≥2个)对预后无显著影响。
结论
中/高危AML患者可在获得CR1/MRD−后直接进行allo-HSCT。
Keywords: 白血病,髓样,急性, 微小残留病, 巩固化疗, 异基因造血干细胞移植, 预后
Abstract
Objective
To probe the prognostic value of consolidation chemotherapy in non-favorable acute myeloid leukemia (AML) patients who were candidates for allogeneic hematopoietic stem cell transplantation (allo-HSCT) with first complete remission (CR1) and negative minimal residual disease (MRD−).
Methods
A retrospective analysis was conducted on 155 patients with non-favorable AML who received allo-HSCT in CR1/MRD− from January 2010 to March 2019. The survival data were compared between patients who received and those not received pre-transplant consolidation chemotherapy.
Results
A total of 102 patients received pre-transplant consolidation chemotherapy (consolidation group), and 53 cases directly proceeded to allo-HSCT when CR1/MRD− was achieved (nonconsolidation group). The median ages were 39 (18–56) years old and 38 (19–67) years old, respectively. Five-year post-transplant overall survival [(59.3±7.5) % vs (62.2±6.9) %, P=0.919] and relapse-free survival [(53.0±8.9) % vs (61.6±7.0) %, P=0.936] were not significantly different between the two groups (consolidation vs nonconsolidation). There was a weak relationship between consolidation therapy and cumulative incidence of relapse [consolidation: (21.9±5.4) % vs nonconsolidation: (18.3±6.0) %, P=0.942], as well as non-relapse mortality [consolidation: (22.4±4.3) % vs nonconsolidation: (28.4±6.5) %,P=0.464]. Multivariate analysis indicated that pre-transplant consolidation and the consolidation courses (< 2 vs ≥2 courses) did not have an impact on allo-HSCT outcomes.
Conclusion
Allo-HSCT for candidate patients without further consolidation when CR1/MRD− was attained was feasible.
Keywords: Leukemia, myeloid, acute; Minimal residual disease; Consolidation chemotherapy; Allogeneic hematopoietic stem cell transplantation; Prognosis
异基因造血干细胞移植(allo-HSCT)是中/高危急性髓系白血病(AML)患者的重要治疗手段[1]–[2]。细胞遗传学和分子遗传学特征是急性白血病治疗分层的重要依据之一,微小残留病(MRD)与遗传学指标相结合可以更好判断白血病患者的预后[3]–[6]。以往研究证实移植前MRD阳性是影响预后的独立危险因素[7]–[9]。有研究显示,移植物抗白血病(GVL)效应能克服移植前MRD阳性的不利影响[10]–[12]。如何根据MRD进行分层治疗以及MRD阴性患者可否减轻治疗强度,目前尚无定论[3],[6]。对于已经获得MRD阴性的中/高危AML患者,移植前是否需要巩固治疗有待进一步研究[13]–[15]。本研究对2010年1月至2019年3月在第1次形态学完全缓解且MRD阴性(CR1/MRD−)状态下接受allo-HSCT的155例中/高危AML患者[按照欧洲白血病网(ELN)标准[16]诊断,不含急性早幼粒细胞白血病患者]进行回顾性分析,探讨移植前巩固化疗对CR1/MRD−患者预后的影响。
病例与方法
1.病例:2010年1月至2019年3月,155例中/高危AML患者在CR1/MRD−状态下接受allo-HSCT,其中102例进行了移植前巩固化疗(巩固组,中危82例,高危20例),53例患者未行巩固化疗直接进行移植(非巩固组,中危36例,高危17例)。
2.细胞遗传学及分子生物学检测:骨髓标本经G显带法检测染色体核型,并按照《人类细胞遗传学国际命名体制(ISCN)2013》进行核型描述。采用Prism 7500实时荧光定量PCR仪对43种AML常见融合基因进行检测[12]。通过Ion Torrent测序平台对髓系肿瘤相关34个基因突变进行目标区域PCR富集和高通量平行测序,平均测序深度2 000×,灵敏度为1%[12]。
3.MRD检测:采用多参数流式检测白血病相关免疫表型(LAIP)作为MRD监测指标。抗体组合包括:CD34-PE/CD117-APC/CD45-Percp/CD56-PE-cy7/CD2-FITC/CD7-FITC及CD34-APC/CD64-FITC/CD15-FITC/CD11c-PE/CD45-Percp。LAIP细胞≥0.1%判定为MRD阳性。在巩固治疗中的固定监测点、移植前以及移植后固定监测点均检测MRD。
4.诱导治疗:年龄<65岁的AML患者采用DA方案(柔红霉素60 mg·m−2·d−1第1~3天,阿糖胞苷100~200 mg·m−2·d−1第1~7天)或IA方案(去甲氧柔红霉素10~12 mg·m−2·d−1第1~3天,阿糖胞苷100~200 mg·m−2·d−1第1~7天)。年龄≥65岁或ECOG评分>2分的患者采用D-CAG方案(地西他滨20 mg·m−2·d−1第1~5天,阿克拉霉素10 mg/d第3~6天,阿糖胞苷10 mg/m2每12 h 1次第3~9天,粒细胞集落刺激因子5 µg·kg−1·d−1第1~14天)[17]–[19]。
5.巩固治疗:采用中等剂量阿糖胞苷(2 g/m2每12 h 1次,第1、3、5天)巩固化疗1~4个疗程。ECOG评分>2分的患者以D-CAG方案[18]–[19]巩固治疗。第1次诱导化疗获得部分缓解的患者采用原方案再诱导,未缓解者换用其他方案[18]。
6.移植方案:清髓预处理(MAC)采用经典的Bu-Cy方案(白消安+环磷酰胺)。年龄≥55岁或ECOG评分>1分的患者采用FBA(氟达拉滨+阿糖胞苷+白消安)减低剂量预处理方案(RIC)[17]。无关供者移植和亲缘单倍型移植加用抗人胸腺细胞球蛋白(ATG)。急性GVHD按照修订的西雅图标准[20]进行诊断。慢性GVHD采用美国国立卫生研究院(NIH)的诊断标准及严重程度积分系统[21]。采用环孢素A+霉酚酸酯+短程甲氨蝶呤方案进行GVHD预防[22]。中性粒细胞绝对计数(ANC)≥0.5×109/L连续3 d为粒细胞植活;PLT≥20×109/L连续7 d且脱离血小板输注为血小板植活。
7.随访及疗效评估:采用查阅门诊、住院病例和电话随访方式。随访截至2019年5月20日,中位随访时间为52.5(9~110)个月。疗效评估标准参见文献[18],[23]。CR:白血病的症状和体征消失,白细胞分类中无白血病细胞,骨髓涂片原始粒细胞<5%,无髓外白血病。复发:获得CR患者外周血重新出现白血病细胞或骨髓中原始细胞≥5%或髓外出现白血病浸润。总生存(OS)时间:造血干细胞回输至随访截止或死亡的时间;无复发生存(RFS)时间:造血干细胞回输至复发、随访截止或患者死亡的时间。
8.统计学处理:巩固组及非巩固组临床特征、GVHD发生率的比较,连续变量采用Mann-Whitney U检验,分类变量采用χ2检验。OS、RFS率分析采用Kaplan-Meier法,组间比较采用Log-rank检验。影响OS、RFS的因素采用Cox回归模型进行多因素分析;其中,CR1/MRD−至allo-HSCT间隔以时依协变量纳入分析。采用SPSS 22.0软件进行统计。通过R软件竞争风险模型计算累积复发率(CIR),以复发和非复发死亡(NRM)为竞争风险[24]。P<0.05为差异具有统计学意义。
结果
1.患者特征:155例CR1/MRD−患者中男69例(44.5%),女86例(55.5%),中位年龄38(18~67)岁,65岁以上5例(3.2%)。CR1/MRD−至移植中位时间为5(1~12.5)个月。巩固组中55例诱导化疗后达到MRD阴性,78例患者接受了≥2个疗程巩固化疗,CR1/MRD−至移植的中位时间为8.5(6.5~12.5)个月。非巩固组中25例诱导化疗后达到MRD阴性,17例巩固化疗1个疗程后达MRD阴性,11例巩固2个疗程后获得MRD阴性,CR1/MRD−至移植的中位时间为3(1~7)个月。两组患者在年龄、性别、初诊时血细胞计数、细胞遗传学、分子生物学特征、移植预处理方案、ECOG评分、ELN危险度分组等方面差异无统计学意义(P>0.05),详见表1。
表1. 移植前巩固化疗与非巩固化疗CR1/MRD−中/高危AML患者的临床特征.
| 因素 | 非巩固组(53例) | 巩固组(102例) | χ2/z值 | P值 | |
| 年龄[岁,M(范围)] | 39(18~56) | 38(19~67) | −0.354 | 0.526 | |
| 男性[例(%)] | 28(52.8) | 41(40.2) | 0.079 | 0.168 | |
| 诊断[例(%)] | 0.092 | 0.713 | |||
| 原发AML | 47(88.7) | 87(85.3) | |||
| 继发AML | 6(11.3) | 15(14.7) | |||
| AML亚型[例(%)] | 7.523 | 0.658 | |||
| M1 | 4(7.5) | 5(4.9) | |||
| M2 | 17(32.1) | 31(30.5) | |||
| M4 | 19(35.8) | 37(36.3) | |||
| M5 | 10(18.9) | 18(17.6) | |||
| M6 | 2(3.8) | 8(7.8) | |||
| M7 | 1(1.9) | 3(2.9) | |||
| 诊断时血细胞计数[M(范围)] | |||||
| WBC(×109/L) | 15.8(0.5~372.7) | 14.7(0.3~286.2) | −0.759 | 0.681 | |
| HGB(g/L) | 85.5(7.5~133.0) | 92.0(44.5~149.0) | −0.063 | 0.853 | |
| PLT(×109/L) | 58(4~283) | 29(7~275) | −2.158 | 0.427 | |
| 达CR1/MRD−疗程数[例(%)] | 1.971 | 0.562 | |||
| 1个 | 39(73.6) | 71(69.6) | |||
| 2个 | 14(26.4) | 31(30.4) | |||
| 诱导化疗方案[例(%)] | 5.758 | 0.469 | |||
| DA | 26(49.1) | 56(54.9) | |||
| IA | 23(43.4) | 45(44.1) | |||
| D-CAG | 4(7.5) | 1(1.0) | |||
| 移植前巩固化疗疗程数[例(%)] | 14.712 | <0.001 | |||
| <2个 | 41(77.4) | 22(21.6) | |||
| ≥2个 | 12(22.6) | 80(78.4) | |||
| 诊断至CR1/MRD−时间[月,M(范围)] | 2.0(1.5~4.0) | 2.0(1.5~5.5) | 0.367 | 0.996 | |
| CR1/MRD−至移植时间[月,M(范围)] | 3.0(1.0~7.0) | 8.5(6.5~12.5) | 11.436 | <0.001 | |
| 染色体核型a[例(%)] | 0.718 | 0.718 | |||
| 低危 | 5(9.4) | 15(14.7) | |||
| 中危 | 34(64.2) | 71(69.6) | |||
| 高危 | 14(26.4) | 16(15.7) | |||
| 分子生物学特征[例(%)] | |||||
| NPM1突变伴FLT3-ITDhigh | 10(18.9) | 21(20.6) | 1.125 | 0.736 | |
| NPM1野生型(无FLT3-ITD突变或FLT3-ITDlow) | 27(50.9) | 45(44.1) | 0.529 | 0.464 | |
| NPM1野生型(伴FLT3-ITDhigh) | 6(11.3) | 15(14.7) | 0.115 | 0.521 | |
| RUNX1突变 | 4(7.5) | 7(6.9) | 1.634 | 0.879 | |
| ASXL1突变 | 9(17.0) | 14(13.7) | 0.085 | 0.614 | |
| TP53突变 | 12(22.6) | 18(17.6) | 1.247 | 0.545 | |
| ELN危险度分组[例(%)] | 0.943 | 0.627 | |||
| 中危组 | 36(67.9) | 82(80.4) | |||
| 高危组 | 17(32.1) | 20(19.6) | |||
| 移植预处理方案[例(%)] | 1.936 | 0.462 | |||
| 减低剂量预处理 | 9(17.0) | 35(34.3) | |||
| 清髓预处理 | 44(83.0) | 67(65.7) | |||
| 预处理方案含ATG[例(%)] | 20(37.7) | 41(40.2) | 0.069 | 0.953 | |
| 移植前ECOG体能评分[例(%)] | 0.693 | 0.459 | |||
| ≤1分 | 25(47.2) | 35(34.3) | |||
| 2分 | 23(43.4) | 54(52.9) | |||
| 3分 | 5(9.4) | 13(12.8) | |||
注:AML:急性髓系白血病;CR1/MRD−:第1次完全缓解且MRD阴性;ITD:内部串联重复;FLT3-ITDlow:等位基因低频突变(<0.5);FLT3-ITDhigh:等位基因高频突变(≥0.5);ATG:抗人胸腺细胞球蛋白;DA方案:柔红霉素+阿糖胞苷;IA方案:去甲氧柔红霉素+阿糖胞苷;D-CAG方案:地西他滨+阿克拉霉素+阿糖胞苷+粒细胞集落刺激因子;ELN:欧洲白血病网。a根据ELN标准,低危核型包括t(8;21)(q22; q21.1)、inv(16)(p13.1q22)或t(16;16)(p13.1;q22);中危核型包括正常核型、t(9;11)(p21.3;q23.3)及其他所有未定义异常;高危核型包括t(6;9)(p23;q34.1)、t(v;11q23.3)、t(9;22)(q34.1;q11.2)、inv(3)(q21.3q26.2)或t(3;3)(q21.3;q26.2)、−5或5q-;−7;−17或17p异常、复杂核型(≥3种克隆性染色体异常)、单体核型
2.GVHD发生情况:非巩固组、巩固组急性GVHD发生率分别为18.9%、21.6%(P=0.747),慢性GVHD发生率分别为66.0%(35/53)、63.7%(65/102)(P=0.649),重度慢性GVHD的发生率分别为5.6%(3/53)、8.8%(9/102)(P=0.805)。非巩固组、巩固组分别有3、4例患者肺受累积分≥2分[25]。两组GVHD情况详见表2。
表2. 非巩固组、巩固组移植前CR1/MRD−中/高危AML患者GVHD发生情况[例(%)].
| 组别 | 例数 | 急性GVHD |
慢性GVHD |
||||
| Ⅰ度 | Ⅱ度 | Ⅲ/Ⅳ度 | 轻度 | 中度 | 重度 | ||
| 巩固组 | 102 | 10(9.8) | 7(6.9) | 5(4.9) | 22(21.6) | 34(33.3) | 9(8.8) |
| 非巩固组 | 53 | 1(1.9) | 4(7.6) | 5(9.4) | 15(28.3) | 17(32.1) | 3(5.6) |
| χ2值 | 0.052 | 1.273 | |||||
| P值 | 0.738 | 0.649 | |||||
注:AML:急性髓系白血病;CR1/MRD−:第1次完全缓解且微小残留病阴性
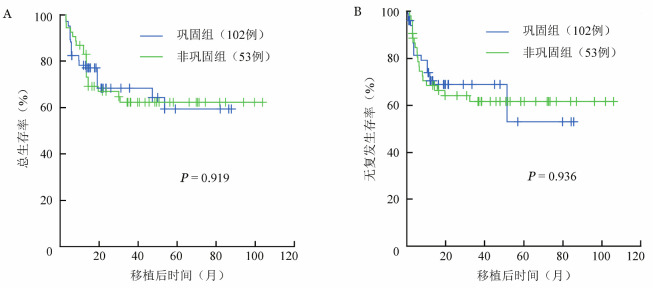
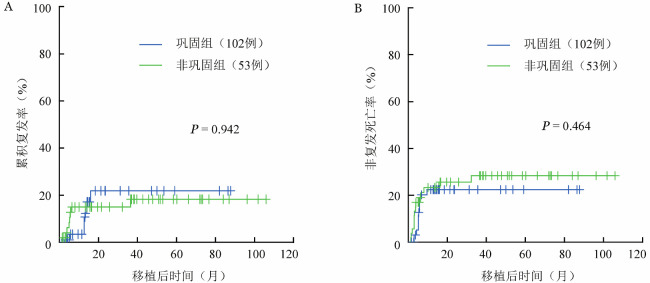
3.生存及复发:非巩固组、巩固组移植后5年OS率分别为(59.3±7.5)%、(62.2±6.9)%(P=0.919)(图1A),RFS率分别为(53.0±8.9)%、(61.6±7.0)%(P=0.936)(图1B),5年CIR分别为(21.9±5.4)%、(18.3±6.0)%(P=0.942)(图2A)。非巩固组、巩固组移植后5年NRM率分别为(22.4±4.3)%、(28.4±6.5)%(P=0.464)(图2B)。非复发死亡原因:非巩固组GVHD 7例,感染7例,出血2例;巩固组GVHD 13例,感染6例,出血2例。
图1. 移植前巩固化疗对第1次完全缓解且微小残留病阴性中/高危急性髓系白血病患者总生存(A)和无复发生存(B)的影响.
图2. 移植前巩固化疗对第1次完全缓解且微小残留病阴性中/高危急性髓系白血病患者复发(A)和非复发死亡(B)的影响.
巩固组、非巩固组ELN中危AML患者分别为82、36例,移植后5年OS率分别为(57.2±18.0)%、(71.5±6.3)%(P=0.753),RFS率分别为(54.1±17.3)%、(68.4±6.4)%(P=0.759)。
4.预后影响因素的多因素分析:多因素分析结果显示,FLT3-ITD高频突变(FLT3-ITD突变率≥0.5,FLT3-ITDhigh)及TP53突变是影响预后的独立危险因素。而移植前巩固化疗的疗程数(<2个/≥2个)、获得CR1/MRD−后是否接受巩固化疗及获得CR1/MRD−至移植的间隔时间均对OS和RFS无显著影响(P>0.05),详见表3。
表3. 155例在第1次完全缓解且微小残留病阴性(CR1/MRD−)状态下接受allo-HSCT患者的总生存和无复发生存影响因素的多因素分析.
| 因素 | 总生存 |
无复发生存 |
||
| HR(95%CI) | P值 | HR(95%CI) | P值 | |
| 年龄(<38岁,≥38岁) | 0.564(0.212~1.553) | 0.232 | 0.653(0.324~1.462) | 0.263 |
| ECOG体能评分(1分,2~3分) | 0.342(0.453~1.252) | 0.364 | 0.626(0.365~1.375) | 0.453 |
| 预处理方案(RIC,MAC) | 0.925(0.523~1.654) | 0.921 | 1.532(0.623~1.734) | 0.917 |
| 诱导化疗后获得CR1/MRD−(是,否) | 0.837(0.338~1.834) | 0.649 | 0.686(0.311~1.562) | 0.664 |
| 移植前巩固化疗疗程(<2个,≥2个) | 1.780(0.791~2.085) | 0.747 | 1.179(0.575~2.467) | 0.761 |
| CR1/MRD−后接受巩固化疗(是,否) | 0.313(0.464~1.168) | 0.376 | 0.675(0.486~1.482) | 0.457 |
| 获得CR1/MRD−至移植间隔(时依协变量) | 0.750(0.423~1.257) | 0.294 | 0.731(0.476~1.294) | 0.253 |
| 染色体核型(低危,中/高危) | 0.623(0.372~1.081) | 0.185 | 0.534(0.328~1.158) | 0.195 |
| NPM1突变 | 0.495(0.291~0.849) | 0.126 | 0.550(0.367~1.158) | 0.241 |
| FLT3-ITDhigh | 1.972(1.144~3.401) | 0.018 | 2.008(1.168~3.461) | 0.012 |
| RUNX1突变 | 0.999(0.993~1.005) | 0.721 | 0.875(0.513~1.464) | 0.572 |
| ASXL1突变 | 0.997(0.998~1.007) | 0.589 | 0.992(0.890~1.008) | 0.442 |
| TP53突变 | 1.251(0.672~2.231) | 0.032 | 1.275(0.524~2.571) | 0.041 |
注:allo-HSCT:异基因造血干细胞移植;RIC:减低剂量预处理;MAC:清髓预处理;FLT3-ITDhigh:等位基因高频突变(≥0.5)
讨论
越来越多研究表明,对于中危AML患者,allo-HSCT的疗效优于化疗[22],[26]–[27]。而移植前病程和移植时机也影响预后[28]。既往文献报道,CR1后继续巩固对移植患者的预后影响不大[28]–[32]。近期,刘秀娟等[28]研究结果显示,allo-HSCT前病程≥6个月的AML患者预后较差。
Rashidi等[14]的一项单中心回顾性研究纳入126例在CR1/MRD−状态下接受allo-HSCT的AML患者,中位年龄60(23~74)岁,以多参数流式细胞术检测MRD<0.5%定义为MRD阴性,结果显示移植前巩固化疗的患者预后较好。随后,该团队又开展了一项多中心研究[33],纳入明尼苏达大学和华盛顿大学共111例AML患者,均在CR1/MRD−状态下接受移植,其中26例患者以MRD<0.5%定义为MRD阴性,85例以MRD<0.1%为MRD阴性,移植前巩固组和非巩固组复发率和NRM差异均无统计学意义[33]。相对于Rashidi等[14]的研究,本组患者较年轻(中位年龄38岁),以<0.1%为MRD阴性阈值,移植前MRD阴性患者的预后优于MRD阳性患者,与文献[34]–[35]报道的结果一致。我们进一步分析CR1/MRD−状态下接受allo-HSCT中/高危AML患者的预后,结果显示,是否进行移植前巩固化疗对患者的OS、RFS、CIR及NRM无显著影响,多因素分析结果也证实CR1/MRD−至移植的时间、移植前巩固化疗疗程数不是预后的影响因素。本研究结果提示,年轻的中/高危AML患者,化疗达CR1/MRD−后可考虑直接进行allo-HSCT。
目前,各中心MRD检测的方法及敏感性尚缺乏统一标准,MRD阈值的选取影响对缓解深度的判断,从而影响基于MRD的分层治疗[3],[6]。本研究的局限性:①各组内患者实际接受的化疗次数和累积剂量有差异,无法确定最佳的治疗疗程和强度。②两组患者在ELN危险度、ECOG体能评分、供者选择及预处理方案等方面均存在异质性。③非巩固组CR1/MRD−至移植的时间明显较短,如果因各种原因致其移植前病程延长,部分患者可能在移植前复发,这种分组偏倚会影响两组的可比性。尽管通过时间依存模型能一定程度上消除这种偏倚的影响,本研究结论仍需前瞻性的随机对照研究加以验证。
Funding Statement
基金项目: 国家自然科学基金面上项目 (81770160、81470321); 上海市卫生计生委卫生系统优秀学科带头人培养计划 (2017BR012)
Fund program: National Natural Science Foundation of China (81770160, 81470321); Municipal Human Resources Development Program for Outstanding Leaders in Medical Disciplines in Shanghai (2017BR012)
References
- 1.Yang X, Wang J. Precision therapy for acute myeloid leukemia[J] J Hematol Oncol. 2018;11:3. doi: 10.1186/s13045-017-0543-7. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2.Khwaja A, Bjorkholm M, Gale RE, et al. Acute myeloid leukaemia[J] Nat Rev Dis Primers. 2016;2:16010. doi: 10.1038/nrdp.2016.10. [DOI] [PubMed] [Google Scholar]
- 3.李 舒心, 刘 爽, 常 英军, et al. 急性髓系白血病微小残留病研究现状及展望[J] 中华血液学杂志. 2019;40(1):83–86. doi: 10.3760/cma.j.issn.0253-2727.2019.01.018. [DOI] [Google Scholar]
- 4.Terwijn M, van Putten WL, Kelder A, et al. High prognostic impact of flow cytometric minimal residual disease detection in acute myeloid leukemia: data from the HOVON/SAKK AML 42A study[J] J Clin Oncol. 2013;31(31):3889–3897. doi: 10.1200/JCO.2012.45.9628. [DOI] [PubMed] [Google Scholar]
- 5.Schuurhuis GJ, Heuser M, Freeman S, et al. Minimal/measurable residual disease in AML: a consensus document from the European LeukemiaNet MRD Working Party[J] Blood. 2018;131(12):1275–1291. doi: 10.1182/blood-2017-09-801498. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Zhu HH, Zhang XH, Qin YZ, et al. MRD-directed risk stratification treatment may improve outcomes of t(8;21)AML in the first complete remission: results from the AML05 multicenter trial[J] Blood. 2013;121(20):4056–4062. doi: 10.1182/blood-2012-11-468348. [DOI] [PubMed] [Google Scholar]
- 7.Walter RB, Gooley TA, Wood BL, et al. Impact of pretransplantation minimal residual disease, as detected by multiparametric flow cytometry, on outcome of myeloablative hematopoietic cell transplantation for acute myeloid leukemia[J] J Clin Oncol. 2011;29(9):1190–1197. doi: 10.1200/JCO.2010.31.8121. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.Walter RB, Buckley SA, Pagel JM, et al. Significance of minimal residual disease before myeloablative allogeneic hematopoietic cell transplantation for AML in first and second complete remission[J] Blood. 2013;122(10):1813–1821. doi: 10.1182/blood-2013-06-506725. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.卢 岳, 吴 彤, 王 卉, et al. 预处理前多参数流式细胞术监测的微小残留病对急性髓系白血病异基因造血干细胞移植预后的影响[J] 中华血液学杂志. 2017;38(2):118–123. doi: 10.3760/cma.j.issn.0253-2727.2017.02.007. [DOI] [Google Scholar]
- 10.Leung W, Pui CH, Coustan-Smith E, et al. Detectable minimal residual disease before hematopoietic cell transplantation is prognostic but does not preclude cure for children with very-high-risk leukemia[J] Blood. 2012;120(2):468–472. doi: 10.1182/blood-2012-02-409813. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.Tian H, Chen GH, Xu Y, et al. Impact of pre-transplant disease burden on the outcome of allogeneic hematopoietic stem cell transplant in refractory and relapsed acute myeloid leukemia: a single-center study[J] Leuk Lymphoma. 2015;56(5):1353–1361. doi: 10.3109/10428194.2014.961016. [DOI] [PubMed] [Google Scholar]
- 12.张 莹, 张 益敏, 陈 琪, et al. 巩固治疗前微小残留病检测在预后中等初诊年轻成人急性髓系白血病患者中的预后价值[J] 中华血液学杂志. 2019;40:147–151. doi: 10.3760/cma.j.issn.0253-2727.2019.02.011. [DOI] [Google Scholar]
- 13.张 益敏, 胡 晓霞. 阿糖胞苷在成年人急性髓系白血病巩固化疗中的应用[J] 国际输血及血液学杂志. 2018;41(1):2–9. doi: 10.3760/cma.j.issn.1673-419X.2018.01.001. [DOI] [Google Scholar]
- 14.Rashidi A, Linden MA, DeFor TE, et al. History of consolidation is prognostic in acute myeloid leukemia patients undergoing allogeneic hematopoietic cell transplantation in minimal residual disease-negative first complete remission[J] Am J Hematol. 2017;92(10):1032–1036. doi: 10.1002/ajh.24834. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.Zhu Y, Gao Q, Du J, et al. Effects of post-remission chemotherapy before allo-HSCT for acute myeloid leukemia during first complete remission: a meta-analysis[J] Ann Hematol. 2018;97(9):1519–1526. doi: 10.1007/s00277-018-3414-6. [DOI] [PubMed] [Google Scholar]
- 16.Döhner H, Estey E, Grimwade D, et al. Diagnosis and management of AML in adults: 2017 ELN recommendations from an international expert panel[J] Blood. 2017;129(4):424–447. doi: 10.1182/blood-2016-08-733196. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.Zhang WP, Wang ZW, Hu XX, et al. Preconditioning with fludarabine, busulfan and cytarabine versus standard BuCy2 for patients with acute myeloid leukemia: a prospective, randomized phase II study[J] Bone Marrow Transplant. 2018 doi: 10.1038/s41409-018-0356-5. [DOI] [PubMed] [Google Scholar]
- 18.中华医学会血液学分会白血病淋巴瘤学组. 成人急性髓系白血病(非急性早幼粒细胞白血病)中国诊疗指南(2017年版)[J] 中华血液学杂志. 2017;38(3):177–182. doi: 10.3760/cma.j.issn.0253-2727.2017.03.001. [DOI] [Google Scholar]
- 19.Zhang WP, Yang D, Song XM, et al. Allogeneic peripheral blood stem cell transplantation is a promising and safe choice for the treatment of refractory/relapsed acute myelogenous leukemia, even with a higher leukemia burden[J] Biol Blood Marrow Transplant. 2013;19(4):653–660. doi: 10.1016/j.bbmt.2013.01.015. [DOI] [PubMed] [Google Scholar]
- 20.Glucksberg H, Storb R, Fefer A, et al. Clinical manifestations of graft-versus-host disease in human recipients of marrow from HLA-matched sibling donors[J] Transplantation. 1974;18(4):295–304. doi: 10.1097/00007890-197410000-00001. [DOI] [PubMed] [Google Scholar]
- 21.Paczesny S, Hakim FT, Pidala J, et al. National Institutes of Health Consensus Development Project on Criteria for Clinical Trials in Chronic Graft-versus-Host Disease: III. The 2014 Biomarker Working Group Report[J] Biol Blood Marrow Transplant. 2015;21(5):780–792. doi: 10.1016/j.bbmt.2015.01.003. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 22.Zhang Y, Zhang YM, Chen Q, et al. Allogeneic hematopoietic stem cells transplantation improves the survival of intermediate-risk acute myeloid leukemia patients aged less than 60 years[J] Ann Hematol. 2019;98(4):997–1007. doi: 10.1007/s00277-018-3584-2. [DOI] [PubMed] [Google Scholar]
- 23.Cheson BD, Bennett JM, Kopecky KJ, et al. Revised recommendations of the International Working Group for Diagnosis, Standardization of Response Criteria, Treatment Outcomes, and Reporting Standards for Therapeutic Trials in Acute Myeloid Leukemia[J] J Clin Oncol. 2003;21(24):4642–4649. doi: 10.1200/JCO.2003.04.036. [DOI] [PubMed] [Google Scholar]
- 24.Lin DY. Non-parametric inference for cumulative incidence functions in competing risks studies[J] Stat Med. 1997;16(8):901–910. doi: 10.1002/(sici)1097-0258(19970430)16:8<901::aid-sim543>3.0.co;2-m. [DOI] [PubMed] [Google Scholar]
- 25.Lee SJ. Classification systems for chronic graft-versus-host disease[J] Blood. 2017;129(1):30–37. doi: 10.1182/blood-2016-07-686642. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 26.Stelljes M, Krug U, Beelen DW, et al. Allogeneic transplantation versus chemotherapy as postremission therapy for acute myeloid leukemia: a prospective matched pairs analysis[J] J Clin Oncol. 2014;32(4):288–296. doi: 10.1200/JCO.2013.50.5768. [DOI] [PubMed] [Google Scholar]
- 27.Lv M, Wang Y, Chang YJ, et al. Myeloablative haploidentical transplantation is superior to chemotherapy for patients with intermediate-risk acute myelogenous leukemia in first complete remission[J] Clin Cancer Res. 2019;25(6):1737–1748. doi: 10.1158/1078-0432.CCR-18-1637. [DOI] [PubMed] [Google Scholar]
- 28.刘 秀娟, 黄 晓军, 许 兰平, et al. 移植前病程对急性髓系白血病患者异基因造血干细胞移植预后的影响[J] 中华血液学杂志. 2019;40(3):182–186. doi: 10.3760/cma.j.issn.0253-2727.2019.03.003. [DOI] [Google Scholar]
- 29.Tallman MS, Rowlings PA, Milone G, et al. Effect of postremission chemotherapy before human leukocyte antigen-identical sibling transplantation for acute myelogenous leukemia in first complete remission[J] Blood. 2000;96(4):1254–1258. doi: 10.1016/S1246-7820(00)80033-6. [DOI] [PubMed] [Google Scholar]
- 30.McCormack SE, Cao Q, Oran B, et al. Pre-transplant consolidation chemotherapy may not improve outcomes after reduced intensity conditioning hematopoietic stem cell transplantation for acute myeloid leukemia in first complete remission[J] Leuk Res. 2011;35(6):757–761. doi: 10.1016/j.leukres.2010.12.013. [DOI] [PubMed] [Google Scholar]
- 31.Yeshurun M, Labopin M, Blaise D, et al. Impact of postremission consolidation chemotherapy on outcome after reduced-intensity conditioning allogeneic stem cell transplantation for patients with acute myeloid leukemia in first complete remission: a report from the Acute Leukemia Working Party of the European Group for Blood and Marrow Transplantation[J] Cancer. 2014;120(6):855–863. doi: 10.1002/cncr.28498. [DOI] [PubMed] [Google Scholar]
- 32.Warlick ED, Paulson K, Brazauskas R, et al. Effect of postremission therapy before reduced-intensity conditioning allogeneic transplantation for acute myeloid leukemia in first complete remission[J] Biol Blood Marrow Transplant. 2014;20(2):202–208. doi: 10.1016/j.bbmt.2013.10.023. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 33.How J, Vij KR, Ebadi M, et al. Prognostic value of prior consolidation in acute myeloid leukemia patients undergoing hematopoietic cell transplantation in minimal residual disease-negative first complete remission[J] Am J Hematol. 2018;93(12):E381–E383. doi: 10.1002/ajh.25262. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 34.Oran B, Jorgensen JL, Marin D, et al. Pre-transplantation minimal residual disease with cytogenetic and molecular diagnostic features improves risk stratification in acute myeloid leukemia[J] Haematologica. 2017;102(1):110–117. doi: 10.3324/haematol.2016.144253. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 35.Walter RB, Gyurkocza B, Storer BE, et al. Comparison of minimal residual disease as outcome predictor for AML patients in first complete remission undergoing myeloablative or nonmyeloablative allogeneic hematopoietic cell transplantation[J] Leukemia. 2015;29(1):137–144. doi: 10.1038/leu.2014.173. [DOI] [PMC free article] [PubMed] [Google Scholar]