白血病是常见的造血系统恶性肿瘤之一[1],白血病细胞对化疗药物产生多药耐药(multi-drug resistance,MDR)是临床上导致白血病治疗失败和白血病复发的主要原因[2]。研究表明,STAT3磷酸化能通过多种途径介导肿瘤耐药[3]–[7]。我们此前的研究结果显示,耐药白血病细细胞(K562/AO2)STAT3磷酸化水平明显升高[8],抑制STAT3磷酸化可以降低耐药白血病细胞P-gp蛋白的表达[9]。本研究中,我们通过转染K562细胞建立耐药白血病细胞株K562/STAT3,阐明STAT3磷酸化介导白血病细胞发生耐药的可能机制。
材料与方法
1.细胞及主要试剂:K562细胞由苏州大学附属医院陈苏宁教授惠赠。抗STAT3抗体、抗磷酸化STAT3(Tyr705)抗体、抗GAPDH抗体购于美国Cell Signaling公司。抗P-gp抗体购于美国Abbiotec公司。STAT3抑制剂(STAT3 inhibitor Ⅶ)购于德国Calbiochem公司。
2.K562/STAT3细胞株的构建和培养:取pcDNA3.1-STAT3质粒和空载体质粒(常州优博精准医疗有限公司产品),按照说明书转染K562细胞,筛选稳定高表达STAT3的细胞(K562/STAT3)进行实验。细胞用含有10%灭活胎牛血清(FBS)、100 U/ml青霉素和100 µg/ml链霉素的PRMI1640培养液,置于5% CO2、37 °C培养箱内常规培养。
3.MTT法检测细胞增殖抑制率:调整细胞密度为5×105/ml,接种于96孔板,每孔100 µl,分别加入不同浓度的多柔比星,抑制实验中加入2 µmol/L STAT3 inhibitor Ⅶ,培养48 h后每孔加入10 µl MTT标记液再培养4 h(培养条件37°C、5% CO2),然后加入100 µl DMSO,用酶标仪测定570 nm处吸光度(A)值,计算细胞增殖抑制率。
4.Western blot法检测STAT3磷酸化水平以及P-gp蛋白的表达水平:收集细胞加入裂解缓冲液(裂解缓冲液中提前加入蛋白酶抑制剂和磷酸化抑制剂),提取细胞内总蛋白,测定蛋白浓度。每个电泳孔内加入50 µg蛋白,用10% SDS-PAGE分离蛋白,聚偏氟乙烯膜(PVDF)转膜后,用55 g/L的脱脂奶粉溶液封闭。然后加入单克隆抗体4 °C孵育过夜,充分洗脱后,加入二抗室温孵育2 h后,应用ECL化学发光显色,Image J灰度分析,以GAPDH作为内参。
5.实时荧光定量PCR(RQ-PCR)法检测P-gp基因表达水平:用Isogen提取RNA,然后逆转录成cDNA,储存于-20 °C冰箱待用。LightCycler PCR system分析P-gp基因表达水平。以GAPDH为内参,白血病细胞P-gp基因的表达水平用P-gp mRNA和GAPDH mRNA比值(P-gp/GAPDH)表示。P-gp:上游引物5′-ACAGAGGGGATGGTCAGTGT-3′,下游引物5′-TCACGGCCATAGCGAATGTT-3′。管家基因GAPDH:上游引物5′-CTATTCGATGCCGTGTATGC-3′,下游引物5′-GCCTGGTCCAGACTTCTTTC-3′。
6.白血病患者标本制备:2例复发难治急性髓系白血病(AML)患者标本均来自常州第二人民医院血液科住院患者(M5和M4各1例)。初诊和复发时抽取患者外周血5 ml(已获得本单位伦理委员会批准),用淋巴细胞分离液分离外周血单个核细胞(PBMC),流式细胞术检测分离PBMC中白血病细胞均超过80%,分离的PBMC用细胞冻存液保存在液氮中备用。
7.统计学处理:采用SPSS17.0统计学软件进行分析。实验数据用均数±标准差表示,两组间比较用t检验,P<0.05为差异有统计学意义。
结果
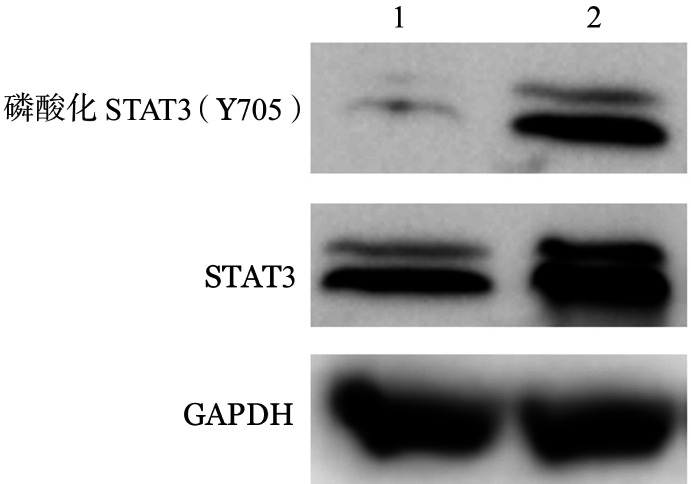
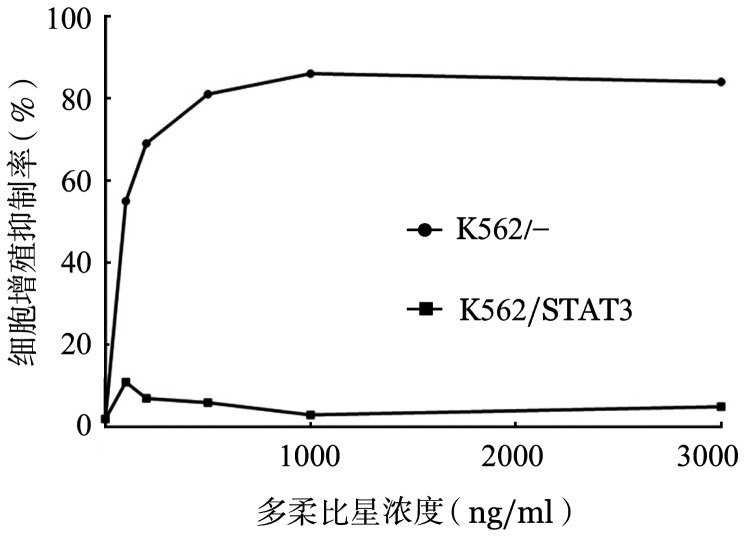
1.K562/-细胞和pcDNA3.1-STAT3转染后细胞(K562/STAT3细胞)内STAT3表达水平及对多柔比星敏感性的变化:Western blot法检测显示,K562/STAT3细胞内总STAT3和磷酸化STAT3表达水平均明显升高(图1)。用MTT法检测多柔比星对K562/STAT3细胞和K562/-细胞增殖的影响,结果显示多柔比星对K562/STAT3细胞的抑制作用明显减弱(图2)。
图1. K562/-细胞和K562/STAT3细胞STAT3和磷酸化STAT3表达水平.
1:K562/-细胞;2:K562/STAT3细胞
图2. K562/-细胞和K562/STAT3细胞对多柔比星的耐药性.
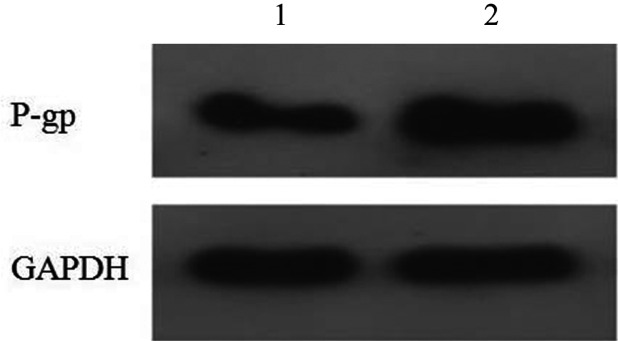
2.K562/-细胞和K562/STAT3细胞P-gp基因及P-gp蛋白的表达水平:RQ-PCR检测结果显示,K562/STAT3细胞P-gp基因表达水平为(360.54±11.22)%,较K562/-细胞的(1.02±0.18)%明显升高(t=45.32,P=0.001)。Western blot法检测显示,K562/STAT3细胞P-gp蛋白表达水平明显升高(图3),表明转染后细胞内STAT3的表达水平影响了P-gp基因和蛋白的表达。
图3. K562/-细胞和K562/STAT3细胞内P-gp蛋白表达水平.
1:K562/-细胞;2:K562/STAT3细胞
3.抑制STAT3磷酸化对K562/STAT3细胞对于多柔比星敏感性的影响:用2 µmol/L的STAT3抑制剂处理K562/STAT3细胞,Western blot法检测发现K562/STAT3细胞的P-gp蛋白表达水平下降(图4);同时在多柔比星浓度为10 µg/ml的条件下,MTT法检测结果显示用STAT3抑制剂处理过的K562/STAT3细胞在多柔比星中的增殖能力明显下降[(65.67±6.03)%对(83.66±4.04)%,t=4.296,P=0.013],表明抑制STAT3的磷酸化可以降低P-gp蛋白的表达,从而增加耐药细胞对多柔比星的敏感性。
图4. STAT3抑制剂对K562/STAT3细胞P-gp蛋白表达水平的影响.
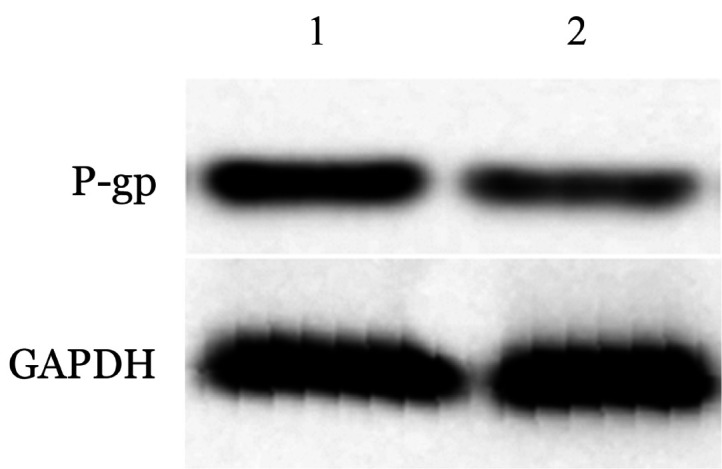
1:未加STAT3抑制剂处理组;2:2 µmol/L STAT3抑制剂处理组
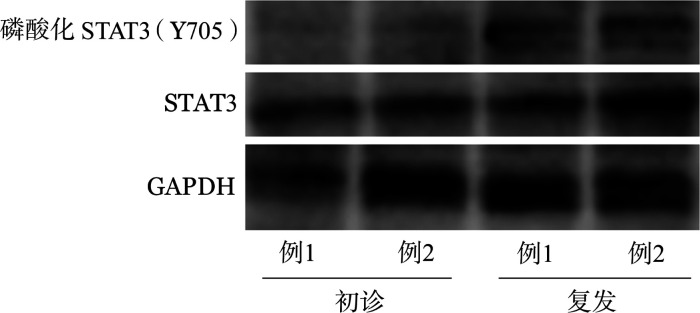
4.复发难治白血病患者STAT3磷酸化水平和P-gp基因表达:我们检测2例复发难治白血病患者初诊和复发时的外周血标本,Western blot法检测患者白血病细胞内STAT3的表达水平,结果显示白血病患者复发时细胞内磷酸化STAT3表达水平较初诊时明显升高(图5)。RQ-PCR检测结果显示白血病患者复发时细胞内P-gp基因表达水平较初诊时明显升高(例1:0.35±0.07对0.07±0.05,t=5.638,P=0.005;例2:0.36±0.05对0.13±0.03,t=6.832,P=0.002),表明复发难治患者的白血病细胞内STAT3磷酸化水平以及耐药基因的表达水平均升高。
图5. 两例白血病患者初发时和复发时白血病细胞STAT3和磷酸化STAT3的表达水平.
讨论
STAT3是信号传导与转录激活因子蛋白家族,已有多项研究表明激活的STAT3在肿瘤耐药中起重要作用[4]。多项研究显示,与肿瘤药物敏感株相比,耐药肿瘤细胞株磷酸化STAT3的表达水平明显升高,抑制STAT3磷酸化,耐药肿瘤细胞株对化疗药物的敏感性明显增加[3],[5]–[7],[10]–[11]。既往我们在研究中也发现耐药白血病细胞株K562/AO2细胞内STAT3磷酸化水平明显升高,加入STAT3抑制剂后K562/AO2细胞对多柔比星的敏感性明显上升[8]–[9]。本研究通过转染K562细胞,获得稳定高表达磷酸化STAT3的K562/STAT3细胞株,发现它对多柔比星的敏感性明显下降,表明STAT3磷酸化可能诱导白血病细胞发生化疗耐药。
近年来有研究表明STAT3的活化可通过增加mdr1基因的表达介导乳腺癌细胞发生耐药[12],降低STAT3磷酸化的水平可以降低耐药蛋白P-gp的表达水平,逆转肿瘤细胞的耐药性[5],[13]–[14]。其机制可能为在P-gp启动子区域中含有一个与STAT3结合的DNA序列,这个序列位于P-gp启动子中P-gp起始编码位点上游1 014 bp处,并具有较强的结合能力[15]。P-gp是一种与耐药相关的高分子糖蛋白,由mdr1基因编码,可利用ATP水解释放的能量将化疗药物泵至细胞外,减弱药物的细胞毒作用,从而导致细胞对结构和作用机制不同的多种化疗药物产生耐药[16]–[17]。本研究发现,K562/STAT3细胞P-gp基因和蛋白的表达明显升高(P=0.001),用STAT3抑制剂干预后,K562/STAT3细胞对多柔比星的敏感性明显升高,同时其P-gp蛋白表达水平明显降低。因此可推断,STAT3磷酸化可能是通过诱导白血病细胞耐药蛋白P-gp的表达,从而产生化疗耐药;抑制STAT3磷酸化可以通过降低P-gp表达水平恢复耐药白血病细胞对化疗药物的敏感性。
我们进一步用白血病患者的白血病细胞验证STAT3磷酸化介导的化疗耐药,我们比较2例AML患者复发时和初诊时白血病细胞的STAT3磷酸化水平以及耐药蛋白P-pg的表达水平,结果显示,AML患者复发时白血病细胞STAT3磷酸化水平以及P-gp基因表达水平均明显升高(P<0.01)。遗憾的是可获得的这两例患者的白血病细胞较少,未能进一步比较患者复发时和初诊时其对多柔比星的敏感程度。
本研究通过转染获得耐药K562/STAT3白血病细胞株,发现STAT3磷酸化水平与白血病耐药密切相关;抑制STAT3磷酸化下调P-gp基因和蛋白的表达,从而逆转白血病细胞化疗耐药。STAT3可能成为有效克服白血病细胞耐药潜在的新靶点,联合靶向STAT3抑制剂可能提高部分耐药白血病细胞对化疗药物的敏感性,为复发难治白血病患者提供可选择的治疗手段。
Funding Statement
基金项目: 常州市科技局应用基础研究计划 (CJ20160018); 常州市高层次卫生人才培养工程 (2016CZLJ027); 江苏省自然科学青年基金 (BK20160283)
References
- 1.Shipley JL, Butera JN. Acute myelogenous leukemia[J] Exp Hematol. 2009;37(6):649–658. doi: 10.1016/j.exphem.2009.04.002. [DOI] [PubMed] [Google Scholar]
- 2.Shaffer BC, Gillet JP, Patel C, et al. Drug resistance: still a daunting challenge to the successful treatment of AML[J] Drug Resist Updat. 2012;15(1-2):62–69. doi: 10.1016/j.drup.2012.02.001. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.Li R, Yanjiao G, Wubin H, et al. Secreted GRP78 activates EGFR-SRC-STAT3 signaling and confers the resistance to sorafeinib in HCC cells[J] Oncotarget. 2017;8(12):19354–19364. doi: 10.18632/oncotarget.15223. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.Zhao C, Li H, Lin HJ, et al. Feedback Activation of STAT3 as a Cancer Drug-Resistance Mechanism[J] Trends Pharmacol Sci. 2016;37(1):47–61. doi: 10.1016/j.tips.2015.10.001. [DOI] [PubMed] [Google Scholar]
- 5.Seo HS, Ku JM, Lee HJ, et al. SH003 reverses drug resistance by blocking signal transducer and activator of transcription 3 (STAT3)signaling in breast cancer cells[J] Biosci Rep. 2017;37(6) doi: 10.1042/BSR20170125. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Zeng R, Tang Y, Zhou H, et al. STAT3 mediates multidrug resistance of Burkitt lymphoma cells by promoting antioxidant feedback[J] Biochem Biophys Res Commun. 2017;488(1):182–188. doi: 10.1016/j.bbrc.2017.05.031. [DOI] [PubMed] [Google Scholar]
- 7.Gleixner KV, Schneeweiss M, Eisenwort G, et al. Combined targeting of STAT3 and STAT5: a novel approach to overcome drug resistance in chronic myeloid leukemia[J] Haematologica. 2017;102(9):1519–1529. doi: 10.3324/haematol.2016.163436. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.贾 祝霞, 蔡 晓辉, 肖 溶, et al. NKG2D配体介导耐药白血病细胞K562/A02免疫逃逸的机制研究[J] 中华血液学杂志. 2018;39(3):251–254. doi: 10.3760/cma.j.issn.0253-2727.2018.03.018. [DOI] [Google Scholar]
- 9.Cai X, Lu X, Jia Z, et al. STAT3 contributes to NK cell recognition by modulating expression of NKG2D ligands in adriamycin-resistant K562/AO2 cells[J] Int J Hematol. 2015;102(5):536–543. doi: 10.1007/s12185-015-1860-7. [DOI] [PubMed] [Google Scholar]
- 10.Li H, Lu H, Lv M, et al. Parthenolide facilitates apoptosis and reverses drug-resistance of human gastric carcinoma cells by inhibiting the STAT3 signaling pathway[J] Oncol Lett. 2018;15(3):3572–3579. doi: 10.3892/ol.2018.7739. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.Shi K, Fang Y, Gao S, et al. Inorganic kernel-Supported asymmetric hybrid vesicles for targeting delivery of STAT3-decoy oligonucleotides to overcome anti-HER2 therapeutic resistance of BT474R[J] J Control Release. 2018;279:53–68. doi: 10.1016/j.jconrel.2018.04.023. [DOI] [PubMed] [Google Scholar]
- 12.Bourguignon LY, Peyrollier K, Xia W, et al. Hyaluronan-CD44 interaction activates stem cell marker Nanog, Stat-3-mediated MDR1 gene expression, and ankyrin-regulated multidrug efflux in breast and ovarian tumor cells[J] J Biol Chem. 2008;283(25):17635–17651. doi: 10.1074/jbc.M800109200. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.Jagadeeshan S, David D, Jisha S, et al. Solanum nigrum Unripe fruit fraction attenuates Adriamycin resistance by down-regulating multi-drug resistance protein(Mdr)-1 through Jak-STAT pathway[J] BMC Complement Altern Med. 2017;17(1):370. doi: 10.1186/s12906-017-1872-3. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Yun M, Lee D, Park MN, et al. Cinnamaldehyde derivative(CB-PIC)sensitizes chemo-resistant cancer cells to drug-induced apoptosis via suppression of MDR1 and its upstream STAT3 and AKT signalling[J] Cell Physiol Biochem. 2015;35(5):1821–1830. doi: 10.1159/000373993. [DOI] [PubMed] [Google Scholar]
- 15.Zhang X, Xiao W, Wang L, et al. Deactivation of signal transducer and activator of transcription 3 reverses chemotherapeutics resistance of leukemia cells via down-regulating P-gp[J] PLoS One. 2011;6(6):e20965. doi: 10.1371/journal.pone.0020965. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.Abdallah HM, Al-Abd AM, El-Dine RS, et al. P-glycoprotein inhibitors of natural origin as potential tumor chemo-sensitizers: A review[J] J Adv Res. 2015;6(1):45–62. doi: 10.1016/j.jare.2014.11.008. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.Qiu Q, Shi W, Li Z, et al. Exploration of 2-((Pyridin-4-ylmethyl)amino)nicotinamide Derivatives as Potent Reversal Agents against P-Glycoprotein-Mediated Multidrug Resistance[J] J Med Chem. 2017;60(7):2930–2943. doi: 10.1021/acs.jmedchem.6b01879. [DOI] [PubMed] [Google Scholar]