Abstract
目的
分析CD7在初治急性髓系白血病(AML)患者中的表达和预后价值,进一步探讨CD7表达情况与CEBPA突变的相关性,明确其在CEBPA野生型和突变型AML患者中与预后的关系。
方法
回顾性分析2010年1月至2016年12月收治的298例初治AML患者(除外M3亚型)的临床资料,在全部患者以及CEBPA野生型和突变型组中,分别比较CD7阳性(CD7+)和CD7阴性(CD7−)患者的临床特征及预后差异,并联合CD7表达情况和CEBPA突变状态初步建立新的危险分层模型。
结果
在CD7+组中,CEBPA单位点和双位点突变的发生率分别为10.1%和33.9%,显著高于CD7−组(5.3%和4.2%),差异具有统计学意义(P=0.000)。在CEBPA野生型患者中,CD7+组患者相较CD7−组患者完全缓解率低(P=0.001)、复发率高(P=0.023),而两组总生存(OS)期和无病生存(DFS)期差异无统计学意义(P值均>0.05);在CEBPA突变患者中,CD7+组显示有更长的OS期(P=0.019)和DFS期(P=0.010)。根据CD7表达和CEBPA突变与否将AML患者分为三个亚组:CD7+伴CEBPA突变组、CD7−组和CD7+伴CEBPA野生型组。三组患者的3年OS率分别为80.2%、48.0%和30.6%(P<0.001),3年的DFS率分别为74.1%、37.4%和22.2%(P<0.001)。
结论
CD7+组中CEBPA突变率显著高于CD7−组,CD7+在CEBPA野生型组和突变组AML中存在截然相反的预后意义。根据CD7表达情况和CEBPA突变与否建立新的危险分层模型,有助于指导临床个体化治疗。
Keywords: CD7抗原, 基因,CEBPA, 白血病,髓样,急性, 预后
Abstract
Objective
To analyze the prognostic value of CD7 expression in newly diagnosed acute myeloid leukemia (AML) patients, and to further explore the correlation between CD7 expression and CEBPA mutation, and to clarify the prognostic value of CD7+ in AML patients with wild-type (WT) or mutant-type (MT) CEBPA.
Methods
The clinical data of 298 newly diagnosed non-M3 AML patients between January 2010 and December 2016 were analyzed retrospectively. The clinical characteristics and prognosis of CD7+ and CD7− patients were respectively compared in all patients, and in patients with WT and MT CEBPA. The relationship between CD7 expression and CEBPA mutation was determined by chi-square, and the effects of CEBPA mutation on survival and prognosis in CD7+ group by Kaplan-Meier method.
Results
In CD7+ group, the frequencies of CEBPA mutation were 10.1% (single site) and 33.9% (double site), significantly higher than those of the CD7− group (5.3% and 4.2%) (P=0.000). Subgroup prognostic analysis showed a lower CR rate (P=0.001) and a higher RR (P=0.023) in CD7+ group comparing to those of CD7− group in AML patients with wild type CEBPA. There were no statistical difference between CD7+ group and CD7− group in overall survival (OS) and disease free survival (P>0.05), while in the CEBPA mutant group the CD7+ group has higher OS (P=0.019) and DFS (P=0.010). Based on the CD7 expression and CEBPA mutation, 298 cases were divided into 3 subgroups, named as CD7+-CEBPA MT group, CD7− and CD7+-CEBPA WT group. The 3-year OS of the 3 groups were 80.2%, 48.0% and 30.6%, respectively (P<0.001), and the 3-year DFS were 74.1%, 37.4% and 22.2%, respectively (P<0.001).
Conclusion
The CEBPA mutation rate was higher in CD7+ AML patients then that of CD7− patients. CD7 expression has opposite prognostic significance in AML patients carrying the wild-type or mutant-type CEBPA. Based on CD7 expression and CEBPA mutation, a new risk stratification model can be established, which is helpful to guide the clinical individualized treatment for AML patients.
Keywords: CD7 antigen; Gene, CEBPA; Leukemia, myeloid, acute; Prognosis
CD7分子主要表达于T细胞表面,亦可见于早期造血细胞。在急性髓系白血病(AML)患者中,其阳性表达率为21%~30%[1]–[2],而其表达的预后意义在报道中不尽一致[3]–[5],需进一步在亚组分析评估。
CCAAT/增强子结合蛋白α(CCAAT/enhancer-binding protein alpha, CEBPA)基因定位于染色体19q13.1,其编码的蛋白是维持造血系统粒系分化的重要转录因子[6]。CEBPA突变在AML中的发生率为7%~11%,伴CEBPA突变的AML患者有更高的缓解率及更长的生存期,提示预后良好[7]–[9]。有研究显示伴CEBPA双位点突变、单位点突变或野生型的AML患者8年的总生存(OS)率分别为54%、31%和34%[9]。2016年WHO的AML分类指南中已明确指出CEBPA双位点突变是良好预后指标[10]。在CEBPA突变的AML患者中伴CD7表达(CD7+)的比例明显高于野生型组[11]–[13]。CD7+在CEBPA突变型和野生型AML中的预后意义是否存在差异尚不清楚。本研究中我们回顾性分析我院298例初发AML患者(除外M3亚型),评价CD7+与CEBPA突变的相关性,并进一步分析CD7+在CEBPA野生型和突变型AML患者中的预后价值,为更好地对AML患者进行危险分层并指导临床治疗提供依据。
病例与方法
1.病例:以2010年1月至2016年12月本院收治的298例初治AML(M3除外)患者为研究对象,所有患者经骨髓细胞形态学、细胞遗传学、免疫表型及分子生物学检查确诊为AML,完成1~2个疗程诱导化疗并进行疗效评估。其中男170例,女128例,中位年龄50(14~83)岁。FAB分型:M0 29例(9.7%),M1 23例(7.7%),M2 142例(47.7%),M4 17例(5.7%),M5 82例(27.5%),M6 5例(1.7%)。
2.流式细胞术及基因检测方法:均由本院血液病研究所完成。治疗前取骨髓液,肝素抗凝,分离单个核细胞。采用单克隆抗体直接免疫荧光标记法和流式细胞术进行标记和检测,以细胞表面抗原阳性率≥20%为阳性标准。另抽提DNA后,进行PCR扩增,RT-PCR检测NPM1、FLT3-ITD、CEBPA突变方法及结果分析参考文献[14]–[15]。CEBPA基因的突变须排除已知的单核苷酸多态性(SNP),特别是非常常见的p.Hisl95-Pro196dup[16]–[17]。将一个纯合突变或两个不同的非同义突变定义为双突变。
3.治疗:在对患者病情评估后主要采用标准化疗,即蒽环类药物联合阿糖胞苷方案,蒽环类药物包括去甲氧柔红霉素(IDA,8~10 mg/m2,第1~3天)、米托蒽醌(MIT,8 mg/m2,第1~3天)、阿柔比星(Acla,20 mg/d,第1~5天),阿糖胞苷(Ara-C)100 mg/m2,第1~7天;老年合并基础疾病的患者主要采用减低剂量化疗,即减低剂量的Ara-C为基础的化疗方案联合地西他滨,或者单用地西他滨。1~2个疗程诱导化疗未获得完全缓解(CR)则更换二线方案。诱导缓解后采用中大剂量Ara-C为主的巩固治疗,并予腰椎穿刺及鞘内注射甲氨蝶呤或Ara-C、地塞米松预防中枢神经系统白血病。有条件的患者行造血干细胞移植。
4.疗效判定:参照文献[18]分为CR、部分缓解(PR)、未缓解及复发。OS时间定义为从患者疾病确诊到死亡(包含任何原因死亡)、失访或随访截止的时间。无病生存(DFS)时间定义为从获得CR到白血病复发、死亡(包含任何原因死亡)、失访或随访截止的时间。
5.随访:所有病例随访截至2017年8月31日,其中失访56例,失访病例以末次就诊或随访日期为审视截点,采用查阅住院病历或电话联系方式随访。存活患者的中位随访时间为31(2~82)个月。
6.统计学处理:应用SPSS 19.0软件进行统计学分析。计量资料以均数±标准差表示,计量资料两组比较应用独立样本t检验或Mann-Whitney非参数检验;计数资料比较应用卡方检验或Fisher精确概率法;生存分析应用Kaplan-Meier方法,不同组别之间的差异比较应用Log-rank检验。以P<0.05为差异有统计学意义。
结果
1.一般临床特征:298例AML患者中,CD7+组109例(男60例,女49例),CD7−组189例(男110例,女79例)。与CD7−组相比较,CD7+组患者相对年轻(P=0.017)、初发时血小板计数低(P=0.020)。两组患者的性别、白细胞计数、血红蛋白水平、白蛋白水平、球蛋白水平、乳酸脱氢酶水平、肌酐水平、骨髓原始细胞比例、细胞遗传学危险分层以及治疗方案差异均无统计学意义(P值均>0.05)。根据FAB分型,CD7+组和CD7−组均以M2和M5最为常见,且在CD7+组中超过半数患者为M2(占60.6%)。在CD7+组中,CEBPA单位点和双位点突变的发生率分别为10.1%和33.9%,显著高于CD7−组(5.3%和4.2%),其差异具有统计学意义(P=0.000)。患者一般临床特征详见表1。
表1. 298例初治急性髓系白血病患者的临床特征.
| 临床特征 | CD7−组(189例) | CD7+组(109例) | 统计量(t/χ2/Z) | P值 | |
| 性别(例,男/女) | 110/79 | 60/49 | 0.281 | 0.596 | |
| 年龄[岁,M(范围)] | 50(18~83) | 46(14~77) | −2.384 | 0.017 | |
| FAB分型[例(%)] | 23.686 | 0.000 | |||
| M0 | 19(10.1) | 10(9.2) | |||
| M1 | 11(5.8) | 12(11.0) | |||
| M2 | 76(40.2) | 66(60.6) | |||
| M4 | 11(5.8) | 6(5.5) | |||
| M5 | 69(36.5) | 13(11.9) | |||
| M6 | 3(1.6) | 2(1.8) | |||
| WBC[×109/L,M(范围)] | 12.5(0.7~241.0) | 11.0(0.6~357.0) | −0.016 | 0.987 | |
| HGB[g/L,M(范围)] | 82(40~160) | 94(41~150) | −1.912 | 0.056 | |
| PLT[×109/L,M(范围)] | 53(4~361) | 40(4~722) | −2.322 | 0.020 | |
| 白蛋白[g/L,M(范围)] | 39.4(25.3~59.3) | 40.8(26.9~57.7) | −1.899 | 0.058 | |
| 球蛋白[g/L,M(范围)] | 24.9(12.5~47.2) | 24.6(14.5~44.0) | −0.370 | 0.711 | |
| 肌酐[µmol/L,M(范围)] | 61(23~355) | 60(21~173) | −1.293 | 0.196 | |
| 乳酸脱氢酶[U/L,M(范围)] | 405.5(27~5 332) | 315(94~5 526) | −1.455 | 0.146 | |
| 骨髓原始细胞比例[%,M(范围)] | 64.0(18.0~96.0) | 64.9(18.0~97.6) | −0.810 | 0.418 | |
| 细胞遗传学危险分层[例(%)] | 5.249 | 0.154 | |||
| 预后良好 | 14(7.4) | 2(1.8) | |||
| 预后中等 | 123(65.1) | 71(65.1) | |||
| 预后不良 | 15(7.9) | 13(11.9) | |||
| 未做或未显带 | 37(19.6) | 23(21.1) | |||
| 诱导治疗[例(%)] | 0.027 | 0.869 | |||
| 标准治疗 | 167(88.4) | 97(89.0) | |||
| 减剂量治疗 | 22(11.6) | 12(11.0) | |||
| CEBPA突变[例(%)] | 47.757 | 0.000 | |||
| 野生型 | 171(90.5) | 61(56.0) | |||
| 单位点突变 | 10(5.3) | 11(10.1) | |||
| 双位点突变 | 8(4.2) | 37(33.9) | |||
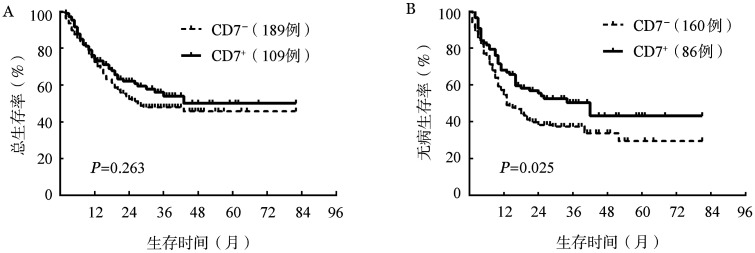
2.疗效及预后:298例患者在经过1~2个疗程诱导化疗后有246例(82.6%)患者获得CR。其中115例(46.7%)患者在后续巩固维持治疗过程中出现复发。CD7+组和CD7−组的CR率分别为78.9%(86/109)和84.7%(160/189),差异无统计学意义(χ2=1.591,P=0.207);两组的复发率分别为43.0%(37/86)和48.8%(78/160),差异亦无统计学意义(χ2=0.737,P=0.391)。CD7−组患者中位OS时间为27个月,中位DFS时间为13个月,3年OS率和DFS率分别为48.0%和37.4%;CD7+组的中位OS时间未达到,中位DFS时间为42个月,3年OS率和DFS率分别为54.0%和50.5%。两组患者的OS率差异无统计学意义(P=0.263);但CD7+组的DFS时间明显长于CD7−组,差异具有统计学意义(P=0.025)(图1)。
图1. CD7+和CD7−组急性髓系白血病患者总生存(A)和无病生存(B)曲线比较.
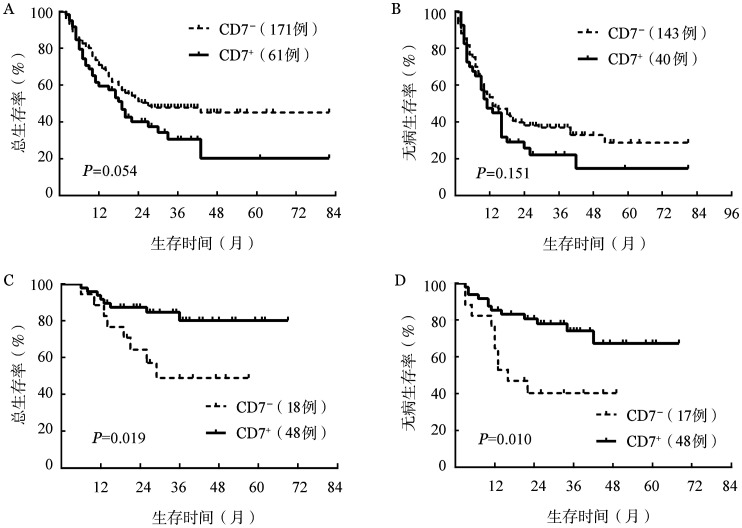
在CEBPA野生型患者中,与CD7−组相比,CD7+组患者的CR率低(62.3%和83.6%,χ2=11.928,P=0.001)、复发率高(71.1%和50.3%,χ2=5.193,P=0.023);CD7+组中位OS和DFS时间分别为19个月和11个月,略低于CD7−组的27个月和13个月,但差异无统计学意义(P>0.05)。在CEBPA突变患者中,CD7−组与CD7+组的CR率分别为94.4%和100%,复发率分别为41.2%和23.8%,两组间的CR率和复发率差异均无统计学意义(P>0.05)。CD7−组的中位OS和DFS时间分别为29个月和16个月,而CD7+组的中位OS和DFS时间均未达到,生存曲线分析显示CD7+组的OS及DFS均优于CD7−组(P=0.019和P=0.010)(图2)。
图2. CEBPA野生型和突变患者中CD7−组和CD7+组生存曲线比较.
A、B分别为CEBPA野生型患者中两组总生存和无病生存曲线比较;C、D分别为CEBPA突变型患者中两组总生存和无病生存曲线比较
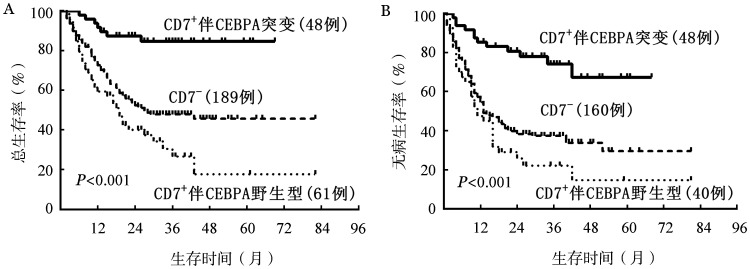
3.根据CD7表达情况和CEBPA突变与否对AML患者建立新的危险分层系统:CD7−组无论是否伴有CEBPA突变,其OS和DFS的差异均无统计学意义(P=0.473和P=0.500)。根据CD7表达情况和CEBPA突变与否初步将AML患者进行危险分层,分为三个亚组:低危组为CD7+伴CEBPA突变组(包括双位点和单位点突变),中危组为CD7−组,高危组为CD7+伴CEBPA野生型组。以上三组患者分别占总AML的16.1%、63.4%和20.5%;3年的OS率分别为84.6%、48.0%和26.8%(P<0.001),3年的DFS率分别为74.1%、37.4%和22.2%(P<0.001)(图3)。
图3. 三个预后亚组的总生存(A)和无病生存(B)曲线比较.
讨论
CD7抗原是一种在AML中较为常见的T细胞相关抗原,在健康人的胸腺细胞、T细胞和自然杀伤细胞以及淋巴细胞和骨髓细胞的祖细胞上表达[19],而在AML中CD7阳性表达患者占21%~30%[20]。我们的资料显示在AML患者中伴CD7+的比例为36.6%,略高于相关文献报道。目前关于CD7+是否提示AML不良预后仍存在争议,Ogata等[21]研究发现CD7+对不同细胞遗传学状况下AML患者的预后影响存在差异,根据2017 ELN细胞遗传学危险分层,在低危组和中危组的AML患者中CD7+不具有预后不良价值,而高危组的CD7+患者预后极差,并且随危险度增加CD7+的比例也逐渐升高。另外,AML伴CD7+患者预后较差可能与该类患者本身伴有侵袭性分子临床学特征或者对标准治疗耐药相关[13],需进一步探讨。我们的研究资料显示:与CD7−组患者相比,CD7+组患者相对年轻(P=0.017),初发时血小板计数较低(P=0.020),与相关报道基本相似。本研究发现两组间OS差异无统计学意义,但CD7+组较CD7−组患者DFS时间更长(P=0.025),提示CD7阳性可能对AML预后存在积极意义。
CEBPA基因在造血系统早期分化时促进造血干细胞/祖细胞向粒细胞分化,抑制细胞增殖。2016年WHO的AML分类指南中已明确指出CEBPA双位点突变是良好预后指标[10]。近年来的研究表明,野生型CEBPA与CD7表达水平呈负相关。我们的研究也显示了在CEBPA单位点和双位点突变组AML患者中CD7+比例显著高于CEBPA野生型组(P=0.000)。Röhrs等[13]研究发现在CD7+细胞中CEBPA过表达不能抑制CD7表达,而在CD7−细胞中敲除CEBPA基因亦不能诱导CD7阳性表达;故野生型CEBPA并非CD7表达的直接负调控因子。同时他们也发现在CD7−AML细胞中去甲基化药物阿扎胞苷可诱导CD7阳性表达,在CD7−细胞株细胞中CD7内含子1的CpGs呈现甲基化,而在CD7+细胞株细胞中则表现为去甲基化,因此可以推测CD7表达受到甲基化调控。但在AML初发患者中CD7表达是否受甲基化调控,以及CEBPA与CD7阳性表达呈负相关的原因,两者之间是否存在相互调控关系仍需进一步研究探讨。
本研究初步发现CD7+在CEBPA突变组和野生型AML中存在不同预后意义。有趣的是,在野生型组AML中CD7+患者较CD7−患者CR率低、复发率高,但OS和DFS的差异无统计学意义;而在CEBPA突变型AML中两组的CR率和复发率差异无统计学意义,但CD7+患者显示出更长的OS及DFS时间。野生型组AML中CD7+与不良预后相关,而CEBPA突变组AML中CD7+则提示预后良好,说明在不同细胞遗传学背景下CD7+具有不同的预后价值。
免疫分型在细胞遗传学的基础上可以对初发AML患者尤其是核型正常的亚型进行更精确的危险分层,以期更好地指导临床治疗,改善患者的预后。我们根据CD7表达情况和CEBPA突变与否将AML患者分为三个危险亚组:CD7+伴CEBPA突变组(包括双位点和单位点突变)、CD7−组和CD7+伴CEBPA野生型组,三组患者的3年OS率分别为80.2%、48.0%和30.6%。该危险分层模型提示无论CEBPA是单位点突变还是双位点突变,只要伴有CD7阳性均提示预后极佳;而CEBPA双位点突变患者若CD7阴性则可能归于中危组,而不再是低危组,其OS和DFS显著低于CD7+伴CEBPA突变组。由于本研究为单中心回顾性研究,分组后有部分组别病例数偏少,可能存在数据偏差,仍需要更多的临床数据进一步验证并明确两者相互调控的机制。
综上所述,我们发现CEBPA突变与CD7的表达存在一定的相关性。在CEBPA野生型组中CD7+提示低CR率、高复发率,但OS和DFS差异无统计学意义;而在CEBPA突变组中CD7表达与否与CR率及复发率无关,但CD7+可预示更长的OS和DFS时间。根据CD7的表达情况和CEBPA突变与否建立了新的危险分层模型,显示出较好的预后分层价值,但仍需要进一步进行前瞻性研究验证其临床意义,以期更好地指导临床个体化治疗,改善患者预后。此外,CEBPA与CD7阳性表达之间相互负调控机制仍需进一步研究探讨。
Funding Statement
基金项目: 浙江省医药卫生科技项目 (2017KY059)
Fund program: Zhejiang Medical and Health Science Research Foundation (2017KY059)
References
- 1.Auewarakul CU, Promsuwicha O, U-Pratya Y, et al. Immunophenotypic profile of adult acute myeloid leukemia(AML): analysis of 267 cases in Thailand[J] Asian Pac J Allergy Immunol. 2003;21(3):153–160. [PubMed] [Google Scholar]
- 2.Venditti A, Del PG, Buccisano F, et al. Prognostic relevance of the expression of Tdt and CD7 in 335 cases of acute myeloid leukemia[J] Leukemia. 1998;12(7):1056–1063. doi: 10.1038/sj.leu.2401067. [DOI] [PubMed] [Google Scholar]
- 3.Bene MC, Castoldi G, Knapp W, et al. Proposals for the immunological classification of acute leukemias. European Group for the Immunological Characterization of Leukemias(EGIL)[J] Leukemia. 1995;9(10):1783–1786. [PubMed] [Google Scholar]
- 4.Rabinowich H, Pricop L, Herberman RB, et al. Expression and function of CD7 molecule on human natural killer cells[J] J Immunol. 1994;152(2):517–526. [PubMed] [Google Scholar]
- 5.Fenchel K, Bergmann L, Christ S, et al. Prognstic value of simultaneous expression of CD7 and CD33 on leukemia blasts in AML. Unfavourale outcome of patients with CD54+[J] Blood(ASH annual meeting abstract). 1993;82:122. [Google Scholar]
- 6.Pabst T, Mueller BU, Zhang P, et al. Dominant-negative mutations of CEBPA, encoding CCAAT/enhancer binding protein-alpha(C/EBPalpha), in acute myeloid leukemia[J] Nat Genet. 2001;27(3):263–270. doi: 10.1038/85820. [DOI] [PubMed] [Google Scholar]
- 7.Fröhling S, Schlenk RF, Stolze I, et al. CEBPA mutations in younger adults with acute myeloid leukemia and normal cytogenetics: prognostic relevance and analysis of cooperating mutations[J] J Clin Oncol. 2004;22(4):624–633. doi: 10.1200/JCO.2004.06.060. [DOI] [PubMed] [Google Scholar]
- 8.Patel JP, Gönen M, Figueroa ME, et al. Prognostic relevance of integrated genetic profiling in acute myeloid leukemia[J] N Engl J Med. 2012;366(12):1079–1089. doi: 10.1056/NEJMoa1112304. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.Green CL, Koo KK, Hills RK, et al. Prognostic significance of CEBPA mutations in a large cohort of younger adult patients with acute myeloid leukemia: impact of double CEBPA mutations and the interaction with FLT3 and NPM1 mutations[J] J Clin Oncol. 2010;28(16):2739–2747. doi: 10.1200/JCO.2009.26.2501. [DOI] [PubMed] [Google Scholar]
- 10.Arber DA, Orazi A, Hasserjian R, et al. The 2016 revision to the World Health Organization classification of myeloid neoplasms and acute leukemia[J] Blood. 2016;127(20):2391–2405. doi: 10.1182/blood-2016-03-643544. [DOI] [PubMed] [Google Scholar]
- 11.Lin LI, Chen CY, Lin DT, et al. Characterization of CEBPA mutations in acute myeloid leukemia: most patients with CEBPA mutations have biallelic mutations and show a distinct immunophenotype of the leukemic cells[J] Clin Cancer Res. 2005;11(4):1372–1379. doi: 10.1158/1078-0432.CCR-04-1816. [DOI] [PubMed] [Google Scholar]
- 12.Renneville A, Boissel N, Gachard N, et al. The favorable impact of CEBPA mutations in patients with acute myeloid leukemia is only observed in the absence of associated cytogenetic abnormalities and FLT3 internal duplication[J] Blood. 2009;113(21):5090–5093. doi: 10.1182/blood-2008-12-194704. [DOI] [PubMed] [Google Scholar]
- 13.Röhrs S, Scherr M, Romani J, et al. CD7 in acute myeloid leukemia: correlation with loss of wild-type CEBPA, consequence of epigenetic regulation[J] J Hematol Oncol. 2010;3:15. doi: 10.1186/1756-8722-3-15. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Care RS, Valk PJ, Goodeve AC, et al. Incidence and prognosis of c-KIT and FLT3 mutations in core binding factor(CBF)acute myeloid leukaemias[J] Br J Haematol. 2003;121(5):775–777. doi: 10.1046/j.1365-2141.2003.04362.x. [DOI] [PubMed] [Google Scholar]
- 15.Verhaak RG, Goudswaard CS, van Putten W, et al. Mutations in nucleophosmin(NPM1)in acute myeloid leukemia(AML): association with other gene abnormalities and previously established gene expression signatures and their favorable prognostic significance[J] Blood. 2005;106(12):3747–3754. doi: 10.1182/blood-2005-05-2168. [DOI] [PubMed] [Google Scholar]
- 16.陈 菲菲. 杭州: 浙江大学; 2014. CEBPA基因突变的急性髓系白血病异质性研究[D] [Google Scholar]
- 17.Wouters BJ, Louwers I, Valk PJ, et al. A recurrent in-frame insertion in a CEBPA transactivation domain is a polymorphism rather than a mutation that does not affect gene expression profiling-based clustering of AML[J] Blood. 2007;109(1):389–390. doi: 10.1182/blood-2006-08-042325. [DOI] [PubMed] [Google Scholar]
- 18.张 之南, 沈 悌. 血液病诊断及疗效标准[M] 3版. 北京: 科学出版社; 2007. pp. 131–133. [Google Scholar]
- 19.Ochi K, Fuji S, Takano K, et al. The putative anti-leukemic effects of anti-thymocyte globulins in patients with CD7-positive acute myeloid leukemia[J] Bone Marrow Transplant. 2018;53(8):1019–1029. doi: 10.1038/s41409-018-0115-7. [DOI] [PubMed] [Google Scholar]
- 20.Gomes-Silva D, Atilla E, Atilla PA, et al. CD7 CAR T cells for the therapy of acute myeloid leukemia[J] Mol Ther. 2019;27(1):272–280. doi: 10.1016/j.ymthe.2018.10.001. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 21.Ogata K, Yokose N, Shioi Y, et al. Reappraisal of the clinical significance of CD7 expression in association with cytogenetics in de novo acute myeloid leukaemia[J] Br J Haematol. 2001;115(3):612–615. doi: 10.1046/j.1365-2141.2001.03139.x. [DOI] [PubMed] [Google Scholar]