Abstract
Describimos el caso de una gestante de 24 años de edad, sin enfermedades previas, que fue ingresada con diagnóstico de neumonía bilateral por el nuevo coronavirus 2. Por empeoramiento clínico precisó cesárea urgente con anestesia general e intubación orotraqueal por intolerancia al decúbito. Tras la extubación desarrolló un cuadro de obnubilación que obligó al diagnóstico diferencial de encefalitis/meningitis por SARS-CoV-2, con tomografía computarizada (TC) y angioTC normales, bioquímica del líquido cefalorraquídeo (LCR) inespecífica y resonancia magnética informada como «síndrome de encefalopatía posterior reversible» (al presentar características radiológicas sugestivas de edema vasogénico con alteraciones en la sustancia blanca de localización parieto-temporo-occipital, junto con alteración de nivel de conciencia) secundaria a cuadro hipertensivo del embarazo. La paciente 11 días después de la cesárea comenzó a desarrollar un cuadro hipertensivo que requirió tratamiento.
La encefalopatía posterior reversible (PRES) asocia un conjunto de características clínicas (cefalea, alteración del nivel de conciencia, alteraciones visuales y convulsiones) y radiológicas (alteraciones reversibles en la sustancia blanca fundamentalmente en regiones parieto-temporo-occipitales) sugestivas de edema vasogénico.
En pacientes gestantes SARS-CoV-2, el diagnóstico diferencial de la patología hipertensiva y las alteraciones de nivel de conciencia puede ser extremadamente complicado, al encontrarnos pruebas complementarias normales y ausencia de hipertensión arterial (HTA) en el periparto inmediato. Tal vez la secuenciación del genoma del SARS-CoV-2 en el LCR nos hubiera permitido un diagnóstico de certeza, aunque el tratamiento no hubiera variado.
Palabras clave: COVID-19, SARS-CoV-2, Encefalopatía, Postparto
Abstract
We describe the case of a 24-year-old pregnant woman with no history of note who was admitted with a diagnosis of bilateral pneumonia caused by the new coronavirus.
Due to clinical worsening, she required urgent cesarean section with general anaesthesia and intubation for decubitus intolerance. After extubation, she presented altered mental state that required a differential diagnosis of encephalitis/meningitis secondary to SARS-CoV-2.
CT and CT-angiography were normal, spinal fluid tests were non-specific, and magnetic resonance imaging reported posterior reversible encephalopathy syndrome (PRES) (due to radiological features suggestive of white matter vasogenic edema affecting the parietal, temporal and occipital lobes, along with altered mental state) secondary to gestational hypertension. Eleven days after the cesarean section the patient began to develop hypertension that required treatment.
PRES is associated with certain clinical (headache, altered mental state, visual disturbances and convulsions) and radiological (reversible changes in white substance mainly affecting the parietal, temporal, and occipital lobes) characteristics suggestive of vasogenic oedema In pregnant SARS-CoV-2 patients, the differential diagnosis of hypertension and altered mental state is often extremely complicated because complementary tests can be normal and there is no immediate sign of peripartum hypertension. SARS-CoV-2 genome sequencing in spinal fluid could have provided a definitive diagnosis, but the treatment would not have differed.
Keywords: COVID-19, SARS-CoV-2, Encephalopathy, Postpartum
Introducción
La infección por el SARS-CoV-2 es un problema de salud pública global. Aunque inicialmente se temió que el estado de inmunosupresión que supone el embarazo pudiera generar una mayor incidencia de complicaciones, las series de casos parecen indicar que las características de la infección en la gestante no difieren de la población general1, 2.
No obstante, algunos de los cuadros clínicos y síntomas pueden agravarse o enmascararse con las alteraciones fisiológicas propias de la gestación. Aunque al principio de la pandemia no fue descrito, es conocido que el neurotropismo del SARS-CoV-2 puede producir afectación del sistema nervioso central (SNC), planteando un difícil diagnóstico diferencial con patología asociada al embarazo que ocasione síntomas similares.
Caso clínico
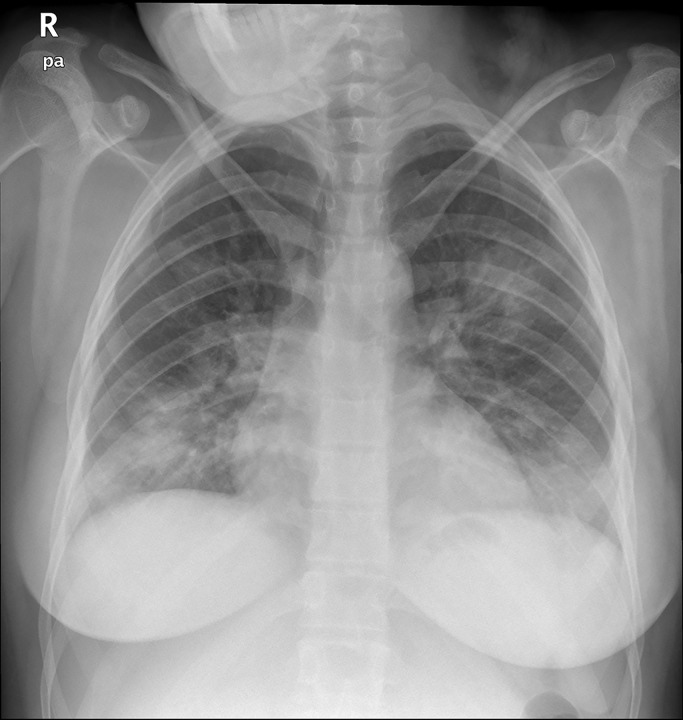
Una gestante a término de 24 años de edad (talla: 1,61 m; peso: 68 kg) ingresó por fiebre, tos y disnea de tres días de evolución, con radiografía de tórax con patrón de neumonía intersticial bilateral en campos medios e inferiores (fig. 1 ) y reacción en cadena de la polimerasa con transcriptasa inversa (RT-PCR) para COVID-19 positiva. Se inició tratamiento con hidroxicloroquina, azitromicina, ceftriaxona, lopinavir/ritonavir y enoxaparina.
Figura 1.
Radiografía posteroanterior de tórax: consolidaciones parenquimatosas bilaterales en campos pulmonares inferiores y medios, compatibles con neumonía vírica por COVID-19, dado el contexto epidémico.
El segundo día de ingreso se indujo el parto debido al empeoramiento clínico (aumento de tos y disnea). Se realizó analgesia epidural precoz sin incidencias durante el trabajo de parto, lográndose un nivel de analgesia óptimo en T8, sin bloqueo motor.
Durante las horas siguientes, desarrolló disnea de reposo con taquipnea progresiva hasta presentar más de 30 rpm y deterioro de la mecánica ventilatoria con uso de musculatura accesoria, permaneciendo en sedestación con cabecero elevado 900. La saturación fue disminuyendo progresivamente desde 99% con gafas nasales a 2 lpm cuando se inició la inducción hasta 91-92% con gafas nasales a 6 lpm. El nivel de conciencia era óptimo en ese momento, y se mantuvo alerta y orientada, sin somnolencia ni otras alteraciones. El rápido deterioro respiratorio obligó a la realización de cesárea urgente. La paciente no toleró el decúbito necesario para la cesárea, con desaturación hasta 89%, por lo que precisó anestesia general. Tras la intubación se realizó maniobra de reclutamiento, permaneciendo ventilada con FiO2 de 0,4, PEEP de 12 mmHg, volumen corriente de 7 mL/kg y frecuencia respiratoria de 16 rpm, manteniendo saturación de O2 de 98-99%. Tras la cirugía fue trasladada a la Unidad de Cuidados Intensivos (UCI) específica para pacientes COVID-19.
Las gasometrías posteriores en la UCI mostraron una relación PaO2/FiO2 de 455. Se mantuvo a la paciente con parámetros ventilatorios similares a los de quirófano, y sedada con propofol y remifentanilo. Presentó buena evolución, siendo extubada a las 20 horas. Tras la extubación presentó un síndrome confusional hipoactivo con desorientación temporo-espacial sin otra focalidad. Se trasladó a la sala de hospitalización dos días después.
En la sala la paciente desarrolló discreta hemiparesia derecha, fluctuación del nivel de conciencia y aumento de la somnolencia, que fue empeorando progresivamente hasta presentar un nivel en la escala de coma de Glasgow de 10 (M5, O2, V2) y afasia motora intercalada con periodos de agitación, que condicionaron deterioro respiratorio. Se realizó tomografía computarizada (TC) craneal que no evidenció patología aguda.
Ante el empeoramiento neurológico, la paciente ingresó en la unidad de reanimación de maternidad. Fue valorada por un neurólogo y se realizó angioTC (sin hallazgos) y punción lumbar que mostró xantocromía, proteínas: 0,53 g/L; leucocitos: 5 cel/μL, glucosa: 41 mg/dL. Tinción de Gram, cultivo bacteriano y detección molecular de enterovirus, VVZ y VHS 1 y 2 negativas. Se instauró tratamiento con enoxaparina (60 mg/sc/24 h), metilprednisolona (1 mg/kg/24 h) y ceftriaxona. A las 12 horas de ingreso, se produjo deterioro respiratorio que obligó a reintubación y nuevo traslado a la UCI.
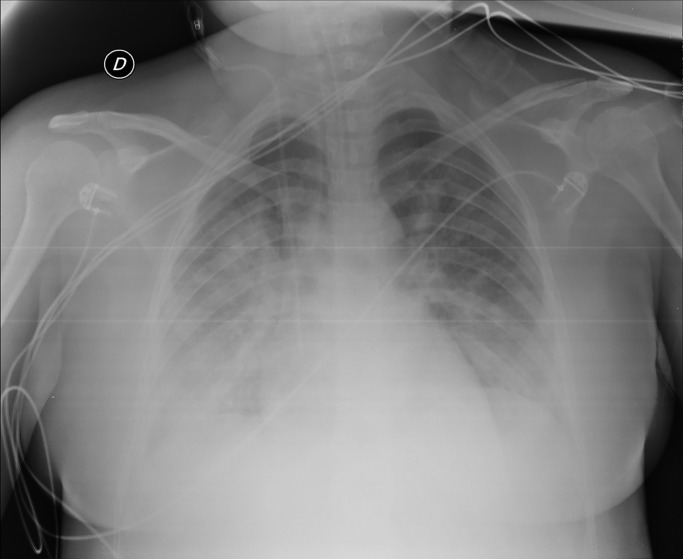
En la nueva radiografía de tórax se objetivó empeoramiento (fig. 2 ) y la analítica demostró un estado proinflamatorio con IL-6: 151 pg/mL, PCR: 13,4 mg/dL, procalcitonina: 9,3 ng/mL, por lo que se administró tocilizumab. La mecánica respiratoria evolucionó favorablemente permitiendo disminuir la PEEP y cambiar a ventilación con soporte de presión al tercer día de ingreso. Se inició levetirazetam por posible origen comicial del deterioro neurológico. El electroencefalograma (EEG) evidenció patrón de lentificación marcada y ondas ocasionales trifásicas, más marcado a nivel temporal izquierdo, lo que obligó a valorar una posible lesión subyacente, pero sin observar actividad epileptiforme. Se realizaron ventanas de sedación diarias, conectando la paciente al cuarto día y permitiendo su extubación. Durante su estancia presentó un episodio puntual de hipertensión arterial (HTA) que respondió a 25 mg de urapidilo iv. La paciente fue dada de alta a la unidad de hospitalización al quinto día.
Figura 2.
Radiografía de tórax anteroposterior en decúbito supino: empeoramiento radiológico respecto a fig. 1. Menores volúmenes pulmonares, aumento de las opacidades bibasales. Afectación radiológica moderada-grave.
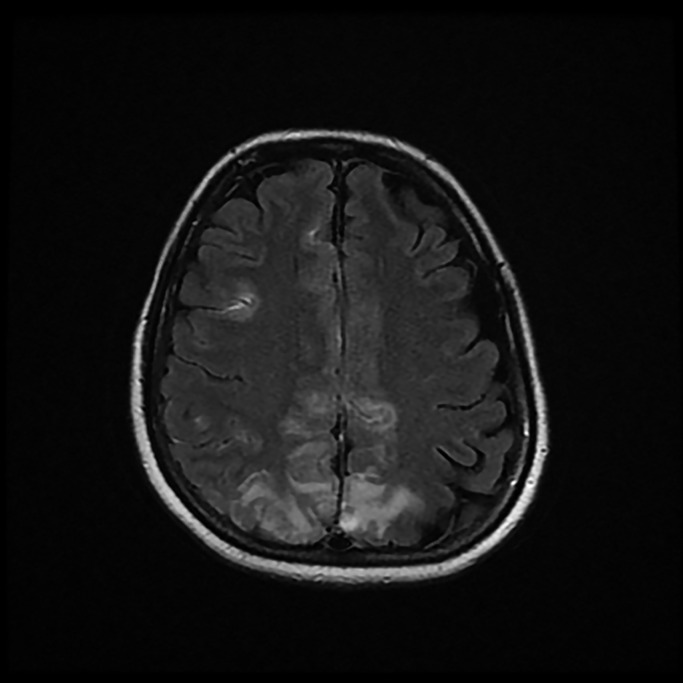
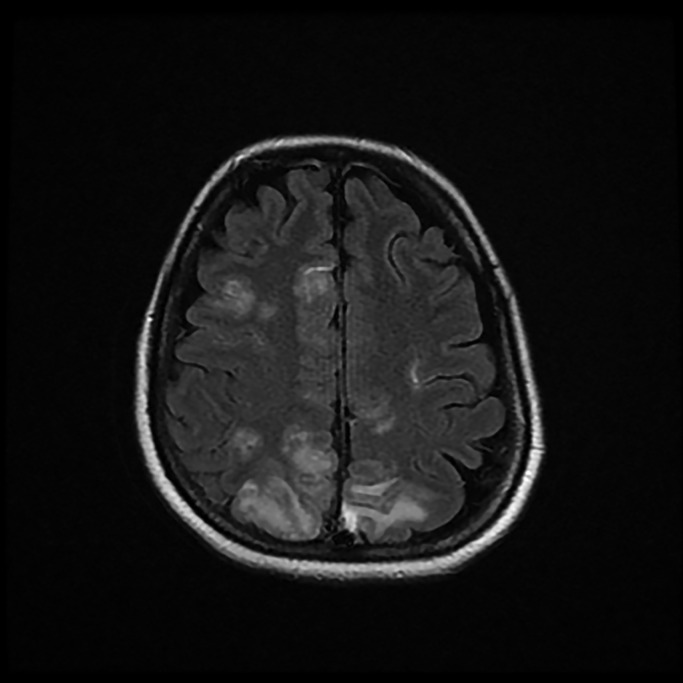
En la sala de hospitalización destacó inatención, apatía y movilización asimétrica de miembro inferior derecho. Aunque presentó mejoría progresiva tanto respiratoria como neurológica, se realizó resonancia magnética (RM) que se informó como extensas zonas hiperintensas con afectación tanto del córtex como de la sustancia blanca subcortical, de forma bilateral y simétrica, pero con mayor extensión en el hemisferio derecho y afectación de la región parasagital y de la convexidad parietal bilateral, la región parasagital frontal bilateral y zonas en la región de la convexidad superior frontal derecha. Se identificaron pequeñas captaciones leptomeníngeas, correspondientes a flujo más enlentecido intravascular, sin restricción en la difusión. La imagen se informó como encefalopatía posterior reversible (PRES) (Figura 3, Figura 4 ) Desde el tercer día de ingreso en hospitalización, la paciente presentó episodios de HTA, tratados inicialmente con labetalol y posteriormente con enalapril y amlodipino, diagnosticándose de cuadro hipertensivo del periparto. A los nueve días de reingreso la paciente recibió el alta hospitalaria, con estancia hospitalaria total de 18 días. Como tratamiento ambulatorio se pautó enalapril, amlodipino y levetirazetam.
Figura 3.
Resonancia magnética (secuencia potenciada en T2 y FLAIR): Cortes axiales en los que se identifican zonas hiperintensas, con afectación bilateral tanto cortical como de sustancia blanca subcortical, más extensa en el hemisferio derecho. Se aprecia afectación en región parasagital y convexidad parietal bilateral y región parasagital frontal bilateral. La imagen sugiere que se trata de una PRES.
Figura 4.
Resonancia magnética (secuencia potenciada en T2 y FLAIR): Cortes axiales en los que se identifican zonas hiperintensas, con afectación bilateral tanto cortical como de sustancia blanca subcortical, más extensa en el hemisferio derecho. Se aprecia afectación en región parasagital y convexidad parietal bilateral y región parasagital frontal bilateral. La imagen sugiere que se trata de una PRES.
En el momento de redactar este artículo la paciente había sido dada de alta al domicilio con clara mejoría, aunque a las 48 horas del alta acudió de nuevo a urgencias por sensación de obnubilación. Queda pendiente una RM de control dos meses después.
Discusión
El SARS-CoV-2 produce afectación neurológica a nivel del SNC (temblores, cefaleas, alteración del nivel de conciencia, accidente cerebrovascular, ataxia y convulsiones), sistema nervioso periférico (alteración del gusto, del olfato o de la visión y dolor neuropático) y del sistema musculoesquelético. Mao et al. describieron síntomas neurológicos hasta en 36,4% de los pacientes, asociando su aparición a la gravedad de la enfermedad. El 14% de los pacientes con enfermedad grave presentaron alteración de nivel de conciencia3, 4. La anosmia y la ageusia presentan una prevalencia del 85% en Europa, siendo la alteración olfativa el síntoma inicial en el 12% de casos5, 6.
Los mecanismos fisiopatológicos no están completamente dilucidados. Al igual que en otros virus, la afectación neurológica podría producirse por infección directa del sistema nervioso, por encefalopatía tóxica asociada a la infección sistémica grave o como lesiones desmielinizantes. Además, los pacientes con COVID-19 suelen asociar niveles elevados de dímero D, trombopenia y microangiopatía, que junto con el daño endotelial aumenta su propensión a ictus por diferentes mecanismos7.
En primer lugar, uno de los targets para varios coronavirus es la enzima convertidora de angiotensina 2 (ACE 2), muy abundante en los alveocitos tipo II, las células gliales y en las neuronas4. Fundamentalmente regula la presión arterial y el control de mecanismos antiescleróticos. La interacción de las proteínas del SARS-CoV-2 con la ACE2 del endotelio capilar origina HTA, daño directo vascular y alteración de la barrera hematoencefálica (BHE)7, facilitada por la respuesta inflamatoria exagerada que provoca la tormenta de citoquinas que favorecen la penetración del virus al SNC7 y aumentan el riesgo de hemorragia cerebral4.
En segundo lugar está descrita la invasión por migración viral a través de la vía neuronal, mediante la infección de las terminaciones nerviosas sensitivas o motoras, como en la vía olfatoria. Los nervios del tracto olfatorio y del bulbo olfatorio en la cavidad nasal y craneal son un canal directo entre el epitelio nasal y el SNC. El SARS-CoV-2 entraría al SNC a través del tracto olfatorio al inicio de la infección alcanzando el cerebro y el líquido cefalorraquídeo (LCR), causando inflamación y desmielinización. Distintos análisis han encontrado secuencias genómicas del SARS en neuronas7.
Además, las neumonías bilaterales graves causadas por el SARS-CoV-2, originan hipoxia importante y favorecen el metabolismo anaeróbico en las mitocondrias neuronales, produciendo vasodilatación cerebral, afectación neuronal, edema intersticial, alteración del flujo sanguíneo y cefalea, y pudiendo originar hipertensión intracraneal, deterioro del estado de conciencia y coma.
Junto a esto, el síndrome de respuesta inflamatoria asociado al COVID-19, induce un estado proinflamatorio con elevación importante de IL-6 que puede activar las células gliales, dando lugar a inflamación crónica y daño cerebral7.
Para el diagnóstico, la realización de PCR en el LCR frente a los virus más sospechosos es el método diagnóstico primario, pero debe ir acompañado de pruebas de neuroimagen, EEG, examen del LCR, pruebas serológicas de detección de antígenos e incluso de biopsia cerebral.
La capacidad de invasión del SNC por la COVID-19 se reportó por primera vez en enero del 2020 en una paciente de 56 años de Wuhan, la cual presentó disminución del nivel de conciencia y TAC normal. El diagnóstico de encefalitis se confirmó por secuenciación genómica del SARS-CoV-2 en el LCR6. En marzo de 2020 se describió otro caso de un varón de 24 años en Japón con convulsiones generalizadas. Las muestras nasofaríngeas fueron negativas, pero presentó RT-PCR positiva en el LCR, por lo que fue diagnosticado de meningitis/encefalitis por COVID-198. En ambos casos destaca la alteración de nivel de conciencia con TC normal sin datos de edema cerebral.
Poyiadji et al. describen un caso de encefalopatía necrotizante aguda hemorrágica, relacionada con el síndrome de la tormenta de citoquinas descrito en la COVID-19 y con imágenes características en TC y RM9.
En nuestra paciente, la punción lumbar presentó características inespecíficas, similar a los casos previos de encefalitis publicados. No se realizó RT-PCR SARS-CoV-2 en el LCR por imposibilidad del laboratorio.
Los EEG de los casos publicados de encefalitis no están descritos. Aunque inespecíficos, los hallazgos en nuestra paciente son compatibles con una encefalitis viral. Previamente se había descartado la causa tromboembólica (frecuente en pacientes COVID-19) y la hemorragia/isquemia cerebral con TC sin contraste y angioTC normales. La RM realizada dos días después (Figura 3, Figura 4) con secuencias potenciadas en T1 en el plano sagital y en T2 y FLAIR en el plano axial, era compatible con PRES.
El PRES asocia un conjunto de características clínicas (cefalea, alteración del nivel de conciencia, alteraciones visuales y convulsiones) y radiológicas (alteraciones reversibles en la sustancia blanca fundamentalmente en regiones parieto-temporo-occipitales) sugestivas de edema vasogénico10. Se ha asociado fundamentalmente a HTA e inmunosupresión10. Como mecanismos fisiopatológicos están la vasoconstricción, el aumento de perfusión y el daño endotelial. En las embarazadas, es característica la aparición de PRES tras cuadros hipertensivos del embarazo, pero nuestra paciente no había presentado tensiones elevadas ni criterios de preeclampsia hasta 10 días después del parto, cuando desarrolló cifras tensionales diastólicas elevadas hasta 110 mmHg, que requirieron tratamiento antihipertensivo.
El debut de cuadros hipertensivos del embarazo en el postparto es infrecuente10, y no podemos olvidar que el SARS-CoV-2 puede originar HTA, edema cerebral y encefalopatía, y la propia encefalopatía hipertensiva debería tratarse como un signo de infección4, pasando a ser por tanto el COVID nuestra primera sospecha etiológica, tanto de la elevación de las cifras tensionales como de la encefalopatía con PRES.
Por otro lado, parecería simplista asociar el PRES solamente a un cuadro de HTA no documentado hasta 11 días después del ingreso, en el seno de un cuadro clínico por COVID-19 tan grave como el que sufrió esta paciente.
Aunque la literatura es limitada, la sensación subjetiva de los profesionales que tratamos COVID es que los síntomas neurológicos y los cuadros de encefalopatía son numerosos. La limitación para realizar algunas pruebas de laboratorio y lo inespecífico de las alteraciones en EEG y RM complican el diagnóstico certero en las pacientes obstétricas. Son necesarias series de casos mayores para conocer la incidencia y pronóstico real de este tipo de complicaciones.
Financiación
Los autores no han recibido ningún tipo de financiación para la publicación de este artículo.
Conflicto de intereses
Los autores de este artículo no presentan conflictos de intereses que declarar.
Bibliografía
- 1.Liang H., Acharya G. Novel corona virus disease (COVID-19) in pregnancy: What clinical recommendations to follow? Acta Obstet Gynecol Scand. 2020;99:439–442. doi: 10.1111/aogs.13836. [DOI] [PubMed] [Google Scholar]
- 2.Chen H., Guo J., Wang C., Luo F., Yu X., Zhang W. Clinical characteristics and intrauterine vertical transmission potential of COVID-19 infection in nine pregnant women: a retrospective review of medical records. Lancet [Internet]. 2020;395(10226):809–815. doi: 10.1016/S0140-6736(20)30360-3. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.Mao L., Jin H., Wang M., Hu Y., Chen S., He Q. Neurologic manifestations of hospitalized patients with coronavirus disease 2019 in Wuhan, China. JAMA Neurol. 2020 doi: 10.1001/jamaneurol.2020.1127. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.Sellner J., Taba P., Öztürk S., Helbok R. The need for neurologists in the care of COVID-19 patients. Eur J Neurol. 2020 doi: 10.1111/ene.14257. 0-1. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Lechien J.R., Chiesa-Estomba C.M., De Siati D.R., Horoi M., Le Bon S.D., Rodriguez A. Olfactory and gustatory dysfunctions as a clinical presentation of mild-to-moderate forms of the coronavirus disease (COVID-19): a multicenter European study. Eur Arch Oto-Rhino-Laryngol[Internet]. 2020:2. doi: 10.1007/s00405-020-05965-1. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Carod Artal F.J. Complicaciones neurológicas por coronavirus y COVID-19. Rev Neurol. 2020;70:311–322. doi: 10.33588/rn.7009.2020179. [DOI] [PubMed] [Google Scholar]
- 7.Wu Y., Xu X., Chen Z., Duan J., Hashimoto K., Yang L. Nervous system involvement after infection with COVID-19 and other coronaviruses. Brain Behav Immun. 2020 doi: 10.1016/j.bbi.2020.03.031. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.Moriguchi T., Harii N., Goto J., Harada D., Sugawara H., Takamino J. A first case of meningitis/encephalitis associated with SARS-Coronavirus-2. Int J Infect Dis. 2020;94:55–58. doi: 10.1016/j.ijid.2020.03.062. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.Poyiadji N., Shahin G., Noujaim D., Stone M., Patel S., Griffith B. COVID-19–associated acute hemorrhagic necrotizing encephalopathy: CT and MRI Features. Radiology. 2020:2. doi: 10.1148/radiol.2020201187. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.Wagner S.J., Acquah L.A., Lindell E.P., Craici I.M., Wingo M.T., Rose C.H. Posterior reversible encephalopathy syndrome and eclampsia: Pressing the case for more aggressive blood pressure control. Mayo Clin Proc. 2011;86:851–856. doi: 10.4065/mcp.2011.0090. [DOI] [PMC free article] [PubMed] [Google Scholar]