Abstract
Pertussis wird durch das gramnegative Bakterium Bordetella pertussis verursacht. Die Krankheitsmanifestationen reichen von unspezifischem Husten bis zu lebensbedrohlichen Verläufen mit Hyperleukozytose und respiratorischer Insuffizienz, v.a. bei jungen Säuglingen. Die Diagnose basiert auf klinischer Symptomatik und mikrobiologischen Nachweisverfahren. Die Therapie besteht aus Makrolidantibiotika; bei Apnoen kann Koffein versucht werden. Die Inzidenz beträgt 10–40 Fälle/100.000 Bevölkerung und Jahr, bei Säuglingen ist sie am höchsten (ca. 50), gefolgt von Jugendlichen (30–35). Mehr als 50 % der in den ersten 5 Lebensmonaten an Pertussis erkrankten Kinder werden hospitalisiert. Die Impfprävention umfasst Grundimmunisierung und regelmäßige Auffrischimpfungen mit azellulären Impfstoffen. Um schwere Verläufe bei jungen Säuglingen zu verhindern, ist die Impfung schwangerer Frauen am erfolgversprechendsten. Säuglinge geimpfter Mütter sollen zeitgerecht ab dem Alter von 2 Monaten für den Eigenschutz immunisiert werden.
Schlüsselwörter: Bordetella pertussis, Übertragung, Polymerase-Kettenreaktion, Antibiotika, Impfprävention
Abstract
Pertussis is caused by the gram-negative bacterium Bordetella pertussis. The disease manifestations range from unspecific coughing to life-threatening courses with hyperleukocytosis and respiratory failure, especially in young infants. The diagnosis is based on clinical symptoms and microbiological detection methods. The treatment consists of macrolide antibiotics and caffeine can be used against apnea. The incidence is 10–40 cases/100,000 inhabitants per year and highest in infants (approximately 50), followed by adolescents (30–35). In the first 5 months of life more than 50% of all children with pertussis are hospitalized. Vaccination prevention consists of basic immunization and regular booster doses with acellular component vaccines. Vaccination of pregnant women is the most promising strategy to prevent severe pertussis in young infants. Infants of vaccinated mothers should still be immunized in a timely manner for their own protection from the age of 2 months onwards.
Keywords: Bordetella pertussis, Transmission, Polymerase chain reaction, Antibiotics, Immunization
Lernziele
Nach Lektüre dieses Beitrags
können Sie die Bedeutung der Pertussis im Kindesalter gut beurteilen.
ziehen Sie Schlüsse aus der gegenwärtigen epidemiologischen Situation.
identifizieren Sie zuverlässig Patienten mit Pertussis und kennen die richtige Behandlung der Krankheit.
wenden Sie die verfügbaren Prophylaxemaßnahmen, insbesondere Impfungen, richtig an und tragen dazu bei, dass möglichst wenige Säuglinge an Pertussis sterben.
Einleitung
Pertussis ist trotz verfügbarer Impfstoffe eine häufige Infektionskrankheit
häufige Infektionskrankheit
. Dies hat verschiedene Gründe: suboptimale Wirksamkeit der Impfstoffe, zu späte und unvollständige Durchführung der empfohlenen Impfungen sowie kontinuierlich nachlassender Impfschutz [1]. Ohne vollständige Kenntnis der Epidemiologie, konsequente Diagnostik, Meldung aller Krankheitsfälle und Umsetzung der bestehenden Impfempfehlungen wird diese Krankheit weiterhin einen hohen Tribut fordern. Jeder Pädiater sollte deshalb die Merkmale der Krankheit und ihre Präventionsmöglichkeiten kennen.
Kurzkasuistik
Lea erkrankt im Alter von 4 Wochen plötzlich an einer Rhinitis und rezidivierenden Apnoen. Dabei wird sie zyanotisch und wirkt wie abwesend. Kurz vor der Geburt war Leas Mutter (28 Jahre alt, letzte Pertussisimpfung im Alter von 14 Jahren) zu Besuch bei einer Freundin, die seit 2 Wochen an einem anfallsartigen Husten litt. Zehn Tage nach der Geburt erkrankte sie dann selbst an einem hartnäckigen Husten, der immer noch besteht. Sie ist sehr besorgt und bringt Lea zu ihrer Kinderärztin. Diese untersucht das Kind, findet außer der Rhinitis keine besonderen Krankheitszeichen. Aufgrund der Anamnese äußert sie den Verdacht auf Pertussis, entnimmt Nasopharyngealsekret für eine Polymerase-Kettenreaktion (PCR) und weist Lea in die nächste Kinderklinik ein. Lea wird kontinuierlich pulsoxymetrisch überwacht und erhält eine antibiotische Therapie mit Azithromycin. Sie hat etwa alle 20–30 min stimulationsbedürftige Apnoen mit Bradykardie und Abfall der Sauerstoffsättigung. Im Blutbild besteht eine Leukozytose von 52.000/µl mit 82 % Lymphozyten. Am nächsten Tag übermittelt das Labor das Ergebnis der PCR: B. pertussis im Sekret nachgewiesen.
Erreger
Pertussis wird durch das gramnegative Bakterium Bordetella pertussis
Bordetella pertussis
hervorgerufen. Ein geringer, regional und im zeitlichen Verlauf variabler Anteil keuchhustenähnlicher Krankheitsbilder wird durch B.-parapertussis- oder B.-holmesii-Bakterien verursacht [1]. Wichtigster Virulenzfaktor von B. pertussis ist das Pertussistoxin
Pertussistoxin
(PT). Es inhibiert G‑Proteine, wodurch auch die charakteristische Leukozytose (durch Lymphozytose) bedingt ist [2].
Krankheitszeichen
Manifestation und Verlauf
Nach einer Inkubationszeit von 7 bis 10 Tagen manifestiert sich die Krankheit sehr variabel: von leichtem, unspezifischen Husten über wochenlang anhaltende, intermittierende Hustenattacken
intermittierende Hustenattacken
(„Keuchhusten“) bis hin zu lebensbedrohlichen Verläufen mit Hyperleukozytose und respiratorischer Insuffizienz. Letale Verläufe werden fast ausschließlich im jungen Säuglingsalter beobachtet [1, 3].
Besonderheiten im Säuglingsalter
Junge Säuglinge ohne von der Mutter passiv erworbene Immunität gegen B. pertussis erkranken bei Exposition besonders schwer. Statt intermittierenden Hustenattacken können rezidivierende Apnoen
rezidivierende Apnoen
mit Bradykardien im Vordergrund stehen, die eine stationäre Überwachung und ggf. intensivmedizinische Betreuung erforderlich machen [4]. Gleiches gilt für den Fall einer leukämoiden Lymphozytose
leukämoiden Lymphozytose
im peripheren Blutbild, die durch den Effekt des PT hervorgerufen wird. Dieses Toxin wird nur durch B. pertussis exprimiert. Die Werte können 30.000 Zellen/µl und mehr erreichen. Gefürchtete Folgen der Lymphozytose sind die Bildung von Lymphozytenaggregaten im Lungenkapillargebiet und eine konsekutiv auftretende respiratorische Globalinsuffizienz
respiratorische Globalinsuffizienz
, die tödlich verlaufen kann [5].
Bei Pertussis durch Infektion mit B. pertussis (sic!) im Säuglingsalter ist ein Differenzialblutbild zur Früherkennung einer bedrohlichen Lymphozytose unverzichtbar [6]. Säuglinge, die bereits eine oder mehrere Impfdosen erhalten haben, bilden dank den vorhandenen Anti-PT-Antikörpern kaum noch eine Lymphozytose aus.
Cave
Bei Pertussis durch B.-pertussis-Infektion im Säuglingsalter ist ein Differenzialblutbild zur Früherkennung einer bedrohlichen Lymphozytose unverzichtbar.
Diagnose
Die Diagnose einer Pertussis stützt sich auf die klinische Symptomatik
klinische Symptomatik
, ergänzt durch mikrobiologische Nachweisverfahren wie PCR und/oder serologische Bestimmungen (Tab. 1; [7]). Das sensitivste Nachweisverfahren in den ersten 2 bis 3 Krankheitswochen ist der Nachweis des Erregers mithilfe der Polymerase-Kettenreaktion
Polymerase-Kettenreaktion
(PCR) im Nasopharyngealsekret. Fehlen die typischen Krankheitszeichen (Hustenattacken, anschließendes Erbrechen und inspiratorisches Juchzen), wird die Diagnose häufig übersehen [4].
| Hustendauer (Wochen) | Säuglinge | Ab dem Alter von 6 (bis 12) Monaten |
|---|---|---|
| <2 | PCR aus Nasopharyngealsekret | PCR aus Nasopharyngealsekret |
| 2–3 |
PCR aus Nasopharyngealsekret oder Spezifische Pertussistoxin-IgG-Antikörper im Serum |
|
| ≥3 Wochen | Spezifische Pertussistoxin-IgG-Antikörper im Serum |
PCR Polymerase-Kettenreaktion
Merke
Bordetella pertussis siedelt sich auf dem zilientragenden Epithel des Nasopharynx, nicht aber im vorderen Nasenabschnitt an.
Das Sekret für den Nachweis von B. pertussis muss tief aus dem Nasopharynx gewonnen werden (Absaugen oder Abstrich).
Ab der 3. Krankheitswoche ist die serologische Untersuchung
serologische Untersuchung
diagnostisch erfolgversprechend. Dabei wird in einer Serumprobe der Anti-PT-IgG-Wert bestimmt. Voraussetzung für eine gute Aussagekraft ist, dass der Patient mindestens 6 (bis 12) Monate alt ist, somit keine interferierenden maternalen Antikörper mehr im Blut hat und dass in den letzten 12 Monaten keine Pertussisimpfung stattgefunden hat (die ebenfalls zu erhöhten Antikörpertitern führen kann). Sind diese Voraussetzungen erfüllt, gelten Werte von mindestens 50 EU/ml als starker Hinweis auf eine kürzlich stattgefundene B.-pertussis-Infektion [7].
Cave
In folgenden Fällen ist keine zuverlässige serologische Diagnose einer Pertussis möglich:
bei Säuglingen im Alter unter 6 Monaten (beachte: passiv übertragene maternale PT-IgG-Antikörper) sowie
bei Patienten mit einer Pertussisimpfung in den letzten 12 Monaten (beachte: Induktion von eigenen PT-IgG-Antikörpern).
Kurzkasuistik
Die Kinderärztin hat richtig gehandelt und bei V. a. Pertussis Nasopharyngealsekret für eine pertussisspezifische PCR von Lea entnommen. Eine serologische Antikörperbestimmung wäre nicht hilfreich gewesen, da diese allenfalls transplazentar übertragene mütterliche IgG-Antikörper nachgewiesen hätte.
Therapie
Verschiedene Antibiotika, insbesondere Makrolide
Makrolide
, sind gegen B. pertussis wirksam. Empfohlene Substanzen, Altersgruppen und Dosierungen sind in Tab. 2 zusammengefasst [8]. Der Effekt einer Antibiotikabehandlung auf den Krankheitsverlauf ist gering, es sei denn, dass die Behandlung in der katarrhalischen Frühphase der Krankheit einsetzt, was in der Praxis selten gelingt. Jedoch beendet die Antibiotikagabe zuverlässig die Kontagiosität
Kontagiosität
des Patienten. Im Säuglingsalter kann zwar B. pertussis über die antibiotische Behandlungsdauer hinaus mithilfe der PCR im Nasopharynx nachgewiesen werden, die Übertragung des Erregers scheint aber dennoch effizient verhindert zu werden [9].
| Antibiotikum | Patientenalter | Tagesdosis | Therapiedauer (Tage) |
|
|---|---|---|---|---|
| Empfohlen | Maximal | |||
| Azithromycin | Ab Geburt | 10 mg/kgKG (in einer Dosis) | 500 mg | 5 |
| Clarithromycin | Ab einem Monat | 15 mg/kgKG (in 2 Dosen) | 1 g | 7 |
| Erythromycinestolat | Ab einem Monat | 40 mg/kgKG (in 2 Dosen) | 2 g | 14 |
| Trimethoprim(TMP)-Sulfamethoxazol | Ab 2 Monaten | 8 mg (TMP)/kgKG (in 2 Dosen) | 320 mg | 14 |
Supportive Behandlungsmaßnahmen umfassen häufige kleinere Mahlzeiten und das Vermeiden von Hustenanfälle auslösenden Trigger-Faktoren, wie z. B. Racheninspektionen. Der Nutzen von Antitussiva, Sedativa, Mukolytika, β‑sympathikomimetischen Substanzen, Kortikosteroiden und Antihistaminika ist fraglich und nicht durch kontrollierte Studien belegt [1]. Bei wiederholten Apnoen kann jedoch ein Therapieversuch mit Koffein
Koffein
erfolgen. Bei einem im Alter von 4 Monaten an Pertussis erkrankten ehemaligen Frühgeborenen der 27. Schwangerschaftswoche kam es nach einer Dosis Koffein (20 mg/kgKG i.v.) binnen 1 h zu keinen weiteren die Apnoen mehr [10]. Die Autoren vermuten, dass das Koffein ähnlich wie bei unreifen Frühgeborenen den Atemantrieb stimulierte und weitere Apnoen dadurch verhindert wurden. Zudem könnte Koffein einen positiven Einfluss auf den durch Leukozytenaggregate in den Pulmonalgefäßen hervorgerufenen pulmonalen Hypertonus haben.
Merke
Die antibiotische Behandlung einer nachgewiesenen Pertussis zielt in erster Linie auf die Beendigung der Kontagiosität des Patienten.
Der antibiotische Effekt auf den Krankheitsverlauf ist gering.
Lebensbedrohliche Blutbildveränderungen erfordern die Durchführung von Austauschtransfusionen
Austauschtransfusionen
[11]. Bei respiratorischer Insuffizienz kann eine extrakorporale Membranoxygenierung
extrakorporale Membranoxygenierung
(ECMO) lebensrettend sein [12].
Kurzkasuistik
Auch am 2. Hospitalisierungstag zeigt Lea weiterhin mehrmals pro Stunde Apnoen mit Zyanose. In der wiederholten Untersuchung des Blutbilds hat die Leukozytenzahl auf 76.000/µl mit 87 % Lymphozyten zugenommen. Lea wird daraufhin intubiert, beatmet und erhält eine Austauschtransfusion. Anschließend beträgt der Leukozytenwert 27.000/µl mit 91 % Lymphozyten, und die Frequenz der Apnoen nimmt ab. Nach 2 Tagen kann sie extubiert werden und verbleibt noch 12 weitere Tage unter dem Monitoring von Atmung und Herzfrequenz in der Klinik. Nachdem sie dann für 28 h keine Apnoen mehr aufweist, wird sie nach 16 Tagen Aufenthalt entlassen.
Epidemiologie
Bordetella pertussis ist ein ausschließlich humanpathogenes Bakterium und wird durch Tröpfchen
Tröpfchen
von Mensch zu Mensch übertragen. Die Inkubationszeit beträgt 7 bis 10 Tage (Variationsbreite: 5 bis 21 Tage). Junge Säuglinge erkranken an Pertussis, nachdem sie durch Personen aus ihrem engen Umfeld, meistens der eigenen Familie, infiziert wurden. In etwa der Hälfte der Fälle bleibt die Ansteckungsquelle unklar, was gezielte Prophylaxemaßnahmen erschwert [13].
Kurzkasuistik
Die Infektionskette, die zur lebensbedrohlichen Pertussis bei Lea führte, ist klassisch: Ihre hochschwangere Mutter steckte sich kurz vor der Geburt mit hoher Wahrscheinlichkeit bei einer Freundin an. Diese litt an einem anfallsartigen Husten, typisch für Pertussis, aber offenbar nicht als solche erkannt. Auch als Leas Mutter selbst Husten entwickelt, fühlt sie sich nicht sehr krank, sodass kein Arztbesuch stattfindet. Erst die Kinderärztin stellt die richtigen Fragen an die Mutter, äußert die korrekte Verdachtsdiagnose und deckt die Infektionskette auf.
Pertussis betrifft Personen jeden Lebensalters, aber mit unterschiedlicher Häufigkeit und longitudinalen Veränderungen. Seit März 2013 [14] ist „Keuchhusten“ in Deutschland meldepflichtig. Die Meldedaten sind über die SurvStat-Datenbank
SurvStat-Datenbank
des Robert Koch-Instituts (RKI) frei zugänglich und werden nach verschiedenen Falldefinitionen stratifiziert [15]. In den Publikationen des RKI werden die klinisch-labordiagnostisch oder klinisch-epidemiologisch bestätigten Fälle mitgeteilt.
Die aktuellen Auswertungen können, wie folgt, zusammengefasst werden.
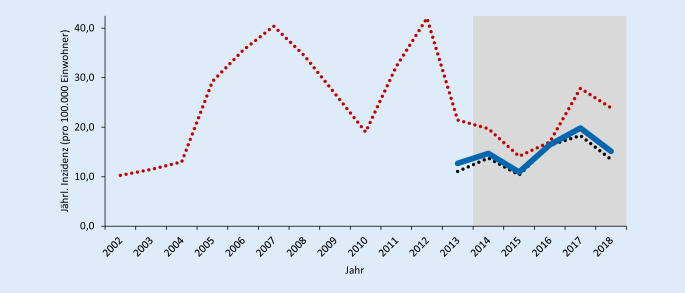
Jährliche Inzidenz.
Die jährliche Inzidenz der an das RKI übermittelten Fälle variierte in den Jahren 2002–2018 unregelmäßig zwischen 10 und 40 Fällen/100.000 Einwohner. In Abb. 1 ist dies grafisch dargestellt. Vor Einführung einer bundesweiten Meldepflicht für Pertussis 2013 wurden nur Fälle aus den 5 östlichen Bundesländern Brandenburg, Mecklenburg-Vorpommern, Sachsen, Sachsen-Anhalt und Thüringen übermittelt (Abb. 1rote gepunktete Linie). Zur besseren Vergleichbarkeit mit der Periode vor der Einführung einer bundesweiten Meldepflicht sind ab 2013 die jährlichen Inzidenzen sowohl für alle 16 Bundesländer zusammen (Abb. 1blaue Linie) als auch unterteilt nach den 5 östlichen Bundesländern und den anderen 11 Bundesländern (Abb. 1schwarze gepunktete Linie) abgebildet. Zusätzliche Auswertungen wurden auf die bundesweiten Surveillance-Daten der letzten 5 Jahre beschränkt (2014–2018; Abb. 1grauer Bereich). Es zeigt sich, dass die Inzidenz derzeit in den westlichen Bundesländern niedriger ist als in den östlichen. Vermutlich liegt dies eher am Meldeverhalten, als dass es sich um einen echten Unterschied handelt.
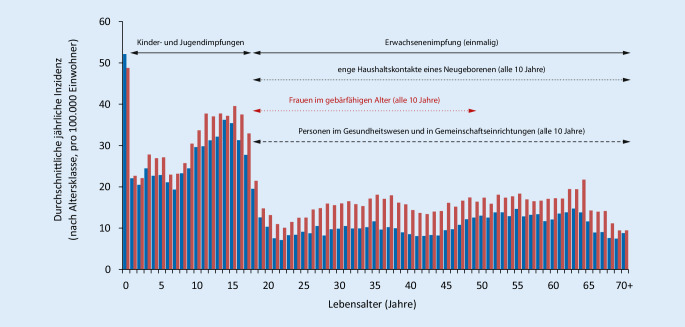
Altersabhängige jährliche Inzidenz.
Im Zeitraum 2014–2018 hatten Säuglinge die höchste altersabhängige jährliche Inzidenz der Pertussis
höchste altersabhängige jährliche Inzidenz der Pertussis
in Deutschland (ca. 50/100.000), gefolgt von Jugendlichen im Alter von 10 bis 18 Jahren (30–35/100.000), Kindern im Alter von einem bis 9 Jahren (20–25/100.000) und Erwachsenen jeden Alters (10–20/100.000). In jeder Altersstufe, ausgenommen Säuglinge, ist die Inzidenz beim weiblichen Geschlecht höher als beim männlichen. In Abb. 2 sind neben der durchschnittlichen jährlichen Pertussisinzidenz (Fallzahlen nach Infektionsschutzgesetz, IfSG), differenziert nach Lebensalter und Geschlecht (blaue Balken männlich; rote Balken weiblich) im Zeitraum 2014–2018 zudem die derzeit gültigen STIKO-Impfempfehlungen für Pertussis ersichtlich (durchgehender Pfeil Standardimpfungen; gepunkteter Pfeil Indikationsimpfungen; gestrichelter Pfeil berufliche Indikationsimpfung; RKI 2019).
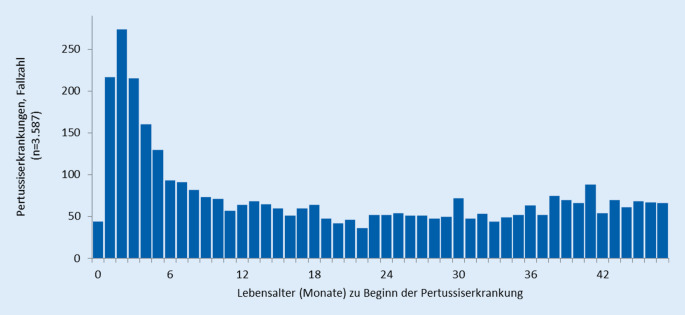
Fallzahlen in den ersten 4 Lebensjahren.
Bei genauer Betrachtung der Fallzahlen in den ersten 4 Lebensjahren ist der Gipfel im Alter von 2 bis 6 Monaten (Abb. 3) zu erkennen. Dies ist das Alter, in dem Säuglinge noch einen gewissen Nestschutz gegen viele andere Infektionskrankheiten aufweisen, von dem sie bis zum Erwerb des eigenen Schutzes durch Impfungen im Alter von 2 bis 4 Monaten profitieren. Diesen Krankheitsgipfel zu reduzieren, ist das Ziel der Pertussisimpfung bei Schwangeren (s. Abschn. „Impfprophylaxe“).
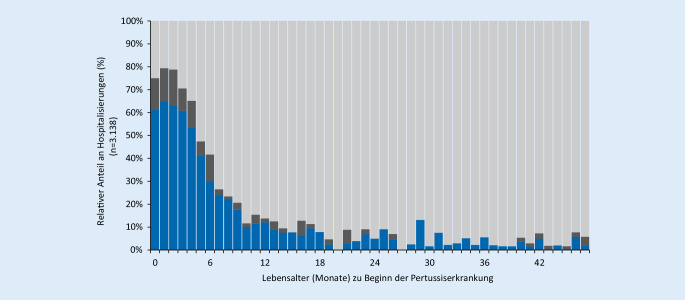
Hospitalisierung.
Mehr als 50 % der in den ersten 5 Lebensmonaten an Pertussis erkrankten Kinder werden hospitalisiert. Im übrigen Säuglingsalter geht der Anteil der Hospitalisierungen kontinuierlich auf etwa 10 % zurück und verbleibt bis zum Alter von 4 Jahren auf diesem niedrigen Niveau oder darunter (Abb. 4, Angaben zu Erkrankungsbeginn, Geburtsdatum und Krankenhausbehandlung wurden von 3138 Betroffenen im Alter <4 Jahre im Meldezeitraum 2014–2018 übermittelt; blau Hospitalisierung wegen einer Pertussis; dunkelgrau Hospitalisierungsgrund unbekannt oder Angabe eines anderen Hospitalisierungsgrundes bei gleichzeitig bestehender Pertussis; hellgrau nicht hospitalisiert)
Merke
Pertussis ist keine „Kinderkrankheit“, sondern betrifft Menschen jedes Alters.
Am häufigsten und schwerwiegendsten verläuft die Pertussis im jungen Säuglingsalter.
Meldepflicht, Isolationsmaßnahmen und Wiederzulassung in Gemeinschaftseinrichtungen
Für den Verdacht, die Erkrankung und den Tod an Keuchhusten besteht die ärztliche Meldepflicht
ärztliche Meldepflicht
gemäß §6 IfSG. Gemäß §7 IfSG besteht eine Labormeldepflicht
Labormeldepflicht
für den direkten oder indirekten Nachweis von B. pertussis und B. parapertussis [14].
Personen mit Pertussis sollen für 5 Tage nach Beginn der Antibiotikatherapie isoliert werden. Die Wiederzulassung in Gemeinschaftseinrichtungen
Wiederzulassung in Gemeinschaftseinrichtungen
nach Pertussis regelt §34 Abs. 1 IfSG, wie folgt:
Für Erkrankte ist sie 5 Tage nach Beginn einer wirksamen Antibiotikatherapie (bei Gabe von Azithromycin nach 3 Tagen) oder 21 Tage nach Beginn des Hustens, wenn keine antibiotische Behandlung durchgeführt wurde, möglich.
Für Krankheitsverdächtige ist die Wiederzulassung nach Vorliegen eines negativen Befunds mithilfe des Nukleinsäurenachweises (z. B. PCR) aus Nasopharyngealsekret möglich. Es sei denn, dass der behandelnde Arzt aufgrund der Gesamtbewertung aller vorliegenden klinischen und labordiagnostischen Befunde zu der Einschätzung kommt, der Patient könnte dennoch infektiös sein (falsch-negativer Befund). Im Übrigen gelten sinngemäß die Kriterien für die Erkrankten.
Als krankheitsverdächtig gelten gemäß IfSG Personen mit typischen Zeichen oder Symptomen einer Pertussis, sofern sie engen Kontakt zu einer Person mit bestätigter Pertussis während der Dauer der Ansteckungsfähigkeit hatten.
Prävention
Pertussis kann durch postexpositionelle Antibiotikagabe und präexpositionelle Impfungen wirksam verhindert werden, wohingegen die Expositionsprophylaxe mangels spezifischer Frühsymptome infektiöser Kontaktpersonen insuffizient ist.
Antibiotikaprophylaxe
Insbesondere Makrolidantibiotika sind gegen B. pertussis wirksam und werden zur Prophylaxe in gleicher Dosierung und Dauer wie bei der Therapie eingesetzt (Tab. 2).
Die Postexpositionsprophylaxe
Postexpositionsprophylaxe
mit einem Antibiotikum („Chemoprophylaxe“) wird von der STIKO [16] empfohlen für:
„ungeimpfte Personen mit engen Kontakten zu einer erkrankten Person in Familie, Wohngemeinschaft oder einer Gemeinschaftseinrichtung“ sowie
„geimpfte Personen mit engen Kontakten zu einer erkrankten Person, wenn sich in ihrer Umgebung gefährdete Personen (wie z. B. ungeimpfte oder nicht vollständig geimpfte Säuglinge, Kinder mit kardialen oder pulmonalen Grundleiden oder Schwangere im letzten Trimester) befinden“.
Impfprophylaxe
In den meisten Ländern Europas sind ausschließlich sog. azelluläre Pertussisimpfstoffe
azelluläre Pertussisimpfstoffe
zugelassen, die ein bis 5 B.-pertussis-spezifische inaktivierte Antigene enthalten – alle zumindest das Pertussistoxoid. Sie gelten als vergleichbar effizient [1] und sind nur in Kombination mit Diphtherie- und Tetanustoxoid (und ggf. weiteren Komponenten wie inaktivierten Polioviren, Haemophilus-influenzae-Typ-b-Polysacchariden und „hepatitis B surface antigen“) verfügbar (Tab. 3). Pertussiseinzelimpfstoffe sind nicht erhältlich, wären aber z. B. für die Impfung von schwangeren Frauen wünschenswert [17].
| Impfstoff (Handelsname, Komponenten) |
Hersteller bzw. Vertrieb | Pertussistoxoid | Filamentöses Hämagglutinin | Pertaktin | Fimbrienagglutinogene 2 und 3 | Alterszulassung | Impfalter gemäß STIKO-Empfehlung | Kommentare |
|---|---|---|---|---|---|---|---|---|
| Infanrix hexa (DTaP-HepB-IPV+Hib) | GSK | 25 µg | 25 µg | 8 µg | – | Säuglinge bis einschließlich Kleinkindaltera | 2-3‑4 und 11–14 Monate | „Kleinkindalter“ ist nicht verbindlich definiert |
| Infanrix-IPV+Hib (DTaP-IPV+Hib) | 25 µg | 25 µg | 8 µg | – | ab 2 Monate | 2-3‑4 und 11–14 Monate | ||
| Infanrix (DTaP) | 25 µg | 25 µg | 8 µg | – | 2–72 Monate | 2-3‑4 und 11–14 Monate | ||
| Hexyon (DTaP-HepB-IPV+Hib) | Sanofi Pasteur | 25 µg | 25 µg | – | – | 6 Wochen–72 Monate | 2-3‑4 und 11–14 Monate | – |
| Pentavac (DTaP-IPV+Hib) | 25 µg | 25 µg | – | – | 2–24 Monate | 2-3‑4 und 11–14 Monate | – | |
| Vaxelis (DTaPHepB-IPV+Hib) | MSD | 20 µg | 20 µg | 3 µg | 5 µg | 6 Wochen – einschließlich Kleinkindaltera | 2-3‑4 und 11–14 Monate | „Kleinkindalter“ ist nicht verbindlich definiert |
| Boostrix (Tdap) | GSK | 8 µg | 8 µg | 2,5 µg | – | ≥48 Monate | 5–6 Jahre, 9–17 Jahre, Erwachsene | Ab 40 Jahre zulassungskonform für Erstimmunisierung |
| Boostrix-Polio (Tdap-IPV) | 8 µg | 8 µg | 2,5 µg | – | ≥36 Monate | dito | dito | |
| Covaxis (TdaP) | Sanofi Pasteur | 2,5 µg | 5 µg | 3 µg | 5 µg | ≥48 Monate | 5–6 Jahre, 9–17 Jahre, Erwachsene | Ab 12 Jahre zulassungskonform für Erstimmunisierung |
| Repevax (TdaP-IPV) | 2,5 µg | 5 µg | 3 µg | 5 µg | ≥36 Monate | dito | dito | |
| Tdap-IMMUN (Tdap) | Pfizer | 25 µg | – | – | – | ≥48 Monate | 5–6 Jahre, 9–17 Jahre, Erwachsene | Ab 12 Jahre zulassungskonform für Erstimmunisierung |
STIKO Ständige Impfkommission am Robert Koch-Institut
aZur jeweils aktuellen Verfügbarkeit siehe www.pei.de → Arzneimittel → Impfstoffe → Lieferengpässe → Listen
Kurzkasuistik
Im Entlassungsbrief von Lea werden keine Angaben zu den anstehenden Impfungen gemacht. Was tun? In Rücksprache mit einem Impfexperten erhält die Kinderärztin folgende Auskunft: Lea soll zeitgerecht im Alter von 2 Monaten die 1. Dosis DTaP-HepB-IPV+Hib erhalten.
Kinder, die an Pertussis erkrankten, entwickeln keine dauerhafte Immunität
keine dauerhafte Immunität
und sollten deshalb trotzdem gegen Pertussis geimpft werden. Zudem sind keine Impfstoffe ohne Pertussisantigene für die ab dem Alter von 2 Monaten empfohlene Impfprophylaxe verfügbar. Auch lässt die Anwendung der Pertussisimpfung in Gegenwart vorbestehender spezifischer Antikörper keine vermehrten Nebenwirkungen erwarten, sodass die komplette reguläre Impfserie bei zuvor an Pertussis erkrankten Kindern die einzig sinnvolle Maßnahme darstellt.
Cave
Säuglinge, die an Pertussis erkrankt waren, sollen dennoch pünktlich zu allen von der STIKO empfohlenen Zeitpunkten mit einem üblichen hexavalenten Impfstoff geimpft werden.
Nachdem in den 1950er-Jahren die ersten Pertussisimpfstoffe auf der Basis komplett abgetöteter B.-pertussis-Bakterien, „Ganzkeimimpfstoffe“
„Ganzkeimimpfstoffe“
, eingeführt wurden, kam es zum Rückgang der Krankheitslast. Diskussionen um angeblich durch die Pertussisimpfung verursachte Hirnschäden bei Säuglingen („Enzephalopathie“) führten in den 1970er-Jahren zum Aussetzen der Impfempfehlung in vielen Ländern, so auch in Deutschland. Im Nachhinein bestätigte sich, was viele Experten von Beginn an vermuteten: Die Behauptungen waren auf Koinzidenz und nicht auf Kausalität zurückzuführen [18]. Daraufhin wurde die Impfung in Deutschland rehabilitiert [19] und wird seit 1991 wieder empfohlen. Nichtsdestoweniger hatten die Diskussionen die Entwicklung der mutmaßlich sichereren, definitiv aber besser verträglichen oben genannten azellulären Vakzinen induziert und nach ausgedehnten klinischen Studien zu deren Zulassung geführt [1]. Seitdem haben die Pertussisimpfempfehlungen in Deutschland eine stetige Veränderung mit sukzessiver Erweiterung der Zielgruppen für den Impfschutz erfahren (Tab. 4). Der Hypothese, dass der in vielen Ländern beobachtete Wiederanstieg („reemergence“) von Pertussis auf den Wechsel von Ganzkeim- zu den weniger effizienten azellulären Impfstoffen zurückzuführen sei [20], kann nicht zugestimmt werden [21, 22].
| 1991 | Wiedereinführung als Standardimpfung mit 4 Impfdosen in den ersten beiden Lebensjahren (und Nachholimpfung für unzureichend geimpfte ältere Kinder) |
| Ab 1995 | Zulassung und Einführung der ersten azellulären Pertussisimpfstoffe in Deutschland (monovalent, aP, und in Kombination mit Diphtherie- und Tetanustoxoid, DTaP) |
| 1998 | Wechsel von Pertussisganzkeim- hin zu azellulären Kombinationsimpfstoffen für alle 4 Dosen (1–3 im 1. Lebensjahr, 4 mit 11 bis 14 Monaten) |
| 2000 | Einführung einer 5. Dosis für Jugendliche im Alter von 9 bis 17 Jahren |
| 2001 | Erstmals Einführung einer Indikationsimpfempfehlung für Erwachsene: Personal in Pädiatrie und Infektionsmedizin sowie in Gemeinschaftseinrichtungen für das Vorschulalter und Kinderheimen |
| 2003 | Modifikation der Indikationsimpfempfehlung für Erwachsene: Personal in Einrichtungen der Pädiatrie, der Schwangerenbetreuung und der Geburtshilfe sowie in Gemeinschaftseinrichtungen für das Vorschulalter und Kinderheimen |
| 2004 | Einführung der „Cocoon“-Strategie durch Modifikation der Indikationsimpfempfehlung für Erwachsene durch eine Erweiterung auf Frauen mit Kinderwunsch präkonzeptionell sowie bei anstehender Geburt für enge Haushaltskontaktpersonen (Eltern, Geschwister) und Betreuer (z. B. Tagesmütter, Babysitter, ggf. Großeltern), spätestens 4 Wochen vor Geburt des Kindes, sofern kein adäquater Immunschutz vorliegt |
| Definition des adäquaten Immunschutzes: Impfung oder mikrobiologisch bestätigte Erkrankung innerhalb der vergangenen 10 Jahre | |
| 2006 | Einführung einer weiteren Standardimpfdosis für Kinder im Alter von 5 bis 6 Jahren (chronologisch die 5. Dosis, Beibehalten der Auffrischimpfung bei Jugendlichen als chronologisch 6. Standardimpfdosis). Indikationsimpfung für Erwachsene: da kein monovalenter Pertussisimpfstoff mehr verfügbar ist, wurde der Hinweis aufgenommen, Tdap(-IPV) möglichst nicht früher als 5 Jahre nach der vorhergehenden Dosis der anderen im Impfstoff enthaltenen Antigene (Td) zu verabreichen |
| Weitere ergänzende Hinweise: | |
| Im Zusammenhang mit erkannten Pertussishäufungen kann auch bei vollständig geimpften Kindern und Jugendlichen mit engem Kontakt zu Erkrankten im Haushalt oder in Gemeinschaftseinrichtungen eine Impfung erwogen werden, wenn die letzte Impfung länger als 5 Jahre zurückliegt | |
| Jede Auffrischimpfung mit Td (auch im Verletzungsfall) sollte Anlass sein, eine mögliche Indikation einer Pertussisimpfung zu überprüfen und ggf. einen Kombinationsimpfstoff (Tdap) einzusetzen | |
| 2009 | Einführung einer Pertussisstandardimpfung für alle Erwachsenen zum Zeitpunkt der nächsten fälligen Td-Impfung (einmalig als Tdap-, bei entsprechender Indikation als Tdap-IPV-Kombinationsimpfung) |
| Modifikation der Indikationsimpfempfehlung für Erwachsene bei beruflicher Indikation: Für Personal in Gemeinschaftseinrichtungen wurde die Einschränkung „für das Vorschulalter“ aufgehoben sowie die Indikation einer Pertussisimpfung auf „Personal im Gesundheitsdienst“ (statt bisher „Personal in Einrichtungen der Pädiatrie, der Schwangerenbetreuung und der Geburtshilfe“) geändert. Der Zusatz möglichst nicht früher als 5 Jahre nach der vorhergehenden Dosis der anderen im Impfstoff enthaltenen Antigene (Td) wurde gestrichen und die Definition des adäquaten Impfschutzes (s. 2004) durch folgenden Hinweis ersetzt: sofern in den letzten 10 Jahren keine Pertussisimpfung stattgefunden hat | |
| 2010 | Modifikation der Terminologie der Indikationsimpfempfehlung für Erwachsene (Frauen im gebärfähigen Alter statt Frauen mit Kinderwunsch) |
| 2019 | Überprüfung der Impfempfehlung für eine einmalige Pertussisimpfung im Erwachsenenalter: Die bestehende Standardimpfempfehlung eines einmaligen Boosters für Erwachsene soll zunächst beibehalten werden. Für Risikogruppen – a) Frauen im gebärfähigen Alter, b) enge Haushaltskontaktpersonen und Betreuende eines Neugeborenen und c) Personen, die im Gesundheitsdienst oder in einer Gemeinschaftseinrichtung arbeiten – bleibt es bei Auffrischimpfungen im Zehnjahresrhythmus |
| 2020 | Die Pertussisimpfung soll als Indikationsimpfung in jeder Schwangerschaft erfolgen |
Die Pertussisimpfung in der Schwangerschaft
Schwangerschaft
ist ein in vielen Ländern aktuell diskutiertes Thema [23], auch in Deutschland [24]. Sie gilt als sicher und effizient und sollte unabhängig vom mütterlichen Pertussisimpfstatus in jeder Schwangerschaft erneut erfolgen [25]. Ihr Ziel ist es – neben dem direkten Schutz der Schwangeren selbst – insbesondere das Neugeborene mit dem optimalen Repertoire an transplazentar übertragenen mütterlichen Antikörpern gegen B. pertussis auszustatten [26]. Dadurch können die bedrohlichen Krankheitsfälle bei jungen Säuglingen mit noch fehlendem oder unvollständigem eigenen Impfschutz wirkungsvoll verhindert werden. Als Folge der durch die mütterlichen Antikörper vermittelten kindlichen Leihimmunität
kindlichen Leihimmunität
könnte man vermuten, dass eine Verschiebung des 1. Impftermins vom Alter 2 auf z. B. 3 Monate sinnvoll wäre, um einen negativen Einfluss („blunting“) auf die eigene Immunitätsentwicklung beim Kind zu entgegnen [27]. Ein derartiges Vorgehen wird aktuell in den Niederlanden diskutiert [28]. Der Autor des vorliegenden Beitrags ist der Ansicht, dass dies wenig begründet ist. Zum einen kann ein negativer Effekt der zeitgerechten Impfung nicht konsistent gezeigt werden [29]. Zum anderen wird durch eine Verschiebung des Impfbeginns der Impfschutz gegen die anderen Krankheiten (wie z. B. invasive Haemophilus-influenzae-Typ-b[Hib]-Infektionen) verzögert, was ein unnötiges Risiko darstellt [30].
Fazit für die Praxis
Pertussis wird durch Bordetella pertussis verursacht, von Mensch zu Mensch übertragen und ist im jungen Säuglingsalter eine lebensbedrohliche Krankheit.
Das empfohlene diagnostische Verfahren in den ersten 2 bis 3 Wochen seit Hustenbeginn ist der Erregernachweis mithilfe der Polymerase-Kettenreaktion (PCR) aus Nasopharyngealsekret, später dann serologische Bestimmungen.
Der Effekt einer Antibiotikabehandlung (Makrolidantibiotikum) auf den Krankheitsverlauf ist gering, beendet aber zuverlässig die Kontagiosität des Patienten.
Die Inzidenz beträgt aktuell in Deutschland ca. 10–40 Fälle/100.000 Einwohner; die höchste altersabhängige Inzidenz haben Säuglinge (im Mittel ca. 50/100.000 und Jahr).
Kinder, die an Pertussis erkrankten, entwickeln keine dauerhafte Immunität und sollten deshalb trotzdem gegen Pertussis geimpft werden. Azelluläre Pertussisimpfstoffe gibt es nur in Kombination mit anderen Impfantigenen in variabler Zusammensetzung.
Die Pertussisimpfung in der Schwangerschaft ist sicher und effizient. Die transplazentar übertragenen mütterlichen Antikörper schützen den jungen Säugling vor Pertussis.
CME-Fragebogen
Ein 5 Wochen alter Säugling mit nachgewiesener Pertussis wird wegen Apnoen und Zyanoseanfällen in eine Kinderklinik eingewiesen. Welche der folgenden Untersuchungen ist essenziell?
Differenzialblutbild
Blutgasanalyse
Bestimmung des C‑reaktiven Proteins (CRP)
Ultraschall des Zentralnervensystems (ZNS)
Thoraxröntgen
Welches der folgenden Medikamente sollte bei einem Säugling mit häufig rezidivierenden Apnoen im Rahmen einer Pertussis als Therapie versucht werden?
Sedativum
Mukolytikum
β‑Sympathikomimetikum
Koffein
Kortikosteroid
Ein 5‑jähriges Kind hustet seit ca. 4 Wochen ohne Besserungstendenz. Sie vermuten eine Pertussis als Ursache. Welches Testverfahren ist am ehesten zur Diagnosesicherung geeignet?
Spezifische Pertussistoxin-IgM-Antikörper im Serum
Spezifische Pertussistoxin-IgG-Antikörper im Serum
Polymerase-Kettenreaktion (PCR) auf B. pertussis aus Nasopharyngealsekret
Polymerase-Kettenreaktion (PCR) auf B. pertussis aus Rachenabstrich
Blutbild und C‑reaktives Protein (CRP)
Welches ist das hauptsächliche Ziel der antibiotischen Therapie einer Pertussis?
Verkürzung der Dauer der Kontagiosität
Verkürzung der Hustendauer
Verhinderung einer sekundären Pneumonie
Behandlung der Leukozytose
Verhinderung von Hustenanfällen
In welcher Altersgruppe ist die altersabhängige Inzidenz der Pertussis in Deutschland am höchsten?
Jugendliche im Alter von 15 bis 17 Jahren
Schulkinder im Alter von 11 bis 14 Jahren
Schulkinder im Alter von 6 bis 10 Jahren
Säuglinge im Alter von 0 bis 5 Monaten
Säuglinge im Alter von 6 bis 11 Monaten
Für welche Situation besteht eine ärztliche Meldepflicht für Keuchhusten in Deutschland?
Verdacht, Erkrankung und Tod an Keuchhusten
Nur Erkrankung und Tod an Keuchhusten
Nur Erkrankung und Tod an Keuchhusten, sofern die Diagnose mikrobiologisch gesichert ist
Nur Tod an Keuchhusten
Nur Tod an Keuchhusten, sofern die Diagnose mikrobiologisch gesichert ist
Wie erfolgt die antibiotische Postexpositionsprophylaxe einer Pertussis bei einem 3 Wochen alten Neugeborenen?
Einmalgabe von Rifampicin
Gabe von 4 Dosen Rifampicin im 12-h-Intervall
Gabe von Azithromycin einmal täglich über 5 Tage
Gabe von Azithromycin einmal täglich über 3 Tage
Gabe von Clarithromycin 2‑mal täglich über 7 Tage
Wie viele Pertussisimpfdosen sind als Standardimpfungen nach aktuellem Stand der Empfehlungen (2019/2020) der Ständigen Impfkommission (STIKO) in Deutschland vorgesehen?
3
4
5
6
7
Wann sollte ein Kind, das aktuell im Alter von 4 Wochen an Pertussis erkrankte, gegen Pertussis geimpft werden?
Sofort
Sobald es wieder gesund und mindestens 2 Monate alt ist
Im Alter von 6 Monaten
Ab dem Alter von einem Jahr
Gar nicht, weil es natürliche Immunität erworben hat
Wann ist eine Pertussisimpfung in der Schwangerschaft sinnvoll?
Wenn die Schwangere in den letzten 10 Jahren keine Pertussisimpfung erhielt
Wenn die Schwangere in den letzten 5 Jahren keine Pertussisimpfung erhielt
Wenn die Frau das erste Mal schwanger ist
In jeder Schwangerschaft, unabhängig von Anzahl und Zeitpunkt früherer Pertussisimpfungen
Gar nicht, weil sie nur die Mutter vor Pertussis schützt, aber nicht das Neugeborene
Einhaltung ethischer Richtlinien
Interessenkonflikt
Gemäß den Richtlinien des Springer Medizin Verlags werden Autoren und Wissenschaftliche Leitung im Rahmen der Manuskripterstellung und Manuskriptfreigabe aufgefordert, eine vollständige Erklärung zu ihren finanziellen und nichtfinanziellen Interessen abzugeben.
Autoren
U. Heininger: A. Finanzielle Interessen: Vortragshonorare zu Impfthemen ohne Produktbezug von: MSD, Pfizer, Sanofi. – Beratungstätigkeiten: Central and Eastern Europe Pertussis Awareness Group (Sanofi-Pasteur), Global Pertussis Initiative seit 2001 (Sanofi-Pasteur), Beantwortung von Elternfragen zu Impfungen auf www.rundumsbaby.de (USMedia), INFOVAC – Impfberatung für Ärztinnen und Ärzte in der Schweiz mit Unterstützung des Bundesamt für Gesundheit, Bern, und zahlreicher medizinischer Fachgesellschaften. – B. Nichtfinanzielle Interessen: Universitäts-Kinderspital beider Basel, Schweiz, Chefarzt-Stellvertreter und Leitender Arzt für Infektiologie und Vakzinologie | Universität Basel, Mitglied der Medizinischen Fakultät und Vertreter Pädiatrie im Fakultätsausschuss | Mitgliedschaften: Ständige Impfkommission (STIKO) am Robert Koch-Institut (seit 2001) und folgender STIKO-Arbeitsgruppen: Respiratorische Syncytial-Viren (RSV), SARS-CoV-2, Immundefizienz; Lieferengpässe; Masern, Mumps, Röteln; Meningokokken B; Pertussis (beratend); Sechsfachimpfung 2 + 1 | Mitgliedschaften und Tätigkeiten in Komitees: Kommission für Infektionskrankheiten und Impfungen der Deutschen Akademie für Kinderheilkunde und Jugendmedizin (Kommissionssprecher); Paediatric Infectious Disease Group Switzerland (Präsident); Global Advisory Committee for Vaccine Safety, GACVS, WHO; Eidgenössische Kommission für Pandemievorbereitung und -bewältigung (EKP), Eidgenössisches Departement des Innern, Bern, Schweiz; Arbeitsgruppe COVID-19-Impfstoff, Bundesamt für Gesundheit, Bern, Schweiz | Mitgliedschaften in Editorial Boards: Pädiatrische Praxis, Hans Marseille, München; Klinische Pädiatrie, Thieme, Stuttgart; Pediatric Infectious Disease Journal, Wolters und Kluwer, USA; ARS MEDICI, Rosenfluh, Schaffhausen, Schweiz; Archives of Disease in Childhood, British Medical Association, London | Mitgliedschaften in medizinischen Fachgesellschaften: Deutsche Gesellschaft für Kinderheilkunde und Jugendmedizin (DGKJ); Süddeutsche Gesellschaft für Kinderheilkunde und Jugendmedizin (SGKJ); Berufsverband der Kinder- und Jugendärzte, Deutschland (BVKJ); Deutsche Gesellschaft für Pädiatrische Infektiologie (DGPI); Schweizerische Gesellschaft für Pädiatrie (SGP); Swiss Society for Infectious Diseases (SSI); European Society for Pediatric Infectious Diseases (ESPID); Pediatric Infectious Disease Society of America (PIDS); American Society for Microbiology (ASM); Infectious Diseases Society of America (IDSA).
Wissenschaftliche Leitung
Die vollständige Erklärung zum Interessenkonflikt der Wissenschaftlichen Leitung finden Sie am Kurs der zertifizierten Fortbildung auf www.springermedizin.de/cme.
Der Verlag
erklärt, dass für die Publikation dieser CME-Fortbildung keine Sponsorengelder an den Verlag fließen.
Für diesen Beitrag wurden von den Autoren keine Studien an Menschen oder Tieren durchgeführt. Für die aufgeführten Studien gelten die jeweils dort angegebenen ethischen Richtlinien.
Literatur
- 1.Cherry JD, Heininger U. Pertussis and other Bordetella infections (Chapter 129) In: Cherry JD, Demmler-Harrison GJ, Kaplan SL, Hotez PJ, editors. Feigin and cherry’s textbook of pediatric infectious diseases. 6. Philadelphia: WB Saunders; 2018. pp. 1159–1178. [Google Scholar]
- 2.Scanlon K, Skerry C, Carbonetti N. Role of major toxin virulence factors in pertussis infection and disease pathogenesis. Adv Exp Med Biol. 2019;1183:35–51. doi: 10.1007/5584_2019_403. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.Nieves DJ, Heininger U. Bordetella pertussis. Microbiol Spectr. 2016 doi: 10.1128/microbiolspec.EI10-0008-2015. [DOI] [PubMed] [Google Scholar]
- 4.Heininger U, Stehr K, Cherry JD. Serious pertussis overlooked in infants. Eur J Pediatr. 1992;151:342–343. doi: 10.1007/BF02113254. [DOI] [PubMed] [Google Scholar]
- 5.Paddock CD, Sanden GN, Cherry JD, et al. Pathology and pathogenesis of fatal Bordetella pertussis infection in infants. Clin Infect Dis. 2008;47:328–338. doi: 10.1086/589753. [DOI] [PubMed] [Google Scholar]
- 6.Cherry JD, Wendorf K, Bregman B, et al. An Observational Study of Severe Pertussis in 100 Infants ≤120 Days of Age. Pediatr Infect Dis J. 2018;37:202–205. doi: 10.1097/INF.0000000000001710. [DOI] [PubMed] [Google Scholar]
- 7.Guiso N, Berbers G, Fry NK, et al. What to do and what not to do in serological diagnosis of pertussis: recommendations from EU reference laboratories. Eur J Clin Microbiol Infect Dis. 2011;30:307–312. doi: 10.1007/s10096-010-1104-y. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.Liese JG, Heininger U, Hellenbrand W, Wirsing von König CH. Pertussis. In: Berner R, Bialek R, Forster J, Härtel C, Heininger U, Huppertz HI, Liese JG, Nadal D, Simon A, editors. Deutsche Gesellschaft für Pädiatrische Infektiologie: DGPI Handbuch Infektionen bei Kindern und Jugendlichen. 7. Stuttgart: Thieme; 2018. pp. 669–675. [Google Scholar]
- 9.Dierig A, Beckmann C, Heininger U. Antibiotic treatment of pertussis: are 7 days really sufficient? Pediatr Infect Dis J. 2015;34:444–445. doi: 10.1097/INF.0000000000000567. [DOI] [PubMed] [Google Scholar]
- 10.Evered J, Pfeifer E, Gracianette M. Caffeine to prevent respiratory failure and improve outcome in infant pertussis. Case Rep: BMJ; 2018. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.Nieves D, Bradley JS, Gargas J, et al. Exchange blood transfusion in the management of severe pertussis in young infants. Pediatr Infect Dis J. 2013;32:698–699. doi: 10.1097/INF.0b013e31828c3bb3. [DOI] [PubMed] [Google Scholar]
- 12.Domico M, Ridout D, MacLaren G, et al. Extracorporeal membrane oxygenation for pertussis: predictors of outcome including pulmonary hypertension and leukodepletion. Pediatr Crit Care Med. 2018;19:254–261. doi: 10.1097/PCC.0000000000001454. [DOI] [PubMed] [Google Scholar]
- 13.Heininger U. Update on pertussis in children. Expert Rev Anti Infect Ther. 2010;8:163–173. doi: 10.1586/eri.09.124. [DOI] [PubMed] [Google Scholar]
- 14.Gesetz zur Verhütung und Bekämpfung von Infektionskrankheiten beim Menschen (Infektionsschutzgesetz – IfSG). http://www.gesetze-im-internet.de/bundesrecht/ifsg/gesamt.pdf Zugegriffen: 1. März 2020
- 15.https://survstat.rki.de/ Zugegriffen: 1. März 2020
- 16.Mitteilung der Ständigen Impfkommission am Robert Koch-Institut (2019) Empfehlungen der Ständigen Impfkommission (STIKO) am Robert Koch-Institut – 2019/2020. Epid Bull 34, S 313–364
- 17.Heininger U. Is there a need for a stand-alone acellular pertussis vaccine? Pediatr Infect Dis J. 2018;37:359–360. doi: 10.1097/INF.0000000000001767. [DOI] [PubMed] [Google Scholar]
- 18.Cherry JD. ‘Pertussis vaccine encephalopathy’: it is time to recognize it as the myth that it is. JAMA. 1990;263:1679–1680. doi: 10.1001/jama.1990.03440120101046. [DOI] [PubMed] [Google Scholar]
- 19.Stehr K, Heininger U, Beer E, Wenzel D. Rehabilitation der Pertussisimpfung. Postvakzinale Dauerschäden: ein Mythos. Pädiatr. Prax. 1994;47:175–183. [Google Scholar]
- 20.Althouse BM, Scarpino SV. Asymptomatic transmission and the resurgence of Bordetella pertussis. BMC Med. 2015;13:146. doi: 10.1186/s12916-015-0382-8. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 21.Domenech de Cellès M, Magpantay FM, King AA, Rohani P. The pertussis enigma: reconciling epidemiology, immunology and evolution. Proc Biol Sci. 2016;283(1822):20152309. doi: 10.1098/rspb.2015.2309. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 22.Heininger U, André P, Chlibek R, et al. Comparative epidemiologic characteristics of pertussis in 10 central and eastern European countries, 2000–2013. PLoS ONE. 2016;11(6):e0155949. doi: 10.1371/journal.pone.0155949. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 23.Campbell H, Gupta S, Dolan GP, et al. Review of vaccination in pregnancy to prevent pertussis in early infancy. J Med Microbiol. 2018;67:1426–1456. doi: 10.1099/jmm.0.000829. [DOI] [PubMed] [Google Scholar]
- 24.AG Pertussis der Ständigen Impfkommission (STIKO) Wissenschaftliche Begründung für die Empfehlung der Pertussisimpfung mit einem Tdap-Kombinationsimpfstoff in der Schwangerschaft. Epidemiol. Bull. 2020;14:3–34. doi: 10.25646/6584. [DOI] [Google Scholar]
- 25.Vygen-Bonnet S, Hellenbrand W, Garbe E, et al. Safety and effectiveness of acellular pertussis vaccination during pregnancy: a systematic review. BMC Infect Dis. 2020;20:136. doi: 10.1186/s12879-020-4824-3. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 26.Heininger U. Impfen in der Schwangerschaft zum frühen Infektionsschutz für Neugeborene. Monatsschr Kinderheilkd. 2019;167:213–219. doi: 10.1007/s00112-018-0629-5. [DOI] [Google Scholar]
- 27.Voysey M, Kelly DF, Fanshawe TR, et al. The influence of maternally derived antibody and infant age at vaccination on infant vaccine responses: an individual participant meta-analysis. JAMA Pediatr. 2017;171:637–646. doi: 10.1001/jamapediatrics.2017.0638. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 28.Barug D, Pronk I, van Houten MA, et al. Maternal pertussis vaccination and its effects on the immune response of infants aged up to 12 months in the Netherlands: an open-label, parallel, randomised controlled trial. Lancet Infect Dis. 2019;19:392–401. doi: 10.1016/S1473-3099(18)30717-5. [DOI] [PubMed] [Google Scholar]
- 29.Amirthalingam G, Campbell H, Ribeiro S, et al. Sustained effectiveness of the maternal pertussis immunization program in england 3 years following introduction. Clin Infect Dis. 2016;63(suppl 4):S236–S243. doi: 10.1093/cid/ciw559. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 30.Heininger U. Early prevention of pertussis is key. Lancet Infect Dis. 2019;19:689. doi: 10.1016/S1473-3099(19)30268-3. [DOI] [PubMed] [Google Scholar]