Abstract
目的
评价芦可替尼在中国骨髓纤维化患者中的疗效和安全性。
方法
63例中国骨髓纤维化患者纳入研究,男32例,女31例,中位年龄55(25~79)岁。芦可替尼起始剂量:基线PLT(100~200)×109/L者(25例)30 mg/d,基线PLT>200×109/L者(38例)40 mg/d。使用MRI/CT、欧洲癌症研究与治疗组织生活质量调查问卷核心30(EORTC QLQ-C30)和骨髓纤维化症状评估表(MFSAF)v2.0对患者进行脾脏体积、生活质量和症状评估。
结果
截至12个月随访结束,47例(74.6%)患者仍在继续治疗,25例(39.7%)患者脾脏体积较基线缩小超过35%,首次达到脾脏体积缩小≥35%的中位时间为12.71(95%CI 12.14~35.00)周。治疗期间,85.7%(54/63)的患者有不同程度的脾脏缩小,中位最佳脾脏体积缩小百分比为35.5%,48周时中位脾脏缩小体积为34.7%。治疗48周时53.1 %(26/49)的患者MFSAF症状评分降低超过50%,生活质量得到改善。最常见的血液学不良事件包括贫血和血小板计数降低,但极少造成停药。非血液学不良事件以1/2级为主。
结论
芦可替尼使中国骨髓纤维化患者的脾脏体积获得持续缩小、症状改善,不良反应可耐受。
Keywords: 骨髓纤维化, JAK抑制剂, 芦可替尼, 治疗结果, 药物毒性
Abstract
Objective
To evaluate the efficacy and safety of ruxolitinib in Chinese myelofibrosis patients.
Methods
This study enrolled 63 Chinese patients (32 males and 31 females) in total, whose median age was 55 (25–79) years. The initial dose of ruxolitinib was 30mg/d (25 patients) with a baseline of PLT (100–200)×109/L and 40 mg/d (38 patients) with a baseline of PLT>200×109/L. Spleen volume, quality of life (QOL) and symptoms were evaluated by MRI/CT, European Organization for Research and Treatment of Cancer QOL Questionnaire Core 30 (EORTC QLQ-C30) and MF Symptom Assessment Form (MFSAF) v2.0 questionnaire.
Results
At the time of this analysis (follow-up of 12 months), 47 patients (74.6%) were still receiving treatment, 25 patients (39.7%) achieved ≥35% reduction in spleen volume from baseline. First time to achieve≥35% reduction was 12.71 (95% CI 12.14–35.00) weeks. During the treatment, 85.7% (54 /63) of patients achieved reduction in spleen volume in different extent, the median optimal spleen volume reduction was 35.5% and the median spleen volume reduction was 34.7% at week 48. 53.1% (26/49) of patients achieved ≥50% reduction in spleen volume from baseline in total symptom score and QOL was improved at week 48. The most common hematologic adverse events were anemia and thrombocytopenia, which merely resulted in discontinuation of treatment. Non-hematologic adverse events were almost grade 1/2.
Conclusion
These data indicated that ruxolitinib treatment provided durable reductions in spleen volume and improvement in symptoms in Chinese myelofibrosis patients, and the adverse events were tolerated.
Keywords: Myelofibrosis, JAK inhibitor, Ruxolitinib, Treatment outcome, Drug toxicity
骨髓纤维化(myelofibrosis, MF)是以髓系增生为特征的造血干细胞克隆性疾病。除原发性骨髓纤维化(PMF)外,真性红细胞增多症(PV)和原发性血小板增多症(ET)后期也可出现MF,称为真性红细胞增多症后骨髓纤维化(post-PV MF)和原发性血小板增多症后骨髓纤维化(post-ET MF)[1]。MF主要表现为骨髓进行性纤维化、进行性贫血、白细胞增多或减少、血小板增多或减少以及由髓外造血导致的巨脾[2]。巨脾可导致早饱、呼吸困难和门脉高压。此外,患者可出现严重的全身症状(乏力、盗汗、体重减轻、发热、骨痛等)以及血栓形成、微血管病变等并发症[3]。根据骨髓纤维化研究和治疗国际工作组(IWG-MRT)的评分标准,高危患者的中位生存期只有27个月[4]。
在MF的发病中,Janus激酶(JAK)/信号转导和转录活化因子(STAT)信号通路起重要作用。约65%的PMF、55%的post-ET MF、96%的post-PV MF患者存在JAK2 V617F基因突变[5]。芦可替尼是一种强效JAK1 /JAK2抑制剂,美国和欧洲开展的随机对照研究(COMFORT-Ⅰ和COMFORT-Ⅱ)均显示芦可替尼口服给药具有良好的治疗效果[6]–[7],已被欧盟和美国批准用于MF的治疗。A2202研究(诺华制药有限公司,注册号NCT01392443)是一项亚洲多个国家和地区参与的评价芦可替尼对亚洲MF患者有效性和安全性的Ⅱ期临床试验,共纳入63例中国患者。我们在本文中分析A2202研究中63例中国MF患者随访1年的结果。
病例与方法
1.入组标准:①年龄≥18岁;②满足2008年WHO PMF诊断标准或IWG-MRT建议的post-PV MF或post-ET MF的诊断标准,无论是否有JAK2突变;③脾脏左肋缘下≥5 cm;④具有≥2个IWG-MRT危险因素(中危-2或高危患者):年龄>65岁,有全身症状(体重减轻、发热、夜间盗汗),HGB<100 g/L或输血依赖,WBC>25×109/L,外周血幼稚细胞≥1%;⑤外周血幼稚细胞<10%;⑥美国东部肿瘤协作组(ECOG)体能状态评分0~2分;⑦具有一定的骨髓功能储备[中性粒细胞计数(ANC)≥1×109/L、PLT≥100×109/L];⑧不适合造血干细胞移植(HSCT),既往未接受过JAK抑制剂治疗;⑨暂无法行HSCT;⑩至少停用其他MF治疗药物28 d。
2.治疗方案及分组:研究方案设计见文献[8]。根据芦可替尼起始剂量分为:①30 mg/d组(25例):基线PLT(100~200)×109/L者,分2次给药;②40 mg/d组(38例):基线PLT>200×109/L者,分2次给药。根据疗效和不良反应发生情况进行剂量调整,一般剂量不超过50 mg/d或低于10 mg/d。治疗期间出现PLT<50×109/L、ANC<0.5×109/L或3/4级非血液学不良反应时暂停服药,PLT≥50 × 109/L、ANC≥0.5×109/L且非血液学不良反应恢复至1级时继续给药。
3.研究终点及评估:采用MRI或CT评估脾脏体积。主要终点:芦可替尼治疗24周时脾脏体积缩小≥35%的患者比例。次要终点包括:①MF症状评估表(MFSAF)2.0版评估的第24周患者总症状评分降低≥50%的患者比例;②欧洲癌症研究与治疗组织生活质量调查问卷核心30(EORTC QLQ-C30)评估的基线至24周时患者的生活质量变化;③达到脾脏体积缩小≥35%的最佳应答患者比例以及脾脏缩小持续时间(首次出现脾脏体积缩小≥35%至发生死亡、脾脏放疗、脾切除、白血病转化、脾脏体积较基线增加≥25%的时间)。按照美国卫生及公共服务部、国立卫生研究院、国家癌症研究所联合发布的不良反应常用术语标准(CTCAE) 4.03版进行不良反应评估。
4.随访:通过走访、门诊进行随访。在患者末次服药后30 d进行末次安全性随访。随访截止时间为2014年1月9日,中位随访时间为14.1 (0.5~14.3)个月。
5.统计学处理:使用SPSS 20.0进行数据分析,采用Kaplan-Meier曲线对脾脏缩小持续时间进行评估。数据采用95%可信区间描述。
结果
1.病例资料:本研究共纳入中国MF患者63例,男32例,女31例,中位年龄55(25~79)岁;PMF 49例(77.8%),post-PV MF 5例(7.9%),post-ET MF 9例(14.3%);疾病诊断至入组的中位时间为1.3(0.1~20.3)年;ECOG评分0分34例(54.0%),1分26例(41.3%),2分3例(4.8%);修订版国际预后评分系统(IPSS)评分:高危15例(23.8%),中危-2 48例(76.2%);脾脏大小中位数为肋缘下15(6~45)cm,脾脏体积中位数为2 236(685~6 076)cm3;中位PLT为227(96~986)×109/L,所有患者均未输注单采或浓缩血小板;中位HGB为99(47~179)g/L,7例(11.1%)患者曾输注红细胞;28例(44.4%)患者曾接受羟基脲治疗;全部63例患者均未行JAK2基因突变检测。至随访结束,47例(74.6%)患者仍在继续治疗,16例(25.4%)患者已终止治疗。
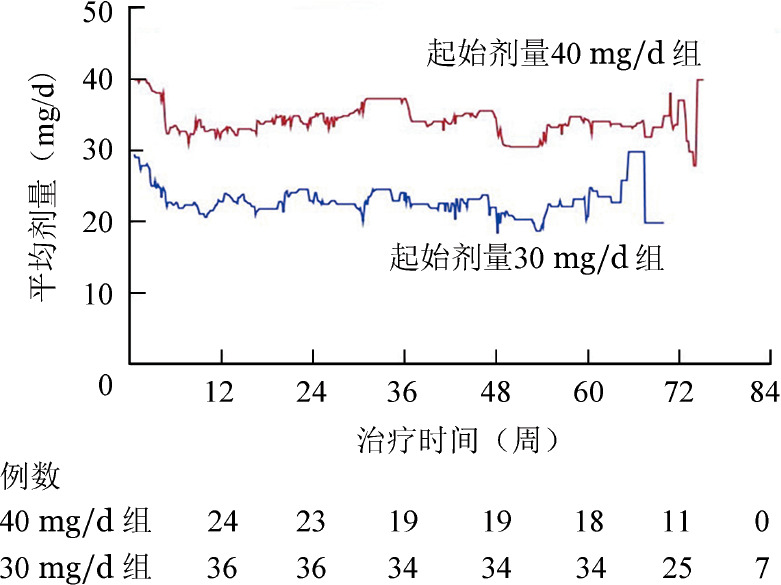
2.药物剂量:起始剂量30 mg/d组25例患者的中位给药剂量为22.0(8.9~30.4)mg/d,平均给药剂量为23.0 mg/d;起始剂量40 mg/d组38例患者的中位给药剂量为37.5(19.3~47.7)mg/d,平均给药剂量为34.9 mg/d。详见图1。
图1. 骨髓纤维化患者芦可替尼的平均剂量.
3.脾脏体积评估:29例(46.0%)患者在随访中曾经达到脾脏体积缩小≥35%。在治疗第12、24、36、48周时,脾脏体积缩小≥35%的患者分别为23.8%(15/63)、27.0%(17/63)、31.7%(20/63)、39.7%(25/63)。首次达到脾脏体积缩小≥35%的中位时间为12.71(95%CI 12.14~35.00)周。Kaplan-Meier分析结果显示,患者在48周时脾脏持续缩小≥35%的比例为64%(95%CI 7%~93%),60周时这一比例仍为64%(95%CI 7%~93%),由于事件数太少(2例),中位时间尚未达到。治疗期间,85.7%(54/63)的患者有不同程度的脾脏缩小,中位最佳脾脏体积缩小百分比为35.5%。在不同时间点对脾脏体积缩小的程度进行分析,脾脏体积自基线的中位变化在24%和35%之间波动。第48周时,中位脾脏体积缩小为34.7%。
4.症状和生活质量评估:从基线至第24周,患者EORTC QLQ-C30评分结果在既往研究中已有相应报道[8]。24周后此数据无更新,因此我们重点关注MFSAF问卷所包含的总症状评分(不含“不活跃”症状)变化情况。第48周时,49例患者中有26例(53.1%)总症状评分较基线降低≥50%。患者的症状改善迅速,第4周时,58例患者中有29例(50.0%)达到总症状评分降低≥50%。首次达到总症状评分降低≥50%的中位时间为6.14(95% CI 4.14~8.14)周。整个随访期间,44.6%~71.2%的患者总症状评分降低持续≥50%。第48周时,患者的单项症状也有明显改善,盗汗、瘙痒、早饱感、骨骼或肌肉疼痛、腹部不适感的中位症状评分改善均≥ 50%(图2)。治疗期间患者体重逐渐增加,第48周时,患者体重平均增加3.14 kg。
图2. 接受芦可替尼治疗骨髓纤维化患者症状评估评分较基线的中位降低比例.
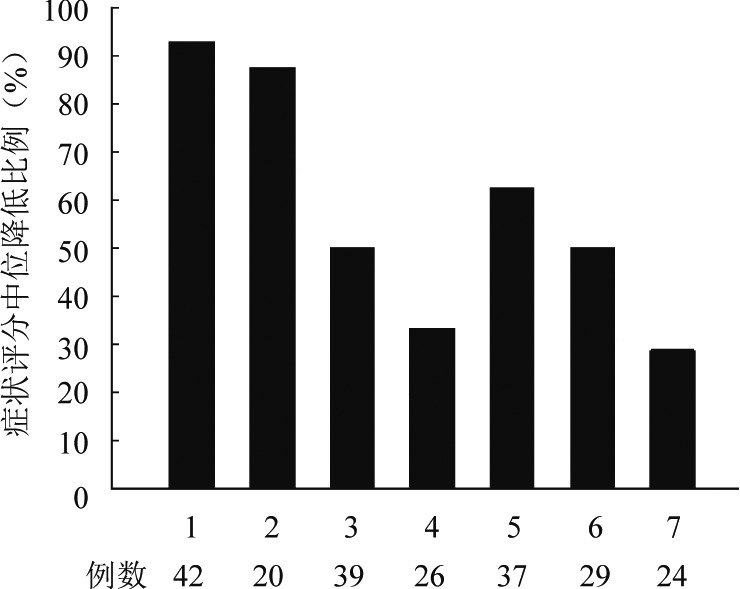
1:盗汗;2:瘙痒;3:腹部不适;4:左上腹肋缘下疼痛;5:早饱感;6:骨骼或肌肉疼痛;7:不活跃症状
5.骨髓纤维化程度变化:治疗第48周时共取得48例患者骨髓病理结果,18.8%(9/48)的患者骨髓纤维化程度较基线结果改善(1例患者从3级改善至0级),58.3%(28/48)的患者稳定,18.8%(9/48)的患者加重。
6.安全性:在随访期间,61例(96.8%)患者发生1次及以上的不良事件,其中43例(68.3%)发生3/4级不良事件。40例(63.5%)患者因不良事件而药物减量或中断治疗,9例(14.3%)因不良事件而终止给药。最常见的减量或中断给药原因是血小板计数降低(23例,36.5%)和血小板减少症(12例,19.0%),1例患者因血小板计数降低、1例患者因血小板减少症终止治疗。
发生率≥20%的不良事件包括贫血(66.7%)、血小板计数降低(38.1%)、上呼吸道感染(20.6%)、丙氨酸转氨酶升高(20.6%),最常见的3/4级血液学不良事件包括贫血(47.6%)、血小板计数降低(9.5%)和血小板减少症(3.2%)(表1)。治疗开始至首次出现3/4级贫血中位时间为75(1~512)d,至首次出现3/4级血小板减少症中位时间为88(15~329)d。非血液学不良事件以1/2级为主。与芦可替尼相关不良事件包括贫血(58.7%,37/63)、血小板计数降低(36.5%,23/63)、血小板减少症(19.0%,12/63)和丙氨酸转氨酶升高(20.6%,13/63)。15例(23.8%)患者发生至少1次严重不良反应(SAE),考虑与药物相关的SAE为3例(4.8%)。发生2例以上的SAE包括肺感染(3例)、贫血(2例)、发热(2例)和肺炎(2例)。在不同时间段,最常见的不良事件为贫血、血小板计数降低和血小板减少症。随着治疗时间延长,未发现新的非预期不良事件。不良事件的发生率为48.6%~71.2%。治疗48周后,贫血、血小板计数降低、血小板减少症的发生率有所下降(表2)。11.1%(7/63)的患者治疗前接受1次及以上红细胞输注。开始芦可替尼治疗后,需要输注红细胞的患者上升至41.3%(26/63)。治疗前红细胞中位输注量0(0~2.7)U/月,治疗后为0(0~3.0)U/月。随治疗时间延长,输注红细胞的患者逐渐减少。
表1. 芦可替尼治疗63例骨髓纤维化患者主要不良事件(发生率≥10%)分布情况[例(%)].
| 不良事件 | 所有级别 | 3/4级 |
| 贫血 | 42(66.7) | 30(47.6) |
| 血小板计数降低 | 24(38.1) | 6(9.5) |
| 上呼吸道感染 | 13(20.6) | 3(4.8) |
| 丙氨酸转氨酶升高 | 13(20.6) | 0(0.0) |
| 血小板减少症 | 12(19.0) | 2(3.2) |
| 腹胀 | 12(19.0) | 2(3.2) |
| 腹泻 | 12(19.0) | 1(1.6) |
| 天冬氨酸转氨酶升高 | 11(17.5) | 0(0) |
| 发热 | 10(15.9) | 1(1.6) |
| 谷氨酰转移酶升高 | 10(15.9) | 4(6.3) |
| 中性粒细胞计数减少 | 8(12.7) | 1(1.6) |
| 体重增加 | 8(12.7) | 2(3.2) |
| 外周性水肿 | 7(11.1) | 0(0) |
表2. 芦可替尼治疗过程中不良事件发生情况[例(%)].
| 不良事件 | 治疗时间(周) |
||||||||
| 0~4(63例) | > 4~8(62例) | > 8~12(61例) | > 12~24(59例) | > 24~36(55例) | > 36~48(54例) | > 48~60(53例) | > 60~72(35例) | > 72(7例) | |
| 贫血 | 6(9.5) | 13(21) | 13(21.3) | 14(23.7) | 9(16.4) | 12(22.2) | 5(9.4) | 3(8.6) | 1(14.3) |
| 血小板计数降低 | 9(14.3) | 9(14.5) | 10(16.4) | 9(15.3) | 7(12.7) | 10(18.5) | 5(9.4) | 0(0) | 0(0) |
| 血小板减少症 | 5(7.9) | 2(3.2) | 2(3.3) | 7(11.9) | 1(1.8) | 4(7.4) | 3(5.7) | 0(0) | 0(0) |
| 腹胀 | 1(1.6) | 1(1.6) | 1(1.6) | 0(0) | 1(1.8) | 4(7.4) | 5(9.4) | 4(11.4) | 0(0) |
| 发热 | 1(1.6) | 4(6.5) | 1(1.6) | 2(3.4) | 1(1.8) | 1(1.9) | 0(0) | 1(2.9) | 1(14.3) |
| 丙氨酸转氨酶升高 | 2(3.2) | 5(8.1) | 1(1.6) | 4(6.8) | 3(5.5) | 0(0) | 4(7.5) | 0(0) | 0(0) |
| 合计 | 34(54.0) | 34(54.8) | 31(50.8) | 42(71.2) | 30(54.5) | 37(68.5) | 34(64.2) | 17(48.6) | 1(14.3) |
7.生存情况:至随访截止,全部63例患者中58例(92.1%)存活。5例(7.9%)患者分别在随访第15、33、68、157、348天死亡,直接死亡原因:心力衰竭1例,感染4例。研究者认为5例患者的死亡与芦可替尼治疗没有直接关系。死亡患者中有1例在第22天时诊断为急性髓系白血病,第33天死亡。本研究中还有另外2例患者转化为急性白血病。3例白血病转化患者MF病史均较长(分别为3.0、5.2、9.6年),基线外周血原始细胞均≥1%。
讨论
本组病例的基线资料与COMFORT[6]–[7]研究略有差异。本组患者的中位脾脏体积(2 236 cm3)略小于COMFORT-Ⅰ(2 598 cm3)和COMFORT-Ⅱ(2 408 cm3),中位HGB(99 g/L)略低于COMFORT-Ⅰ(105 g/L)和COMFORT-Ⅱ(106 g/L)。76.2%(48例)的患者为中危-2组,略高于COMFORT-Ⅰ(41.0%)和COMFORT-Ⅱ(40.0%)。
既往研究表明,芦可替尼对MF患者具有良好的疗效。其中COMFORT-Ⅰ在治疗24周[6]、COMFORT-Ⅱ在治疗48周[7],芦可替尼治疗组中有更多患者达到脾脏体积较基线水平缩小≥35%的目标。在改善全身症状和提高生活质量方面,芦可替尼也具有显著的优越性。这两项研究还分别进行了长达5年的随访,结果发现芦可替尼组患者的生存较安慰剂组[HR=0.69(95% CI 0.50~0.96),P= 0.025][9]和最佳治疗组(BAT组)[HR=0.67(95% CI 0.44~1.02),P=0.06][10]显著延长。芦可替尼对亚洲MF患者也有良好的疗效,治疗24周后,中位脾脏体积缩小26.9%[8]。本研究表明,中国MF患者在治疗48周后疗效仍在持续,39.7%患者脾脏体积较基线水平缩小≥35%,中位脾脏体积缩小34.7%。大多数患者短期内可以达到脾脏缩小,首次达到脾脏体积缩小≥35%的中位时间为12.71周,与COMFORT-Ⅱ(中位时间12周)研究类似。由于患者每12周才评估1次脾脏体积,因此实际达到脾缩小的中位时间可能短于12.71周。29例(46.0%)患者脾脏体积至少1次达到缩小≥35%,与COMFORT-Ⅱ研究相似(47%的患者至少1次达到缩小≥35%)[7]。在0至48周,随着治疗时间的延长,脾脏体积缩小≥35%的患者比例逐渐上升。
除脾脏缩小外,芦可替尼还可改善患者全身症状。治疗48周后,53.1%的患者症状评分降低≥ 50%,且改善迅速,首次达到总症状评分降低≥50%的中位时间为6.14周。在整个随访期间,44.6%~71.2%的患者MFSAF总症状评分降低持续≥50%。这与COMFORT-Ⅰ研究[6]24周时46%的患者总症状评分降低≥50%的结果类似。芦可替尼可以使患者全身症状快速改善而且作用持久。而MFSAF全身症状评分与患者的生活质量密切相关[11],表明芦可替尼对患者生活质量的提高具有重要意义。
在治疗的前6周,大多数患者的药物剂量需要调整,30 mg/d组和40 mg/d组患者可耐受的平均给药剂量分别为22.9 mg/d和34.9 mg/d。这种早期剂量调整的趋势与COMFORT-Ⅰ研究[12]类似,之后药物剂量趋于稳定。
由于JAK/STAT通路是正常造血的重要机制,JAK抑制剂芦可替尼可导致骨髓抑制,最常见的表现是贫血和血小板减少。本组病例中,3/4级贫血、血小板计数降低、血小板减少症的发生率分别为47.6%、9.5%、3.2%,与COMFORT-Ⅰ的结果(贫血45.2%、血小板减少12.9%)[6]相似。首次发生3/4级贫血、血小板计数降低和血小板减少症的中位时间为开始治疗后75~88 d,提示在此期间需要密切监测血常规。尽管贫血和血小板减少的发生率较高,但都能通过暂时停药、调整芦可替尼剂量或输血进行纠正,没有一例患者因贫血而终止治疗,36.5%(23例)和19.0%(12例)患者因血小板计数降低和血小板减少症而药物减量,仅1例患者因血小板计数降低、1例患者因血小板减少症终止治疗。
本组患者治疗期间的不良事件发生率保持在48.6%~71.2%,表明不良事件未随治疗时间延长而增加。14.3%(9例)患者因不良事件而终止治疗,但未发生芦可替尼相关死亡事件,表明中国MF患者对芦可替尼耐受性良好。
治疗早期接受红细胞输注的患者比例增加,这与芦可替尼对骨髓造血的抑制以及中国患者基线期血红蛋白水平较低可能相关。此外,18.8%的患者骨髓纤维化程度改善(其中1例患者从3级改善至0级),58.3%的患者骨髓纤维化程度稳定,提示芦可替尼可逆转MF患者的病程进展。治疗过程中,患者的体重平均增加3.14 kg,体现了治疗的有效性。
本研究结果表明,芦可替尼可使MF患者获得长期的脾脏缩小和全身症状改善。不良反应主要为可控制的贫血和血小板减少,且发生率并没有随着治疗时间的延长而增加。芦可替尼为中国MF患者提供了一个有效的治疗选择。
Funding Statement
基金项目:国家自然科学基金(81370643-H0812);浙江省重点创新团队(2011R50015)
Fund Program: National Natural Science Foundation of China(81370643-H0812); Key Innovation Team of Zhejiang Province(2011R50015)
Footnotes
临床试验注册 诺华制药有限公司(NCT01392443)
Clinical trial registration Novartis pharma (NCT01392443)
References
- 1.Mesa RA, Verstovsek S, Cervantes F, et al. Primary myelofibrosis (PMF), post polycythemia vera myelofibrosis (post-PV MF), post essential thrombocythemia myelofibrosis (post-ET MF), blast phase PMF (PMF-BP): consensus on terminology by the international working group for myelofibrosis research and treatment (IWG-MRT)[J] Leuk Res. 2007;31(6):737–740. doi: 10.1016/j.leukres.2006.12.002. [DOI] [PubMed] [Google Scholar]
- 2.Barosi G, Rosti V, Vannucchi AM. Therapeutic approaches in myelofibrosis[J] Expert Opin Pharmacother. 2011;12(10):1597–1611. doi: 10.1517/14656566.2011.568939. [DOI] [PubMed] [Google Scholar]
- 3.Mesa RA, Niblack J, Wadleigh M, et al. The burden of fatigue and quality of life in myeloproliferative disorders (MPDs): an international Internet-based survey of 1179 MPD patients[J] Cancer. 2007;109(1):68–76. doi: 10.1002/cncr.22365. [DOI] [PubMed] [Google Scholar]
- 4.Cervantes F, Dupriez B, Pereira A, et al. New prognostic scoring system for primary myelofibrosis based on a study of the International Working Group for Myelofibrosis Research and Treatment[J] Blood. 2009;113(13):2895–2901. doi: 10.1182/blood-2008-07-170449. [DOI] [PubMed] [Google Scholar]
- 5.Tefferi A, Vainchenker W. Myeloproliferative neoplasms: molec-ular pathophysiology, essential clinical understanding, and treatment strategies[J] J Clin Oncol. 2011;29(5):573–582. doi: 10.1200/JCO.2010.29.8711. [DOI] [PubMed] [Google Scholar]
- 6.Verstovsek S, Mesa RA, Gotlib J, et al. A double-blind, placebo-controlled trial of ruxolitinib for myelofibrosis[J] N Engl J Med. 2012;366(9):799–807. doi: 10.1056/NEJMoa1110557. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Harrison C, Kiladjian JJ, Al-Ali HK, et al. JAK inhibition with ruxolitinib versus best available therapy for myelofibrosis[J] N Engl J Med. 2012;366(9):787–798. doi: 10.1056/NEJMoa1110556. [DOI] [PubMed] [Google Scholar]
- 8.Jung CW, Shih LY, Xiao Z, et al. Efficacy and safety of ruxolitinib in Asian patients with myelofibrosis[J] Leuk Lymphoma. 2015;56(7):2067–2074. doi: 10.3109/10428194.2014.969260. [DOI] [PubMed] [Google Scholar]
- 9.Gupta V, Verstovsek S, Mesa RA, et al. Long-term outcomes of ruxolitinib (RUX) therapy in patients (pts) with myelofibrosis (MF): 5-year update from COMFORT-I[J] J Clin Oncol (Meeting Abstracts) 2016;34(15_suppl):7012. [Google Scholar]
- 10.Harrison CN, Vannucchi AM, Kiladjian JJ, et al. Long-term findings from COMFORT-II, a phase 3 study of ruxolitinib vs best available therapy for myelofibrosis[J] Leukemia. 2016;30(8):1701–1707. doi: 10.1038/leu.2016.148. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.Mesa RA. Assessing new therapies and their overall impact in myelofibrosis[J] Hematology Am Soc Hematol Educ Program. 2010;2010:115–121. doi: 10.1182/asheducation-2010.1.115. [DOI] [PubMed] [Google Scholar]
- 12.Verstovsek S, Mesa RA, Gotlib J, et al. Efficacy, safety and survival with ruxolitinib in patients with myelofibrosis: results of a median 2-year follow-up of COMFORT-I[J] Haematologica. 2013;98(12):1865–1871. doi: 10.3324/haematol.2013.092155. [DOI] [PMC free article] [PubMed] [Google Scholar]


