Abstract
目的
分析造血干细胞移植(HSCT)治疗血管免疫母细胞性T细胞淋巴瘤(AITL)的临床疗效。
方法
回顾性分析2007年6月至2017年6月期间在国内八所医院接受HSCT的AITL患者。
结果
共有19例患者纳入本研究,其中男13例,女6例,中位年龄50(32~60)岁;自体造血干细胞移植(auto-HSCT)12例,异基因造血干细胞移植(allo-HSCT)7例(均为同胞全相合供者,其中2例为auto-HSCT后复发患者)。auto-HSCT组移植前疾病处于完全缓解(CR)、部分缓解(PR)状态者分别为5例、7例;allo-HSCT组患者移植前疾病处于PR、疾病进展(PD)状态者分别为2例、3例。失访2例(均为auto-HSCT组),中位随访时间46.5(1~100)个月。allo-HSCT组3例患者发生急性移植物抗宿主病(GVHD)(Ⅰ度2例,Ⅱ度1例),5例发生慢性GVHD(局限型2例,广泛型3例)。auto-HSCT组死亡4例(原发病复发死亡3例),allo-HSCT组死亡3例(移植相关死亡2例,原发病复发死亡1例)。auto-HSCT组(10例)、allo-HSCT组(7例)的3年总生存率分别为56%(95%CI 32%~100%)、57%(95%CI 30%~100%)(P=0.979);3年累积无进展生存率分别为34%(95%CI 14%~85%)、57%(95%CI 30%~100%)(P=0.451)。
结论
auto-HSCT和allo-HSCT均是AITL的有效治疗方法。
Keywords: 造血干细胞移植, 淋巴瘤,T细胞,血管免疫母细胞性, 生存率分析
Abstract
Objective
To evaluate clinical outcomes of autologous (auto-HSCT) and allogeneic hematopoietic stem cell transplantation (allo-HSCT) for angioimmunoblastic T-cell lymphoma (AITL).
Methods
From June 2007 to June 2017, clinical data of AITL patients who underwent HSCT in eight hospitals were assessed retrospectively.
Results
Of 19 patients, 13 male and 6 female with a median age of 50 (32–60) years old, 12 auto-HSCT and 7 allo-HSCT recipients were enrolled in this study, all donors were HLA-identical siblings. Two of allo-HSCT recipients were relapsed auto-HSCT ones. There were 5 patients (5/12) in complete response (CR) status and 7 (7/12) in partial remission (PR) status before transplantation in auto-HSCT group, and 2 (2/7) in PR status and 3 (3/7) in progression disease (PD) status before transplantation in allo-HSCT group. The median follow-up for the surviving patients was 46.5 months (range, 1–100 months) for the whole series, two patients lost in auto-HSCT group. Three patients developed acute graft-versus-host disease (aGVHD) and 5 chronic graft-versus-host disease (cGVHD) after allo-HSCT. Three patients died of primary disease and 1bleeding in auto-HSCT group. One patient died of primary disease and 2 transplantation-related mortality in allo-HSCT group. The 3-year cumulative overall survival (OS) were 56% (95%CI 32%–100%) and 57% (95%CI 30%-100%) for auto-HSCT and allo-HSCT, respectively (P=0.979). The 3-year cumulative progression-free survival (PFS) were 34% (95%CI 14%–85%) and 57% (95%CI 30%–100%) for auto-HSCT and allo-HSCT, respectively (P=0.451).
Conclusion
Both auto-HSCT and allo-HSCT were optimal choices for AITL. In clinical practice, which HSCT was better for AITL patients should be based on comprehensive factors including sensitivity to chemotherapy, risk stratification and disease status at transplantation.
Keywords: Hematopoietic stem cell transplantation; Lymphoma, T-Cell, Angioimmunoblastic; Survival analysis
血管免疫母细胞性T细胞淋巴瘤(angioimmunoblastic T-cell lymphoma, AITL)发病率低、侵袭性强、预后差,是外周T细胞淋巴瘤的一种主要亚型(占15%~20%)[1]。在蒽环类药物为基础的联合化疗序贯自体造血干细胞移植(auto-HSCT)治疗模式下,AITL患者的5年总生存(OS)率为52%,5年无进展生存(PFS)率为49%,而复发/难治性AITL患者的中位生存期仅为5.5个月[2]。AITL预后评分(PIAI)低危组、高危组的5年OS率分别为44%、24%[3]。近年来,组蛋白去乙酰化酶抑制剂(西达本胺、罗米地辛、贝利司他)、来那度胺、阿仑单抗、硼替佐米、普拉曲沙等新药已用于AITL的治疗,但疗效均不理想,尤其对于侵袭性强的初治患者及复发/难治性患者,造血干细胞移植(HSCT)仍为最佳选择。本研究对来自国内八所医院接受HSCT的AITL患者进行回顾性分析,探讨HSCT治疗AITL的疗效。
病例与方法
1.病例:研究纳入2007年6月至2017年6月期间在中国人民解放军总医院、北京友谊医院、北京大学第一医院、福建协和医院、中国人民解放军原第304医院、中国人民解放军原第307医院、陆军医科大学附属新桥医院、郑州大学附一院接受HSCT的19例AITL患者。所有患者均基于病理细胞形态学和免疫组化资料进行诊断。
2.预处理及移植物抗宿主病预防:auto-HSCT组预处理方案包括BEAM(卡莫司汀+依托泊苷+阿糖胞苷+美法仑)、CBV(环磷酰胺+卡莫司汀+依托泊苷)方案;异基因造血干细胞移植(allo-HSCT)组预处理方案包括TBI/Cy(全身照射+环磷酰胺)、Bu/Cy(白消安+环磷酰胺)方案。allo-HSCT后移植物抗宿主病(GVHD)的预防以环孢素A+短疗程甲氨蝶呤为基础。
3.支持治疗:患者在HSCT期间接受层流病房环境保护,无侵袭性真菌病史患者口服氟康唑预防真菌感染,有真菌感染史患者以既往治疗有效药物行二级预防。allo-HSCT患者以复方磺胺甲噁唑预防卡氏肺孢子虫感染。患者血红蛋白低于80 g/L时输注辐照浓缩红细胞,血小板计数低于20×109/L或有活动性出血时输注辐照去白细胞机采血小板。
4.造血重建与疗效评价:中性粒细胞绝对计数(ANC)>0.5×109/L持续3 d为粒细胞植入,PLT>20×109/L持续7 d且脱离血小板输注为血小板植入。疗效评价标准参照文献[4],分为完全缓解(CR)、部分缓解(PR)、疾病稳定(SD)、疾病进展(PD)。
5.随访:随访截止时间为2017年12月31日,采用电话联系进行随访。OS期:造血干细胞回输至因各种原因死亡或末次随访时间;PFS期:造血干细胞回输至疾病进展、复发或任何原因导致死亡的时间。
6.统计学处理:采用SPSS 16.0软件进行数据分析。生存分析采用Kaplan-Meier法。组间患者的基本资料之间的差异检验,连续变量采用独立样本的t检验,分类变量采用卡方检验,以P<0.05为差异有统计学意义。
结果
1.一般资料:全部19例AITL患者中男13例,女6例,中位年龄50(32~60)岁。12例行auto-HSCT,7例行allo-HSCT(allo-HSCT均为HLA全合同胞供者,其中2例为auto-HSCT后复发患者)。移植时疾病状态:CR 5例,PR 9例,SD 2例,PD 3例;诊断距移植中位时间为8.5(3~52)个月。19例患者临床资料详见表1。
表1. 19例接受造血干细胞移植AITL患者的临床资料.
| 临床特征 | auto-HSCT(12例) | allo-HSCT(7例) | 统计量 | P值 |
| 性别(例,男/女) | 7/5 | 6/1 | 8.437 | 0.010 |
| 年龄[岁,M(范围)] | 50.5(32~60) | 47(38~59) | 0.098 | 0.758 |
| aaIPI>2分[例(%)] | 2(16.7) | 0 | 0.005 | 0.942 |
| PIT>2分[例(%)] | 1(8.3) | 0 | 2.478 | 0.134 |
| 骨髓受累[例(%)] | 2(16.7) | 1(14.3) | 0.069 | 0.796 |
| 中枢神经系统受累[例(%)] | 0 | 0 | ||
| B症状[例(%)] | 7(58.3) | 4(57.1) | 0.069 | 0.796 |
| 结外病变>1处[例(%)] | 8(66.7) | 2(28.6) | 0.004 | 0.953 |
| 诊断距移植时间[月,M(范围)] | 8.25(4~52) | 11(3~22) | 0.583 | 0.456 |
| 移植前化疗疗程[个,M(范围)] | 6.5(4~10) | 6(4~16) | 1.249 | 0.279 |
| 移植前化疗方案种类[例(%)] | 5.213 | 0.036 | ||
| 1种 | 5(41.7) | 0 | ||
| 2种 | 2(16.6) | 4(57.1) | ||
| ≥3种 | 5(41.7) | 3(42.9) | ||
| 移植前局部放疗[例(%)] | 4(33.3) | 2(28.6) | 27.936 | <0.000 |
| 移植前疾病状态[例(%)] | 8.036 | 0.011 | ||
| CR1 | 4(33.4) | 0 | ||
| CR2 | 1(8.3) | 0 | ||
| PR1 | 6(50.0) | 2(28.6) | ||
| PR2 | 1(8.3) | 0 | ||
| SD | 0 | 2(28.6) | ||
| PD | 0 | 3(42.8) | ||
| 预处理方案[例(%)] | 5.174 | 0.039 | ||
| BEAM | 6(50.0) | 1(14.3) | ||
| CBV | 3(25.0) | 0 | ||
| TBI/Cy | 0 | 3(42.8) | ||
| Bu/Cy | 0 | 1(14.3) | ||
| FB | 0 | 2(28.6) |
注:AITL:血管免疫母细胞性T细胞淋巴瘤;auto-HSCT:自体造血干细胞移植;allo-HSCT:异基因造血干细胞移植;aaIPI:年龄校正的国际预后评分;PIT:T 细胞淋巴瘤预后指数;CR1、CR2分别为第1、2次完全缓解;PR1、PR2分别为第1、2次部分缓解;SD:疾病稳定;PD:疾病进展。BEAM方案:卡莫司汀+依托泊苷+阿糖胞苷+美法仑;B症状:发热、盗汗、体重减低;CBV方案:环磷酰胺+卡莫司汀+依托泊苷;TBI:全身照射;Cy:环磷酰胺;Bu:白消安;Flu:氟达拉滨;FB方案:Flu+Bu
2.造血重建及早期移植相关死亡:auto-HSCT组12例、allo-HSCT组7例患者移植后存活均超过1个月且均获得造血重建。auto-HSCT组粒细胞植入中位时间为10(9~12)d,血小板植入中位时间为10(7~20)d。allo-HSCT组粒细胞植入中位时间为12(11~22)d,血小板植入中位时间为12(10~35)d。allo-HSCT组患者3例发生急性GVHD(Ⅰ度2例,Ⅱ度1例),5例患者发生慢性GVHD(局限型2例,广泛型3例)。
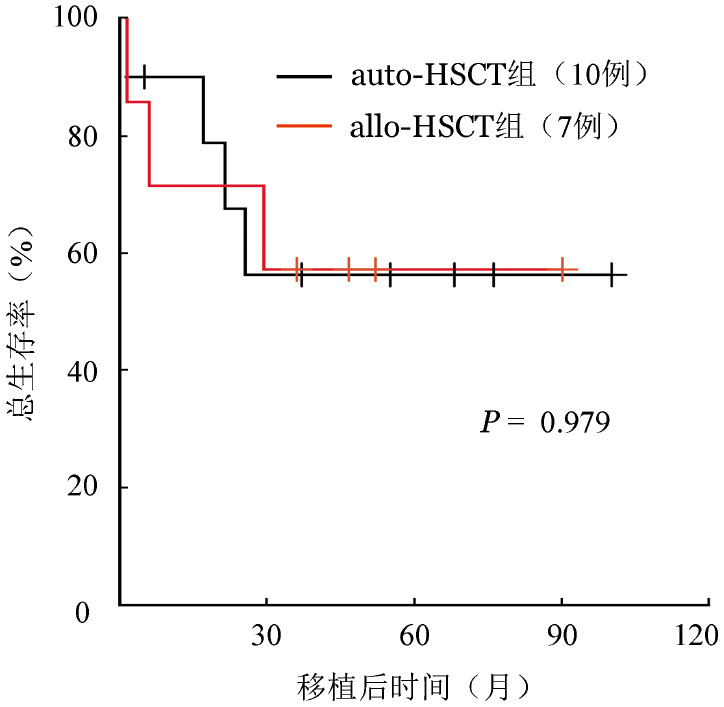
3.复发与生存:auto-HSCT组失访2例,中位随访时间为31(1~100)个月。allo-HSCT组无失访患者,中位随访时间为36(1.5~90)个月。auto-HSCT组完成随访的10例患者中4例死亡,其中3例死于肿瘤复发/进展,1例死于脑出血。allo-HSCT组7例患者中3例死亡,其中1例死于肿瘤复发/进展,1例死于广泛型慢性GVHD,1例死于心功能不全。10例行auto-HSCT组(10例)、allo-HSCT组(7例)3年OS率分别为56%(95%CI 32%~100%)、57%(95%CI 30%~100%)(P=0.979)(图1),3年PFS率分别为34%(95%CI 14%~85%)、57%(95%CI 30%~100%)(P=0.451)。
图1. auto-HSCT组与allo-HSCT组血管免疫母细胞性T细胞淋巴瘤患者移植后总生存曲线.
讨论
AITL是一种较少见的侵袭性外周T细胞淋巴瘤,其5年OS率、PFS率仅为31.6%、20.4%[5]。传统化疗效果不理想且复发率高,HSCT是其重要治疗手段,但选择auto-HSCT还是allo-HSCT仍存在分歧[6]–[7]。
欧洲骨髓移植组织淋巴瘤工作组的一项多中心回顾性研究[8]发现,大剂量化疗后行auto-HSCT可明显改善AITL患者的预后,146例AITL患者的中位随访时间为31个月,2、4年OS率分别为67%、59%,PFS率分别为53%、42%,疗效较传统化疗明显改善;研究同时发现移植前患者的疾病状态可能是影响生存的主要因素,与挽救性移植相比,CR状态下进行auto-HSCT有更好的长期存活率,2、4年无进展生存率(PFS)分别为70%、56%,而复发性AITL患者的2、4年PFS分别为42%、30%,难治性AITL患者的2、4年PFS率均为23%。日本的一项回顾性研究[9]探索了AITL患者行auto-HSCT的时机,巩固治疗组(移植前≥PR)、挽救性治疗组及难治性治疗组的3年OS率分别为68.7%、46.5%、48.4%,PFS率分别为49.1%、34.3%、24.9%,该研究同时发现年龄及移植时的疾病状态是影响OS的主要因素。在本研究中,10例行auto-HSCT的AITL患者的3年OS、PFS率低于上述研究结果,可能与本研究中移植前CR的患者比例偏低及病例数少有关。
从上述研究可见auto-HSCT对于复发/难治性AITL患者的远期疗效欠佳,而allo-HSCT被认为是有望治愈AITL的唯一手段,移植物抗淋巴瘤效应可进一步改善预后[6]–[7],[10]。Mamez等[11]报告了1例allo-HSCT后100 d疾病进展的AITL患者,在1个月内减停免疫抑制剂获得CR,证实了allo-HSCT有确切的移植物抗T细胞淋巴瘤效应。Kyriakou等[10]回顾性研究发现,45例AITL患者行allo-HSCT,其中11例是auto-HSCT失败患者,3年OS、PFS率分别为66%、53%;移植后100 d时Ⅰ~Ⅳ度、Ⅱ~Ⅳ度急性GVHD的累积发生率分别为60%、29%;移植后19例(55.9%)发生慢性GVHD(局限型11例,广泛型8例),发生慢性GVHD的患者中未出现疾病复发。另一项研究[12]表明AITL患者行allo-HSCT时疾病状态<PR提示较差OS及无事件生存(EFS),Ⅲ/Ⅳ度急性GVHD提示较差OS及较高的非复发死亡率,同时HLA不相合供者也提示较高非复发死亡率。在本研究中,7例患者行allo-HSCT,其中2例为auto-HSCT失败患者,3年OS率相对比上述研究较差,原因可能为本研究中移植时疾病状态<PR的患者比例较高。在本研究中移植后发生急性GVHD的患者占30%,均为Ⅰ/Ⅱ度,较上述研究急性GVHD的发生率低且严重程度轻,考虑主要跟供者类型(本研究均为同胞全合供者)、预处理方案有关。
本研究auto-HSCT组死亡原因中75%(3/4)为肿瘤复发/进展,allo-HSCT组死亡原因中33.3%(1/3)为肿瘤复发/进展,66.7%为非复发死亡,auto-HSCT和allo-HSCT两组患者生存分析无统计学差异,但auto-HSCT组患者移植前疾病状态明显优于allo-HSCT组患者,两组基线水平差异较大,生存情况无实际可比性。Mamez等[11]研究显示,allo-HSCT后5年内33例(43%)患者死亡,其中8例(18.6%)死于肿瘤进展/复发,25例(81.4%)非复发死亡患者中42.4%因感染死亡,提示AITL患者auto-HSCT后的主要问题是肿瘤复发/进展allo-HSCT具有较低的肿瘤复发率,但非复发死亡率较高。移植前过度治疗、重度GVHD、HLA不相合供者、诊断距移植时间超过1年、体能状态差可能导致allo-HSCT后非复发死亡率高、OS降低[12]–[13]。因此,如何权衡复发与移植风险,并结合患者疾病状态、经济条件等选择移植方式仍是重大难题。
目前国内外尚缺乏大宗的针对AITL患者auto-HSCT与allo-HSCT疗效的对比研究,考虑可能与AITL的发病率较低有关。本研究初步探索了auto-HSCT与allo-HSCT疗效治疗AITL的疗效,两组患者的3年OS率均超过50%,提示HSCT是治疗AITL的有效手段。本研究为回顾性研究且病例数少,两组患者基线资料差异较大,如何根据AITL患者危险度、化疗反应及疾病状态等选择移植模式、移植时机有待进一步探索。
References
- 1.Federico M, Rudiger T, Bellei M, et al. Clinicopathologic characteristics of angioimmunoblastic T-cell lymphoma: analysis of the international peripheral T-cell lymphoma project[J] J Clin Oncol. 2013;31(2):240–246. doi: 10.1200/JCO.2011.37.3647. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2.Lunning MA, Vose JM. Angioimmunoblastic T-cell lymphoma: the many-faced lymphoma[J] Blood. 2017;129(9):1095–1102. doi: 10.1182/blood-2016-09-692541. [DOI] [PubMed] [Google Scholar]
- 3.Broccoli A, Zinzani PL. Angioimmunoblastic T-cell lymphoma[J] Hematol Oncol Clin North Am. 2017;31(2):223–238. doi: 10.1016/j.hoc.2016.12.001. [DOI] [PubMed] [Google Scholar]
- 4.张 之南, 沈 悌. 血液病诊断及疗效标准[M] 3版. 北京: 科学出版社; 2007. pp. 220–227. [Google Scholar]
- 5.Ellin F, Landström J, Jerkeman M, et al. Real-world data on prognostic factors and treatment in peripheral T-cell lymphomas: a study from the Swedish Lymphoma Registry[J] Blood. 2014;124(10):1570–1577. doi: 10.1182/blood-2014-04-573089. [DOI] [PubMed] [Google Scholar]
- 6.黄 文荣, 刘 代红. 异基因造血干细胞移植治疗外周T细胞淋巴瘤现状[J] 白血病·淋巴瘤. 2018;27(5):305–307. doi: 10.3760/cma.j.issn.1009-9921.2018.05.014. [DOI] [Google Scholar]
- 7.Huang WR, Liu DH. Peripheral T-cell lymphomas: updates in allogeneic hematopoietic stem cell transplantation[J] Chin Med J (Engl) 2018;131(17):2105–2111. doi: 10.4103/0366-6999.239315. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.Kyriakou C, Canals C, Goldstone A, et al. High-dose therapy and autologous stem-cell transplantation in angioimmunoblastic lymphoma: complete remission at transplantation is the major determinant of Outcome-Lymphoma Working Party of the European Group for Blood and Marrow Transplantation[J] J Clin Oncol. 2008;26(2):218–224. doi: 10.1200/JCO.2007.12.6219. [DOI] [PubMed] [Google Scholar]
- 9.Yamasaki S, Chihara D, Kim SW, et al. Risk factors and timing of autologous stem cell transplantation for patients with peripheral T-cell lymphoma[J] Int J Hematol. 2019;109(2):175–186. doi: 10.1007/s12185-018-2560-x. [DOI] [PubMed] [Google Scholar]
- 10.Kyriakou C, Canals C, Finke J, et al. Allogeneic stem cell transplantation is able to induce long-term remissions in angioimmunoblastic T-cell lymphoma: a retrospective study from the lymphoma working party of the European group for blood and marrow transplantation[J] J Clin Oncol. 2009;27(24):3951–3958. doi: 10.1200/JCO.2008.20.4628. [DOI] [PubMed] [Google Scholar]
- 11.Mamez AC, Souchet L, Roos-Weil D, et al. Graft-versus-T-cell lymphoma effect: a sustained CR after tapering immunosuppressive drugs in a patient with angioimmunoblastic T-cell lymphoma in relapse after allogeneic transplantation[J] Bone Marrow Transplant. 2015;50(2):304–306. doi: 10.1038/bmt.2014.243. [DOI] [PubMed] [Google Scholar]
- 12.Le Gouill S, Milpied N, Buzyn A, et al. Graft-versus-lymphoma effect for aggressive T-cell lymphomas in adults: a study by the Société Francaise de Greffe de Moëlle et de Thérapie Cellulaire[J] J Clin Oncol. 2008;26(14):2264–2271. doi: 10.1200/JCO.2007.14.1366. [DOI] [PubMed] [Google Scholar]
- 13.Bachanova V, Burns LJ, Ahn KW, et al. Impact of pretransplantation 18F-fluorodeoxy glucose-positron emission tomography status on outcomes after allogeneic hematopoietic cell transplantation for non-Hodgkin lymphoma[J] Biol Blood Marrow Transplant. 2015;21(9):1605–1611. doi: 10.1016/j.bbmt.2015.05.007. [DOI] [PMC free article] [PubMed] [Google Scholar]


