急性髓系白血病(AML)是一组临床及生物学特性均具有异质性的造血系统恶性克隆性病变。AML在儿童白血病中占15%~20%[1]。近年来随着联合化疗方案、靶向治疗、造血干细胞移植及支持治疗的进展,儿童AML的诱导缓解率已达80%~90%,5年无事件生存率达50%~60%[2]。白细胞减少合并骨髓增生低下、重症感染或一疗程方案诱导未达完全缓解(CR)的患者对高强度诱导化疗的耐受性较差,Yamada等[3]提出的不良反应较小的预激方案为此类患者提供了新的治疗选择。国内曾有学者应用CAG预激方案(阿克拉霉素+阿糖胞苷+G-CSF)治疗老年AML,一疗程CR率为46.67%[4]。以往应用CAG预激方案治疗儿童AML相关报道的病例数均较少[5]–[6]。本研究中,我们对2008年1月至2017年7月期间以CAG方案预激方案诱导治疗的26例儿童AML患者(不含急性早幼粒细胞白血病)进行回顾性分析。
病例与方法
1.病例:2008年1月至2017年7月期间于我院儿童血液病诊疗中心接受CAG预激方案诱导缓解治疗的26例儿童AML患者(不含急性早幼粒细胞白血病)纳入本研究。入组患者至少满足以下1条标准:①WBC<4×109/L且骨髓增生程度为活跃−及以下;②合并重症感染(WHO分级中的Ⅳ级感染);③其他方案诱导未获CR。诊断和分型标准参照WHO2016急性白血病分型标准[7]。
2.CAG预激方案及疗效评价:阿克拉霉素6 mg·m−2·d−1,第1~8天;阿糖胞苷10 mg/m2每12 h 1次,第1~14天皮下注射;G-CSF 200 µg·m−2·d−1(最大剂量300 µg/d),第1~14天皮下注射(WBC≥20×109/L停用)。疗效评价参照文献[8],分为CR、部分缓解(PR)和未缓解(NR)。
3.随访:采用电话随访和查阅门诊/住院病历方式进行随访。随访截止日期为2018年5月31日。中位随访时间为18.5(2.0~66.0)个月。总生存(OS)时间:确诊日期至死亡或随访截止的时间。无病生存(DFS)时间:确诊日期至复发或随访截止日的时间。
4.统计学处理:采用SPSS17.0软件进行数据分析。生存时间分析用Kaplan-Meier法。以P<0.05为差异有统计学意义。
结果
1.一般资料:26例患者中,男20例,女6例,中位年龄5.5(0.8~15.0)岁。FAB分型:M0 2例,M1 1例,M2 5例,M5 11例,M6 2例,M7 5例。首次诱导治疗的初诊患者14例(初诊组),其他方案未获CR患者12例(再诱导组)。25例患者有染色体核型分析结果:正常核型者9例,伴t(8;21)(q22;q22)染色体异常者4例,−7者4例,+21者2例,t(1;8)(p33;q24)者1例,t(6;9)(p23;q34)者1例,t(13;17)(q22;q21)者1例,+?11者1例,复杂核型者1例。AML1/ETO突变4例(均不伴C-KIT突变),FLT3-ITD 3例,FLT3-TKD 1例,MLL 1例,CEBPA双突变1例,IDH2 1例。2例患者伴髓外浸润。CAG方案化疗前合并重症感染9例。化疗前基线血常规:WBC 8.17(0.74~148.75)×109/L,HGB 86.5(35.0~127.0)g/L,PLT 66(1~516)×109/L。
2.治疗反应:全部26例患者均完成CAG方案化疗,10例(38.46%)获得CR,6例(23.08%)获得PR,总有效率(ORR)为61.54%(16/26)。初诊组14例患者中,6例(42.86%)获得CR,4例(28.57%)获得PR,ORR为71.43%(10/14);再诱导组12例患者中,4例获得CR。4例伴t(8;21)(q22;q22)患者均获得CR。
2.不良反应:所有患者化疗后均发生Ⅲ/Ⅳ级骨髓抑制,中位持续时间为10(5~30)d;26例患者均发生Ⅰ/Ⅱ级消化道反应(恶心、呕吐、腹胀、腹泻、腹痛、便秘等)。18例患者(69.23%)发生Ⅲ/Ⅳ级感染:无明确部位的粒细胞缺乏期发热6例,肺感染6例,肺感染合并肠道感染3例,肺感染合并化脓性扁桃体炎1例,肺感染合并皮肤软组织感染1例,口腔溃疡感染合并血流感染1例。1例患者死于肺感染合并脑、脾梗死,其余17例患者抗感染治疗均有效;未发生严重心、肺、肝、肾功能受损及出血事件。
3.生存分析:初诊组1例(3.8%)患者发生早期死亡(骨髓抑制期死于发生肺感染、脑梗死、脾梗死)。3例患者放弃治疗,5例患者桥接造血干细胞移植,其余17例患者均接受至少1个疗程序贯化疗(伊达比星+阿糖胞苷+依托泊苷/伊达比星+阿糖胞苷/柔红霉素+阿糖胞苷+高三尖杉酯碱)。
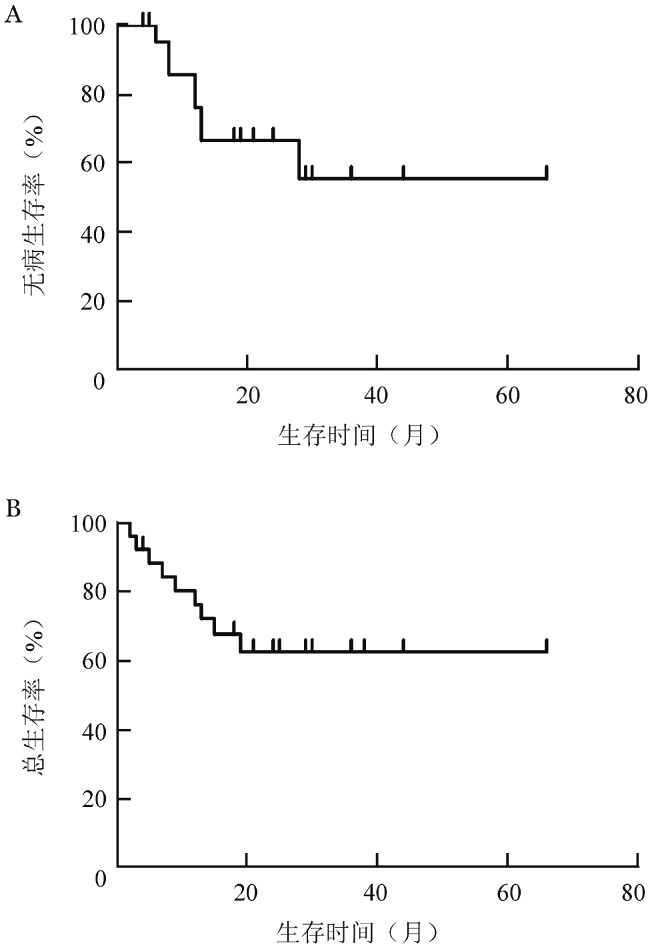
10例获CR患者中4例复发,复发时间分别为确诊后第6、8、12、28个月。1、2、3年DFS率分别为(66.12±10.43)%、(66.12±10.43)%、(54.10±13.82)%(图1A),OS率分别为(71.89±9.05)%、(62.40±10.05)%、(62.40±10.05)%(图1B)。初诊组1、2、3年DFS率分别为(83.33±10.76)%、(83.33±10.76)%、(59.52±21.54)%,OS率分别为(78.57±10.97)%、(78.57±10.97)%、(78.57±10.97)%。再诱导组1、2、3年DFS率分别为(41.88±16.94)%、(41.88±16.94)%、(41.88±16.94)%,OS分率别为(62.84±14.82)%、(41.89±15.61)%、(41.89±15.61)%。
图1. 26例儿童急性髓系白血病患者CAG预激方案诱导治疗后无病生存(A)及总生存(B)曲线.
讨论
儿童AML是一种少见的异质性疾病,精确诊断后根据细胞遗传学、分子生物学及诱导治疗反应进行危险度评估,然后对不同危险组别分层进行针对性治疗可提高长期无病生存率。目前,儿童AML(不含急性早幼粒细胞白血病)的主要化疗方案是蒽环类联合中、大剂量阿糖胞苷;作为诱导治疗的经典方案,“3+7”DA方案(柔红霉素+阿糖胞苷)的总缓解率为78%[9]。国内大多采用AML-XH-99方案(柔红霉素+阿糖胞苷+依托泊苷/高三尖杉酯碱+柔红霉素+阿糖胞苷/高三尖杉酯碱+阿糖胞苷+依托泊苷/去甲氧柔红霉素+阿糖胞苷等)治疗儿童AML,CR率为76.7%~84.1%,早期死亡率约为5%[10]–[11]。2009年日本协作组发布的AML99方案[12]通过增加诱导治疗强度,使CR率提高到90%以上,但在初次治疗时白细胞减少合并骨髓增生减低、发生重症感染或一疗程未获CR等情况下,患者对化疗的耐受性不佳,借鉴成人难治复发患者的预激方案诱导化疗可改善使这些患儿的预后。
本组26例儿童AML(不含急性早幼粒细胞白血病)以CAG方案诱导治疗,1疗程ORR为61.54%(16/26),CR率为38.46%(10/26),其中初诊组的ORR、CR率分别为71.43%、42.86%。李双月等[6]应用CAG方案治疗8例儿童AML,3例获CR。本中心应用CAMS-2005方案(柔红霉素+阿糖胞苷+高三尖杉酯碱)治疗82例儿童AML患者,一疗程CR率为64.6%[13]。本组26例患者中,仅1例患者(3.8%)因肺感染、脑梗死、脾梗死而早期死亡,其余患者均能耐受化疗相关不良反应,未见严重消化道反应、脏器功能损伤及出血事件。Yamada等[3]在1995年首次应用CAG预激方案治疗18例成人复发AML患者,1~2个疗程CR率为83%(15/18)。此后陆续报道CAG方案治疗难治复发或初诊老年AML的CR率为49%~58%[14]–[16]。一项纳入1 754例患者的荟萃分析显示[17],HAG方案(高三尖杉酯碱+阿糖胞苷+G-CSF)治疗AML的CR率为24%~78%,初治患者CR率显著高于复发难治性患者(62%对50%,P=0.001),HAG组与CAG组CR率差异无统计学意义(P=0.073),HAG/CAG方案早期死亡率及Ⅳ度骨髓抑制发生率显著低于传统“3+7”DA方案。
预激方案的相关机制[18]如下:①G-CSF通过募集原幼阶段的肿瘤细胞由G0期进入细胞增殖周期,从而使减低剂量的阿糖胞苷、高三尖杉酯碱能充分发挥细胞毒作用于S期细胞;②G-CSF还可以通过促进粒细胞由骨髓向外周血转移来增强阿克拉霉素、高三尖杉酯碱、阿糖胞苷抗肿瘤活性;③G-CSF可通过上调Gfi-1表达而减少CXCL12/CXCR4表达,抑制肿瘤细胞归巢。
本组儿童AML患者3年DFS率为(54.10±13.82)%,OS率为(62.40±10.05)%,提示CAG预激方案诱导治疗儿童AML具有较满意的疗效,可为危重患儿争取接受造血干细胞移植的机会,其长期疗效有待于进一步观察。
Funding Statement
基金项目:国家自然科学基金(81470339)
References
- 1.Rubnitz JE. Current management of childhood acute myeloid leukemia[J] Paediatr Drugs. 2017;19(1):1–10. doi: 10.1007/s40272-016-0200-6. [DOI] [PubMed] [Google Scholar]
- 2.Pui CH, Carroll WL, Meshinchi S, et al. Biology, risk stratification, and therapy of pediatric acute leukemias: an update[J] J Clin Oncol. 2011;29(5):551–565. doi: 10.1200/JCO.2010.30.7405. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.Yamada K, Furusawa S, Saito K, et al. Concurrent use of granulocyte colony-stimulating factor with low-dose cytosine arabinoside and aclarubicin for previously treated acute myelogenous leukemia: a pilot study[J] Leukemia. 1995;9(1):10–14. [PubMed] [Google Scholar]
- 4.吴 小津, 吴 德沛, 孙 爱宁, et al. 预激方案诱导治疗老年性急性髓系白血病的疗效观察[J] 中华内科杂志. 2004;43(12):936–937. doi: 10.3760/j.issn:0578-1426.2004.12.017. [DOI] [Google Scholar]
- 5.宋 华, 石 淑文, 徐 卫群, et al. CAG方案在儿童急性髓系白血病中的应用[J] 中华血液学杂志. 2004;25(6):383–384. doi: 10.3760/j:issn:0253-2727.2004.06.021. [DOI] [Google Scholar]
- 6.李 双月, 裴 仁治, 张 丕胜, et al. G-HAA方案治疗难治、复发性急性髓系白血病的疗效观察[J] 浙江医学. 2013;35(2):105–107. [Google Scholar]
- 7.张 瑞东, 王 林娅, 郑 胡镛. 世界卫生组织2016急性白血病分型解读[J] 中华儿科杂志. 2017;55(1):15–18. doi: 10.3760/cma.j.issn.0578-1310.2017.01.003. [DOI] [Google Scholar]
- 8.张 之南, 沈 悌. 血液病诊断及疗效标准[M] 3版. 北京: 科学出版社; 2007. p. 106. [Google Scholar]
- 9.Buckley JD, Lampkin BC, Nesbit ME, et al. Remission induction in children with acute non-lymphocytic leukemia using cytosine arabinoside and doxorubicin or daunorubicin: a report from the Childrens Cancer Study Group[J] Med Pediatr Oncol. 1989;17(5):382–390. doi: 10.1002/mpo.2950170507. [DOI] [PubMed] [Google Scholar]
- 10.李 娟, 顾 龙君, 薛 惠良, et al. AML-XH-99方案治疗儿童急性髓系白血病82例疗效分析[J] 中华血液学杂志. 2004;25(6):351–354. doi: 10.3760/j:issn:0253-2727.2004.06.008. [DOI] [PubMed] [Google Scholar]
- 11.邹 尧, 王 华, 陈 晓娟, et al. 141例儿童急性髓系白血病的疗效及预后相关因素分析[J] 中华血液学杂志. 2006;27(9):621–625. doi: 10.3760/j:issn:0253-2727.2006.09.011. [DOI] [Google Scholar]
- 12.Tsukimoto I, Tawa A, Horibe K, et al. Risk-stratified therapy and the intensive use of cytarabine improves the outcome in childhood acute myeloid leukemia: the AML99 trial from the Japanese Childhood AML Cooperative Study Group[J] J Clin Oncol. 2009;27(24):4007–4013. doi: 10.1200/JCO.2008.18.7948. [DOI] [PubMed] [Google Scholar]
- 13.阮 敏, 戚 本泉, 刘 芳, et al. 儿童急性髓系白血病82例长期随访研究[J] 中华儿科杂志. 2018;56(10):730–734. doi: 10.3760/cma.j.issn.0578-1310.2018.10.003. [DOI] [Google Scholar]
- 14.Qian SX, Li JY, Tian T, et al. Effect of low-dose cytarabine and aclarubicin in combination with granulocyte colony-stimulating factor priming (CAG regimen) on the outcome of elderly patients with acute myeloid leukemia[J] Leuk Res. 2007;31(10):1383–1388. doi: 10.1016/j.leukres.2007.02.009. [DOI] [PubMed] [Google Scholar]
- 15.Suzushima H, Wada N, Yamasaki H, et al. Low-dose cytarabine and aclarubicin in combination with granulocyte colony-stimulating factor for elderly patients with previously untreated acute myeloid leukemia[J] Leuk Res. 2010;34(5):610–614. doi: 10.1016/j.leukres.2009.08.010. [DOI] [PubMed] [Google Scholar]
- 16.Fukushima T, Kawabata H, Sawaki T, et al. Low-dose cytarabine plus aclarubicin for patients with previously untreated acute myeloid leukemia or high-risk myelodysplastic syndrome ineligible for standard-dose cytarabine plus anthracycline[J] Anticancer Res. 2012;32(4):1347–1353. [PubMed] [Google Scholar]
- 17.Xie M, Jiang Q, Li L, et al. HAG (homoharringtonine, cytarabine, G-CSF) regimen for the treatment of acute myeloid leukemia and myelodysplastic syndrome: a meta-analysis with 2,314 participants[J] PLoS One. 2016;11(10):e0164238. doi: 10.1371/journal.pone.0164238. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18.Liu L, Zhang Y, Jin Z, et al. Increasing the dose of aclarubicin in low-dose cytarabine and aclarubicin in combination with granulocyte colony-stimulating factor (CAG regimen) can safely and effectively treat relapsed or refractory acute myeloid leukemia[J] Int J Hematol. 2014;99(5):603–608. doi: 10.1007/s12185-014-1528-8. [DOI] [PubMed] [Google Scholar]