Abstract
目的
了解CD19异构体对双特异性T细胞衔接器(BiTE)治疗的反应,进一步探讨BiTE治疗无效的相关机制及相应的解决方案。
方法
通过半定量RT-PCR的方法检测1例CD19+急性B淋巴细胞白血病(B-ALL)患者BiTE治疗前后CD19异构体mRNA表达量的情况,Sanger测序对相应的异构体序列进行分析,流式细胞术及转录组测序分析治疗前后谱系特异性分子的表达情况。
结果
患者初诊时即存在2号外显子缺失型CD19异构体的表达,BiTE治疗后患者未缓解,流式细胞术检测发现CD19抗原表达转阴,但2号外显子缺失型CD19异构体的表达量并无增加,且细胞表型及转录组测序均未见谱系转化的发生。外显子可变剪接引起的缺失型CD19异构体的表达及谱系转化并非该患者CD19抗原表位缺失的机制。该例患者在疾病进展退出BiTE治疗组之后,采用中国医学科学院血液病医院自主研发的CD22及CD19 CAR-T序贯治疗后完全缓解。
结论
该例患者CD19抗原-缺失导致BiTE治疗无效,其缺失并非由可变剪接或谱系转换所致,更换为CD22、CD19双靶点CAR-T细胞治疗有效。
Keywords: 白血病,淋巴细胞,急性, 双特异性T细胞衔接器, 表位缺失, 异构体, CD19
Abstract
Objective
To analyze the influence of CD19 isoforms to the efficacy of CD19/CD3 Bispecific T-cell Engager (BiTE) antibody, and explore the resistance mechanism of BiTE immunotherapy.
Methods
Semi-quantitative RT-PCR (qRT-PCR) was used to detect the expression of CD19 mRNA isoforms before and after BiTE treatment in a patient with CD19+ B cell acute lymphoblastic leukemia (ALL). CD19 isoforms were analyzed by Sanger sequencing. Flow cytometry and transcriptome sequencing were performed to analyze the expression of cell lineage specific molecules before and after BiTE treatment.
Results
The expression of CD19 isoform with exon 2 deletion was identified at diagnosis. After relapsed and treatment of BiTE antibody, the patient did not achieve remission and CD19 antigen on leukemic cells turned negative detected by flow cytometry after BiTE treatment. However the expression ratio of CD19 isoform with exon 2 deletion was not increased. Flow cytometry phenotype and transcriptome sequencing confirmed that no linage switching developed, which suggested the expression of CD19 isoform caused by exon alternative splicing and lineage switching was not related to CD19 epitope loss in this patient. This patient achieved complete remission by sequential administration of self-developed CD22 CAR-T and CD19 CAR-T after disease progression.
Conclusion
Targeting or combining an alternative antigen specific CAR-T may be a promising treatment option after losing CD19 expression in relapsed ALL.
Keywords: Leukemia, lymphoblastic, acute; Bispecific T-cell engagers; Epitope-loss; Isoform; CD19
CD19是一个B细胞系的特异性分子,是B细胞来源的急性淋巴细胞白血病(B-ALL)治疗的理想靶点,目前靶向CD19最有效的免疫治疗方法包括嵌合抗原受体T细胞(CAR-T)和双特异性T细胞衔接器(Bispecific T-cell engagers,BiTE)——一种双特异性的抗CD19/CD3抗体,二者均在ALL治疗中取得良好的效果[1]–[2]。但在CAR-T或BiTE治疗的患者中,CD19阴性复发分别见于10%~20%的患者。
CD19基因突变、可变剪接、CD19截短型蛋白的表达是导致CD19 CAR-T治疗抗性的重要原因[3]–[4],此外,髓系谱系变化也可能是导致混合谱系白血病患者CAR-T[5]和blinatumomab[6]治疗失败的一个重要原因。以上CD19阴性免疫逃逸的机制对靶向CD19的免疫治疗方案的优化至关重要。
1例CD19+ B-ALL患者经BiTE治疗未达缓解,且流式细胞检测发现该例患者CD19抗原表达转阴。该患者在疾病进展退出BiTE治疗组之后,采用我们自主研发的CD22 CAR-T及CD19 CAR-T序贯治疗后获得完全缓解,现报道如下并复习相关文献。
病例资料
患者,男,26岁,2019年1月7日首次入院,病初血常规:WBC 137.7×109/L,HGB 64 g/L,PLT 34×109/L;骨髓象:幼稚淋巴细胞占0.970;急性白血病免疫分型:异常细胞占有核细胞的87%,强表达CD34、CD10,表达HLA-DR、CD19、TDT、cCD79a、CD38、CD4,部分表达CD123、CD20,弱表达CD22、CD33;白血病43种融合基因筛查阴性。诊断为Common B-ALL,予VDCLP方案(长春地辛+柔红霉素+环磷酰胺+左旋门冬酰胺酶+糖皮质激素)诱导化疗后病情平稳出院。后骨髓形态提示幼稚淋巴细胞占60%,考虑未缓解,予CAM(环磷酰胺+阿糖胞苷+巯嘌呤)+VP(长春地辛+泼尼松)再诱导化疗,骨髓形态提示原始淋巴细胞占76%,流式MRD-B-ALL:异常B淋巴母细胞占有核细胞的60.51%。染色体检查:核型描述:46,XY,del(9)(p13)[12]/46, XY[8]。经伦理委员会批准、患者知情同意并签署知情同意书,患者入组一项旨在评价BiTE抗体用于中国成人复发/难治B-ALL受试者有效性及安全性的Ⅲ期临床研究(临床试验编号NCT03476239),BiTE治疗前流式细胞术:异常细胞占有核细胞的60.51%,表达CD19。BiTE治疗第11天,患者白细胞升高至16.38×109/L,外周血幼稚细胞比例增高至62%,复查骨髓幼稚细胞比例增高,流式细胞术:异常细胞占有核细胞的80.43%,表达cCD79a、CD10,部分表达CD34,不表达CD19,弱表达CD22、CD20、CD38、CD45,为异常B淋巴母细胞;提示患者经BiTE治疗,未获得完全缓解,CD19抗原表达转阴。29种Ph样ALL相关融合基因检测:IKZF1阳性,BCR-Jak2阳性,修正诊断为Ph样ALL,临床试验退组。随后进行CD22及CD19序贯治疗(临床试验编号ChiCTR1900025419),于6月6日至6月9日给予FC方案预治疗,6月11日输注CD22 CAR-T,6月12日输注CD19 CAR-T,CAR-T细胞按照1×106/kg输注,回输后21 d血象恢复,行骨髓穿刺示形态学缓解。
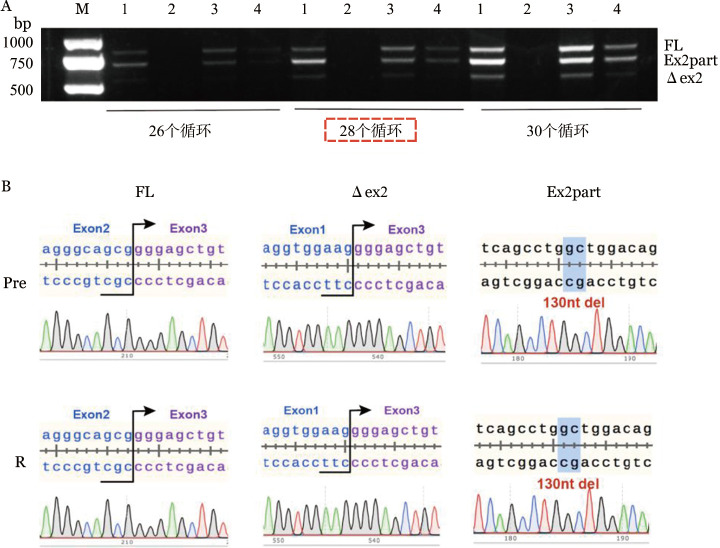
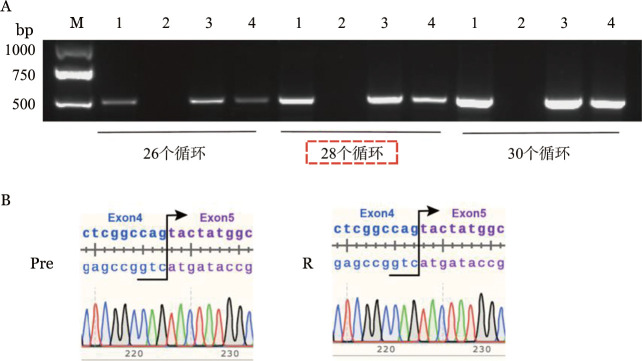
为了验证该患者治疗前是否存在2号外显子缺失型CD19异构体,半定量RT-PCR扩增患者治疗前后CD19基因的1~5号外显子。结果显示均能扩增出2号外显子缺失型及部分缺失型异构体,扩增条带长度分别为800、533、670 bp(图1A),分别对应CD19的胞外区全长、2号外显子部分缺失及缺失型三种异构体类型;Sanger测序对三个条带纯化产物的序列进行了进一步验证,显示三条带分别对应CD19 1~5号外显子全长,1~3号外显子跳跃及2号外显子存在130 bp的缺失(图1B),与文献[3]报道一致。已知CD19基因5~6号外显子缺失影响CD19的跨膜区及胞内区,通过PCR扩增该患者治疗前后4~8号外显子,仅扩增出单一的490 bp条带,未出现缺失331 bp的5~6号外显子缺失型异构体(图2A),Sanger测序验证纯化产物,示该490 bp的条带为4~8号外显子全长(图2B),提示该患者治疗前并不存在5~6号外显子缺失型异构体。
图1. 半定量RT-PCR及Sanger测序检测患者治疗前后骨髓标本CD19 1~5号外显子结果.
A:不同循环数半定量RT-PCR结果,1:Nalm6(阳性对照);2:MV4-11(阴性对照);3:Pre(BiTE治疗前样本);4:R(BiTE治疗无效后样本);B:Sanger测序结果,FL:1~5号外显子全长条带;∆ex2:2号外显子缺失型条带;Ex2part:2号外显子部分缺失型条带
图2. 半定量RT-PCR(A)及Sanger测序(B)检测患者治疗前后骨髓标本CD19 4~8号外显子结果.
1:Nalm6(阳性对照);2:MV4-11(阴性对照);3:Pre(BiTE治疗前样本);4:R(BiTE治疗无效后样本)
为进一步探索CD19基因2号外显子缺失型异构体表达量的变化,我们进行了RT-PCR了解患者治疗前后骨髓标本CD19 mRNA的水平,采用跨1号及3号外显子的特异性引物扩增2号外显子缺失型CD19 mRNA,并设计了针对不同外显子区的引物(表1)对CD19 mRNA的各个外显子区进行扩增。结果显示,CD19 mRNA在针对不同外显子的不同引物扩增下,下降至27.4%~50.1%(图3A)。转录组测序也显示,编码蛋白的两种CD19转录本水平在治疗后有表达量也下降至57%~90%(图3B),与上述结果一致。此外,根据文献报道采用3~4号外显子作为内参对RT-PCR的结果进行分析,结果也显示并未出现2号外显子缺失型CD19 mRNA的累积。同时,转录组测序可变剪接部分的差异基因中也并未筛选到CD19。因此,2号外显子缺失型CD19异构体的表达在治疗后并未出现累积。
表1. RT-PCR检测CD19 mRNA不同外显子区表达引物序列.
| 区域 | 引物序列(5′-3′) |
| 1~2号外显子 | 上游引物:GGAGAGTCTGACCACCATGC;下游引物:ACTGCAGCACAGCGTTATCT |
| 3~4号外显子 | 上游引物:GAGCCCCAAGCTGTATGTGT;下游引物:GGACACAGAGTCAGGGGGTA |
| 4~5号外显子 | 上游引物:AAGGGGCCTAAGTCATTGCT;下游引物:CAGCAGCCAGTGCCATAGTA |
| 6/7~8号外显子 | 上游引物:CCCCACCAGGAGATTCTTCA;下游引物:TGCTCGGGTTTCCATAAGAC |
| Junct1/3(∆ex2) | 上游引物:GCCTCCTCTTCTTCCTCCTCTT;下游引物:CCGGAACAGCTCCCCTTCCACCTTC |
图3. 患者治疗前后骨髓标本中CD19 mRNA不同外显子区(A)及CD19不同转录本(B)的表达情况.
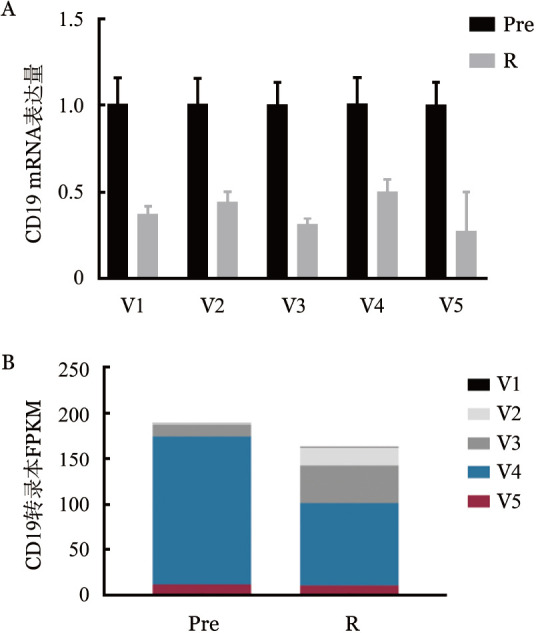
V1~V5代表5种不同的转录本,对应ensembl数据库中不同转录本的ID分别为:ENST00000567368、ENST00000566890、ENST00000565089、ENST00000324662、ENST00000538922,V1~V3为3种内含子滞留型转录本,V4、V5为两种编码外显子的转录本;Pre:BiTE治疗前;R:BiTE治疗无效后
谱系转换是抗原转阴的一个重要原因,为进一步了解该患者BiTE治疗失败是否与髓系谱系转换有关,我们首先查看了患者治疗前后的流式免疫表型检测结果,患者治疗前后的流式免疫表型检测结果,并未见到髓系相关分子CD33、CD123、CD117的表达。转录组测序检测谱系特异性分子CD19、CD22、CD20、HLA-DRA、CD10、CD123 CD33及CD117等治疗前后的表达差异,BiTE治疗后CD19转录组水平表达降低,且未见髓系特异性分子CD33、CD123、CD117表达的明显升高(图4),与流式免疫表型结果一致,排除谱系转换的可能。
图4. 患者骨髓细胞谱系特异性分子治疗前后转录组表达差异.
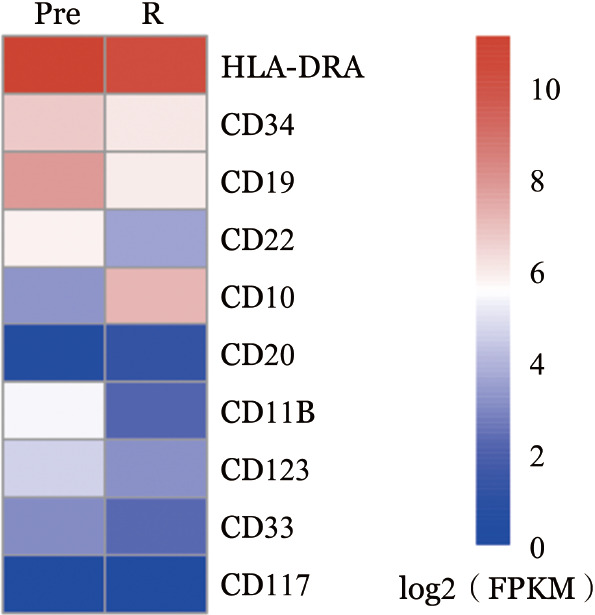
Pre:BiTE治疗前;R:BiTE治疗无效后
讨论及文献复习
靶向CD19的免疫治疗中,BiTE是一种双特异性抗体,能够结合肿瘤细胞表面的靶抗原,且能够同时结合患者自身的T细胞,将这两种细胞拉近,使患者自身的免疫系统能够杀死肿瘤细胞[8]。其他类型的免疫治疗法复发机制常见于MHC限制性、共刺激分子及TCR识别[9],而BiTE治疗无效的机制包括髓外逃逸、靶抗原缺失及内源性免疫反应的不足。
与BiTE治疗相似,CAR-T采用患者自体的T细胞表达与肿瘤抗原结合的嵌合抗原受体,CD19 CAR-T临床应用最为广泛,且与blinatumomab存在很多相似性,如作用机制、副作用及复发机制等特点。在blinatumomab难治的患者中,CD19靶抗原缺失发生率为10%~20%[10]–[11],抗原缺失导致疾病难治的主要机制有两个方面,且大部分数据均借鉴于CAR-T在难治/复发B-ALL中的经验。
CD19阴性免疫逃逸主要存在两个方面的原因。
其一,是恶性B细胞特异性丧失CD19靶抗原:Sotillo等[3]证明了抗原表位缺失可能由CD19基因的可变剪接导致,且可变剪接导致的2号外显子缺失造成了CD19截短型蛋白的表达,该截短型蛋白只有10%的出膜率,且直接影CD19 CAR-T(CTL109)的识别,导致治疗失败。本研究中BiTE治疗失败的患者发生了CD19抗原的缺失,但也未见可变剪接的CD19异构体的累积。此外,转录组测序数据显示,该患者在3号外显子的位置存在单核苷酸变异(SNV)c.520C>G,因此该患者可能是由于基因突变而引起CD19转阴,导致治疗失败。Orlando等[12]也阐明了基因突变是导致CAR-T免疫治疗后CD19抗原表位缺失的主要原因,且并未发现Sotillo等提出的可变剪接的证据。此外,还有一项研究阐述了CD19阴性复发的另一机制,即blinatumomab难治继发于异常的抗原转运,并证实CD81阻止了CD19在高尔基复合体内的转运,并导致了白血病细胞异常的糖基化[13]。
其二,谱系转换也是CD19阴性免疫逃逸的机制:谱系转换即淋系肿瘤细胞转分化为不表达CD19的髓系肿瘤细胞,本例患者也未见谱系转换的发生。该现象在混合谱系白血病(MLL)重排的患者中最广为人知,在化疗的选择性压力下发生从淋系到髓系的谱系转换[5],而在blinatumomab治疗后,无MLL重排的白血病患者也有谱系转换的发生[14]。
Sotillo等[3]的研究提示,CD19 CAR-T(CTL109)的识别的关键表位在CD19抗原的2号外显子区域,因此识别表位在CD19胞外区其他外显子的CAR-T或许是一种有效的治疗方案。本研究我们发现,该例BiTE治疗失败患者发生的CD19抗原的缺失,并非由可变剪接及谱系转换所致,也未见髓外免疫逃逸的发生,因此,针对此类抗原缺失,靶向可变剪接导致的CD19异构体的其他抗原识别表位的治疗可能无效。该例患者在疾病进展退出BiTE治疗组之后,针对靶标抗原的丢失,采用我们自主研发的CD22 CAR-T及CD19 CAR-T序贯治疗后完全缓解。因此,在CD19靶抗原缺失时更换其他治疗靶点或进行双靶点治疗是一种有效的治疗方案。目前已有其他研究探索了同时靶向CD19和CD22两个靶点的CAR-T免疫治疗[15]。此外,为了增强患者对BiTE的T细胞反应性,有临床试验(NCT02879695)正在探索添加免疫检查点抑制剂是否可以增强blinatumab的疗效。BiTE是治疗B系来源的血液恶性肿瘤的有效疗法,需要更多的研究来阐明这类免疫治疗的无效及复发机制,并探索其他有效的治疗方案。
Funding Statement
基金项目:国家重点研发计划(2019YFA0110204);国家自然科学基金重点项目(81830005);中国医学科学院医学与健康科技创新工程项目(2016-I2M-1-007)
Fund program: National Key R&D Program of China(2019YFA0110204); National Natural Science Foundation of China(81830005); CAMS Initiative Fund for Medical Sciences(2016-I2M-1-007)
References
- 1.Tasian SK, Gardner RA. CD19-redirected chimeric antigen receptor-modified T cells: a promising immunotherapy for children and adults with B-cell acute lymphoblastic leukemia (ALL)[J] Ther Adv Hematol. 2015;6(5):228–241. doi: 10.1177/2040620715588916. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2.Przepiorka D, Ko CW, Deisseroth A, et al. FDA Approval: Blinatumomab[J] Clin Cancer Res. 2015;21(18):4035–4039. doi: 10.1158/1078-0432.CCR-15-0612. [DOI] [PubMed] [Google Scholar]
- 3.Sotillo E, Barrett DM, Black KL, et al. Convergence of Acquired Mutations and Alternative Splicing of CD19 Enables Resistance to CART-19 Immunotherapy[J] Cancer Discov. 2015;5(12):1282–1295. doi: 10.1158/2159-8290.CD-15-1020. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.Asnani M, Hayer KE, Naqvi AS, et al. Retention of CD19 intron 2 contributes to CART-19 resistance in leukemias with subclonal frameshift mutations in CD19[J] Leukemia. 2019 doi: 10.1038/s41375-019-0580-z. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Gardner R, Wu D, Cherian S, et al. Acquisition of a CD19-negative myeloid phenotype allows immune escape of MLL-rearranged B-ALL from CD19 CAR-T-cell therapy[J] Blood. 2016;127(20):2406–2410. doi: 10.1182/blood-2015-08-665547. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Duffner U, Abdel-Mageed A, Younge J, et al. The possible perils of targeted therapy[J] Leukemia. 2016;30(7):1619–1621. doi: 10.1038/leu.2016.18. [DOI] [PubMed] [Google Scholar]
- 7.Wood BL. Principles of minimal residual disease detection for hematopoietic neoplasms by flow cytometry[J] Cytometry B Clin Cytom. 2016;90(1):47–53. doi: 10.1002/cyto.b.21239. [DOI] [PubMed] [Google Scholar]
- 8.Löffler A, Kufer P, Lutterbüse R, et al. A recombinant bispecific single-chain antibody, CD19 x CD3, induces rapid and high lymphoma-directed cytotoxicity by unstimulated T lymphocytes[J] Blood. 2000;95(6):2098–2103. [PubMed] [Google Scholar]
- 9.Goebeler ME, Bargou R. Blinatumomab: a CD19/CD3 bispecific T cell engager (BiTE) with unique anti-tumor efficacy[J] Leuk Lymphoma. 2016;57(5):1021–1032. doi: 10.3109/10428194.2016.1161185. [DOI] [PubMed] [Google Scholar]
- 10.Jabbour E, Düll J, Yilmaz M, et al. Outcome of patients with relapsed/refractory acute lymphoblastic leukemia after blinatumomab failure: No change in the level of CD19 expression[J] Am J Hematol. 2018;93(3):371–374. doi: 10.1002/ajh.24987. [DOI] [PubMed] [Google Scholar]
- 11.Mejstríková E, Hrusak O, Borowitz MJ, et al. CD19-negative relapse of pediatric B-cell precursor acute lymphoblastic leukemia following blinatumomab treatment[J] Blood Cancer J. 2017;7(12):659. doi: 10.1038/s41408-017-0023-x. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.Orlando EJ, Han X, Tribouley C, et al. Genetic mechanisms of target antigen loss in CAR19 therapy of acute lymphoblastic leukemia[J] Nat Med. 2018;24(10):1504–1506. doi: 10.1038/s41591-018-0146-z. [DOI] [PubMed] [Google Scholar]
- 13.Braig F, Brandt A, Goebeler M, et al. Resistance to anti-CD19/CD3 BiTE in acute lymphoblastic leukemia may be mediated by disrupted CD19 membrane trafficking[J] Blood. 2017;129(1):100–104. doi: 10.1182/blood-2016-05-718395. [DOI] [PubMed] [Google Scholar]
- 14.Zoghbi A, Zur Stadt U, Winkler B, et al. Lineage switch under blinatumomab treatment of relapsed common acute lymphoblastic leukemia without MLL rearrangement[J] Pediatr Blood Cancer. 2017;64(11) doi: 10.1002/pbc.26594. [DOI] [PubMed] [Google Scholar]
- 15.Qin H, Ramakrishna S, Nguyen S, et al. Preclinical Development of Bivalent Chimeric Antigen Receptors Targeting Both CD19 and CD22[J] Mol Ther Oncolytics. 2018;11:127–137. doi: 10.1016/j.omto.2018.10.006. [DOI] [PMC free article] [PubMed] [Google Scholar]