Abstract
目的
评价巩固化疗联合异基因NK细胞输注治疗低中危急性髓系白血病(AML)的疗效。
方法
回顾性分析2014年1月至2019年6月北京大学人民医院诊治的23例经化疗达血液学完全缓解(CR),且巩固治疗3个疗程后,应用巩固化疗联合异基因NK细胞回输治疗的低中危AML患者,对照组为1∶2配对的46例AML患者,配对因素为患者的性别、年龄、诊断、预后危险分层、诱导CR及NK细胞输注前巩固化疗的疗程数。比较两组微小残留病(MRD)转阴率、复发率、无白血病生存(LFS)及总生存(OS)。
结果
治疗组23例低中危AML患者于巩固化疗第4~7个疗程共输注NK细胞45次,中位NK细胞输注数量7.5(6.6~8.6)×109/L,NK细胞中位存活率95.4%(93.9%~96.9%),中位扩增倍数141.1(86.1~171.1),其中中位CD3−CD56+细胞数5.0(1.4~6.4)×109/L,占回输细胞总数的76.8%(30.8%~82.9%);CD3+CD56+细胞数0.55(0.24~1.74)×109/L,占回输细胞总数的8.8%(4.9%~20.9%)。NK细胞输注前,治疗组MRD阳性患者为9例(39.1%),对照组MRD阳性患者为19例(41.3%),两组间差异无统计学意义(χ2=0.030,P=0.862)。治疗组输注NK细胞前后疗效评估与同期对照组对比,MRD阴性转阳性比例两组差异无统计学意义[14.3%(2/14)对22.2%(6/27),χ2=0.037,P=0.847]。治疗组MRD由阳性转为阴性的患者占66.7%(6/9),明显高于对照组的10.5%(2/19)(χ2=6.811,P=0.009)。其中治疗组有1例MRD阴性患者发生了形态学复发,对照组有2例MRD阳性患者形态学复发。截至末次随访,中位随访35(10~59)个月,治疗组与对照组MRD阴性患者比例差异无统计学意义[43.5%(10/23)对43.5%(20/46),χ2=1.045,P=0.307]。在形态学复发方面,虽然两组差异无统计学意义,但是治疗组形态学复发患者比例明显低于对照组[30.4%(7/23)对50.2%(24/46),χ2=2.929,P=0.087]。治疗组预计3年LFS率为(65.1±11.1)%,明显高于对照组的(50.0±7.4)%(P=0.047)。治疗组、对照组的预计3年OS率分别为(78.1±10.2)%、(65.8±8.0)%(P=0.212)。
结论
巩固化疗联合异基因NK细胞输注可能有助于低中危AML患者达到更深层次的缓解,减少远期复发。
Keywords: 自然杀伤细胞, 白血病,髓样,急性, 治疗结果
Abstract
Objective
To evaluate the efficacy of consolidation chemotherapy combined with allogeneic natural killer (NK) cell infusion in the treatment of low or intermediate-risk (LIR) acute myeloid leukemia (AML).
Methods
A cohort of 23 LIR AML patients at hematologic complete remission (CR) received NK cell transfusion combined with consolidation chemotherapy after 3 consolidation courses from January 2014 to June 2019 were reviewed. Control group cases were concurrent patients from Department of Hematology, and their gender, age, diagnosis, risk stratification of prognosis, CR and the number of courses of consolidate chemotherapy before NK cell transfusion were matched with LIR AML patients.
Results
A total of 45 times of NK cells were injected into 23 LIR AML patients during 4 to 7 courses of chemotherapy. The median NK cell infusion quantity was 7.5 (6.6-8.6) ×109/L, and the median survival rate of NK cells was 95.4% (93.9%-96.9%). Among them, the median CD3−CD56+ cell number was 5.0 (1.4-6.4) ×109/L, accounting for 76.8% (30.8%-82.9%) ; The number of CD3+ CD56+ cells was 0.55 (0.24-1.74) ×109/L, accounting for 8.8% (4.9%-20.9%). Before NK cell infusion, the number of patients with positive MRD in the treatment and control groups were 9/23 (39.1%) and 19/46 (41.3%) (χ2=0.030, P=0.862) respectively. After NK infusion, There was no significant difference in terms of MRD that went from negative to positive between the treatment and the control groups (14.3% vs 22.2%, χ2=0.037, P=0.847). In the treatment group, 66.7% (6/9) of the MRD were converted from positive to negative, which was significantly higher than that in the control group (10.5%, 2/19) (χ2=6.811, P=0.009). Morphological recurrence occurred in 1 case of MRD negative in the treatment group and 2 cases of MRD positive in the control group. By the end of follow-up, the median follow-up was 35 (10-59) months, the number of patients with morphological recurrence in the treatment group was 30.4% (7/23), which was significantly lower than that in the control group (50.2%, 24/46) (χ2=2.929, P=0.087), although there was no statistically significant difference between the two groups. There was no significant difference on MRD-negative between the treatment and the control groups (43.5% vs 43.5%, χ2=1.045, P=0.307). The 3-year leukemia-free survival was better in the treatment group [(65.1±11.1) %] than that in the control group [(50.0±7.4) %] (P=0.047). The 3-year overall survival in the treatment and control groups were (78.1±10.2) % and (65.8±8.0) % (P=0.212), respectively.
Conclusion
The consolidation of chemotherapy combined with allogeneic NK cell infusion contributed to the further remission of patients with LMR AML and the reduction of long-term recurrence.
Keywords: Natural killer cell; Leukemia, myeloid, acute; Treatment outcome
急性髓系白血病(AML)作为血液恶性肿瘤,化疗和造血干细胞移植(HSCT)是其治疗的主要手段。中外AML诊疗指南[1]–[3]推荐高危AML在第1次完全缓解(CR1)期接受异基因造血干细胞移植(allo-HSCT),可明显改善预后;低中危AML缓解后可接受含大剂量阿糖胞苷(HD-Ara-C)方案巩固化疗,但仍有相当一部分患者复发。为了获得更好治疗结果,目前AML治疗已发展成为分子靶向治疗、生物免疫治疗、细胞治疗、HSCT等组成的多元化体系。近年来非移植背景下过继性免疫细胞治疗——异基因NK细胞治疗AML取得一定疗效,文献报道的治疗方法均为氟达拉滨联合环磷酰胺预处理后单纯NK细胞输注[4],巩固化疗联合异基因NK细胞输注尚缺乏相关报道。本研究回顾性分析了23例低中危AML患者巩固化疗联合异基因NK细胞输注的治疗效果,现将结果报告如下。
对象与方法
1.研究对象:治疗组为2014年1月至2019年6月在北京大学人民医院诊治的低中危AML患者[1]。诊断标准参照WHO(2016)造血和淋巴组织肿瘤分类[5]。所有患者均经化疗达血液学完全缓解(CR),且巩固3个疗程后,应用化疗联合异基因NK细胞回输。接受NK细胞预防治疗的患者均签署知情同意书。对照组为我院同期收治的性别、年龄、预后危险分层同治疗组1∶2匹配的AML患者,且治疗组巩固化疗联合NK细胞输注前与同期对照组均处于血液学CR状态。
2.治疗方案:所有AML患者诱导及巩固化疗均按北京大学血液病研究所诊疗常规进行。诱导方案包括采用“3+7”方案(IA、小剂量MA、HAA或CAG方案)化疗。获得部分缓解(PR)的患者采用原方案再诱导。缓解后给予2~4个疗程HD-Ara-C方案(Ara-C 2 g/m2,每12 h 1次,第1~3天),之后接受DA、MA、AA、HAA、MAE等方案化疗,巩固治疗6~8个疗程。
3.亲缘异基因NK细胞输注:采集亲缘单倍型健康供者外周血40 ml,将其移至淋巴细胞分离管中,800×g离心15 min;离心后将血浆吸出,灭活后备用;取新鲜分离出的单个核细胞(1.5~3.0)×107与滋养细胞共同培养于含10%自体血浆的GT-T551-H3培养基内,将细胞置于37 °C、5%CO2的恒温培养箱中培养诱导。第11天,取细胞悬液进行无菌、内毒素及流式细胞术检测;第13天收取细胞制成制剂进行回输。于巩固治疗第4~7个疗程(非HD-Ara-C方案)第2~4天输注NK细胞,常规给予1 g葡糖糖酸钙预防及抗过敏。
4.骨髓检测方法:骨髓细胞形态学评估参见文献[3]。骨髓细胞多参数流式细胞术(FCM)分析方法参见文献[6]。骨髓标本采用G显带法分析染色体核型[7]。分子生物学检测:采用实时荧光定量PCR(RT-PCR)方法检测RUNX1-RUNX1T1、NPM1、CBF-MTH11等转录本水平[8]。
5.疗效评估:CR、PR、复发的评估标准参见文献[3]。无白血病生存(LFS)时间指从CR到复发或死亡的时间。总生存(OS)时间指从诊断到死亡或末次随访的时间。MRD相关定义依照2018年ELN MRD工作组共识,检测方法包括FCM或RT-PCR。NPM1突变、RUNX1-RUNX1T1、CBFβ-MYH11融合基因作为MRD检测标志,无上述分子标志的均采用FCM检测。①MRD阳性:FCM定量检测骨髓异常免疫表型的微小残留细胞≥0.1%或RT-PCR法检测上述特异基因为阳性;②MRD阴性:FCM定量检测骨髓异常免疫表型的微小残留细胞<0.1%或RT-PCR法检测上述特异基因阴性;③MRD阴转阳(分子学复发):骨髓MRD由阴性转为阳性,且4周后骨髓MRD水平上升>1个数量级;④MRD阳转阴:治疗后RT-PCR或FCM检测MRD转为阴性[9]。
6.随访:通过电话或病案查询方式进行随访,69例患者无一例失访,均可进行疗效分析,随访截止时间为2019年5月31日。
7.统计学处理:统计分析均采用SPSS 20.0统计软件完成。对于两组患者临床特征的差异性分析,分类变量采用卡方检验,连续变量采用两独立样本t检验或Mann-Whitney U检验。Kaplan-Meier法用于分析LFS与OS,并采用Log-rank检验比较组间差异。P值采用双侧分析,P<0.05为差异有统计学意义。
结果
1.临床特征:治疗组共23例(低危16例、中危7例),其中男11例,女12例,年龄(50.1±15.3)岁。治疗组与对照组患者基本情况在性别比例、年龄构成、诊断、FAB分型、分子标志、预后分层、初诊时血细胞计数等差异均无统计学意义(P>0.05)(表1),表明两组病例具有均衡性。治疗组1个疗程诱导治疗达CR者占88.5%(23/26);对照组1个疗程诱导治疗达CR者占84.8%(39/46),两组2个疗程治疗后均达CR。
表1. 治疗组与对照组急性髓系白血病患者一般资料及临床特征比较.
| 变量 | 治疗组(23例) | 对照组(46例) | Z/χ2值 | P值 |
| 性别(例,男/女) | 11/12 | 22/24 | 0 | 1.000 |
| 年龄(岁) | 48.0±14.9 | 47.6±14.5 | -0.510 | 0.959 |
| FAB分型[例(%)] | ||||
| M2 | 17(73.9) | 37(80.4) | 0.383 | 0.536 |
| M4 | 4(17.4) | 5(10.9) | 0.144 | 0.705 |
| M5 | 2(8.7) | 4(8.7) | 0 | 1.000 |
| 初诊血细胞计数[M(范围)] | ||||
| WBC(×109/L) | 11.3(3.9~39.4) | 12.5(4.4~41.4) | -0.067 | 0.947 |
| HGB(g/L) | 95(75~101) | 88(66~108) | -0.091 | 0.928 |
| PLT(×109/L) | 62(37~95) | 46(21~114) | -0.389 | 0.697 |
| 骨髓原始细胞[M(范围)] | 0.470(0.355~0.725) | 0.505(0.325~0.655) | -0.168 | 0.867 |
| 分子标志[例(%)] | 0 | 1.000 | ||
| NPM1+FLT3− | 7(30.4) | 14(30.4) | 0 | 1.000 |
| CEBPA++ | 4(17.4) | 8(17.4) | 0 | 1.000 |
| CBFβ+C-Kit− | 3(13.0) | 6(13.0) | 0 | 1.000 |
| ETO+C-Kit− | 2(8.7) | 4(8.7) | 0 | 1.000 |
| 无特殊标志 | 7(30.4) | 14(30.4) | 0 | 1.000 |
| 预后分层[例(%)] | 0 | 1.000 | ||
| 低危 | 16(69.6) | 32(69.6) | 0 | 1.000 |
| 中危 | 7(30.4) | 14(30.4) | 0 | 1.000 |
2.治疗组NK细胞临床资料:治疗组23例低、中危患者于巩固化疗第4~7个疗程共输注45次NK细胞,输注1~4次的患者分别有8、10、3、2例,中位输注2(1~4)次。中位NK细胞输注数量7.5(6.6~8.6)×109/L,中位细胞存活率95.4%(93.9%~96.9%),其中CD3− CD56+细胞数5.0(1.4~6.4)×109/L,占76.8%(30.8%~82.9%);CD3+CD56+细胞数0.55(0.24~1.74)×109/L,占8.8%(4.9%~20.9%)。不良反应方面,仅2例患者输注后即刻出现短暂发热,所有患者均未出现移植物抗宿主病(GVHD)表现。
3.疗效分析:治疗组NK细胞输注前MRD阴性、阳性的患者数分别为14、9例,对照组MRD阴性、阳性的患者数分别为27、19例,两组间差异无统计学意义(χ2=0.030,P=0.862)。治疗组输注NK细胞前后疗效评估与同期对照组对比,MRD阴转阳患者比例治疗组与对照组差异无统计学意义[14.3%(2/14)对22.2%(6/27),χ2=0.037,P=0.847]。但治疗组MRD由阳转阴的患者占66.7%(6/9),明显高于对照组的10.5%(2/19)(χ2=6.811,P=0.009)(表2)。其中治疗组有1例MRD阴性患者发生了形态学复发,对照组有2例MRD阳性患者形态学复发。
表2. 治疗组NK细胞输注后与对照组近期与远期疗效比较[例(%)].
| 变量 | 治疗组(23例) | 对照组(46例) | χ2值 | P值 |
| 近期疗效 | ||||
| 持续MRD阴性 | 12(85.7) | 21(77.8) | ||
| MRD阴性转阳性 | 2(14.3) | 6(22.2) | 0.037 | 0.847 |
| 持续MRD阳性 | 3(33.3) | 17(89.5) | ||
| MRD阳性转阴性 | 6(66.7) | 2(10.5) | 6.811 | 0.009 |
| 远期疗效 | ||||
| MRD阴性 | 10(43.5) | 20(43.5) | 1.045 | 0.307 |
| MRD阳性 | 13(56.5) | 26(56.5) | 1.855 | 0.208 |
注:MRD:微小残留病
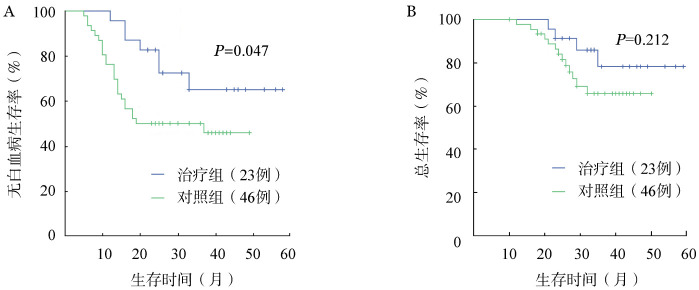
截至末次随访,中位随访35(10~59)个月,在形态学复发方面,虽然两组差异无统计学意义,但是治疗组形态学复发患者比例明显低于对照组[30.4%(7/23)对50.2%(24/46),χ2=2.929,P=0.087];治疗组有4例(17.4%)患者因形态学复发死亡,对照组有13例(28.3%)患者因形态学复发死亡(χ2=0.976,P=0.323)。治疗组中有3例低危患者因分子学复发行allo-HSCT,对照组3例患者(2例低危,1例中危)因分子学复发行allo-HSCT。治疗组与对照组MRD阴性患者比例差异无统计学意义[43.5%(10/23)对43.5%(20/46),χ2=1.045,P=0.307]。值得注意的是,治疗组在近期疗效阳转阴6例患者中4例持续MRD阴性,2例MRD转阳。治疗组与对照组的预计3年LFS率分别为(65.1±11.1)%和(50.0±7.4)%(P=0.047,图1A),预计3年OS率分别为(78.1±10.2)%和(65.8±8.0)%(P=0.212,图1B)。
图1. 治疗组和对照组患者无白血病生存(A)和总生存(B)比较.
讨论
尽管AML患者CR率达60%~85%,然而中低危AML的治疗似乎达到了瓶颈,化疗方案的不断改进并未带来治愈率的大幅提高,CR患者中有50%~70%终将复发。虽然个体化治疗、替代治疗等方式取得了一定进步,但仍不足以满足AML的治疗需要。因此,寻找复发率低、不良反应少及患者耐受性好的治疗策略依然是AML研究热点。近年来过继性免疫细胞治疗越来越受到关注[10]。早在2002年有研究证实,杀伤抑制受体(KIR)与供者不匹配的NK细胞可通过allo-HSCT治疗AML,可减少免疫耐受且不会出现GVHD[11]。2004年Passweg等[12]研究发现KIR与供者不匹配的供者NK细胞输注治疗allo-HSCT后AML患者有效。非移植背景下,2005年Miller等[13]首次报道了输注HLA半相合的异基因NK细胞治疗复发难治AML有效。
NK细胞对肿瘤细胞的识别、杀伤主要依赖于其表面的KIR和杀伤细胞活化受体(KAR),KIR与相对应的KIR配体,即具有特定表位的MHC-1分子结合,传递抑制信号,抑制NK细胞的杀伤作用。白血病细胞MHC-1分子水平下调或丢失,KIR不能识别受者白血病细胞KIR配体,KIR与KAR平衡被打破,此时供者NK细胞不能接受抑制性信号而被激活,发挥强大移植物抗白血病效应同时几乎不会产生GVHD效应[14]。因此有效扩增NK细胞数量和提高NK细胞杀伤活性是异基因NK细胞输注关键一环。目前NK细胞制备方法分为两大类,一类是非体外扩增方法,通过单倍体供者外周血采集分选NK细胞,通过此种方法可获得NK细胞数量约为2×107/kg,平均CD56+CD3−细胞产率为(40±2)%[13]。最近,Romee等[14]通过上述方法联合IL-12、IL-15、IL-18激活NK细胞,获得NK细胞数量1.0×107/kg,但CD56+CD3−细胞产率(>90%)明显增高。另一类为体外扩增方法,主要机制为不同表型膜结合型蛋白人源白血病K562细胞构建成的工程细胞,通过共培养方式扩增外周血中的NK细胞,目前文献报道的有IL-15和4-1BBL工程细胞[15]、IL-21工程细胞[16]等,也有文献报道了脐血CD34+细胞用于扩增NK细胞,获得NK细胞数量(3~30)×106/kg,CD56+CD3−细胞存活率>75%[15]。本研究应用IL-21和4-1BBL蛋白构建形成工程细胞,其mIL-21与NK细胞表面的IL-21受体结合激活STAT3信号转导系统引起细胞增殖,而4-1BBL则通过NK细胞表面的相应受体抑制细胞凋亡,二者协同作用促使NK细胞高效扩增,中位细胞存活率95.4%(93.9%~96.9%),细胞存活率与文献报道一致[17],是首次应用此技术获得NK细胞联合化疗用于治疗AML。目前NK细胞输注前主流预处理方式为大剂量氟达拉滨联合环磷酰胺,清除体内淋巴细胞,尤其调节性T细胞[4]。本研究NK细胞输注前处理方式与既往文献报道不同,我们在患者巩固化疗第4~7疗程的第2~4天进行NK细胞输注。
异体输注的NK细胞具有易活化,高效杀伤HLA-Ⅰ类分子低表达白血病细胞特点。业已证实NK细胞输注治疗AML取得一定疗效。
治疗复发难治AML方面,在Miller等[13]的研究中,19例复发难治AML患者输注HLA半相合异基因NK细胞,结果5例患者获得CR,4例KIR配体不相合患者中3例获得CR,而15例KIR配体相合者仅2例获得CR,揭示NK细胞异体反应性在AML缓解中有效。最近该研究团队[18]通过应用IL-2联合IL-2受体抑制剂白喉毒素融合蛋白(IL2DT),观察输注异基因NK细胞治疗复发难治AML患者的疗效,结果发现IL2DT组获得缓解患者比例明显高于非IL2DT组(53%对21%,P=0.02),6个月时无病生存率亦高于非IL2DT组(33%对5%,P<0.01),提示用IL-2联合IL2DT抑制宿主调节性T细胞可增加异基因NK细胞的杀伤活性,提高复发难治AML治疗疗效。Curti等[19]观察了13例老年高危AML患者,输注单倍体供者NK细胞,结果5例疾病活动期患者仅1例获得短暂的CR,余4例没有临床效应;2例分子学复发的患者再次获得完全分子学反应(CMR)并分别持续9和4个月;6例形态学缓解的患者中3例分别在34、32和18个月仍处于LFS。目前已有文献报道,NK细胞输注治疗复发难治AML患者,安全性良好,对患者再缓解、维持CR以及MRD转阴方面均表现出较好疗效。
诱导后化疗阶段输注异基因NK细胞同样也取得喜人结果。Rubnitz等[20]对10例既往完成了4~5个疗程化疗的儿童AML患者输注HLA半相合的异基因NK细胞,中位随访964(569~1 162)d,结果2年EFS率为100%。2016年Curti等[21]报道了17例获得CR老年AML患者,输注HLA半相合的异基因NK细胞联合IL-2,结果3例MRD阳性AML患者均获得CMR;中位随访22.5(6~68)个月,无病生存率为56%,44%的患者复发,中位复发时间9(3~51)个月。最近,Dolstra等[22]应用脐血CD34+细胞扩增NK细胞,对10例获得CR老年AML患者进行输注,结果4例MRD阳性患者中2例转为阴性。本研究为了更好地评估NK细胞输注治疗疗效,同时我们对治疗组NK细胞输注前基线资料行1∶2匹配设置了对照组,结果治疗组MRD由阳转阴的患者比例明显高于对照组(66.7%对10.5%);中位随访35(10~59)个月,在形态学复发方面虽然两组差异无统计学意义,但是治疗组形态学复发比例(30.4%)明显低于对照组(50.2%)。治疗组预计3年LFS率为(65.1±11.1)%,明显高于对照组的(50.0±7.4)%(P=0.047),提示NK细胞输注可提高MRD阳性低中危AML患者转阴率,同时减少远期复发,结果与文献报道一致。本研究NK细胞输注前处理方式与既往文献报道不同,发现异基因NK细胞输注联合巩固化疗相比单纯巩固化疗的低中危AML患者可获得较好的临床结局。
总之,本回顾性研究结果显示巩固化疗联合异基因NK细胞输注有助于低中危AML患者达到更深层次的缓解,减少远期复发。由于病例数有限,异基因NK细胞输注在低中危AML患者维持治疗中的作用尚需前瞻性研究进一步证实。
Funding Statement
基金项目:国家重点基础研究发展计划(2017YFA0104500);国家自然科学基金创新研究群体科学基金(81621001);首都临床特色应用研究基金(Z181100001718126)
Fund program: National Key Research and Development Program of China(2017YFA0104500); Innovative Research Groups of the National Natural Science Foundation of China(81621001);Capital Characteristic Clinic Project Foundation(Z181100001718126)
References
- 1.O'Donnell MR, Tallman MS, Abboud CN, et al. Acute Myeloid Leukemia, Version 2.2018, NCCN Clinical Practice Guidelines in Oncology[J] J Natl Compr Canc Netw. 2018;1(7):926–957. doi: 10.6004/jnccn.2018.0116. [DOI] [PubMed] [Google Scholar]
- 2.Döhner H, Estey E, Grimwade D, et al. Diagnosis and management of AML in adults: 2017 ELN recommendations from an international expert panel[J] Blood. 2017;129(4):424–447. doi: 10.1182/blood-2016-08-733196. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.中华医学会血液学分会白血病淋巴瘤学组. 成人急性髓系白血病(非急性早幼粒细胞白血病)中国诊疗指南(2017年版)[J] 中华血液学杂志. 2017;38(3):177–182. doi: 10.3760/cma.j.issn.0253-2727.2017.03.001. [DOI] [Google Scholar]
- 4.Veluchamy JP, Kok N, van der Vliet HJ, et al. The rise of allogeneic natural killer cells as a platform for cancer immunotherapy: recent innovations and future developments[J] Front Immunol. 2017;8:631. doi: 10.3389/fimmu.2017.00631. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Arber DA, Orazi A, Hasserjian R, et al. The 2016 revision to the World Health Organization classification of myeloid neoplasms and acute leukemia[J] Blood. 2016;127(20):2391–2405. doi: 10.1182/blood-2016-03-643544. [DOI] [PubMed] [Google Scholar]
- 6.刘 艳荣, 于 弘, 常 艳, et al. 探讨流式细胞术检测胞浆抗原的方法及其在白血病免疫分型中的意义[J] 中国实验血液学杂志. 2002;10(1):17–21. doi: 10.3969/j.issn.1009-2137.2002.01.004. [DOI] [PubMed] [Google Scholar]
- 7.Ruan GR, Li JL, Qin YZ, et al. Nucleophosmin mutations in Chinese adults with acute myelogenous leukemia[J] Ann Hematol. 2009;88(2):159–166. doi: 10.1007/s00277-008-0591-8. [DOI] [PubMed] [Google Scholar]
- 8.秦 亚溱, 李 金兰, 主 鸿鹄, et al. 实时定量RT-PCR技术测定初治白血病患者常见融合基因转录子水平及其标准化的探讨[J] 中华血液学杂志. 2007;28(7):433–437. doi: 10.3760/j:issn:0253-2727.2007.07.001. [DOI] [Google Scholar]
- 9.Schuurhuis GJ, Heuser M, Freeman S, et al. Minimal/measurable residual disease in AML: a consensus document from the European LeukemiaNet MRD Working Party[J] Blood. 2018;131(12):1275–1291. doi: 10.1182/blood-2017-09-801498. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.Arpinati M, Curti A. Immunotherapy in acute myeloid leukemia[J] Immunotherapy. 2014;6(1):95–106. doi: 10.2217/imt.13.152. [DOI] [PubMed] [Google Scholar]
- 11.Ruggeri L, Capanni M, Urbani E, et al. Effectiveness of donor natural killer cell alloreactivity in mismatched hematopoietic transplants[J] Science. 2002;295(5562):2097–2100. doi: 10.1126/science.1068440. [DOI] [PubMed] [Google Scholar]
- 12.Passweg JR, Tichelli A, Meyer-Monard S, et al. Purified donor NK-lymphocyte infusion to consolidate engraftment after haploidentical stem cell transplantation[J] Leukemia. 2004;18(11):1835–1838. doi: 10.1038/sj.leu.2403524. [DOI] [PubMed] [Google Scholar]
- 13.Miller JS, Soignier Y, Panoskaltsis-Mortari A, et al. Successful adoptive transfer and in vivo expansion of human haploidentical NK cells in patients with cancer[J] Blood. 2005;105(8):3051–3057. doi: 10.1182/blood-2004-07-2974. [DOI] [PubMed] [Google Scholar]
- 14.Romee R, Rosario M, Berrien-Elliott MM, et al. Cytokine-induced memory-like natural killer cells exhibit enhanced responses against myeloid leukemia[J] Sci Transl Med. 2016;8(357):357ra123. doi: 10.1126/scitranslmed.aaf2341. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.Shah NN, Baird K, Delbrook CP, et al. Acute GVHD in patients receiving IL-15/4-1BBL activated NK cells following T-cell-depleted stem cell transplantation[J] Blood. 2015;125(5):784–792. doi: 10.1182/blood-2014-07-592881. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.Ciurea SO, Schafer JR, Bassett R, et al. Phase 1 clinical trial using mbIL21 ex vivo-expanded donor-derived NK cells after haploidentical transplantation[J] Blood. 2017;130(16):1857–1868. doi: 10.1182/blood-2017-05-785659. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.Wang X, Lee DA, Wang Y, et al. Membrane-bound interleukin-21 and CD137 ligand induce functional human natural killer cells from peripheral blood mononuclear cells through STAT-3 activation[J] Clin Exp Immunol. 2013;172(1):104–112. doi: 10.1111/cei.12034. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18.Bachanova V, Cooley S, Defor TE, et al. Clearance of acute myeloid leukemia by haploidentical natural killer cells is improved using IL-2 diphtheria toxin fusion protein[J] Blood. 2014;123(25):3855–3863. doi: 10.1182/blood-2013-10-532531. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.Curti A, Ruggeri L, D'Addio A, et al. Successful transfer of alloreactive haploidentical KIR ligand-mismatched natural killer cells after infusion in elderly high risk acute myeloid leukemia patients[J] Blood. 2011;118(12):3273–3279. doi: 10.1182/blood-2011-01-329508. [DOI] [PubMed] [Google Scholar]
- 20.Rubnitz JE, Inaba H, Ribeiro RC, et al. NKAML: a pilot study to determine the safety and feasibility of haploidentical natural killer cell transplantation in childhood acute myeloid leukemia[J] J Clin Oncol. 2010;28(6):955–959. doi: 10.1200/JCO.2009.24.4590. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 21.Curti A, Ruggeri L, Parisi S, et al. Larger size of donor alloreactive NK cell repertoire correlates with better response to NK cell immunotherapy in elderly acute myeloid leukemia patients[J] Clin Cancer Res. 2016;22(8):1914–1921. doi: 10.1158/1078-0432.CCR-15-1604. [DOI] [PubMed] [Google Scholar]
- 22.Dolstra H, Roeven MWH, Spanholtz J, et al. Successful transfer of umbilical cord blood CD34+ hematopoietic stem and progenitor-derived NK cells in older acute myeloid leukemia patients[J] Clin Cancer Res. 2017;23(15):4107–4118. doi: 10.1158/1078-0432.CCR-16-2981. [DOI] [PubMed] [Google Scholar]