Abstract
目的
探讨伴ins(15;17)隐匿型急性早幼粒细胞白血病(APL)的遗传学检测方法及其临床预后。
方法
收集2016年6月至2018年11月收治的373例初诊APL病例,筛选出PML-RARα检测RT-PCR阳性、间期FISH阴性的APL患者进行回顾检测分析,采用中期FISH和Sanger测序进一步验证。
结果
共发现7例隐匿型APL患者,这7例患者15号染色体上分别插入了小的RARα片段,形成ins(15;17)。7例患者中L亚型5例,S亚型1例,V亚型1例。经全反式维甲酸(ATRA)和亚砷酸(ATO)或蒽环类等化疗药物联合化疗后,有6例患者完全缓解,1例患者化疗第6天死于颅内出血。
结论
APL进行FISH检测时应考虑探针大小及覆盖位置,联合中期FISH可提高隐匿型APL检出率。伴ins(15;17)隐匿型APL患者临床特征及治疗方案与经典型APL无差异,ATRA与ATO或蒽环类等联合化疗有效。
Keywords: 白血病,早幼粒细胞,急性, 隐匿型插入易位, 中期荧光免疫杂交
Abstract
Objective
To investigate the genetic screening methods for cryptic acute promyelocytic leukemia (APL) to further explore its clinical prognosis.
Methods
From June 2016 to November 2018, we collected 373 newly diagnosed APL cases. The patients were retrospected by the results of PML-RARα detections both by RT-PCR and i-FISH, those who harbored positive PML-RARα detection by RT-PCR and negative by i-FISH were chosen. Metaphase FISH and Sanger sequencing were further performed to verify these results.
Results
A total of 7 cryptic APL cases were discovered. These cases had tiny fragment of RARα inserted into PML in chromosome 15, formed ins(15;17). The 7 cryptic APL cases had no PML-RARα gene subtype specificity, involving 5 cases in L subtype, 1 case in S subtype and 1 case in V subtype respectively. After the treatment of retinoic acid and arsenic or anthracyclines, 6 cases achieved complete remission, 1 case died of intracranial hemorrhage on the 6th day of therapy.
Conclusion
The size and covering position of PML-RARα probe should be taken into account when PML-RARα was performed by FISH on APL patients. Furthermore, combination with Metaphase FISH could improve the recognition of cryptic APL. There were no differences between the cryptic and common APL patients in terms of clinical features and treatment choices. Cryptic APL patients also had a good response to the therapy of retinoic acid and arsenic or anthracyclines.
Keywords: Leukemia, promyelocytic, acute; Cryptic insertion translocation; Metaphase fluorescence in situ hybridization
急性早幼粒细胞白血病(APL)是急性髓系白血病的一个特殊亚型,约90%的APL患者具有典型的t(15;17)。15号染色体上的PML基因和17号染色体上的RARα基因发生融合,形成PML-RARα融合基因,该融合基因过表达抑制RARα基因的调控,改变PML的核定位,阻滞早幼粒细胞分化成熟和增殖,从而引起APL[1]。涉及15和17号染色体的复杂易位或插入易位,均会产生PML-RARα融合基因[2]。
有极少部分APL患者PML-RARα基因RT-PCR结果为阳性,但是常规染色体核型和FISH检测未发现典型的t(15;17)异常。有可能是因为PML或者RARα的微插入或者复杂变异易位导致了不典型t(15;17),又称为隐匿型易位[3]。隐匿型APL较为罕见,目前国内外已报道的隐匿型APL不足40例,尤其是对ins(15;17)隐匿型APL的认知还很缺乏。APL容易导致DIC,死亡风险高,因此对隐匿型APL的准确诊断显得尤为重要,本研究中我们探讨隐匿型APL更适合的筛查方法及临床预后。
对象与方法
1.研究对象:收集2016年6月1日至2018年11月26日373例经本院分子生物学、流式细胞术免疫分型、形态学等实验室检查综合诊断为APL的初诊患者,筛选PML-RARα融合基因RT-PCR结果阳性及间期FISH结果阴性的APL患者进行回顾性分析,并对筛出患者进行随访。
2.免疫分型:免疫表型分析采用多色流式细胞术,应用单克隆抗体(单抗)免疫荧光标记单个核细胞,上流式细胞仪(BC NAVIOS,Beckman-Coulter,美国BD公司产品)检测分析。采用CD45/SSC设门法,标记的抗体包括:CD117、CD3、cCD3、CD33、CD45、CD123、CD64、CD13、CD56、CD11b、CD36、CD10、CD19、CD14、TDT、MPO、CD5、CD9、CD2、cCD79a、CD7、CD15、HLA-DR、CD4、CD20、CD34、CD38。每个样本分析10 000个细胞。胞质抗原以≥10%为阳性;胞膜抗原以≥20%为阳性。
3.分子生物学分析:取患者骨髓或外周血标本提取总RNA和DNA,采用RT-PCR方法进行PML-RARα基因的定量及定性检测,反应条件、引物及结果判定参照文献[4]–[5],PCR扩增产物进一步行Sanger测序验证。
4.染色体核型分析:24 h短期培养骨髓细胞(RPMI 1640培养液,美国Gibco-BRL公司产品),固定后收获细胞,火焰法滴片,晾干,吉姆萨染色显G带中期分裂象,核型描述依据《人类细胞遗传学国际命名体制(ISCN2016)》描述。
5.FISH:①间期FISH: PML-RARα双色双融合探针分别选用美国Vysis公司和英国Cytocell公司产品,RARα分离探针选用美国Vysis公司产品。取未培养骨髓细胞,依据试剂厂商提供操作说明书完成杂交。使用荧光显微镜(Olympus BX51)双人分别计数500个细胞。②中期FISH:探针同上,采用24 h短期培养法培养骨髓细胞,分析染色体核型后,标记相应分裂象位置,然后进行FISH杂交(操作步骤同上)。观察标记分裂象的探针信号特征。两个公司探针PML基因均标记为红色(R),RARα基因标记为绿色(G),融合信号(RG)为黄色(F),正常阴性信号为2红2绿(2R2G),典型阳性信号为2黄1红1绿(2F1R1G)。
6.随访:患者完全缓解后每3个月或半年或有病情变化时门诊复查,观察其血常规变化并进行形态学、流式细胞术、遗传学、分子生物学等检测,以评估其病情发展情况,随访截止时间为2019年4月。
结果
1.患者临床特征:373例APL患者中共发现7例隐匿型APL患者,RT-PCR检测PML-RARα融合基因阳性;流式免疫表型均表达或弱表达CD33、CD117、CD13、MPO等,不表达CD34、HLA-DR等(表1)。细胞形态学及免疫组化检测结果均支持APL诊断。根据WBC和PLT进行预后分层[6],其中高危3例,中危3例,低危1例。7例隐匿型APL患者中6例在应用全反式维甲酸(ATRA)与亚砷酸(ATO)诱导化疗或蒽环类等化疗药物联合化疗中均获得明显的疗效,且在巩固化疗第1~2个疗程均可获得分子生物学完全缓解(即分子生物学定量或定性检测PML-RARα融合基因转阴),维持治疗后病情一直平稳,随访至2019年4月均无复发。例3入院后第6天因颅内出血、肺部感染等并发症死亡。
表1. 7例伴ins(15;17)隐匿型急性早幼粒细胞白血病患者基本临床资料.
| 例号 | 性别 | 年龄(岁) | WBC(×109/L) | HGB(g/L) | PLT(×109/L) | RT-PCR定量(%) | 免疫分型 | 诱导化疗 | 获初次分子学CR前治疗 |
| 1 | 男 | 37 | 8.8 | 112 | 21 | 86.8 | 表达CD33、CD123、CD117、CD13、CD64、CD9;弱表达MPO、CD38;不表达CD34、HLA-DR、CD7、CD56、CD10、CD19、TDT、cCD79a、cCD3 | ATRA+ATO+柔红霉素 | 1个疗程诱导+ 1个疗程巩固 |
| 2 | 男 | 30 | 0.9 | 67 | 25 | 76.5 | 表达CD33、CD117、CD38、CD13、CD123、CD64、CD9、MPO;弱表达CD15;不表达CD34、HLA-DR、CD11b、CD7、CD36、TdT、CD19、cCD79a、cCD3 | ATRA+ATO | 1个疗程诱导+ 1个疗程巩固 |
| 3 | 男 | 12 | 79.0 | 61 | 21 | 101.4 | 表达CD13、CD33、CD123、CD64、CD9、CD117;弱表达CD38、MPO;不表达CD34、HLA-DR、CD15、CD11b、CD7、CD36、TdT、CD19、cCD79a、cCD3 | ATRA+ATO+柔红霉素 | 入院第6天死亡 |
| 4 | 女 | 51 | 0.4 | 62 | 59 | 27.4 | 表达CD117、CD13、CD33、CD64、MPO、CD9、CD123;弱表达CD45、CD38;不表达CD34、HLA-DR、CD5、CD7、CD16、CD11b、CD15、CD56、CD19、CD10、CD3、TdT、CD14 | ATRA+ATO+蒽环类 | 1个疗程诱导+ 1个疗程巩固 |
| 5 | 女 | 26 | 2.3 | 73 | 27 | 83.6 | 表达CD33、CD38、CD13、CD123、CD64、CD9、MPO;弱表达CD117;不表达CD34、HLA-DR、CD15、CD56、CD36、CD14、CD4、CD7、CD19、TdT、cCD79a、cCD3 | ATRA+伊达比星 | 1个疗程诱导+ 2个疗程巩固 |
| 6 | 女 | 45 | 33.3 | 37 | 11 | 93.4 | 表达CD117、CD38、CD13、CD33、CD123、CD64、CD9;弱表达MPO;不表达CD34、HLA-DR、CD15、CD11b、CD7、CD36、TdT、CD19、cCD79a、cCD3 | ATRA+ATO | 1个疗程诱导+ 2个疗程巩固 |
| 7 | 女 | 33 | 40.6 | 68 | 20 | 89.3 | 表达CD117、CD13、CD33、CD123、CD64、CD9;弱表达CD38、MPO;不表达CD34、HLA-DR、CD15、CD11b、CD7、CD36、TdT、CD19、cCD79a、cCD3 | ATRA+ATO+阿糖胞苷+伊达比星 | 1个疗程诱导+ 1个疗程巩固 |
注:CR:完全缓解;ATRA:全反式维甲酸;ATO:亚砷酸
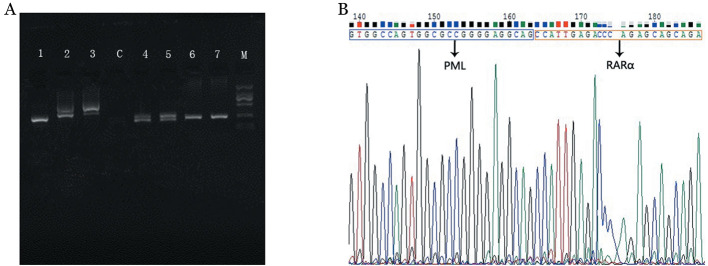
2.分子生物学特征:7例患者RT-PCR PML-RARα定量及定性检测均阳性,其中L亚型5例,V亚型1例,S亚型1例,Sanger测序进一步证实了这7例患者存在PML-RARα融合基因(图1)。
图1. 7例伴ins(15;17)隐匿型急性早幼粒细胞白血病患者PML-RARα融合基因分型及测序验证.
A:RT-PCR检测PML-RARα基因亚型。条带1~7为例1~7,例1为V亚型,产物178 bp;例2、4~7为L亚型,产物214 bp;例3为S亚型,产物289 bp;C:阴性对照;M:Marker。B:Sanger测序验证PML基因与RARα基因存在融合位点
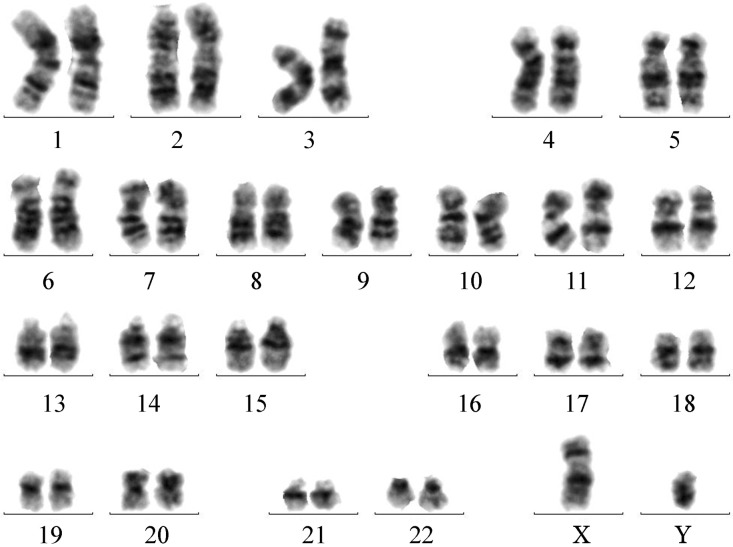
3.染色体核型检查:7例患者染色体核型分析结果均为正常(图2)。
图2. 隐匿型急性早幼粒细胞白血病患者(例3)染色体核型.
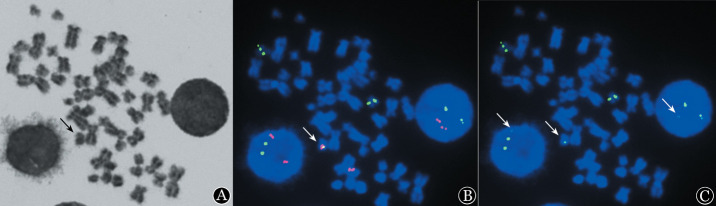
4.FISH检测结果:①间期FISH:7例患者起初使用美国Vysis公司PML-RARα双色双融合探针行间期FISH检测均为阴性,信号特征为2R2G。RARα分离探针检测结果均阴性。随后采用英国Cytocell公司PML-RARα双色双融合探针行回顾检测,结果均为阳性,而且为非典型阳性信号特征1F(Rg)1R2G,融合信号由荧光强度较弱的绿色信号(g)和常规强度红色信号(R)组成。②中期FISH:7例患者采用英国Cytocell公司PML-RARα双色双融合探针检测结果均为阳性,信号特征和间期FISH一致,而且融合信号位于15号染色体上(图3)。
图3. 隐匿型急性早幼粒细胞白血病患者(例3)中期荧光原位杂交(FISH)及染色体核型对照.
A:中期染色体核型;B:双色滤镜下中期FISH;C:单色滤镜下中期FISH。Cytocell公司双色双融合PML-RARα探针,RARα基因荧光标记为绿色(G), PML基因荧光标记为红色(R),PML-RARα融合信号为黄色(F),阴性信号为2R2G,典型阳性信号为2F1R1G。箭头表示衍生15号染色体PML-RARα融合基因,杂交结果显示为不典型阳性1F(Rg)1R2G,在第15号染色体上显示融合信号F(Rg),g为绿色荧光信号减弱。在图C单色滤镜下间期细胞中也可见减弱的绿色信号(g)
讨论
约90%的APL患者伴有t(15;17)(q24.1; q21.2),位于15号染色体上的5′端PML(外显子1~3)和位于17号染色体上的3′端RARα(外显子3~9)发生融合,形成新的PML-RARα融合基因[7]。此外,还有极少部分APL患者是隐匿型,PML或者RARα发生插入变异,这种插入异常多发在15号染色体上,很少发生在17号染色体上,形成隐匿型PML-RARα融合癌蛋白,被认为是APL主要的“驱动”突变[8]。本研究中7例隐匿型APL患者均是RARα插入到15号染色体长臂中,即ins(15;17),形成PML-RARα融合基因。
间期FISH检测隐匿型APL还存在局限性。对于亚显微插入而形成的隐匿型PML-RARα进行FISH检测时,可能由于插入片段太小,杂交信号弱,肉眼无法识别,从而产生假阴性,而通过单色滤光镜观察可能会有帮助[9]–[12]。7例APL患者先后应用Vysis和Cytocell两个公司的PML-RARα探针进行间期FISH检测,并通过中期FISH验证,发现两次结果存在差异,考虑此种差异与探针大小及探针覆盖位置相关。探针片段越大,检测的精确度越小。Vysis公司PML-RARα探针约1 317 kb(PML约517 kb、RARα约800 kb),Cytocell公司PML-RARα探针约656 kb(PML约325 kb、RARα约331 kb)。Vysis探针大小和其标记覆盖面积是Cytocell探针的2倍以上。因此我们推测PML的信号强度与插入15号染色体长臂的小片段RARα信号强度差异较大,使得PML信号强度遮盖RARα信号,以致融合信号不易发现;而Cytocell公司探针覆盖范围较小,两个信号强度差异也相应减小,使得融合信号肉眼更易识别。此外,如果探针未覆盖插入片段,也会造成杂交信号丢失。探针设计一般会存在未覆盖的间隙,经典的染色体断裂重排均可检测到大片段的分离信号,但若微小片段的插入易位且片段刚好位于未覆盖区域,则检测不到信号。相反,如果RARα探针的3′端覆盖较多,片段插入位置能跳过探针未覆盖间隙,则可被检测到的概率更高。国外相关研究也认为在检测隐匿型APL时,FISH检测结果取决于探针大小及覆盖位置[13]–[14]。
结合中期FISH,我们回顾性分析这7例患者的核型分析结果,发现的确存在微小片段插入异常,但仅凭常规核型分析不能判定为异常。因此,对于初诊ins(15;17)或者其他隐匿型APL患者,间期FISH检测应综合考虑探针的大小和覆盖范围,并联合中期FISH验证以提高检出率。而且通过中期FISH的荧光定位,我们还可以更清楚地了解染色体重排发生机制。
PML-RARα转录本亚型分为L亚型、V亚型及S亚型。本研究中7例患者的PML-RARα融合基因亚型未见特异性分布。但因样本量较小,确切的结论还需要扩大病例数进一步研究。
对于经典t(15;17)APL患者,根据APL治疗指南(2018版),应用ATRA和ATO诱导化疗已经是非高危APL患者一线治疗的首选方案[6]。而APL变异型的RARα基因多与其他伙伴基因形成融合基因如PZLF-RARα和STAT5b-RARα等,不存在PML-RARα融合基因靶点,通常会对ATRA具有耐药抗性[15]–[16]。本研究中的隐匿型ins(15;17)虽然与经典t(15;17)形成重排机制不同,但由于同样存在PML-RARα融合基因靶点,因而这类患者对联合诱导治疗具有明显疗效,与经典t(15;17)APL患者一样有着良好的预后,我们的结果与以往文献报道一致[3],[6],[14]。
综上,当疑似APL初诊患者出现PCR、间期FISH及染色体核型结果不一致的时候,应首先考虑是否存在隐匿型变异,此时选用探针的大小及覆盖位置很重要,精准度高的探针可有效提高检出率,应用中期FISH验证可得到更加准确的结果。同时,提高实验室及临床人员对少见类型APL的认识,对APL患者的快速诊断、临床合理用药及预后评估具有重要意义。
References
- 1.Mistry AR, Pedersen EW, Solomon E, et al. The molecular pathogenesis of acute promyelocytic leukaemia: implications for the clinical management of the disease[J] Blood Rev. 2003;17(2):71–97. doi: 10.1016/s0268-960x(02)00075-9. [DOI] [PubMed] [Google Scholar]
- 2.Walz C, Grimwade D, Saussele S, et al. Atypical mRNA fusions in PML-RARA positive, RARA-PML negative acute promyelocytic leukemia[J] Genes Chromosomes Cancer. 2010;49(5):471–479. doi: 10.1002/gcc.20757. [DOI] [PubMed] [Google Scholar]
- 3.Kim MJ, Cho SY, Kim MH, et al. FISH-negative cryptic PML-RARA rearrangement detected by long-distance polymerase chain reaction and sequencing analyses: a case study and review of the literature[J] Cancer Genet Cytogenet. 2010;203(2):278–283. doi: 10.1016/j.cancergencyto.2010.08.026. [DOI] [PubMed] [Google Scholar]
- 4.Gabert J, Beillard E, van der Velden VH, et al. Standardization and quality control studies of ‘real-time’ quantitative reverse transcriptase polymerase chain reaction of fusion gene transcripts for residual disease detection in leukemia - a Europe Against Cancer program[J] Leukemia. 2003;17(12):2318–2357. doi: 10.1038/sj.leu.2403135. [DOI] [PubMed] [Google Scholar]
- 5.van Dongen JJ, Macintyre EA, Gabert JA, et al. Standardized RT-PCR analysis of fusion gene transcripts from chromosome aberrations in acute leukemia for detection of minimal residual disease. Report of the BIOMED-1 Concerted Action: investigation of minimal residual disease in acute leukemia[J] Leukemia. 1999;13(12):1901–1928. doi: 10.1038/sj.leu.2401592. [DOI] [PubMed] [Google Scholar]
- 6.中华医学会血液学分会,中国医师协会血液科医师分会. 中国急性早幼粒细胞白血病诊疗指南(2018年版)[J] 中华血液学杂志. 2018;39(3):179–183. doi: 10.3760/cma.j.issn.0253-2727.2018.03.002. [DOI] [Google Scholar]
- 7.De Braekeleer E, Douet-Guilbert N, De Braekeleer M. RARA fusion genes in acute promyelocytic leukemia: a review[J] Expert Rev Hematol. 2014;7(3):347–357. doi: 10.1586/17474086.2014.903794. [DOI] [PubMed] [Google Scholar]
- 8.Grimwade D, Biondi A, Mozziconacci MJ, et al. Characterization of acute promyelocytic leukemia cases lacking the classic t(15;17): results of the European Working Party. Groupe Français de Cytogénétique Hématologique, Groupe de Français d'Hematologie Cellulaire, UK Cancer Cytogenetics Group and BIOMED 1 European Community-Concerted Action “Molecular Cytogenetic Diagnosis in Haematological Malignancies”[J] Blood. 2000;96(4):1297–1308. [PubMed] [Google Scholar]
- 9.Kim M, Lim J, Kim Y, et al. The genetic characterization of acute promyelocytic leukemia with cryptic t(15;17) including a new recurrent additional cytogenetic abnormality i(17) (q10)[J] Leukemia. 2008;22(4):881–883. doi: 10.1038/sj.leu.2404989. [DOI] [PubMed] [Google Scholar]
- 10.Wang Y, Fang M, Jing Y, et al. Derivative(7) t(7;8): The sole karyotype abnormality in acute promyelocytic leukemia with PML/RARA rearrangement identified by RT-PCR and sequence analysis[J] Leuk Res. 2009;33(7):e55–58. doi: 10.1016/j.leukres.2008.12.002. [DOI] [PubMed] [Google Scholar]
- 11.Blanco EM, Curry CV, Lu XY, et al. Cytogenetically cryptic and FISH-negative PML/RARA rearrangement in acute promyelocytic leukemia detected only by PCR: an exceedingly rare phenomenon[J] Cancer Genet. 2014;207(1-2):48–49. doi: 10.1016/j.cancergen.2014.01.001. [DOI] [PubMed] [Google Scholar]
- 12.Huh J, Moon H, Chi H, et al. Acute promyelocytic leukemia with i(17) (q10) on G-banding and PML/RARA rearrangement by RT-PCR without evidence of PML/RARA rearrangement on FISH[J] Int J Lab Hematol. 2009;31(3):372–374. doi: 10.1111/j.1751-553X.2008.01040.x. [DOI] [PubMed] [Google Scholar]
- 13.Campbell LJ, Oei P, Brookwell R, et al. FISH detection of PML-RARA fusion in ins(15;17) acute promyelocytic leukaemia depends on probe size[J] Biomed Res Int. 2013;2013:164501. doi: 10.1155/2013/164501. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Shepshelovich D, Oniashvili N, Parnes D, et al. Acute promyelocytic leukemia with isochromosome 17q and cryptic PML-RARA successfully treated with all-trans retinoic acid and arsenic trioxide[J] Cancer Genet. 2015;208(11):575–579. doi: 10.1016/j.cancergen.2015.08.001. [DOI] [PubMed] [Google Scholar]
- 15.Chen Z, Brand NJ, Chen A, et al. Fusion between a novel Krüppel-like zinc finger gene and the retinoic acid receptor-alpha locus due to a variant t(11;17) translocation associated with acute promyelocytic leukaemia[J] EMBO J. 1993;12(3):1161–1167. doi: 10.1002/j.1460-2075.1993.tb05757.x. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.Ichikawa S, Ichikawa S, Ishikawa I, et al. Successful treatment of acute promyelocytic leukemia with a t(X;17) (p11.4;q21) and BCOR-RARA fusion gene[J] Cancer Genet. 2015;208(4):162–163. doi: 10.1016/j.cancergen.2015.01.008. [DOI] [PubMed] [Google Scholar]