Abstract
目的
分析罕见疾病伴嗜酸性粒细胞增多和FGFR1重排的髓系/淋系肿瘤(即8p11骨髓增殖综合征,EMS)的临床特征、诊断及治疗。
方法
总结中国医学科学院血液病医院2014年1月至2018年5月收治的5例确诊EMS患者的临床表现、实验室特征、诊治经过及转归。
结果
5例EMS患者外周血白细胞计数均明显升高,伴有嗜酸性粒细胞绝对值增高(均值18.89×109/L);骨髓髓系极度增生,原始细胞均<5%,嗜酸性粒细胞比例增高(均值17.24%)。5例患者染色体核型各不相同,但FISH检查均存在FGFR1基因重排。发病至确诊平均时间为4.8个月,中位生存期仅14个月。
结论
EMS是一种罕见病,恶性程度高,对常规化疗反应差,生存期短,且易发生误诊漏诊,细胞遗传学及分子生物学检查有助于早期诊断。
Keywords: 嗜酸性粒细胞增多, FGFR1重排, 髓系/淋系肿瘤
Abstract
Objective
To investigate the clinic-pathological features, diagnosis and treatment of 8p11 myeloproliferative syndrome (EMS).
Methods
Five patients diagnosed as EMS from Jan 2014 to May 2018 at Blood Disease Hospital, Chinese Academy of Medical Sciences were enrolled. The clinical manifestations, laboratory characteristics, treatment and outcome of these patients were summarized.
Results
The peripheral blood leukocyte count of 5 patients with EMS increased significantly, accompanied with an elevated absolute eosinophils value (the average as 18.89×109/L). The hypercellularity of myeloid cells was common in bone marrow, always with the elevated proportion of eosinophils (the average as 17.24%), but less than 5% of blast cells. The chromosome karyotype of the 5 cases differed from each other, but presenting with the same rearrangement of FGFR1 gene by fluorescence in situ hybridization technology. The average interval between onset and diagnosis was 4.8 months with a median survival of only 14 months.
Conclusion
EMS was a rare hematologic malignancy with poor prognosis and short survival. It was commonly to be misdiagnosed. Analysis of cytogenetics and molecular biology were helpful for early diagnosis.
Keywords: Myeloproliferative syndrome, Fibroblast growth factor receptor 1, Myeloid/lymphoid neoplasms
8p11骨髓增殖综合征(8p11 myeloproliferative syndrome,EMS)也称为干细胞白血病/淋巴瘤综合征(stem cell leukemia/lymphoma syndrome,SCLL),以外周血白细胞计数明显增高、骨髓中髓系细胞增生和嗜酸性粒细胞增多、淋巴母细胞淋巴瘤为特征,可短期内进展为急性白血病。2016年WHO造血与淋巴组织肿瘤分类将其命名为“伴嗜酸性粒细胞增多及FGFR1重排的髓系/淋系肿瘤”[1]。本病临床罕见,患者早期就诊时无特异性临床表现,易出现误诊漏诊。为提高对EMS的认识,我们对我院确诊的5例EMS患者的临床特征及实验室资料进行回顾性分析,并结合文献进行讨论。
病例与方法
1.病例:自2014年1月至2018年5月,我院确诊EMS患者共5例,男4例、女1例。发病年龄最小6岁,最大60岁。自发病至确诊时间为1~9个月,平均4.8个月。随访时间截至2018年12月31日。
2.形态学及组织化学染色检查:骨髓穿刺涂片进行常规细胞形态学及细胞化学检查,按“WHO造血和淋巴组织肿瘤分类(2008)”进行诊断和分类。
3.染色体核型分析:采用骨髓细胞24 h短期培养法(RPMI 1640培养液,含20%小牛血清),按常规方法制备染色体并进行G显带处理。通过Ikaros系统(德国Metasystems公司产品)进行分析判读,并摄取图像。染色体核型描述依据《人类细胞遗传学国际命名体制(ISCN,2016)》。
4.荧光原位杂交(FISH)检测:FGFR1/D8Z2三色分离探针购于英国Cytocell公司,PDGFRA三色分离探针和PDGFRB双色分离探针购于美国Vysis公司。参考产品说明书的操作方法,进行FISH检测。通过荧光显微镜Olympus BX51分析判读,并摄取图像。每份样品计数500个间期细胞,并观察中期分裂象。取10份正常人骨髓样本作对照,计算最佳临界(cut-off)值。
5.流式细胞术免疫分型:使用BD公司的Canto多色流式细胞仪检测;八色荧光抗体标记(FITC、PE、PerCP-Cy5.5、PECY7、APC、APC-H7、V450、PB、BV421、V500)标本。用于分析的抗体包括:CD34、CD117、HLA-DR、CD38、CD123、CD33、CD13、CD15、CD64、CD36、CD11b、CD14、CD19、cCD79b、CD10、CD20、CD5、CD2、CD7、cCD3、CD4、CD8、CD3、CD56、CD16、MPO等。以上抗体均购于美国BD公司及Beckman Culter公司。
6.二代测序基因突变分析:取患者骨髓标本提取DNA后,取1 µg DNA制备DNA全基因组文库。使用PCR引物扩增目的基因组,将目标区域DNA富集后,采用Ion Torrent测序平台进行测序。测序后原始数据利用人基因组数据库(hg19/GRCh37)、dbSNP、1000 genomes、HGMD、SIFT等数据库进行生物信息学分析,确定致病基因的突变位点。平均基因覆盖率99.0%,平均测序深度1 200×。
结果
1.患者临床表现和初诊血细胞计数:患者发病时多数有乏力、盗汗以及体重减轻表现,但均无发热。与肝脏肿大相比,淋巴结病及脾脏肿大更为多见,多为脾脏轻度肿大,例4脾脏可达肋缘下8 cm。
5例患者中位WBC 46.15(37.20~215.94)×109/L、HGB 118(93~153)g/L、PLT 84(61~367)×109/L。5例患者中2例单核细胞比例增高。所有患者嗜酸性粒细胞比例均增高,绝对计数(2.55~62.51)×109/L。患者临床表现详见表1。
表1. 5例伴嗜酸性粒细胞增多及FGFR1重排的髓系/淋系肿瘤患者基本资料.
| 例号 | 性别 | 年龄(岁) | 起病时临床表现 |
起病时血常规 |
|||||||||||
| 乏力 | 盗汗 | 发热 | 体重减轻 | 淋巴结肿大 | 肝脏肿大 | 脾脏肿大 | WBC(×109/L) | HGB(g/L) | PLT(×109/L) | EO#(×109/L) | EO比例(%) | MON#(×109/L) | |||
| 1 | 男 | 60 | + | + | − | + | + | + | + | 215.94 | 102 | 64 | 62.51 | 28.9 | 4.0 |
| 2 | 女 | 36 | − | − | − | + | − | − | − | 45.26 | 118 | 61 | 5.33 | 11.8 | 12.7 |
| 3 | 男 | 53 | − | − | − | + | +a | − | + | 46.15 | 138 | 109 | 2.55 | 5.5 | 5.1 |
| 4 | 男 | 18 | + | + | − | + | − | − | + | 58.02 | 93 | 84 | 20.82 | 35.9 | 3.2 |
| 5 | 男 | 6 | − | − | − | − | +a | − | − | 37.20 | 153 | 367 | 3.24 | 8.7 | 1.7 |
| 例号 | 起病至诊断时间(月) | 骨髓象 |
染色体核型 | FGFR1(FISH) | BCR-ABL | 治疗方案 | 转归 | 生存期c(月) | ||
| 增生程度 | 原始细胞(%) | EO比例(%) | ||||||||
| 1 | 6 | 极度活跃 | 4.2 | 5.5 | 46,XY,+Y,t(8;22)(p11;q11)[20] | + | − | 羟基脲 | 死亡 | 6 |
| 2 | 6 | 极度活跃 | 3.4 | 33.2 | 46,XX,del(8)(p11)[20] | + | − | 伊马替尼+BMT | 存活 | 26 |
| 3 | 1 | 极度活跃 | <1 | 9.5 | 46,XY,t(8;9)(p11;q34)[20] | + | − | 小剂量化疗b+地西他滨+达沙替尼+BMT | 死亡 | 22 |
| 4 | 2 | 极度活跃 | <1 | 27.2 | 46,XY,t(6;8)(p25;p11)[20] | + | − | 伊马替尼+UCBT | 死亡 | 7 |
| 5 | 9 | 极度活跃 | <1 | 10.8 | 46,XY,t(7;8;13)(q21;p21;q14)[20] | + | − | Vp16+DNR+Ara-C+伊马替尼 | 死亡 | 12 |
注:EO#:嗜酸性粒细胞绝对计数;MON#:嗜碱性粒细胞绝对计数;BMT:骨髓移植;UCBT:异基因非血缘脐血干细胞移植;Vp16:依托泊苷;DNR:柔红霉素。a病理活检为T淋巴母细胞淋巴瘤;b长春地辛+泼尼松+阿糖胞苷(Ara-C)+阿克拉霉素;c诊断至末次随访时间或死亡时间。+:阳性;−:阴性
2.诊断和治疗经过:5例患者自发病至确诊时间间隔1~9个月,3例患者超过6个月;2例患者曾按慢性髓性白血病(CML)予羟基脲和(或)伊马替尼治疗,1例患者曾考虑继发性嗜酸性粒细胞增多,给予泼尼松及抗寄生虫治疗。
所有病例骨髓形态均提示粒系明显增生,多为各阶段幼稚粒细胞,原始细胞比例均未超过5%,3例患者伴有嗜酸性粒细胞明显增多,1例骨髓形态类似慢性粒-单核细胞白血病。2例患者行淋巴结切检,病理回报为T淋巴母细胞淋巴瘤,并均进展至急性髓系白血病(AML)。
4例患者染色体核型分析涉及8p11的异常,其中3例染色体易位类型既往文献均有报道[2]–[5],例2患者染色体异常为缺失而非易位,RT-PCR扩增追查发现ZNF198-FGFR1融合基因阳性。例5染色体易位涉及8p21,但FGFR1基因重排阳性率达85%,可能与核型分析精确性相关。所有患者染色体FISH PDGFRA/PDGFRB双色探针检测基因重排均为阴性,双色分离探针FGFR1检测均提示FGFR1基因重排阳性(图1)。所有患者BCR-ABL、AML1-ETO、PML-RARα、CBFβ-MYH11融合基因均为阴性;所有患者均行二代测序,发现突变基因为RUNX1、FAT1、RELN、ASXL1,未发现JAK2、NPM1、FLT3-ITD、IDH1、DNMT3A基因突变。
图1. FISH检测FGFR1基因重排结果.
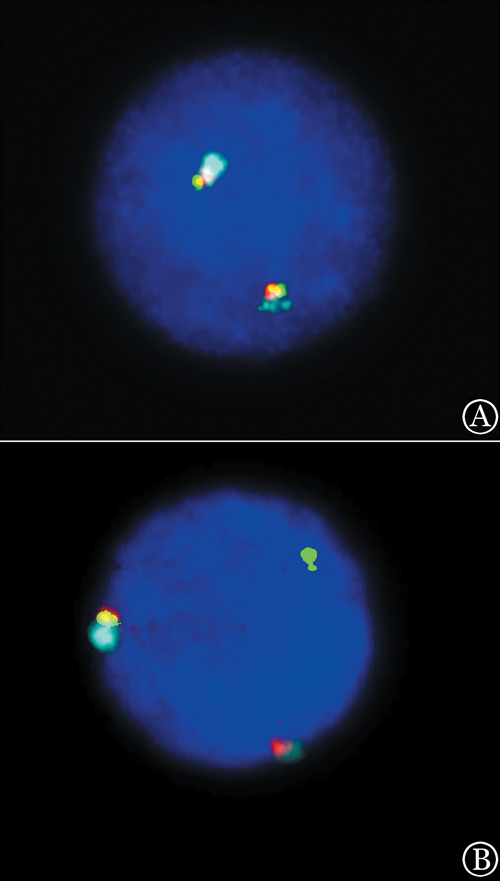
A:双色FISH检测正常细胞,显示为红绿融合信号;B:双色FISH检测8p11阳性细胞,显示为一红一绿一融合,提示FGFR1基因重排阳性
例1因年龄及经济原因,给予羟基脲维持治疗,确诊2个月后死亡;其余4例患者均应用酪氨酸激酶抑制剂(TKI)联合化疗,最长生存期26个月。例5确诊前口服泼尼松及抗组胺药物治疗,确诊后给予伊马替尼及羟基脲,FGFR1基因重排持续阳性,7个月后进展为AML并给予联合方案化疗(表1),最终因疾病进展及重度感染死亡。5例患者中3例进行了异基因造血干细胞移植治疗,其中2例患者进行了HLA同胞全相合造血干细胞移植:例2确诊后即口服伊马替尼并行造血干细胞移植,随访期结束仍生存;例3应用包含急性淋巴细胞白血病治疗方案的小剂量化疗联合去甲基化药物进行治疗,FGFR1基因重排一度转阴,维持约2个月后再度转阳性,后应用传统化疗联合地西他滨/达沙替尼治疗,慢性期达18个月,此后进展为AML并行造血干细胞移植,移植过程中出现严重感染死亡。例4确诊后行异基因非血缘脐血干细胞移植,移植后1个月因多脏器功能衰竭死亡。
讨论
EMS是临床上罕见的一种恶性血液肿瘤疾病,在任何年龄阶段均可发生,报道病例中年龄最小5个月,最大84岁[6]–[7]。多数患者起病时伴有乏力、盗汗、体重减轻或出现不明原因发热,少数患者起病无症状,仅发现全血细胞计数异常。全身淋巴结肿大并可累及结外淋巴组织是EMS显著特征之一,60%的患者有脾脏肿大。此外,EMS患者外周血白细胞计数多明显增高,嗜酸性粒细胞增多;骨髓检查髓系细胞过度增生,嗜酸性粒细胞比例多增高,类似CML或慢性粒-单核细胞白血病骨髓象,易误诊。EMS在临床表现及骨髓形态学上无特异性,因此对嗜酸性粒细胞增多伴有骨髓细胞明显增生患者,需考虑到EMS的可能。而伴有骨髓增殖性肿瘤的临床和实验室表现同时组织病理提示T淋巴母细胞淋巴瘤的结果很少发生于其他疾病,多提示EMS。与CML相似,EMS也有慢性期和急变期,急变多发生在诊断后2年内,平均时间4.2个月[7],多数进展为CML。目前,EMS尚无特定的流式细胞标志,染色体核型分析和染色体FISH仍是EMS诊断的主要方式。随着分子生物学技术的进展,RT-PCR技术可为EMS的诊断提供更为敏感的检测方法。本文5例患者临床特征均为外周血白细胞计数明显升高,嗜酸性粒细胞及单核细胞绝对值增高;骨髓形态学提示粒系高度增生,2例伴嗜酸性粒细胞比例增高,1例形态类似慢性粒-单核细胞白血病骨髓象。因其骨髓形态的不典型性,或初始没有进行染色体核型分析、融合基因筛查,导致诊断延误,发病至确诊的平均时间为4.8个月。3例患者曾误诊为其他疾病,最长发病至确诊间隔时间达9个月,其中1例患者确诊2个月后死亡,1例患者快速进展为AML。因此,对于白细胞计数和嗜酸性粒细胞比例增高的患者,应注意染色体核型分析和相关融合基因(甚至FISH重排)检测,有利于减少误诊,早期诊断且为后续治疗争取时间。
EMS累及8号染色体短臂(8p11)FGFR1基因的易位,FGFR1基因与伙伴基因融合后,持续活化FGFR1酪氨酸激酶活性,导致细胞增殖及恶性转化。目前报道有14种伙伴基因,与FGFR1易位融合形成不同的融合基因,对应不同的染色体改变[3]–[5],[8]–[19]。其中,t(8;13)(p11;q12)是报道中EMS患者最常见的染色体易位,约占目前报道病例的1/2,这类患者临床表现多见周身淋巴结肿大。EMS患者伴t(8;22)(p11;q11)与其他染色体易位类型的EMS相比发病年龄较大(中位年龄61岁)[2],常伴白细胞明显增高、中性粒细胞以及嗜碱性粒细胞增多,骨髓形态与CML相似,易误诊。既往文献中,扁桃体受累多与t(8;9)(p11;q34)相关,其他类型少见,而该类型单核细胞计数增多也更常见。而在伴t(6;8)的EMS中,嗜酸性粒细胞绝对计数增高更为显著[5]。本文5例FGFR1基因重排患者染色体均涉及8染色体短臂的异常,3例染色体易位分别为t(6;8)、t(8;9)、t(8;22),均为典型EMS染色体易位表现;例2为8号染色体p11缺失而非易位;例5染色体异常并未涉及8p11,而是在8号染色体短臂2区1带发生易位。与目前已报道EMS特征核型不相符,分析可能受三方面因素影响:①核型方法本身的精确性,核型条带只能看出5 Mb大小以上的异常,而FISH则更为精确。②核型分析本身的缺陷,细胞培养时生长不佳,导致了核型条带辨认误差。③个人主观因素误差。由此可见,除了常规染色体核型检查外,FISH及PCR方法检测对EMS的诊断亦具有极其重要的意义。
EMS目前尚无公认统一的治疗方案,疾病慢性期可用羟基脲以及淋巴瘤CHOP方案为基础的方案治疗,干扰素可能有效[20]。但本病进展迅速,平均白血病转化时间是4.2个月,常规化疗往往效果不佳,无法达到细胞遗传学的改善。Jackson等[7]对48例EMS患者进行统计,接受常规化疗的非移植患者中位生存期仅为1年。TKI可抑制FGFR1激酶活性,从而抑制下游通路的激活,体外实验报道可抑制EMS细胞系KG1细胞与EMS原代细胞的增殖和生长,并促进其凋亡[21]–[23]。目前亦有临床应用TKI治疗EMS的个案报道[24],但临床疗效尚未得到肯定。本文4例患者应用TKI联合化疗治疗,生存期长短不一。尽管靶向药物为EMS的治疗提供了新的选择,仍需更多的实验加以证实。目前尚无去甲基化药物治疗EMS的机制及疗效的相关报道,本文例3应用地西他滨联合小剂量化疗曾取得短暂的分子生物学缓解,鉴于去甲基化药物在同属干细胞起源的恶性疾病骨髓增生异常综合征、骨髓增殖性肿瘤方面被证实具有良好的疗效,去甲基化药物对于本类疾病是否同样有临床疗效,亦未可知,尚需探索和尝试。异基因造血干细胞移植是目前治愈EMS的唯一有效手段[25]。本文两例患者进行HLA同胞全相合造血干细胞移植,1例至随访结束仍存活,生存期已达26个月。应建议EMS患者尽早寻找合适供者,于慢性期进行异基因造血干细胞移植。
综上所述,EMS是一种少见的、伴嗜酸性粒细胞增多的髓系/淋系肿瘤,因其发病率低,前期临床表现多样,且骨髓形态不典型,临床上常被误诊漏诊。本病进展迅速,常规治疗疗效不佳,一旦延误可能丧失治疗时机,因此对于疑似病例及时进行细胞遗传学及分子生物学检查,可有助于早期诊断。一旦确诊,应在维持慢性期治疗基础上尽早行异基因造血干细胞移植。此外,针对FGFR1的靶向药物可能会为EMS提供更多的治疗选择。
Funding Statement
基金项目:国家科技重大专项(2017ZX09304024);天津市科技计划项目(15ZXLCSY00010)
Fund program: Important National Science & Technology Specific Projects(2017ZX09304024); Science and technology project of Tianjin(15ZXLCSY00010)
References
- 1.Arber DA, Orazi A, Hasserjian R, et al. The 2016 revision to the World Health Organization classification of myeloid neoplasms and acute leukemia[J] Blood. 2016;127(20):2391–2405. doi: 10.1182/blood-2016-03-643544. [DOI] [PubMed] [Google Scholar]
- 2.Demiroglu A, Steer EJ, Heath C, et al. The t(8;22) in chronic myeloid leukemia fuses BCR to FGFR1: transforming activity and specific inhibition of FGFR1 fusion proteins[J] Blood. 2001;98(13):3778–3783. doi: 10.1182/blood.v98.13.3778. [DOI] [PubMed] [Google Scholar]
- 3.Buijs A, van Wijnen M, van den Blink D, et al. A ZMYM2-FGFR1 8p11 myeloproliferative neoplasm with a novel nonsense RUNX1 mutation and tumor lysis upon imatinib treatment[J] Cancer Genet. 2013;206(4):140–144. doi: 10.1016/j.cancergen.2013.04.001. [DOI] [PubMed] [Google Scholar]
- 4.Chaffanet M, Popovici C, Leroux D, et al. t(6;8), t(8;9) and t(8;13) translocations associated with stem cell myeloproliferative disorders have close or identical breakpoints in chromosome region 8p11-12[J] Oncogene. 1998;16(7):945–949. doi: 10.1038/sj.onc.1201601. [DOI] [PubMed] [Google Scholar]
- 5.Mozziconacci MJ, Carbuccia N, Prebet T, et al. Common features of myeloproliferative disorders with t(8;9) (p12;q33) and CEP110-FGFR1 fusion: report of a new case and review of the literature[J] Leuk Res. 2008;32(8):1304–1308. doi: 10.1016/j.leukres.2007.11.012. [DOI] [PubMed] [Google Scholar]
- 6.Zhang WW, Habeebu S, Sheehan AM, et al. Molecular monitoring of 8p11 myeloproliferative syndrome in an infant[J] J Pediatr Hematol Oncol. 2009;31(11):879–883. doi: 10.1097/MPH.0b013e3181b83fd0. [DOI] [PubMed] [Google Scholar]
- 7.Jackson CC, Medeiros LJ, Miranda RN. 8p11 myeloproliferative syndrome: a review[J] Hum Pathol. 2010;41(4):461–476. doi: 10.1016/j.humpath.2009.11.003. [DOI] [PubMed] [Google Scholar]
- 8.Vizmanos JL, Hernández R, Vidal MJ, et al. Clinical variability of patients with the t(6;8) (q27;p12) and FGFR1OP-FGFR1 fusion: two further cases[J] Hematol J. 2004;5(6):534–537. doi: 10.1038/sj.thj.6200561. [DOI] [PubMed] [Google Scholar]
- 9.Fioretos T, Panagopoulos I, Lassen C, et al. Fusion of the BCR and the fibroblast growth factor receptor-1 (FGFR1) genes as a result of t(8;22) (p11;q11) in a myeloproliferative disorder: the first fusion gene involving BCR but not ABL[J] Genes Chromosomes Cancer. 2001;32(4):302–310. doi: 10.1002/gcc.1195. [DOI] [PubMed] [Google Scholar]
- 10.Guasch G, Popovici C, Mugneret F, et al. Endogenous retroviral sequence is fused to FGFR1 kinase in the 8p12 stem-cell myeloproliferative disorder with t(8;19) (p12;q13.3)[J] Blood. 2003;101(1):286–288. doi: 10.1182/blood-2002-02-0577. [DOI] [PubMed] [Google Scholar]
- 11.Grand EK, Grand FH, Chase AJ, et al. Identification of a novel gene, FGFR1OP2, fused to FGFR1 in 8p11 myeloproliferative syndrome[J] Genes Chromosomes Cancer. 2004;40(1):78–83. doi: 10.1002/gcc.20023. [DOI] [PubMed] [Google Scholar]
- 12.Belloni E, Trubia M, Gasparini P, et al. 8p11 myeloproliferative syndrome with a novel t(7;8) translocation leading to fusion of the FGFR1 and TIF1 genes[J] Genes Chromosomes Cancer. 2005;42(3):320–325. doi: 10.1002/gcc.20144. [DOI] [PubMed] [Google Scholar]
- 13.Walz C, Chase A, Schoch C, et al. The t(8;17) (p11;q23) in the 8p11 myeloproliferative syndrome fuses MYO18A to FGFR1[J] Leukemia. 2005;19(6):1005–1009. doi: 10.1038/sj.leu.2403712. [DOI] [PubMed] [Google Scholar]
- 14.Soler G, Nusbaum S, Varet B, et al. LRRFIP1, a new FGFR1 partner gene associated with 8p11 myeloproliferative syndrome[J] Leukemia. 2009;23(7):1359–1361. doi: 10.1038/leu.2009.79. [DOI] [PubMed] [Google Scholar]
- 15.Bae SY, Kim JS, Han EA, et al. Cytogenetic abnormality involving 8p11.2 in T-lymphoblastic lymphoma: report of a new case[J] Cancer Genet Cytogenet. 2009;191(1):57–58. doi: 10.1016/j.cancergencyto.2009.02.003. [DOI] [PubMed] [Google Scholar]
- 16.Sohal J, Chase A, Mould S, et al. Identification of four new translocations involving FGFR1 in myeloid disorders[J] Genes Chromosomes Cancer. 2001;32(2):155–163. doi: 10.1002/gcc.1177. [DOI] [PubMed] [Google Scholar]
- 17.Wasag B, Lierman E, Meeus P, et al. The kinase inhibitor TKI258 is active against the novel CUX1-FGFR1 fusion detected in a patient with T-lymphoblastic leukemia/lymphoma and t(7;8) (q22;p11)[J] Haematologica. 2011;96(6):922–926. doi: 10.3324/haematol.2010.036558. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18.Li F, Zhai YP, Tang YM, et al. Identification of a novel partner gene, TPR, fused to FGFR1 in 8p11 myeloproliferative syndrome[J] Genes Chromosomes Cancer. 2012;51(9):890–897. doi: 10.1002/gcc.21973. [DOI] [PubMed] [Google Scholar]
- 19.Gervais C, Dano L, Perrusson N, et al. A translocation t(2;8) (q12;p11) fuses FGFR1 to a novel partner gene, RANBP2/NUP358, in a myeloproliferative/myelodysplastic neoplasm[J] Leukemia. 2013;27(5):1186–1188. doi: 10.1038/leu.2012.286. [DOI] [PubMed] [Google Scholar]
- 20.Zhou L, Fu W, Yuan Z, et al. Complete molecular remission after interferon alpha treatment in a case of 8p11 myeloproliferative syndrome[J] Leuk Res. 2010;34(11):e306–307. doi: 10.1016/j.leukres.2010.06.027. [DOI] [PubMed] [Google Scholar]
- 21.Chen J, Deangelo DJ, Kutok JL, et al. PKC412 inhibits the zinc finger 198-fibroblast growth factor receptor 1 fusion tyrosine kinase and is active in treatment of stem cell myeloproliferative disorder[J] Proc Natl Acad Sci U S A. 2004;101(40):14479–14484. doi: 10.1073/pnas.0404438101. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 22.Chase A, Grand FH, Cross NC. Activity of TKI258 against primary cells and cell lines with FGFR1 fusion genes associated with the 8p11 myeloproliferative syndrome[J] Blood. 2007;110(10):3729–3734. doi: 10.1182/blood-2007-02-074286. [DOI] [PubMed] [Google Scholar]
- 23.Landberg N, Dreimane A, Rissler M, et al. Primary cells in BCR/FGFR1-positive 8p11 myeloproliferative syndrome are sensitive to dovitinib, ponatinib, and dasatinib[J] Eur J Haematol. 2017;99(5):442–448. doi: 10.1111/ejh.12957. [DOI] [PubMed] [Google Scholar]
- 24.Wehrli M, Oppliger LE, Gattiker HH, et al. Response to Tyrosine Kinase Inhibitors in Myeloproliferative Neoplasia with 8p11 Translocation and CEP110-FGFR1 Rearrangement[J] Oncologist. 2017;22(4):480–483. doi: 10.1634/theoncologist.2016-0354. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 25.Dolan M, Cioc A, Cross NC, et al. Favorable outcome of allogeneic hematopoietic cell transplantation for 8p11 myeloproliferative syndrome associated with BCR-FGFR1 gene fusion[J] Pediatr Blood Cancer. 2012;59(1):194–196. doi: 10.1002/pbc.23404. [DOI] [PubMed] [Google Scholar]


