Abstract
目的
探讨手术联合化疗与单纯化疗对原发胃弥漫大B细胞淋巴瘤(PGDLBCL)患者生存的影响,并分析化疗过程中联合应用利妥昔单抗(R)对其预后的影响。
方法
回顾性分析83例PGDLBCL患者的临床资料,并分析外科手术及利妥昔单抗对患者生存的影响。
结果
83例患者中男43例,女40例,中位年龄52 (20~76)岁,中位随访时间为36 (4~59)个月。手术联合化疗组(40例)和单纯化疗组(43例)患者的5年总生存(OS)率分别为68.4%、85.9%(P=0.117),疾病无进展生存(PFS)率分别为66.7%、82.6%(P=0.258),差异均无统计学意义。手术联合化疗患者中R-CHOP方案组(23例)和CHOP方案组(17例)患者的5年OS率分别为73.6%、64.2%(P=0.113),PFS率分别为71.2%、62.5%(P= 0.147);单纯化疗患者中R-CHOP方案组(24例)和CHOP方案组(19例)患者的5年OS率分别为85.7%、83.5%(P=0.152),PFS率分别为83.4%、81.8%(P=0.307)。单纯化疗组和手术联合化疗组Lugano分期早期(Ⅰ~Ⅱ1期)患者的5年OS率分别为86.4%、78.7%,差异无统计学意义(P=0.283);晚期(Ⅱ2~Ⅳ期)患者分别为74.6%、58.5%,差异有统计学意义(P=0.040)。多因素分析显示IPI评分是影响预后的独立因素(RR=0.370,95% CI 0.089~3.537,P=0.015)。
结论
单纯化疗或手术联合化疗对PGDLBCL患者长期生存的影响差异无统计学意义,但由于手术可能造成患者生存质量的下降,因此对于无手术指征者更倾向于推荐单纯化疗。本研究中利妥昔单抗的联合应用未能使大部分这类患者的生存显著获益,但这需要进一步多中心、大样本的研究来证实。
Keywords: 淋巴瘤,大B细胞,弥漫性, 胃, 消化系统外科手术, 利妥昔单抗
Abstract
Objective
To evaluate the outcome of surgical resection and rituximab for treatment of primary gastric diffuse large B cell lymphoma (PGDLBCL).
Methods
Data of 83 patients with primary gastric diffuse large B cell lymphoma were reviewed retrospectively. 40 patients received surgical resection followed by chemotherapy, and the other 43 patients chemotherapy alone. The two groups were further divided into four sub-groups according to chemotherapy regimens (CHOP or R-CHOP). Overall survival (OS) and progression free survival (PFS) as two prognostic indexes were analyzed.
Results
The median age of these 83 cases at diagnosis was 52 years (range, 20–76 years) with a male-to-female ratio of 43 to 40. And the follow-up duration ranged from 4–59 months (mean 36 months). The 5-year PFS for the patients received surgery and chemotherapy was 66.7%. PFS for the patients received chemotherapy alone was 82.6%. And 5-year OS for these two groups was 68.4% and 85.9%,respectively. OS and PFS of chemotherapy alone group were better than the other one without statistically significance. In the combined group, the 5-year OS were 73.6% for patients received R-CHOP and 64.2% for patients received CHOP; the 5-year-PFS were 71.2% and 62.5%, respectively. Meanwhile, the 5-year OS for patients received R-CHOP and CHOP were 85.7% and 83.5%; the 5-year-PFS were 83.4% and 81.8%, respectively. The OS and PFS did not differ significantly (P>0.05) between two chemotherapy regimens. According to the Lugano stage, those who received chemotherapy alone for the patients with advanced stage (Ⅱ2, ⅡE or Ⅳ) had better OS compared with received surgery and chemotherapy. A significant difference was found between the two groups (P<0.05). However for the patients with early stage (Ⅰ or Ⅱ2), there was no statistically significance between the two groups (P>0.05). Univariate analysis showed that age, ECOG, Lugano stage, level of LDH and IPI score (P<0.05) were factors of survival in patients with PGDLBCL. And multivariate analysis showed that IPI score was an independent prognostic factor for OS.
Conclusion
The survival of the patients received combined surgery and chemotherapy was not superior to those received chemotherapy alone. There was no statistically significance between two different regimens for prognosis of PGDLBCL. Because of poor quality of life caused by surgery, surgery shouldn't now been recommended for the patients with PGDLBCL without operative indication. Rituximab had no positive influence on OS and PFS in most patients with PGDLBCL, but this result should be confirmed by further large sample and multi-center study.
Keywords: Lymphoma, large B cell, diffuse; Stomach; Digestive system surgical procedures; Rituximab
原发胃弥漫大B细胞淋巴瘤(PGDLBCL)占胃恶性肿瘤的1%~7%,近年来PGDLBCL的发病率亦呈明显上升趋势[1]。随着诊疗方法的不断改进,PGDLBCL患者的5年总生存(OS)率从20世纪60年代的37%上升至90年代的60%[2]。PGDLBCL的治疗手段包括手术、化疗及放疗等,目前其治疗选择仍然存在争议。主要是手术联合化疗与单纯化疗之间该如何选择;化疗的同时联合应用利妥昔单抗可否使这类患者获益。针对这些问题的文献报道少见。我们对43例接受单纯化疗的PGDLBCL患者临床资料进行回顾性分析,并与同期40例接受手术联合化疗的患者进行比较,观察手术治疗及利妥昔单抗对患者生存的影响。
病例与方法
1.病例:2010年1月至2014年12月苏州大学附属第一、第二医院收治的83例PGDLBCL患者纳入研究,男43例,女40例,中位年龄52(20~76)岁。手术联合化疗组40例(其中R-CHOP方案组23例,CHOP方案组17例),单纯化疗组43例(其中R-CHOP方案组24例,CHOP方案组19例)。两组患者的一般临床特征见表1。
表1. 不同治疗策略患者的一般临床特征[例(%)].
| 临床特征 | 手术联合化疗组(40例) | 单纯化疗组(43例) | P值 |
| 年龄(岁) | 0.211 | ||
| ≤60 | 15(37.5) | 22(51.2) | |
| > 60 | 25(62.5) | 21(48.8) | |
| 性别 | 0.449 | ||
| 男 | 19(47.5) | 24(55.8) | |
| 女 | 21(52.5) | 19(44.2) | |
| Ann Arbor分期 | 0.084 | ||
| Ⅰ~Ⅱ期 | 27(67.5) | 36(83.7) | |
| Ⅲ~Ⅳ期 | 13(32.5) | 7(16.3) | |
| Lugano分期 | 0.350 | ||
| Ⅰ~Ⅱ1期 | 26(65.0) | 32(74.4) | |
| Ⅱ2~Ⅳ期 | 14(35.0) | 11(25.6) | |
| ECOG评分 | 0.739 | ||
| <2分 | 19(47.5) | 22(51.2) | |
| ≥2分 | 21(52.5) | 21(48.8) | |
| IPI评分 | 0.818 | ||
| ≤2分 | 27(67.5) | 28(65.1) | |
| >2分 | 13(32.5) | 15(34.9) | |
| 结外病灶数 | 0.545 | ||
| <2个 | 32(80.0) | 32(74.4) | |
| ≥2个 | 8(20.0) | 11(25.6) | |
| LDH(U/L) | 0.794 | ||
| ≤245 | 24(60.0) | 27(62.8) | |
| > 245 | 16(40.0) | 16(37.2) | |
| 化疗方案 | 0.887 | ||
| R-CHOP | 23(57.5) | 24(55.8) | |
| CHOP | 17(42.5) | 19(44.2) |
注:R:利妥昔单抗;CHOP方案:环磷酰胺、阿霉素或吡喃阿霉素或表阿霉素、长春新碱、泼尼松
2.治疗:手术联合化疗组的患者大多接受胃大部切除术,并于术后1个月左右开始进行化疗。两组患者的化疗方案均为R-CHOP方案或CHOP方案,每3周为1个疗程,共6~8个疗程。CHOP方案:环磷酰胺(CTX)750 mg/m2,第1天;阿霉素(ADM) 50 mg/m2或吡喃阿霉素(THP)50 mg/m2或表阿霉素(EPI)75 mg/m2,第1天;长春新碱(VCR)1.4 mg/m2(最大剂量2 mg),第1天;泼尼松(PDN)60 mg/d,第1~5天。利妥昔单抗375 mg/m2在化疗前1 d输注。甲泼尼龙预处理避免寒战、发热、水肿及低血压等输液相关反应;若患者在化疗过程中出现中性粒细胞减少、缺乏,可以酌情使用G-CSF对症支持治疗;若患者中性粒细胞减少持续至下1个疗程,则可延迟1~2周,待患者血常规好转后再继续进行化疗。
3.诊断和疗效标准:所有患者均采用2008年WHO的DLBCL诊断标准,且所有入组患者均经病理学检查明确诊断。采用5年总生存(OS)、疾病无进展生存(PFS)来评估远期疗效。PFS以诱导治疗结束后3周为起点,肿瘤复发、进展或死亡为终点计算;OS以患者首次确诊为起点,死亡或末次随访日期为终点计算。
4.随访:随访截止日期为2015年2月28日。通过门诊、电话联系等方式进行随访。
5.统计学处理:采用SPSS 18.0软件进行统计学分析。以卡方检验比较两组计数资料是否均衡;各组患者的生存率采用Kaplan-Meier法进行评估,以P≤0.05为标准筛选出可能对预后有影响的指标;多因素分析采用Cox回归模型确定可能的危险因素,采用后退法。所有的检验均取双侧检验,P<0.05为差异有统计学意义。
结果
1.两组患者一般临床特征比较:两组患者在年龄(P=0.211)、性别(P=0.449)、Ann Arbor分期(P= 0.084)、Lugano分期(P=0.350)、美国东部肿瘤协作组(ECOG)体能状态评分(P=0.739)、国际预后指数(IPI)评分(P=0.818)、结外转移灶数量(P=0.545)、LDH水平(P=0.794)、采用不同化疗方案治疗人数(P=0.887)方面差异均无统计学意义(表1),具有可比性。两组患者中大部分尚属早期,病灶局限。
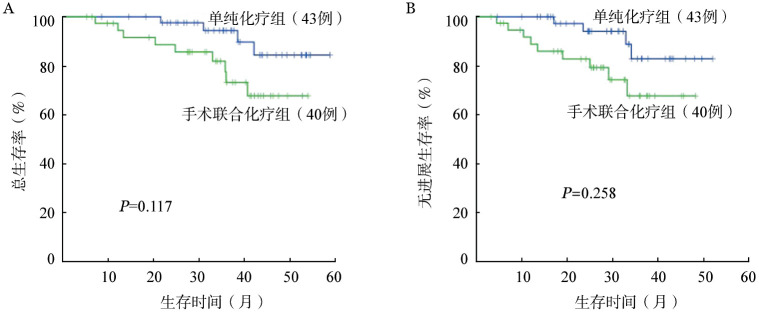
2.两组患者的远期疗效比较:单纯化疗组和手术联合化疗组患者的5年OS率分别为85.9%、68.4%(P=0.117);PFS率分别为82.6%、66.7%(P= 0.258)。单纯化疗组患者的OS和PFS率均较手术联合化疗组高,但差异均无统计学意义(图1)。
图1. 单纯化疗组与手术联合化疗组患者总生存(A)和疾病无进展生存(B)比较.
3.利妥昔单抗对患者远期疗效的影响:40例接受手术联合化疗的患者中,R-CHOP方案组(23例)和CHOP方案组(17例)患者的OS率分别为73.6%、64.2%(P=0.113),PFS率分别为71.2%、62.5%(P= 0.147);43例接受单纯化疗的患者中,R-CHOP方案组(24例)和CHOP方案组(19例)患者的OS率分别为85.7%、83.5%(P=0.152),PFS率分别为83.4%、81.8%(P=0.307)。结果显示各组使用利妥昔单抗者较未使用者虽然OS、PFS率略有提高,但差异均无统计学意义。
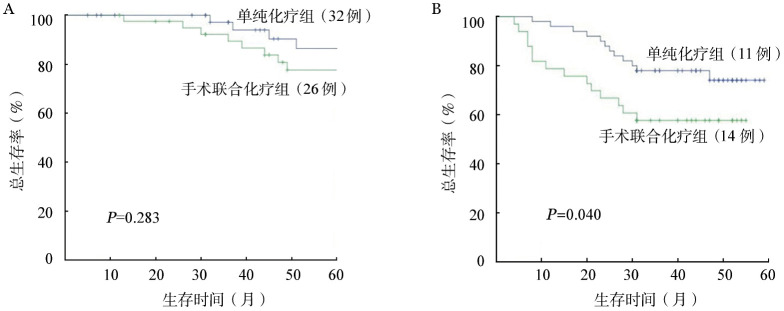
4.手术对早期与晚期患者生存的影响:Lugano分期Ⅰ~Ⅱ1期患者中,单纯化疗组(32例)和手术联合化疗组(26例)患者的5年OS率分别为86.4%、78.7%(P=0.283);Ⅱ2~Ⅳ期患者中,单纯化疗组(11例)和手术联合化疗组(14例)患者的5年OS率分别为74.6%、58.5%(P=0.040)。结果显示手术与否对早期患者长期生存的影响差异无统计学意义,而对于晚期患者则差异有统计学意义(图2)。
图2. 外科手术对不同Lugano分期患者总生存的影响.
A:Lugano分期Ⅰ~Ⅱ1期患者;B:Lugano分期Ⅱ2~Ⅳ期患者
5.预后因素分析:单因素分析结果显示不同性别、Ann Arbor分期、结外病灶数组患者的5年OS和PFS率差异均无统计学意义(P值均>0.05),而不同年龄、Lugano分期、ECOG评分、LDH水平、IPI评分分组患者的5年OS和PFS率差异均有统计学意义(P值均<0.05)(表2)。多因素Cox回归分析结果显示,只有IPI评分是影响患者预后的独立因素(RR= 0.370,95% CI 0.089~3.537,P=0.015)(表3)。
表2. 83例原发胃弥漫大B细胞淋巴瘤患者预后单因素分析.
| 影响因素 | 例数 | 5年OS |
5年PFS |
||
| 率(%) | P值 | 率(%) | P值 | ||
| 性别 | 0.712 | 0.819 | |||
| 男 | 43 | 83.7 | 79.1 | ||
| 女 | 40 | 87.5 | 82.5 | ||
| 年龄(岁) | 0.027 | 0.031 | |||
| ≤60 | 37 | 87.2 | 90.0 | ||
| >60 | 46 | 74.5 | 72.1 | ||
| Ann Arbor分期 | 0.054 | 0.057 | |||
| Ⅰ~Ⅱ期 | 63 | 96.3 | 92.6 | ||
| Ⅲ~Ⅳ期 | 20 | 80.4 | 74.5 | ||
| Lugano分期 | 0.036 | 0.047 | |||
| Ⅰ~Ⅱ1期 | 58 | 96.5 | 91.7 | ||
| Ⅱ2~Ⅳ期 | 25 | 78.6 | 72.6 | ||
| ECOG评分 | 0.001 | 0.001 | |||
| <2分 | 41 | 100.0 | 95.5 | ||
| ≥2分 | 42 | 72.0 | 70.2 | ||
| 结外病灶数 | 0.811 | 0.430 | |||
| <2个 | 64 | 84.2 | 88.2 | ||
| ≥2个 | 19 | 85.9 | 78.8 | ||
| 血清LDH(U/L) | 0.006 | 0.025 | |||
| ≤245 | 51 | 94.1 | 88.2 | ||
| >245 | 32 | 71.9 | 68.8 | ||
| IPI评分 | 0.004 | 0.001 | |||
| ≤2分 | 55 | 100.0 | 100.0 | ||
| >2分 | 28 | 76.9 | 69.2 | ||
| 治疗策略 | 0.117 | 0.258 | |||
| 手术联合化疗 | 40 | 68.4 | 66.7 | ||
| 单纯化疗 | 43 | 85.9 | 82.6 | ||
| 化疗方案 | 0.178 | 0.347 | |||
| R-CHOP | 47 | 78.2 | 77.5 | ||
| CHOP | 36 | 75.7 | 74.9 | ||
注:R-CHOP方案:利妥昔单抗、环磷酰胺、阿霉素或吡喃阿霉素或表阿霉素、长春新碱、泼尼松
表3. 83例原发胃弥漫大B细胞淋巴瘤患者预后多因素分析.
| 变量 | RR(95%CI) | P值 |
| 性别(男/女) | 0.469(0.324~3.013) | 0.686 |
| 年龄(≤60岁/>60岁) | 0.457(0.179~2.892) | 0.616 |
| Ann Arbor分期(Ⅰ~Ⅱ期/Ⅲ~Ⅳ期) | 0.321(0.138~3.291) | 0.437 |
| Lugano分期(Ⅰ~Ⅱ1期/Ⅱ2~Ⅳ期) | 0.305(0.102~3.375) | 0.172 |
| ECOG评分(<2分/≥2分) | 0.494(0.243~3.509) | 0.926 |
| 结外病灶数(<2个/≥2个) | 0.235(0.046~1.437) | 0.114 |
| 血清LDH(≤245 U/L/>245 U/L) | 0.605(1.232~4.378) | 0.067 |
| IPI评分(<2分/≥2分) | 0.370(0.089~3.537) | 0.015 |
| 治疗策略(手术联合化疗/单纯化疗) | 0.568(0.098~4.257) | 0.950 |
| 化疗方案(R-CHOP方案/CHOP方案) | 0.436(0.107~6.871) | 0.568 |
注:R:利妥昔单抗;CHOP方案:环磷酰胺、阿霉素或吡喃阿霉素或表阿霉素、长春新碱、泼尼松
讨论
DLBCL结外病变最常见的部位是胃,其次为小肠、回盲部和结直肠等[3]。长期以来,手术治疗都是早期胃部DLBCL患者的首选治疗方式。但随着化疗药物不良反应的降低,化学免疫疗法适应证的不断拓展,重要脏器保留的益处也逐渐显现。近年来的研究显示,以化疗为主的治疗可以达到与外科治疗相似的疗效,且随着超声内镜及影像技术的发展,外科手术在诊断、分期方面的作用逐渐被替代。另外,得益于对病因认识的深入、肿瘤分期和疗效评价系统的改进、新的化学免疫治疗方案的出现以及放疗技术的进步,PGDLBCL的治疗有了很大的进展。
近年来一些国外学者在采用单纯化疗方案治疗PGDLBCL的可行性和有效性上达成共识[4],而相较之下国内这方面的研究还很少。我们的研究结果显示单纯化疗组与手术联合化疗组比较,患者的5年OS率和PFS率差异均无统计学意义(P值均> 0.05),且单纯化疗组患者的生活质量、营养状态明显优于手术联合化疗组。这一结果与国外的研究相符[4]。在研究中我们还发现单纯化疗组和手术联合化疗组Lugano分期早期(Ⅰ~Ⅱ1期)患者的5年OS率分别为86.4%、78.7%,差异无统计学意义(P= 0.283);晚期(Ⅱ2~Ⅳ期)患者分别为74.6%、58.5%,差异有统计学意义(P=0.040)。提示对于早期患者,考虑到对其生存质量的影响,手术并非必须;而对于晚期患者手术反而会降低其生存率。
利妥昔单抗在DLBCL患者的一线治疗中占有重要地位[5]。联合利妥昔单抗后能够提高初治DLBCL患者的远期生存率,但是对于PGDLBCL这种特殊类型的DLBCL,联合利妥昔单抗是否能使患者获益还缺少研究。为此我们对单纯化疗组和手术联合化疗组中,采用R-CHOP方案和CHOP方案的患者分别进行比较,分析利妥昔单抗对PGDLBCL患者预后的影响。结果显示单纯化疗组和手术联合化疗组中,采用CHOP方案与R-CHOP方案患者的5年OS及PFS率差异均无统计学意义(P值均>0.05)。Sohn等[6]在2012年也曾报道过相似的结果,发现利妥昔单抗的应用未能使这类患者显著获益。究其原因有:①利妥昔单抗的应用对局限期的早期患者获益不明显。曾有学者指出CHOP方案在早期PGDLBCL患者中已展现出显著疗效,因而利妥昔单抗的联合应用在此基础上所能增加的疗效并不显著[7]。事实上,其他类型的DLBCL患者通常发现时已为中晚期,肿瘤负荷高,而大部分PGDLBCL患者则为Ⅰ、Ⅱ1期,属于早期,病灶局限,肿瘤负荷相对较小[8]。利妥昔单抗对进展期尤其是肿瘤负荷高、弥散性的DLBCL疗效更佳,而对局限期的DLBCL患者其获益并不显著[9]。②利妥昔单抗对起源于结外的DLBCL疗效提高不明显。一项单中心研究提示由于生物学特征不同,利妥昔单抗对起源于结内与结外的DLBCL疗效不同。在结内DLBCL患者中,采用CHOP方案与R-CHOP方案患者的5年OS及PFS率差异有统计学意义,而对于结外DLBCL患者,其5年OS及PFS率差异均无统计学意义,PGDLBCL作为最常见的结外DLBCL这一特点尤为突出,即利妥昔单抗的联合应用可能不会像我们预期的那样明显提高这类患者的预后[10]。但另一方面,不管是上述研究还是我们的研究多为单中心研究,且都存在病例数相对较少的局限性,因此对于这一结论,可能还需要多中心、大样本的研究来进一步证实。
综上,对于PGDLBCL患者,在不合并如出血、穿孔等手术指征的情况下,考虑到手术可能带来的远期并发症以及生活质量的下降,故更推荐患者选择单纯化疗的治疗方案,并根据疾病状态、经济情况决定是否联合应用利妥昔单抗。
Funding Statement
基金项目:江苏省基础研究自然科学计划-面上项目(BK2012610);江苏省六大人才高峰高层次人才选拨培养资助方案(WSN-020)
Fund program: Natural Science Foundation of Jiangsu Province(BK2012610); Six Talent Summit Project of Jiangsu Province(WSN-020)
References
- 1.Ducreux M, Boutron MC, Piard F, et al. A 15-year series of gastrointestinal non-Hodgkin's lymphomas: a population-based study[J] Br J Cancer. 1998;77(3):511–514. doi: 10.1038/bjc.1998.82. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2.Brands F, Mönig SP, Raab M. Treatment and prognosis of gastric lymphoma[J] Eur J Surg. 1997;163(11):803–813. [PubMed] [Google Scholar]
- 3.万 伟, 王 晶, 景 红梅, et al. 110例原发胃肠道非霍奇金淋巴瘤临床特征与预后分析[J] 中华血液学杂志. 2011;32(10):652–655. doi: 10.3760/cma.j.issn.0253-2727.2011.10.002. [DOI] [Google Scholar]
- 4.Binn M, Ruskoné-Fourmestraux A, Lepage E, et al. Surgical resection plus chemotherapy versus chemotherapy alone: comparison of two strategies to treat diffuse large B-cell gastric lymphoma[J] Ann Oncol. 2003;14(12):1751–1757. doi: 10.1093/annonc/mdg495. [DOI] [PubMed] [Google Scholar]
- 5.陆 庭勋, 徐 卫, 李 建勇. 弥漫大B细胞淋巴瘤治疗进展:第56届美国血液学会年会报道[J] 白血病·淋巴瘤. 2015;24(1):9–12. doi: 10.3760/cma.j.issn.1009-9921.2015.01.004. [DOI] [Google Scholar]
- 6.Sohn BS, Kim SM, Yoon DH, et al. The comparison between CHOP and R-CHOP in primary gastric diffuse large B cell lymphoma[J] Ann Hematol. 2012;91(11):1731–1739. doi: 10.1007/s00277-012-1512-4. [DOI] [PubMed] [Google Scholar]
- 7.Avilés A, Castañeda C, Cleto S, et al. Rituximab and chemotherapy in primary gastric lymphoma[J] Cancer Biother Radiopharm. 2009;24(1):25–28. doi: 10.1089/cbr.2008.0507. [DOI] [PubMed] [Google Scholar]
- 8.López-Guillermo A, Colomo L, Jiménez M, et al. Diffuse large B-cell lymphoma: clinical and biological characterization and outcome according to the nodal or extranodal primary origin[J] J Clin Oncol. 2005;23(12):2797–2804. doi: 10.1200/JCO.2005.07.155. [DOI] [PubMed] [Google Scholar]
- 9.Persky DO, Unger JM, Spier CM, et al. Phase II study of rituximab plus three cycles of CHOP and involved-field radiotherapy for patients with limited-stage aggressive B-cell lymphoma: Southwest Oncology Group study 0014[J] J Clin Oncol. 2008;26(14):2258–2263. doi: 10.1200/JCO.2007.13.6929. [DOI] [PubMed] [Google Scholar]
- 10.Gutiérrez-García G, Colomo L, Villamor N, et al. Clinico-biological characterization and outcome of primary nodal and extranodal diffuse large B-cell lymphoma in the rituximab era[J] Leuk Lymphoma. 2010;51(7):1225–1232. doi: 10.3109/10428194.2010.483301. [DOI] [PubMed] [Google Scholar]