Abstract
目的
评估老年(≥60岁)重型再生障碍性贫血(SAA)患者接受兔抗人胸腺细胞球蛋白(rATG)/猪抗人淋巴细胞球蛋白(pALG)联合环孢素A(CsA)的强烈免疫抑制治疗(IST)方案的疗效和安全性。
方法
回顾性分析16例老年SAA患者接受rATG/pALG+CsA治疗的血液学反应率和安全性,分析影响疗效的相关因素。
结果
16例患者男13例,女3例,中位年龄63.5(60~79)岁,其中60~69岁13例,≥70岁3例;SAA患者9例,极重型AA(VSAA)患者7例;9例患者接受rATG治疗,7例患者接受pALG治疗。16例患者均顺利完成rATG/pALG治疗,治疗后早期死亡2例(12.5%),均为VSAA患者(2/7, 28.6%);IST后6个月9例(56.3%)患者获得血液学反应,5例无治疗反应。9例应用rATG的患者有2例获得血液学反应,7例应用pALG患者全部获得血液学反应,差异有统计学意义(22.2%对100.0%,P=0.003)。rATG/pALG+CsA相关不良反应轻微,经对症治疗好转。
结论
老年SAA接受rATG/pALG联合CsA的IST方案仍可获较好血液学反应;VSAA患者早期死亡率高,治疗风险大;pALG治疗老年SAA疗效可能优于rATG。
Keywords: 贫血,再生障碍性, 老年人, 免疫抑制法
Abstract
Objective
To evaluate the efficacy and safety of intensive immunosupressive therapy (IST) with antithymocyte/antilymphocyte globulin plus cyclosporine A in the treatment of older patients (≥60 years) with severe aplastic anemia (SAA).
Methods
The hematologic response and safety of sixteen older SAA patients treated with IST regimen in our hospital were retrospectively analyzed, and the factors affecting response were also explored.
Results
A total of 16 older SAA patients were involved, the median age was 63.5 (60–79) years. Among them, 7 were VSAA and 9 were SAA; 9 patients received Rabbit anti-human thymocyte globulin (rATG), and 7 patients porcine anti-human lymphocyte globulin (pALG). Two patients died within 3 months after IST; at the 6 months after IST, 9 patients achieved hematology response and 5 patients had no response; overall response rate was 56.3%. Two (22%) of the 9 patients treated with rATG achieved hematology response; However, all 7 patients (100.0%) treated with pALG achieved hematology response. rATG/pALG associated adverse reactions were mild and easily managed.
Conclusion
The older patients with SAA could still benefit from IST consisting of standard dose rATG/pALG with CsA, and the patients with VSAA had worse prognosis, pALG was inferior to rATG as a first treatment for SAA.
Keywords: Anemia, aplastic; Older; Immunosupressive therapy
重型再生障碍性贫血(Severe aplastic anemia,SAA)临床表现为重度全血细胞减少和骨髓造血衰竭,若不能给予积极有效的治疗,大多数患者会在诊断后的1~2年内死于出血或感染并发症。抗胸腺/淋巴细胞球蛋白(ATG/ALG)联合环孢素A (CsA)是目前公认的不适合行造血干细胞移植(HSCT)的SAA患者的一线强烈免疫抑制治疗(IST)方案。ATG/ALG+CsA治疗可以使60%~80%的SAA患者恢复三系造血。与HSCT不同,年龄本身不是IST的禁忌因素,其实施不受年龄限制[1],国外报道行IST SAA患者最大年龄为89岁[2]。然而国内对老年SAA患者行IST相对保守,缺少应用经验。为了解老年SAA患者行IST的有效性和安全性,我们回顾性总结了我院2006年10月至2014年10月16例接受IST的老年SAA患者的临床特征、IST的耐受性和疗效,初步分析了影响疗效的预后因素,以期对老年SAA患者的治疗提供临床依据。
病例与方法
1.病例:初治老年(年龄≥60岁)SAA/极重型AA(VSAA)患者16例,均为2006年10月至2014年10月我中心住院治疗患者。AA诊断依据1987年国际粒细胞减少和AA诊断标准[3],严重程度分型参照Camitta标准[4]。所有患者均行染色体检查、外周血细胞流式细胞术CD55、CD59或嗜水气单胞菌溶素变异体(Flaer)检测排除低增生性骨髓增生异常综合征(MDS)及阵发性睡眠性血红蛋白尿症(PNH)。所有患者均无重要脏器功能严重异常。
2.IST方案:兔抗人ATG (rATG,美国健赞公司产品)1.75~3.50 mg·kg−1·d−1或猪抗人ALG(pALG,武汉生物制品研究所产品)20 mg·kg−1·d−1静脉输注,连用5 d;同时给予泼尼松1 mg·kg−1·d−1预防即刻不良反应和血清病反应,2周后泼尼松开始减量,3周停药。出现血清病反应者给予氢化可的松100 mg/d静脉滴注。患者疾病诊断明确后即开始CsA口服,以3 mg·kg−1·d−1分两次口服起始,1周后检测血药浓度,调整CsA剂量维持全血谷浓度200~400 µg/L。口服CsA至少6个月,当达到最佳血液学反应并血液学参数稳定至少3个月后开始缓慢减量,每3个月约减量1 mg·kg−1·d−1。口服CsA治疗共2~3年。
3.支持治疗:ANC <0.5 × 109/L时采用G-CSF 300 µg/d皮下注射,HGB<70 g/L及PLT<10×109/L时分别给予红细胞、血小板输注支持治疗。
4.随访及疗效判定:随访截止日期为2015年4月30日。所有患者分别于IST后3、6、9、12个月进行随访,此后每年随访1次,观察包括外周血和骨髓细胞形态学及组织活检、PNH克隆、脏器功能、免疫指标等以评估血液学反应和不良反应。治疗后3个月内死亡定义为早期死亡,纳入治疗相关不良反应及疗效评价分析。疗效判定采用Camitta标准[4]。脱离红细胞和血小板输注,HGB≥100 g/L、ANC≥ 1.5×109/L且PLT≥100×109/L判定为完全治疗反应(CR);脱离红细胞和血小板输注,ANC>0.5×109/L,实验室检查不再符合SAA标准而未达CR标准者判定为部分治疗反应(PR);未达PR标准者为无治疗反应(NR)。生存时间定义为开始IST至患者死亡或随访终点。
5.统计学处理:使用SPSS 19.0软件进行统计学分析,计量资料组间比较采用非参数检验,不同组间6个月血液学反应率的单因素分析采用卡方检验。P<0.05为差异有统计学意义。
结果
1.患者基本特征:16例初诊的老年SAA/VSAA患者,男13例,女3例,中位年龄63.5(60~79)岁;其中60~69岁13例,≥70岁3例。中位ANC 0.41 (0.02~2.60)×109/L,中位网织红细胞绝对值(ARC)14.9(2.8~32.0)× 109/L,中位PLT 15(6~18)× 109/L;AA发病至开始IST中位时间为43(29~390)d;VSAA患者7例,SAA患者9例。所有患者IST前均进行PNH筛查,其中3例患者存在微小PNH克隆,无临床溶血表现和生化检查溶血证据;2例患者染色体核型为45,X,-Y,其余患者为正常核型;1例患者AA发病前2年诊断胃癌并行胃大部切除术。9例患者接受rATG治疗,7例患者接受pALG治疗。
2.早期死亡:16例患者中2例(12.5%)在治疗后3个月内死亡,均为VSAA患者(2/7, 28.6%),死亡原因亦均为重症感染。
3.血液学反应:IST后6个月9例患者获得血液学反应,其中5例CR,4例PR;5例NR,总体血液学反应率56.3%。获得血液学反应的9例患者,脱离红细胞输注中位时间33(0~85) d,脱离血小板输注中位时间36(0~94) d。
4.影响疗效的因素:单因素分析结果显示性别、年龄、发病至开始IST的时间、初始PLT及ARC等对IST后6个月血液学反应无明显影响。分析骨髓造血衰竭严重程度对疗效的影响,VSAA患者7例,早期死亡2例(28.6%),3例获得血液学反应,2例NR;SAA患者9例,无早期死亡,6例获得血液学反应,3例NR,血液学反应率分别为42.8%和66.7%(P=0.615)。分析免疫抑制剂类型对疗效的影响,9例应用rATG患者中,2例早期死亡(22.2%),2例PR(分别于治疗后12个月和24个月达CR),5例NR,总体血液学反应率为22.2%;7例应用pALG患者中,无一例早期死亡,5例CR,2例PR,总血液学反应率为100.0%(7/7),明显高于应用rATG患者(P=0.003)。13例60~69岁患者,1例早期死亡,9例获得血液学反应,3例NR;3例≥70岁患者,1例早期死亡,2例NR(P=0.063)。
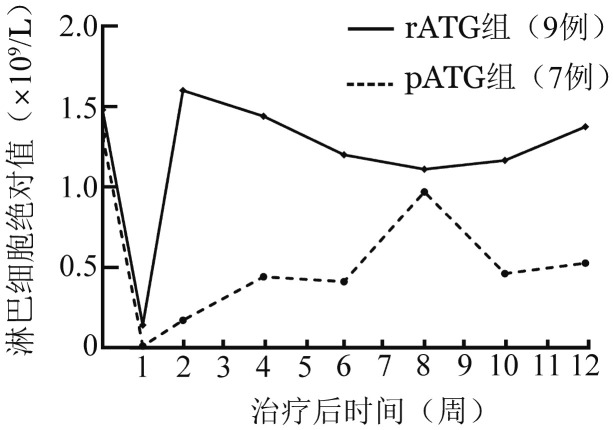
5.IST后淋巴细胞恢复:rATG/pALG两组患者IST前后淋巴细胞绝对值(ALC)变化见图1,结果显示rATG与pALG治疗后患者外周血ALC均明显降低,而以rATG治疗后下降更为明显,ALC低下维持时间更长、恢复更慢,至治疗后12周仍未能恢复到治疗前水平。
图1. 16例老年再生障碍性贫血患者不同免疫抑制剂类型治疗后淋巴细胞绝对值变化.
6.不良反应:IST期间药物相关不良反应包括:药物性发热3例,糖皮质激素致血压升高2例、血糖升高3例,停药后症状消失;血清病反应7例,经对症治疗好转。9例患者合并感染,早期死亡2例,1例于IST后12个月死于反复感染,其余患者经治疗后好转。未出现严重出血和肝肾功能损害,无心脑血管意外发生。无严重不良反应发生。
排除早期死亡2例,剩余14例患者中,2例不能耐受,CsA剂量未达治疗标准(CsA血药浓度持续低于200 µg/L);12例CsA血药浓度浓度达到200~250 µg/L,其中6例在治疗后6~24个月出现肾功能异常(其中3例发生于CsA血药浓度300~450 µg/L时),血肌酐最高者为152 µmol/L,CsA减量后肌酐恢复正常水平,减量后CsA浓度在150 µg/L左右,其中5例获得血液学反应,另6例治疗全程中无肾功能异常。
7.异常克隆转归:合并微小PNH克隆患者3例,治疗后NR、PR、CR各1例,微小PNH克隆均持续存在,无一例发生溶血。−Y患者2例,1例NR,异常克隆持续存在;1例CR,异常克隆于治疗后6个月消失。
8.生存及随访结果:16例患者中位随访18(3~75)个月,2例早期死亡;1例IST后12个月死于反复感染;1例在IST后6个月失访;3例治疗无效患者持续输血依赖;另9例患者生存状况良好无复发,12个月累积生存率为77.8%。2例患者在IST后3个月出现新发克隆性染色体异常,分别为−Y和t(1;13),随访期内2例患者骨髓象无血细胞发育异常形态改变,血常规检查提示持续CR;1例染色体正常核型NR患者IST后20个月转化为典型MDS-难治性贫血伴原始细胞过多,持续输血依赖。2例患者IST后6个月出现新发PNH克隆,无溶血表现。1例既往胃癌患者无肿瘤复发迹象,病情稳定。
讨论
AA可发生于任何年龄段,而10~20岁和≥60岁为两个发病高峰[5]。随着对疾病认识和临床研究的进展,HSCT和IST已经成为SAA患者标准的可选择方案。鉴于年龄>50岁的患者移植相关死亡率大大增高[6],而行IST仍可有60%左右的生存率[7],因此欧洲血液学标准委员会推荐年龄>50岁的患者首选ATG联合CsA的强烈IST。在国内,老年SAA患者治疗方案选择更为保守,行ATG/ALG联合CsA者甚少,资料缺乏。因此我们总结了我中心行IST的老年患者的疗效及安全性,以提高对老年SAA治疗和预后的认识。
本组16例患者年龄大,造血衰竭严重,其中7例患者符合VSAA标准,但身体状况尚好,无重大基础疾病。治疗后6个月的总体血液学反应率为56.3%,其中大部分为良好血液学反应,生存质量得到改善,其血液学反应率与国际报道相当。Tichelli等[2]研究显示≥60岁AA患者IST疗效约为52%,与20~49岁和50~59岁年龄组比较差异无统计学意义(P=0.055),提示SAA患者IST疗效并不依赖于年龄。考虑到标准治疗剂量ATG本身的不良反应和可能增加老年患者的病死率,也有研究者应用低强度免疫抑制剂以提高长期生存率,Killick等[8]单独应用低剂量(1/3标准剂量)马ATG,纳入了14例老年SAA患者,无一例发生治疗相关死亡,12例可评价疗效患者中仅1例有效,提示低剂量ATG耐受性较好,但疗效不佳,并不支持老年AA患者应用低剂量ATG,推荐应用标准剂量IST。
老年患者行IST较年轻患者出现严重感染和出血的风险大,Tichelli等[2]的研究显示,接受IST 3个年龄组AA患者中≥60岁组5年生存率最低,为50%(P<0.01);病死率最高,为32%(P=0.029)。2008年Kao等[9]的研究显示24例老年AA患者中,6例应用标准剂量的ATG+CsA治疗,13例应用减低剂量ATG+CsA治疗。结果显示标准剂量组早期死亡率为43%,减低剂量组为18%(P=0.4);而标准剂量组血液学反应率为43%,减低剂量组为53%(P=0.4)。影响死亡的原因包括疾病严重程度、感染及伴随疾病(冠心病、心力衰竭、肝硬化、脑血管疾病等)。提示此类患者适度减低IST强度仍可获得疗效,或可能减少早期死亡,而治疗前对患者疾病及身体状况评估非常重要。本组16例患者除了2例ATG减量,大部分均应用常规剂量rATG/pALG,输注过程均顺利,无严重不良反应发生。IST后有2例早期死亡,12个月累积生存率为77.8%,表明老年患者对药物的耐受较好,治疗相关死亡率并不高。这可能与本组患者基础身体状况较好有关。
老年患者长期应用CsA引起的肾功能异常需要重视。本组患者中57%(8/14)出现肾功能异常,调整CsA剂量后肾功能均获得好转,尽管减量后CsA血药谷浓度达不到200~400 µg/L,仅在150 µg/L的水平,也未明显影响疗效。因此,针对老年人的最佳CsA血药谷浓度还需要进一步摸索。
本组VSAA与SAA患者疗效差异无统计学意义,但早期死亡患者均为VSAA患者(2/7, 28.6%)。另一个可能影响疗效的因素为免疫抑制剂类型,从血液学反应率看pALG组明显优于rATG组(P= 0.003)。Scheinberg等[10]的随机对照研究显示马与兔ATG 6个月血液学反应率分别为68%对37%(P< 0.01),但相关研究显示,rATG较马ATG有更强的免疫抑制作用,提示更强的IST并不意味着更好的疗效[11]–[13]。但是,这些研究纳入患者中位年龄多在20~40岁,≥60岁患者相关研究较少。在我们的研究中rATG组IST血液学反应率较低(22.2%,2/9);而pALG组血液学反应率达100.0%(7/7)。同时,两组患者强烈IST前后ALC变化的统计分析显示,rATG组较pALG组ALC下降更多,恢复更慢;rATG较pALG有更强的免疫抑制作用,可能导致更多的感染、早期死亡,从而导致IST总体疗效不佳。但由于本组患者病例数较少,且为单中心回顾性分析,这些初步发现尚需前瞻性、多中心研究来加以确认。
综上,老年SAA患者进行ATG/ALG+CsA方案的IST耐受性较好,疗效也与60岁以下患者相当;但老年VSAA患者由于造血衰竭重于SAA患者,早期死亡率高,治疗风险较大。
References
- 1.Scheinberg P, Young NS. How I treat acquired aplastic anemia[J] Blood. 2012;120(6):1185–1196. doi: 10.1182/blood-2011-12-274019. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2.Tichelli A, Socié G, Henry-Amar M, et al. Effectiveness of immunosuppressive therapy in older patients with aplastic anemia. European Group for Blood and Marrow Transplantation Severe Aplastic Anaemia Working Party[J] Ann Intern Med. 1999;130(3):193–201. doi: 10.7326/0003-4819-130-3-199902020-00004. [DOI] [PubMed] [Google Scholar]
- 3.Incidence of aplastic anemia: the relevance of diagnostic criteria. By the International Agranulocytosis and Aplastic Anemia Study[J] Blood. 1987;70(6):1718–1721. [PubMed] [Google Scholar]
- 4.Camitta BM, Thomas ED, Nathan DG, et al. Severe aplastic anemia: a prospective study of the effect of early marrow transplantation on acute mortality[J] Blood. 1976;48(1):63–70. [PubMed] [Google Scholar]
- 5.Montané E, Ibáñez L, Vidal X, et al. Epidemiology of aplastic anemia: a prospective multicenter study[J] Haematologica. 2008;93(4):518–523. doi: 10.3324/haematol.12020. [DOI] [PubMed] [Google Scholar]
- 6.Gupta V, Eapen M, Brazauskas R, et al. Impact of age on outcomes after bone marrow transplantation for acquired aplastic anemia using HLA-matched sibling donors[J] Haematologica. 2010;95(12):2119–2125. doi: 10.3324/haematol.2010.026682. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Tichelli A, Schrezenmeier H, Socié G, et al. A randomized controlled study in patients with newly diagnosed severe aplastic anemia receiving antithymocyte globulin (ATG), cyclosporine, with or without G-CSF: a study of the SAA Working Party of the European Group for Blood and Marrow Transplantation[J] Blood. 2011;117(17):4434–4441. doi: 10.1182/blood-2010-08-304071. [DOI] [PubMed] [Google Scholar]
- 8.Killick SB, Cavenagh JD, Davies JK, et al. Low dose antithymocyte globulin for the treatment of older patients with aplastic anaemia[J] Leuk Res. 2006;30(12):1517–1520. doi: 10.1016/j.leukres.2006.02.003. [DOI] [PubMed] [Google Scholar]
- 9.Kao SY, Xu W, Brandwein JM, et al. Outcomes of older patients (> or = 60 years) with acquired aplastic anaemia treated with immunosuppressive therapy[J] Br J Haematol. 2008;143(5):738–743. doi: 10.1111/j.1365-2141.2008.07389.x. [DOI] [PubMed] [Google Scholar]
- 10.Scheinberg P, Nunez O, Weinstein B, et al. Horse versus rabbit antithymocyte globulin in acquired aplastic anemia[J] N Engl J Med. 2011;365(5):430–438. doi: 10.1056/NEJMoa1103975. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.Scheinberg P, Nunez O, Wu C, et al. Treatment of severe aplastic anaemia with combined immunosuppression: anti-thymocyte globulin, ciclosporin and mycophenolate mofetil[J] Br J Haematol. 2006;133(6):606–611. doi: 10.1111/j.1365-2141.2006.06085.x. [DOI] [PubMed] [Google Scholar]
- 12.Scheinberg P, Wu CO, Nunez O, et al. Treatment of severe aplastic anemia with a combination of horse antithymocyte globulin and cyclosporine, with or without sirolimus: a prospective randomized study[J] Haematologica. 2009;94(3):348–354. doi: 10.3324/haematol.13829. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.Scheinberg P, Nunez O, Weinstein B, et al. Activity of alemtu-zumab monotherapy in treatment-naive, relapsed, and refractory severe acquired aplastic anemia[J] Blood. 2012;119(2):345–354. doi: 10.1182/blood-2011-05-352328. [DOI] [PMC free article] [PubMed] [Google Scholar]