Avec plus de 4 137 500 individus infectés au 1er juin 2020, la COVID-19 s’est rapidement répandue dans le monde après les premiers cas détectés en Chine dans la ville de Wuhan en décembre 2020. Le virus responsable est le SARS-CoV-2, un virus à ARN simple brin qui envahit les cellules de l’organisme via le récepteur ACE2, présent au niveau du poumon mais aussi au niveau du cœur et des reins [1], [2], [3]. La présentation clinique est multiple [4] et bien que les symptômes respiratoires soient prédominants, les manifestations cardiovasculaires sont communément décrites [5], [6]. L’interaction entre le cœur et l’infection COVID-19 a été rapidement mise en évidence et peut être envisagée à plusieurs niveaux :
-
•
les patients avec comorbidités cardiaques et facteurs de risque cardiovasculaires sont plus à risque d’être infectés ;
-
•
les comorbidités cardiaques sont associées à une infection plus sévère et plus souvent fatale ;
-
•
le cœur est considéré comme un organe cible du fait de la présence de récepteurs ACE2 au sein du myocarde et il existe des lésions myocardiques au cours de l’infection [3], [7], [8], [9].
Le cœur est considéré organe cible par la présence de récepteurs ACE2.
En effet, des atteintes cardiaques définies par une élévation des troponines hyper-sensibles et/ou des CPK sont communément décrites, associées ou non à des anomalies électrocardiographiques [6], [7]. Dans une revue récente de la littérature portant sur 26 études incluant 11 685 patients infectés, la prévalence pondérée des atteintes cardiaques est de 20 % [10]. L’élévation des troponines est associée à un moins bon pronostic et un taux de mortalité plus important, association qui persiste après ajustement avec comorbidités et caractéristiques cliniques [7], [9], [11]. En pratique clinique, l’élévation de troponines peut correspondre à plusieurs situations qui peuvent être distinguées en deux catégories : les causes ischémiques et non ischémiques. Dans les causes non ischémiques, l’hypothèse selon laquelle le SARS-CoV-2 peut être à l’origine d’une myocardite aiguë a été rapidement évoquée. En effet, les myocardites aiguës sont en majorité secondaires à une infection virale [12], [13]. De plus, des cas ont été décrits lors de l’épidémie de MERS en Moyen-Orient et l’épidémie de SRAS en Asie, deux virus dont la physiopathogénie du SARS-CoV-2 est proche [14] et à tropisme cardiaque [15]. Enfin, le mode de présentation d’une myocardite est multiple allant d’une douleur thoracique mimant ou non celle d’un infarctus du myocarde au choc cardiogénique en passant par des signes d’insuffisance cardiaque et des troubles du rythme, embrassant ainsi une multitude de situations retrouvée en cas d’infection COVID-19 [13].
Comment établir le diagnostic de myocardite ?
La myocardite est définie par un infiltrat inflammatoire au sein du myocarde associé à des zones de nécroses d’origine non ischémique. Le diagnostic certain repose sur des critères histologiques, immunologiques et immunohistochimiques (critères de Dallas) retrouvés à la biopsie myocardique [13]. Plusieurs phases se succèdent. Les dommages cellulaires sont dans la première phase de la maladie liés à la lyse cellulaire médiée par la toxicité virale et la réponse immunitaire innée inflammatoire de l’hôte. Puis la phase d’activation du système immunitaire peut se poursuivre avec mise en jeu de l’immunité cellulaire spécifique, phase auto-immunitaire dont l’objectif est d’éliminer le virus. Parfois, l’hyperactivation du système immunitaire peut conduire à une destruction importante des myocytes et entraîner une dysfonction ventriculaire gauche et de l’insuffisance cardiaque [12]. Ainsi, quatre formes de myocardites sont identifiées :
-
•
fulminante ;
-
•
aiguë ;
-
•
chronique active ;
-
•
chronique persistante.
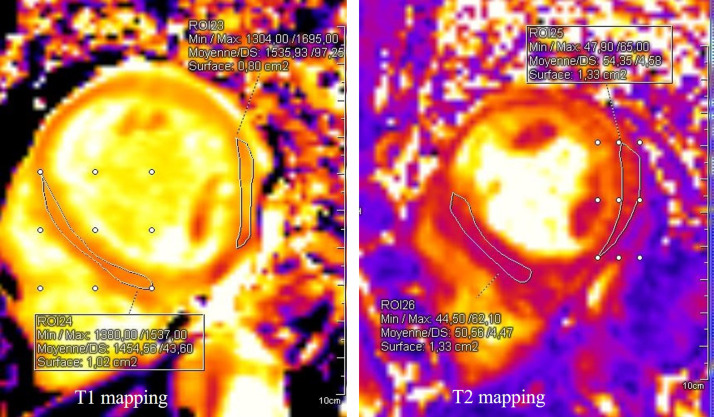
Les deux dernières correspondent à des tableaux de cardiopathie dilatée et leur distinction nécessite une analyse histologique. Le diagnostic de myocardite aiguë est un véritable challenge. Il repose sur un tableau clinique évocateur cité plus haut, des critères électriques, biologiques, dont l’élévation inconstante des troponines et des NT-proBNP, et morphologiques (IRM cardiaque et échocardiographie). L’échocardiographie seule ne permet pas d’affirmer le diagnostic car les anomalies retrouvées ne sont pas assez spécifiques. La biopsie myocardique est l’examen gold standard pour poser le diagnostic [13]. Toutefois, cet examen n’est pas recommandé en pratique courante et l’émergence de l’IRM cardiaque a modifié les stratégies diagnostiques par l’application des critères de Lake Louise de caractérisation tissulaire [4] : œdème, hyperémie et rétention tardive non ischémique signe de nécrose et fibrose [16]. Les nouvelles séquences d’IRM cardiaque incluant les séquences paramétriques de T1 et T2 mapping (Fig. 1 ) contribuent à augmenter les performances diagnostiques de l’IRM cardiaque [17]. Le diagnostic de myocardite est donc complexe et nécessite la réalisation d’examens complémentaires indispensables dont l’IRM cardiaque.
Figure 1.
Femme de 65 ans avec infection COVID-19 confirmée et myocardite aiguë confirmée en IRM cardiaque. Séquences T1 mapping pré-injection et T2 mapping en faveur d’un œdème important : augmentation du T1 à 1454 ms (valeur normale sur 3T < 1256 ms) et du T2 à 50 ms (valeur normale sur 3T < 39 ms).
Quelles sont les données en faveur de la survenue de myocardite aiguë en cas de COVID-19 ?
La prévalence de myocardite aiguë en cas d’infection COVID-19 est inconnue. Certains auteurs avancent que 7 % des décès lors d’une infection COVID-19 est lié à une myocardite aiguë sans toutefois apporter la preuve du diagnostic de myocardite [18], [19], [20]. Dans toutes ces études, la réalisation d’une IRM cardiaque aurait permis de définir des patterns ischémiques ou non pour contribuer ainsi au diagnostic étiologique [21]. Toutefois, il existe peu de données IRM du fait de la limitation des examens complémentaires devant la gravité de l’état clinique mais aussi du risque sanitaire de contagion.
À notre connaissance, seulement 6 cas de myocardite aiguë diagnostiqués sur un tableau clinique évocateur, une élévation des troponines et des images IRM compatibles ont été décrits dans le cadre de COVID-19 confirmée avec prélèvement nasopharyngé positif [22], [23], [24], [25], [26], [27], [28]. Deux autres cas de myocardites ont été décrits sur des données histologiques sans preuve toutefois d’une réplication virale au sein du myocyte [29], [30] et il n’y a jusqu’à ce jour aucune donnée sur la présence de particules virales au sein des myocytes chez l’homme [15]. Des cas d’insuffisance cardiaque et cardiomyopathie ont été rapportés également et considérés comme la conséquence de myocardite aiguë [7], [31]. Deux cas d’épanchement péricarde dont un cas de tamponnade drainée ont été rapportés mais sans traces du virus dans le liquide péricardique [32], [33].
Des troubles du rythme ont également été rapportés chez les patients infectés et pourraient être la conséquence de lésions de myocardite [34] : palpitations dans 7,8 % [35] ou 17 % des cas [5], tachycardies ou fibrillation ventriculaires dans 5,9 % des cas avec une fréquence plus importante des troubles du rythme en cas d’atteintes cardiaques (17,3 % vs 1,4 %, p < 0,001) [9] mais sans preuve pour une myocardite aiguë sous-jacente. Un cas de myocardite aiguë éosinophilique a été rapporté chez un homme de 17 ans pris en charge aux urgences pour une mort subite dans un contexte de fièvre, céphalées et vomissements avec à l’autopsie, un infiltrat de lymphocytes, de macrophages et d’éosinophiles prédominant au niveau du muscle cardiaque et un prélèvement nasopharyngé post-mortem revenu positif à SARS-CoV-2. Toutefois, les auteurs restent prudents quant au lien entre l’infection COVID-19 et la myocardite éosinophilique mise en évidence car rien ne prouve l’implication directe du virus dans sa survenue [36].
Au final, le diagnostic de myocardite aiguë a été souvent évoqué mais rarement confirmé.
Quelles sont les lésions histologiques décrites au sein du myocarde ?
Les analyses histologiques des autopsies ne retrouvent pas d’éléments caractéristiques de myocardite. Il n’a pas été mis en évidence de virus dans les myocytes chez 5 patients décédés suite à une infection COVID-19 [37]. D’autres études rapportent des infiltrats de cellules inflammatoires mais sans preuve de SARS-CoV-2 [30], [38], [39]. Une myocardite lymphocytaire a été rapportée sur 23 patients autopsiés dans les suite d’une infection COVID-19 avérée [40]. Ainsi, les résultats des études autopsies suggèrent que les myocardites aiguës sont moins fréquentes qu’escomptées et suggèrent une interprétation plus mesurée de l’élévation des troponines [41], [42].
COVID-19 et myocardite fulminante
Des cas de suspicion de myocardite aiguë fulminante ont été décrits chez des patients avec infection COVID-19 avérée [43], [44]. La myocardite fulminante fait partie du spectre des myocardites aiguës [12]. Selon les recommandations de l’ESC 2013, elle appartient à une entité histologique particulière définie par la présence au sein du myocarde de lymphocytes, d’éosinophiles et de cellules géantes [13]. La forme lymphocytaire est divisée en deux catégories selon l’origine infectieuse ou non. Le taux d’interleukine 6 est très élevé à la phase critique de défaillance multi-organe, correspondant à l’orage cytokinique bien décrit dans les cas de COVID-19 graves [7]. Or, la toxicité des cytokines sur les myocytes est un mécanisme connu et décrit comme cause de dégradation de la fonction cardiaque en réanimation [45]. L’élévation concomitante des troponines et des BNP est fréquente. Les mécanismes sont encore mal compris et plusieurs hypothèses existent : ischémie résultant de l’inadéquation flux coronaire et besoin myocardique, anomalies de la microcirculation, toxicité des médiateurs chimiques telles que les cytokines et le NO [45].
Mécanismes : quelles sont les hypothèses ?
Tout comme les virus SARS-Cov et MERS-Cov, le SARSCov2 peut entraîner une réaction immunitaire intense avec libération importante de cytokines pro-inflammatoires appelée orage cytokinique [7], [9], [46] qui peut conduire à une dysfonction ventriculaire [47]. Une relation linéaire existe entre élévation des troponines et taux de CRP, faisant évoquer un lien entre inflammation et atteinte myocardique [9]. Dans la population des non-survivants, l’élévation des troponines coïncide avec l’élévation des marqueurs de l’inflammation tels que IL-6 et LDH [7]. Un taux élevé de cytokines Il-2R, IL-6, IL-10 et TNF alpha a été retrouvé dans des cohortes de patients avec des formes modérées à sévères de COVID-19 [6]. Non seulement les cytokines ont un effet délétère sur les myocytes mais également sur le fonction endothéliale [48]. La réponse inflammatoire peut être aussi à l’origine de coagulation intravasculaire et d’atteinte de la microcirculation [49]. Les cytokines peuvent donc entraîner une dysfonction ventriculaire plus ou moins réversible sans que cela soit attribué à une myocardite aigu [46].
L’hypothèse d’une toxicité directe par réplication virale dans le cardiomyocyte est théorique mais non prouvée [50]. Il n’est pas certain non plus que le virus SARS-CoV-2 puisse engendrer la production d’auto-anticorps via un mimétisme moléculaire comme le virus Coxsakie B, virus prédominant dans les myocardites aiguës.
Une attention particulière est portée sur le récepteur ACE2 et son rôle dans la cytotoxicité du virus [51]. Le virus pénètre dans les myocytes via ces récepteurs ACE2 présents dans environ 7,5 % des myocytes [8]. L’internalisation du virus avec le récepteur ACE2 entraîne alors une diminution de l’expression de ACE2 avec pour conséquence une réduction de la conversion de l’angiotensine II en angiotensine 1-7, molécule cardioprotectrice qui s’oppose aux effets pro-inflammatoires, pro-oxydatifs et pro-fibrotiques exercés par l’angiotensine II via le récepteur AT1 [52]. Les données expérimentales montrent que l’angiotensine II contribue aux lésions pulmonaires induites par les coronavirus SARS-CoV, SARS-CoV-2 et possiblement le MERS-Cov [53]. Des particules virales ont été retrouvées au niveau des alvéoles pulmonaires ainsi que des cellules inflammatoires, de la fibrose et de la nécrose [54]. Toutefois, les données histologiques au niveau du myocarde confirmant cette hypothèse sont manquantes [55].
Les analyses histologiques menées par Varga et al. ont fait émerger une autre hypothèse physiopathologique reposant sur les récepteurs ACE2 [56]. Ces derniers sont non seulement exprimés au niveau des myocytes mais également au niveau des cellules endothéliales qui deviennent alors une cible du virus soit par toxicité directe soit par toxicité indirecte immunitaire. Il existe alors une inflammation endothéliale associée à un phénomène d’apoptose et de dysfonction endothéliale. Cette dysfonction endothéliale s’accompagne de vasoconstriction, d’ischémie, d’œdème et de trouble de la coagulation [56].
Les mécanismes physiopathologiques restent encore non élucidés et l’interprétation des troponines incertaine [21]. L’élévation des troponines semble traduire davantage un signal d’alerte d’aggravation du patient infecté que la preuve d’une atteinte cardiaque lésionnelle ischémique ou non (type myocardite) [19]. Ainsi, dans une volonté d’approche pragmatique, il a été défini un « syndrome cardiaque aigu » dans le contexte d’infection COVID-19 confirmée comme toute cardiomyopathie avec altération de la fonction ventriculaire en l’absence de coronaropathie et/ou compliquée de trouble du rythme ventriculaire [50]. Il existe ainsi plusieurs stades de sévérité, ce qui permet de stratifier le risque de complication des patients infectés et de déterminer la pertinence de réalisation d’examens complémentaires ainsi que l’introduction de cardiotropes.
Quel suivi ?
Aucune donnée sur le pronostic des survivants ayant présenté une atteinte cardiaque au cours de l’infection n’est disponible, ce d’autant que le diagnostic étiologique est le plus souvent non documenté. Or, des phénomènes aiguës peuvent conduire à un remodelage ventriculaire et à une dysfonction ventriculaire plusieurs années après l’évènement initial. Les patients survivants qui ont présenté des troponines durant leur prise en charge devraient bénéficier d’explorations sur le plan cardiovasculaire afin notamment de rechercher des séquelles. Une IRM cardiaque pourrait être proposée à titre systématique afin de définir les atteintes cardiaques selon les pattern retrouvés (rétention sous-endocardique ischémique ou rétention sous-épicardique type myocardite ou autres) et de stratifier le risque de complication selon les anomalies tissulaires. Des études ont montré l’importance de la présence de rétention tardive comme facteur pronostique de survenue d’évènements cardiovasculaires, de remodelage ventriculaire et de mortalité [57], [58], [59], ainsi que pour l’évaluation du risque rythmique [34]. Un suivi prolongé devrait être proposé même si les patients sont asymptomatiques [60]. De plus, selon l’étiologie, les traitements sont différents [61]. Il semble raisonnable de ne pas pratiquer d’activités physiques et compétitions de sport pendant 3 à 6 mois dans le doute d’une myocardite aiguë.
Traitement
Il n’y a pas de traitement prouvé efficace contre le virus. Les données sur les traitements en cas d’atteintes cardiaques reposent sur des séries de cas. Les inhibiteurs du système rénine-angiotensine doivent être maintenus selon les sociétés savantes car les données sur leurs interactions possibles avec le virus sont controversées [52]. Des corticoïdes associés ou non à des immunoglobulines ont été administrés en cas de suspicion de myocardite sévère et dans un contexte d’inflammation importante, parfois avec succès [62]. Les essais thérapeutiques en cas de myocardite aiguë avant l’ère COVID ne retrouvaient pas de différence significative en termes de fraction d’éjection ventriculaire gauche et de survie entre les patients traités par cyclosporine/prednisone, aziathropine/prednisone et placebo [63]. Des études sont en cours sur l’efficacité des traitements immunomodulateurs tels que le tocilizumab ou d’autres anti-IL-6 [64], [65]. Les mesures de réanimation avec le recours à la contre-pulsion intra-aortique ou l’ECMO suivent les recommandations habituelles avec conversion possible de l’ECMO veino-veineuse vers ECMO artérioveineuse en cas de choc cardiogénique [66], [67].
Conclusion
Les manifestations cardiaques ne sont pas rares au cours de l’infection COVID-19 et sont associées à un risque de mortalité plus important. Les mécanismes sous-jacents sont encore mal compris. Dans les études, la distinction entre les causes ischémiques et celles non ischémiques n’est pas systématique du fait de la limitation des examens complémentaires dans ce contexte particulier, ce qui entretient la confusion dans l’identification de ces atteintes. Le terme de myocardite aiguë devrait être réservé aux cas prouvés par IRM cardiaque ou biopsie myocardique afin de proposer une prise en charge adaptée à court, moyen et long termes. Il existe quelques cas avérés de myocardites aiguës/fulminantes mais ces derniers ne rendent pas compte de l’ensemble des manifestations cardiaques rapportées. L’inflammation de l’endothélium pourrait être une piste pour expliquer les dommages myocardiques liées à l’infection.
En pratique.
Mécanismes encore mal compris, diagnostic souvent difficile (IRM), facteur de gravité certain.
Déclaration de liens d’intérêts
Les auteurs déclarent ne pas avoir de liens d’intérêts.
Références
- 1.Badawi A., Ryoo S.G. Prevalence of comorbidities in the Middle East respiratory syndrome coronavirus (MERS-CoV) : a systematic review and meta-analysis. Int J Infect Dis. 2016;49:129–133. doi: 10.1016/j.ijid.2016.06.015. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2.Chan J.W.M., Ng C.K., Chan Y.H. Short term outcome and risk factors for adverse clinical outcomes in adults with severe acute respiratory syndrome (SARS) Thorax. 2003;588:686–689. doi: 10.1136/thorax.58.8.686. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.Zhu H., Rhee J.-W., Cheng P. Cardiovascular complications in patients with COVID-19: consequences of viral toxicities and host immune response. Curr Cardiol Rep. 2020;22:32. doi: 10.1007/s11886-020-01292-3. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.2020. Characteristics of Important lessons from the Coronavirus Disease 2019 (COVID-19) outbreak in China: summary of a report of 72,314 cases from the Chinese Center for Disease Control and Prevention | Global Health | JAMA | JAMA Network [Internet]https://www.jamanetwork.com/journals/jama/fullarticle/2762130 [cité 23 juin 2020] [DOI] [PubMed] [Google Scholar]
- 5.Wang D., Hu B., Hu C. Clinical characteristics of 138 hospitalized patients with 2019 novel Coronavirus–infected pneumonia in Wuhan, China. JAMA. 2020;323:1061–1069. doi: 10.1001/jama.2020.1585. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Huang C., Wang Y., Li X. Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China. Lancet. 2020;395:497–506. doi: 10.1016/S0140-6736(20)30183-5. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Zhou F., Yu T., Du R. Clinical course and risk factors for mortality of adult inpatients with COVID-19 in Wuhan, China: a retrospective cohort study. Lancet. 2020;395:1054–1062. doi: 10.1016/S0140-6736(20)30566-3. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.Kang Y., Chen T., Mui D. Cardiovascular manifestations and treatment considerations in covid-19. Heart Br Card Soc. 2020 doi: 10.1136/heartjnl-2020-317056. [heartjnl-2020-317056; online ahead of print] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.Guo T., Fan Y., Chen M. Cardiovascular implications of fatal outcomes of patients with Coronavirus Disease 2019 (COVID-19) JAMA Cardiol. 2020 doi: 10.1001/jamacardio.2020.1017. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.Bavishi C., Bonow R.O., Trivedi V., Abbott J.D., Messerli F.H., Bhatt D.L. Acute myocardial injury in patients hospitalized with COVID-19 infection: a review. Prog Cardiovasc Dis. 2020 doi: 10.1016/j.pcad.2020.05.013. [Epub ahead of print] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.Shi S., Qin M., Shen B. Association of cardiac injury with mortality in hospitalized patients with COVID-19 in Wuhan, China. JAMA Cardiol. 2020:802–810. doi: 10.1001/jamacardio.2020.0950. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.Cooper L.T. Myocarditis. N Engl J Med. 2009;360:1526–1538. doi: 10.1056/NEJMra0800028. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.Caforio A.L.P., Pankuweit S., Arbustini E. Current state of knowledge on aetiology, diagnosis, management, and therapy of myocarditis: a position statement of the European Society of Cardiology Working Group on Myocardial and Pericardial Diseases. Eur Heart J. 2013;34:2636–2648. doi: 10.1093/eurheartj/eht210. [2648a–2648d] [DOI] [PubMed] [Google Scholar]
- 14.Alhogbani T. Acute myocarditis associated with novel Middle East respiratory syndrome coronavirus. Ann Saudi Med. 2016;36:78–80. doi: 10.5144/0256-4947.2016.78. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.Siripanthong B., Nazarian S., Muser D. Recognizing COVID-19-related myocarditis: the possible pathophysiology and proposed guideline for diagnosis and management. Heart Rhythm. 2020 doi: 10.1016/j.hrthm.2020.05.001. [S1547-5271(20)30422-7] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.Friedrich M.G., Sechtem U., Schulz-Menger J. Cardiovascular magnetic resonance in myocarditis: a JACC white paper. J Am Coll Cardiol. 2009;53:1475–1487. doi: 10.1016/j.jacc.2009.02.007. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.Ferreira V.M., Schulz-Menger J., Holmvang G. Cardiovascular magnetic resonance in nonischemic myocardial inflammation: expert recommendations. J Am Coll Cardiol. 2018;72:3158–3176. doi: 10.1016/j.jacc.2018.09.072. [DOI] [PubMed] [Google Scholar]
- 18.Ruan Q., Yang K., Wang W., Jiang L., Song J. Clinical predictors of mortality due to COVID-19 based on an analysis of data of 150 patients from Wuhan, China. Intensive Care Med. 2020;46:846–848. doi: 10.1007/s00134-020-05991-x. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.Deng Q., Hu B., Zhang Y. Suspected myocardial injury in patients with COVID-19: evidence from front-line clinical observation in Wuhan, China. Int J Cardiol. 2020;311:116–121. doi: 10.1016/j.ijcard.2020.03.087. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20.2020. COVID-19 myocarditis and severity factors: an adult cohort study | medRxiv [Internet]https://www.medrxiv.org/content/10.1101/2020.03.19.20034124v1 [cité 21 juin 2020] [Google Scholar]
- 21.Peretto G., Sala S., Caforio A.L.P. Acute myocardial injury, MINOCA, or myocarditis? Improving characterization of coronavirus-associated myocardial involvement. Eur Heart J. 2020;41:2124–2125. doi: 10.1093/eurheartj/ehaa396. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 22.Inciardi R.M., Lupi L., Zaccone G. Cardiac Involvement in a Patient With Coronavirus Disease 2019 (COVID-19) JAMA Cardiol. 2020;5:1–6. doi: 10.1001/jamacardio.2020.1096. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 23.Kim I.-C., Kim J.Y., Kim H.A., Han S. COVID-19-related myocarditis in a 21-year-old female patient. Eur Heart J. 2020;41:1859. doi: 10.1093/eurheartj/ehaa288. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 24.Luetkens J.A., Isaak A., Zimmer S. Diffuse myocardial inflammation in COVID-19 associated myocarditis detected by multiparametric cardiac magnetic resonance imaging. Circ Cardiovasc Imaging. 2020;13:e010897. doi: 10.1161/CIRCIMAGING.120.010897. [DOI] [PubMed] [Google Scholar]
- 25.Doyen D., Moceri P., Ducreux D., Dellamonica J. Myocarditis in a patient with COVID-19: a cause of raised troponin and ECG changes. Lancet Lond Engl. 2020;395:1516. doi: 10.1016/S0140-6736(20)30912-0. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 26.Paul J.-F., Charles P., Richaud C., Caussin C., Diakov C. Myocarditis revealing COVID-19 infection in a young patient. Eur Heart J Cardiovasc Imaging. 2020;21:776. doi: 10.1093/ehjci/jeaa107. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 27.Beşler M.S., Arslan H. Acute myocarditis associated with COVID-19 infection. Am J Emerg Med. 2020 doi: 10.1016/j.ajem.2020.05.100. [S0735-6757(20)30463-0] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 28.Coyle J., Igbinomwanhia E., Sanchez-Nadales A., Danciu S., Chu C., Shah N. A recovered case of COVID-19 myocarditis and ARDS treated with corticosteroids, tocilizumab, and experimental AT-001. JACC Case Rep. 2020 doi: 10.1016/j.jaccas.2020.04.025. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 29.Sala S., Peretto G., Gramegna M. Acute myocarditis presenting as a reverse Tako-Tsubo syndrome in a patient with SARS-CoV-2 respiratory infection. Eur Heart J. 2020;41:1861–1862. doi: 10.1093/eurheartj/ehaa286. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7184339/ [DOI] [PMC free article] [PubMed] [Google Scholar]
- 30.Tavazzi G., Pellegrini C., Maurelli M. Myocardial localization of coronavirus in COVID-19 cardiogenic shock. Eur J Heart Fail. 2020;22:911–915. doi: 10.1002/ejhf.1828. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 31.Arentz M., Yim E., Klaff L. Characteristics and outcomes of 21 critically ill patients with COVID-19 in Washington State. JAMA. 2020;323:1612–1614. doi: 10.1001/jama.2020.4326. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 32.Dabbagh M.F., Aurora L., D'Souza P., Weinmann A.J., Bhargava P., Basir M.B. Cardiac Tamponade Secondary to COVID-19. JACC Case Rep. 2020;3:e2014780. doi: 10.1016/j.jaccas.2020.04.009. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 33.Cizgici A.Y., Zencirkiran Agus H., Yildiz M. COVID-19 myopericarditis: it should be kept in mind in today's conditions. Am J Emerg Med. 2020;38:1547e5–1547e6. doi: 10.1016/j.ajem.2020.04.080. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 34.Peretto G., Sala S., Rizzo S. Arrhythmias in myocarditis: state of the art. Heart Rhythm. 2019;16:793–801. doi: 10.1016/j.hrthm.2018.11.024. [DOI] [PubMed] [Google Scholar]
- 35.Liu K., Fang Y.-Y., Deng Y. Clinical characteristics of novel coronavirus cases in tertiary hospitals in Hubei Province. Chin Med J. 2020;33:1025–1031. doi: 10.1097/CM9.0000000000000744. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 36.Craver R., Huber S., Sandomirsky M., McKenna D., Schieffelin J., Finger L. Fatal eosinophilic myocarditis in a healthy 17-year-old male with severe acute respiratory syndrome Coronavirus 2 (SARS-CoV-2c) Fetal Pediatr Pathol. 2020;39:263–268. doi: 10.1080/15513815.2020.1761491. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 37.Imazio M., Klingel K., Kindermann I. COVID-19 pandemic and troponin: indirect myocardial injury, myocardial inflammation or myocarditis? Heart Br Card Soc. 2020 doi: 10.1136/heartjnl-2020-317186. [DOI] [PubMed] [Google Scholar]
- 38.Xu Z., Shi L., Wang Y. Pathological findings of COVID-19 associated with acute respiratory distress syndrome. Lancet Respir Med. 2020;8:420–422. doi: 10.1016/S2213-2600(20)30076-X. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 39.Beigmohammadi M.T., Jahanbin B., Safaei M. Pathological findings of postmortem biopsies from lung, heart, and liver of 7 deceased COVID-19 patients. Int J Surg Pathol. 2020 doi: 10.1177/1066896920935195. [heartjnl-2020-317186] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 40.Buja L.M., Wolf D.A., Zhao B., Akkanti B., McDonald M., Lelenwa L. The emerging spectrum of cardiopulmonary pathology of the coronavirus disease 2019 (COVID-19): report of 3 autopsies from Houston, Texas, and review of autopsy findings from other United States cities. Cardiovasc Pathol. 2020;48:107233. doi: 10.1016/j.carpath.2020.107233. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 41.Zhou R. Does SARS-CoV-2 cause viral myocarditis in COVID-19 patients? Eur Heart J. 2020;41:2123. doi: 10.1093/eurheartj/ehaa392. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 42.Lippi G., Lavie C.J., Sanchis-Gomar F. Cardiac troponin I in patients with coronavirus disease 2019 (COVID-19): evidence from a meta-analysis. Prog Cardiovasc Dis. 2020 doi: 10.1016/j.pcad.2020.03.001. [Advance online publication. PMID: 32169400; PMCID: PMC7127395] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 43.Zeng J.-H., Liu Y.-X., Yuan J. First case of COVID-19 complicated with fulminant myocarditis: a case report and insights. Infection. 2020:1–5. doi: 10.1007/s15010-020-01424-5. [Advance online publication] [DOI] [PMC free article] [PubMed] [Google Scholar]
- 44.Irabien-Ortiz A. [Fulminant myocarditis due to COVID-19] Rev Esp Cardiol. 2020;73:503–504. doi: 10.1016/j.rec.2020.04.005. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 45.Sato R., Nasu M. A review of sepsis-induced cardiomyopathy. J Intensive Care. 2015;3:48. doi: 10.1186/s40560-015-0112-5. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 46.Mehta P., McAuley D.F., Brown M. COVID-19: consider cytokine storm syndromes and immunosuppression. Lancet Lond Engl. 2020;395:1033–1034. doi: 10.1016/S0140-6736(20)30628-0. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 47.Stanciu A.E. Cytokines in heart failure. Adv Clin Chem. 2019;93:63–113. doi: 10.1016/bs.acc.2019.07.002. [DOI] [PubMed] [Google Scholar]
- 48.Mirzaei H., Ferns G.A., Avan A., Mobarhan M.G. Cytokines and MicroRNA in coronary artery disease. Adv Clin Chem. 2017;82:47–70. doi: 10.1016/bs.acc.2017.06.004. [DOI] [PubMed] [Google Scholar]
- 49.Tang N., Li D., Wang X., Sun Z. Abnormal coagulation parameters are associated with poor prognosis in patients with novel coronavirus pneumonia. J Thromb Haemost. 2020;18:844–847. doi: 10.1111/jth.14768. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 50.Hendren N.S., Drazner M.H., Bozkurt B., Cooper L.T. Description and proposed management of the acute COVID-19 cardiovascular syndrome. Circulation. 2020;141:1903–1914. doi: 10.1161/CIRCULATIONAHA.120.047349. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 51.Zou X., Chen K., Zou J., Han P., Hao J., Han Z. Single-cell RNA-seq data analysis on the receptor ACE2 expression reveals the potential risk of different human organs vulnerable to 2019-nCoV infection. Front Med. 2020;14:185–192. doi: 10.1007/s11684-020-0754-0. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 52.Vaduganathan M., Vardeny O., Michel T., McMurray J.J.V., Pfeffer M.A., Solomon S.D. Renin–Angiotensin–Aldosterone system inhibitors in patients with Covid-19. N Engl J Med. 2020;382:1653–1659. doi: 10.1056/NEJMsr2005760. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 53.South A.M., Diz D.I., Chappell M.C. COVID-19, ACE2, and the cardiovascular consequences. Am J Physiol Heart Circ Physiol. 2020;318:H1084–H1090. doi: 10.1152/ajpheart.00217.2020. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 54.Yao X.H., Li T.Y., He Z.C. [A pathological report of three COVID-19 cases by minimal invasive autopsies] Zhonghua Bing Li Xue Za Zhi. 2020;49:411–417. doi: 10.3760/cma.j.cn112151-20200312-00193. [DOI] [PubMed] [Google Scholar]
- 55.Tersalvi G., Vicenzi M., Calabretta D., Biasco L., Pedrazzini G., Winterton D. Elevated troponin in patients with Coronavirus Disease 2019: possible mechanisms. J Card Fail. 2020;26:470–475. doi: 10.1016/j.cardfail.2020.04.009. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 56.Varga Z., Flammer A.J., Steiger P. Endothelial cell infection and endotheliitis in COVID-19. Lancet Lond Engl. 2020;395:1417–1418. doi: 10.1016/S0140-6736(20)30937-5. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 57.Grün S., Schumm J., Greulich S. Long-term follow-up of biopsy-proven viral myocarditis: predictors of mortality and incomplete recovery. J Am Coll Cardiol. 2012;59:1604–1615. doi: 10.1016/j.jacc.2012.01.007. [DOI] [PubMed] [Google Scholar]
- 58.Imazio M., Brucato A., Barbieri A. Good prognosis for pericarditis with and without myocardial involvement: results from a multicenter, prospective cohort study. Circulation. 2013;128:42–49. doi: 10.1161/CIRCULATIONAHA.113.001531. [DOI] [PubMed] [Google Scholar]
- 59.Filippetti L., Mandry D., Venner C. Long-term outcome of patients with low/intermediate risk myocarditis is related to the presence of left ventricular remodeling in addition to the MRI pattern of delayed gadolinium enhancement. JACC Cardiovasc Imaging. 2018;11:1367–1369. doi: 10.1016/j.jcmg.2018.02.008. [DOI] [PubMed] [Google Scholar]
- 60.Komiyama M., Hasegawa K., Matsumori A. Dilated cardiomyopathy risk in patients with Coronavirus Disease 2019: how to identify and characterise it early? Eur Cardiol. 2020;15:e49. doi: 10.15420/ecr.2020.17. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 61.Agewall S., Beltrame J.F., Reynolds H.R. ESC wrking grup position paper on myocardial infarction with non-obstructive coronary arteries. Eur Heart J. 2017;38:143–153. doi: 10.1093/eurheartj/ehw149. [DOI] [PubMed] [Google Scholar]
- 62.Wei X., Fang Y., Hu H. Glucocorticoid and immunoglobulin to treat viral fulminant myocarditis. Eur Heart J. 2020;41:2122. doi: 10.1093/eurheartj/ehaa357. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 63.Mason J.W., O’Connell J.B., Herskowitz A. A clinical trial of immunosuppressive therapy for myocarditis. N Engl J Med. 1995;333:269–275. doi: 10.1056/NEJM199508033330501. [DOI] [PubMed] [Google Scholar]
- 64.2020. Sarilumab COVID-19 - Full Text View - ClinicalTrials. gov [Internet]https://www.clinicaltrials.gov/ct2/show/NCT04327388 [cité 29 juin 2020] [Google Scholar]
- 65.National Cancer Institute, Naples . 2020. Multicenter study on the efficacy and tolerability of tocilizumab in the treatment of patients with COVID-19 pneumonia [Internet]. clinicaltrials.gov.https://www.clinicaltrials.gov/ct2/show/NCT04317092 [; cité 18 juin 2020, Report No. NCT04317092] [Google Scholar]
- 66.Ramanathan K., Antognini D., Combes A. Planning and provision of ECMO services for severe ARDS during the COVID-19 pandemic and other outbreaks of emerging infectious diseases. Lancet Respir Med. 2020;8:518–526. doi: 10.1016/S2213-2600(20)30121-1. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 67.Fried J.A., Ramasubbu K., Bhatt R. The variety of cardiovascular presentations of COVID-19. Circulation. 2020;141:1930–1936. doi: 10.1161/CIRCULATIONAHA.120.047164. [DOI] [PMC free article] [PubMed] [Google Scholar]