RESUMEN
Objetivo
Identificar qué biomarcadores realizados en la primera analítica de urgencias ayudan a estratificar según riesgo de mortalidad a pacientes COVID 19.
Método
Estudio observacional descriptivo y transversal realizado con datos recogidos de los pacientes con sospecha de COVID-19 en el Servicio de Urgencias del 24 de febrero al 16 de marzo del 2020. Se realizó el estudio univariante y multivariante para encontrar los marcadores independientes de mortalidad y calcular el riesgo mediante la construcción de una escala de gravedad.
Resultados
Se incluyeron 163 pacientes de los que fallecieron 33 y 29 de ellos resultaron positivos para la prueba PCR COVID-19. Obtuvimos como posibles factores para conformar el score de riesgo de mortalidad edad>75 años ((OR ajustada=12,347, IC95%: 4,138-36,845 p=0.001), leucocitos totales> 11.000 cel/mm3 (OR ajustada=2,649, IC95%: 0,879-7,981 p=0,083), glucosa> 126 mg/dL (OR ajustada=3,716, IC95%: 1,247-11,074 p=0,018) y creatinina>1,1 mg/dL (OR ajustada= 2,566, IC95%: 0,889-7,403, p=0,081). Este score se denominó COVEB (COVID, Edad, perfil Básico analítico) con un AUC 0,874 (IC95%: 0,816-0,933, p<0.001; punto de corte= 1 (sensibilidad= 89,66% (IC95%: 72,6%-97,8%), especificidad= 75,59% (IC95%: 67,2%-82,8%). Un score < 1 posee un valor predictivo negativo = 100% (IC95%: 93,51%-100%) y un valor predictivo positivo = 18,59% (IC95%: 12,82%-25,59%).
Conclusiones
Las escalas clínicas de gravedad, los biomarcadores de función renal, los parámetros del recuento leucocitario, el ratio neutrófilos totales/linfocitos y procalcitonina son factores de riesgo tempranos de mortalidad. Destacan las variables edad, glucosa, creatinina y leucocitos totales como mejores predictores de mortalidad. Un score COVEB< 1 indica con un 100% de probabilidad, que el paciente con sospecha de COVID-19 no va a fallecer en los próximos 30 días.
Palabras clave: COVID, SARS-CoV-2, urgencias, escala de riesgo
ABSTRACT
Objective
Identify which biomarkers performed in the first emergency analysis help to stratify COVID-19 patients according to mortality risk.
Method
Observational, descriptive and cross-sectional study performed with data collected from patients with suspected COVID-19 in the Emergency Department from February 24 to March 16, 2020. The univariate and multivariate study was performed to find independent mortality markers and calculate risk by building a severity score.
Results
A total of 163 patients were included, of whom 33 died and 29 of them were positive for the COVID-19 PCR test. We obtained as possible factors to conform the Mortality Risk Score age> 75 years ((adjusted OR = 12,347, 95% CI: 4,138-36,845 p = 0.001), total leukocytes> 11,000 cells / mm3 (adjusted OR = 2,649, 95% CI: 0.879-7.981 p = 0.083), glucose> 126 mg / dL (adjusted OR = 3.716, 95% CI: 1.24711.074 p = 0.018) and creatinine> 1.1 mg / dL (adjusted OR = 2.566, 95% CI: 0.8897.403, p = 0.081) This score was called COVEB (COVID, Age, Basic analytical profile) with an AUC 0.874 (95% CI: 0.816-0.933, p <0.001; Cut-off point = 1 (sensitivity = 89.66 % (95% CI: 72.6% -97.8%), specificity = 75.59% (95% CI: 67.2% -82.8%). A score <1 has a negative predictive value = 100% (95% CI: 93.51% -100%) and a positive predictive value = 18.59% (95% CI: 12.82% -25.59%).
Conclusions
. Clinical severity scales, kidney function biomarkers, white blood cell count parameters, the total neutrophils / total lymphocytes ratio and procalcitonin are early risk factors for mortality. The variables age, glucose, creatinine and total leukocytes stand out as the best predictors of mortality. A COVEB score <1 indicates with a 100% probability that the patient with suspected COVID-19 will not die in the next 30 days.
Key words: COVID, SARS-CoV-2, emergency, score
INTRODUCCION
Un nuevo coronavirus conocido como “severe acute respiratory síndrome coronavirus 2” (SARS-CoV-2), causante del cuadro clínico COVID-19 ha sido el responsable de la declaración de emergencia el pasado 30 de enero de 2020 [1].
Con un tiempo medio de incubación entre 3 – 7 días, los síntomas más comunes mostrados por los pacientes infectados son fiebre, tos y disnea [2]. En el caso de los pacientes en una situación más grave, progresan rápidamente hacia un síndrome de distrés respiratorio agudo, shock séptico, acidosis metabólica y coagulopatía [3]. Estos casos más graves suelen presentar enfermedades concomitantes cardiovasculares o diabetes mellitus, así como fallo renal, cardíaco o hepático [4]. Las pruebas de imagen en estos pacientes muestran una imagen de vidrio deslustrado e infiltrados bilaterales.
Respecto a los marcadores séricos que puedan orientarnos hacia la estratificación de la gravedad, y el pronóstico de COVID-19, se han estudiado numerosos parámetros, desde los indicadores de la función de filtración glomerular (cistatina C, creatinina y urea), la bilirrubina directa, colesterol y LDH [4, 5], transaminasas (AST y ALT), ferritina, proteína C reactiva [6] y la alteración de la fórmula leucocitaria [7] incluyendo indicadores del recuento celular (neutrófilos totales, y linfocitos totales). Se han estudiado también indicadores de inflamación (proteína C reactiva y ferritina), indicadores de coagulación (tiempo de protrombina, tiempo de cefalina y dímero D), indicadores cardiacos (troponina I, CKMB, proBNP) [8] o inmunológicos (IL6, c3 y c4) [9, 10] entre otros buscando su relación con la necesidad de cuidados críticos y mortalidad en pacientes COVID-19.
Sin embargo, la evidencia al respecto es escasa, manteniéndose la significancia estadística solo en algunos de estos parámetros, con variación en los resultados en los distintos estudios. Por otro lado, se disponen de pocos datos respecto a la correlación de los parámetros séricos en la primera visita a urgencias y la posterior evolución del paciente.
Los contagios en la Comunidad de Madrid han supuesto un colapso de los recursos sanitarios donde los hospitales se han dedicado a la atención masiva y prácticamente en exclusividad de esta infección, obligando a adecuar y optimizar la sistemática de trabajo. Por ello el papel de la Urgencia en la identificación, atención inicial y estratificación de la gravedad es fundamental. Esto permite tomar la mejor decisión en cuanto al destino de ingreso del paciente para garantizar el nivel de cuidados óptimo en cada caso [11].
La búsqueda de herramientas objetivas que agilicen la to-ma de decisiones clínicas, que deben tomarse rápidamente y a menudo en condiciones desfavorables durante una enfermedad epidémica altamente infecciosa como es la infección por SARS-CoV-2, es de gran utilidad dado que una identificación temprana, efectiva y simple de los casos más graves puede reducir de forma significativa la mortalidad y el periodo de hospitalización.
Nuestro objetivo principal con este estudio fue identificar qué marcadores séricos realizados en la primera analítica de urgencias pueden ayudarnos, junto a parámetros clínicos, a estratificar según riesgo de mortalidad a 30 días a los pacientes con sospecha de infección por SARS-COV-2 que acuden al Servicio de Urgencias. Nos propusimos identificar los puntos de corte de dichos biomarcadores y evaluar cuáles de ellos se ajustan mejor para construir un Score de riesgo de mortalidad, que sirva de apoyo para las decisiones clínicas.
MÉTODOS
Se realizó un estudio retrospectivo observacional, en el que se incluyeron los pacientes, mayores de edad con sospecha de COVID-19, que acudieron al Servicio de Urgencias en el periodo del 24 de febrero de 2020 al 16 de marzo del 2020. De manera prospectiva se recopiló la información de mortalidad a 30 días. Se excluyeron del estudio los pacientes sin sospecha de COVID-19.
Se consideró como sospecha de COVID-19 cualquier paciente atendido en la Urgencia Hospitalaria que cumpliera alguno de los dos criterios de “caso en investigación”: signos y síntomas de infección respiratoria aguda de vías bajas y hallazgos radiológicos compatibles con infección viral y aquellas personas con un cuadro clínico compatible con infección respiratoria aguda de cualquier gravedad que en los 14 días previos al inicio de los síntomas haya residido o viajado en áreas con evidencia de transmisión comunitaria o tenga historia de contacto estrecho con un caso probable o confirmado.
Se analizaron variables epidemiológicas (sexo, edad) clínicas (Pneumonia Severity Index (PSI), Severity Score for Community-Acquired Pneumonia (CURB65), fiebre (T ≥ 37,8ºC), tos, mortalidad a 30 días) enfermedades concomitantes y hábitos tóxicos (hipertensión arterial (HTA), diabetes mellitus (DM), dislipemia (DL), hábito tabáquico), la presencia de infiltrados en la radiografía de tórax, test de rRT-PCR para COVID-19 y los siguientes parámetros analíticos (leucocitos totales, linfocitos totales, neutrófilos totales, hematocrito, dímero-D, glucosa, urea, creatinina, sodio, GOT, GPT, LDH, GGT, pH arterial y venoso y lactato).
Se realizó el estudio de asociación de los distintos factores con la mortalidad a 30 días. Posteriormente se calcularon las curvas ROC identificando el área bajo la curva (AUC) y el punto de corte. Se realizó un análisis multivariante, mediante regresión logística condicional de pasos hacia atrás, para encontrar los marcadores independientes de mortalidad y calcular el riesgo en forma de Odd Ratio (OR) para cada parámetro analizado.
El proyecto fue aprobado por el Comité de Ética e Inves-tigación clínica del Hospital Universitario de la Princesa (referencia 4120).
RESULTADOS
Durante el periodo estudiado se atendieron un total de 163 sospechas clínicas de COVID-19 de las que fallecieron el 20,2% (33). De los fallecidos el 87,9% (29) obtuvieron un resultado positivo para COVID por PCR y del total de sospechas resultaron positivas el 74,2% (121).
Realizamos una comparación de las variables descriptivas entre los que fallecieron y los que no y no se observaron diferencias estadísticamente significativas por sexos (Hombres: 20 vs 61, Mujeres: 13 vs 69, p=0,177). Si se observaron diferencias significativas por edad (fallecidos vs no fallecidos: 81,09+-8,78 vs 60,60 +-17,89, p<0,001). Se asoció significativamente con mortalidad la HTA, siendo a su vez la comorbilidad más prevalente. No se observaron diferencias significativas para las comorbilidades DM, DL ni para el hábito tabáquico (tabla 1).
Tabla 1.
Descripción de las características de las sospechas y su relación con la mortalidad a 30 días.
| MORTALIDAD A 30 DÍAS | |||||
|---|---|---|---|---|---|
| Exitus | No exitus | ||||
| Porcentaje | N | Porcentaje | N | p | |
| Datos demográficos (totales) | 20,2% | 33 | 79,8% | 130 | |
| Sexo | 0,113 | ||||
| Hombres Mujeres |
60,6%% 39,4% |
20 13 |
46,9% 53,1% |
61 69 |
|
| Antecedentes personales | |||||
| HTA | 78,8% | 26 | 36,4% | 47 | *<0,001 |
| DM | 27,3% | 9 | 17,2% | 22 | 0,144 |
| DL | 36,4% | 12 | 29,7% | 38 | 0,295 |
| Fumador | 33,3% | 11 | 27,7% | 36 | 0,641 |
| Sintomatología | |||||
| Fiebre >37,8ºC |
42,4% | 14 |
62,0% |
80 |
*0,042 |
| Tos | 66,7% | 22 | 73,8% | 96 | 0,268 |
| Pruebas de imagen | |||||
| Radiografía de tórax con infiltrados | 60,6% | 20 | 36,4% | 12 | 0,136 |
| Escalas clínicas de gravedad | |||||
| PSI | |||||
| 0 | 0% | 0 | 6,2% | 8 | |
| 1 | 0% | 0 | 21,7% | 28 | |
| 2 | 6,1% | 2 | 24,8% | 32 | *<0,001 |
| 3 | 9,1% | 3 | 20,2% | 26 |
|
| 4 | 48,5% | 16 | 20,2% | 26 | |
| CURB65 | |||||
| 0 | 0% | 0 | 9,2% | 12 | |
| 1 | 9,1% | 3 | 43,8% | 57 | *<0,001 |
| 2 | 66,7% | 22 | 35,4% | 46 | |
| 3 | 24,2% | 8 | 9,2% | 12 | |
| PCR COVID | |||||
| Positiva | 87,9% | 29 | 70,8% | 92 | |
| Media | SD | Media | SD | p | |
| Edad | 81,09 | 8,78 | 60,60 | 17,89 | *<0,001 |
p<0,05; N: número de casos; HTA: hipertensión arterial; DM: Diabetes Mellitus; DL: Dislipemia; PSI: Pneumonia Severity Index; CURB65: Severity Score for Community-Acquired Pneumonia British Toracic Society,
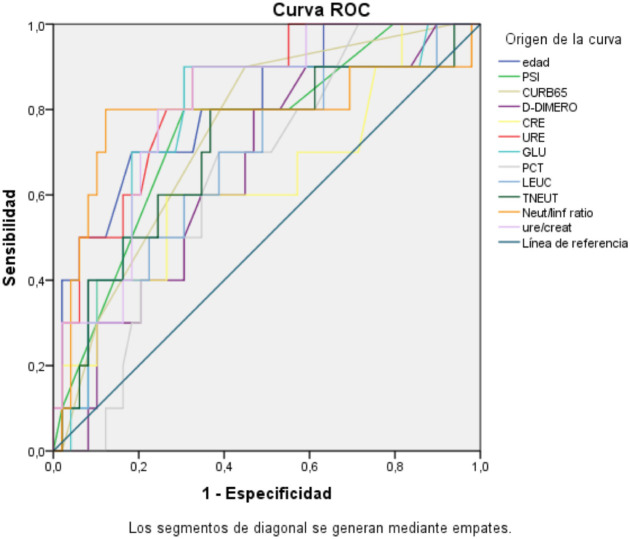
Se estudiaron en las sospechas qué factores se relacionan con mal pronóstico, usando la primera analítica de urgencias, y su capacidad de predicción de mortalidad. Para ello se realizaron las curvas ROC, para seleccionar los puntos de corte que predecían mortalidad a 30 días, los resultados se muestran en la tabla 2. La comparación de las curvas de las variables que demuestran significación estadística se muestra en la figura 1.
Tabla 2.
Capacidad predictora de mortalidad a 30 días de las distintas variables clínicas, séricas y sus puntos de corte en sospechas de COVID-19
| Prueba (N total=163) | Punto de corte | P | AUC | IC 95% | Sensibilidad | IC95% | Especificidad | IC95% |
|---|---|---|---|---|---|---|---|---|
| Creatinina (161) | 1,08 | *0,0008 | 0,688 | 0,610-0,759 | 59,38 | 40,6-76,3 | 79,07 | 71,0-85,7 |
| Dímero D (68) | 0,79 | *0,0339 | 0,738 | 0,617-0,837 | 71,43 | 29,0-96,3 | 85,25 | 73,8-93,0 |
| Edad (163) | 75 | *<0,0001 | 0,851 | 0,787-0,902 | 81,82 | 64,5-93,0 | 79,23 | 71,2-85,8 |
| GGT (156) | 19 | 0,1262 | 0,59 | 0,509-0,668 | 93,55 | 78,6-99,2 | 30,4 | 22,5-39,3 |
| Glucosa (161) | 126 | *0,0012 | 0,682 | 0,604-0,753 | 68,75 | 50,0-83,9 | 72,09 | 63,5-79,6 |
| AST/GOT (154) | 22 | 0,6553 | 0,527 | 0,445-0,608 | 72,41 | 52,8-87,3 | 37,6 | 29,1-46,7 |
| ALT/GPT (157) | 16 | 0,657 | 0,525 | 0,444-0,606 | 48,39 | 30,2-66,9 | 61,11 | 52,0-69,7 |
| Hematocrito | 40,4 | 0,6242 | 0,528 | 0,447-0,608 | 56,67 | 37,4-74,5 | 62,5 | 53,5-70,9 |
| Lactato (127) | 0,9 | 0,0773 | 0,618 | 0,527-0,702 | 100 | 85,8-100 | 28,16 | 19,7-37,9 |
| LDH (129) | 205 | 0,0543 | 0,632 | 0,543-0,715 | 90,91 | 70,8-98,9 | 43,93 | 34,3-53,9 |
| Leucocitos totales (158) | 10,98 | *0,0473 | 0,618 | 0,537-0,694 | 50 | 31,3-68,7 | 78,91 | 70,8-85,6 |
| Linfocitos totales (158) | 0,58 | 0,1138 | 0,588 | 0,507-0,665 | 36,67 | 19,9-56,1 | 85,16 | 77,8-90,8 |
| Neutrófilos totales (158) | 9,24 | *0,0165 | 0,642 | 0,562-0,716 | 50 | 31,3-68,7 | 83,59 | 76,0-89,5 |
| Neutrófilos totales / linfocitos totales (158) | 5,58 | *0,0015 | 0,684 | 0,605-0,755 | 73,33 | 54,1-87,7 | 64,06 | 55,1-72,3 |
| Cociente urea/creatinina (160) | 35,29 | *0,0004 | 0,699 | 0,622-0,769 | 87,50 | 71-96,5 | 49,22 | 40,3-58,2 |
| Sodio (160) | 135 | 0,1924 | 0,572 | 0,491-0,649 | 59,38 | 40,6-76,3 | 70,31 | 61,6-78,1 |
| PCT (156) | 0,09 | *0,0011 | 0,684 | 0,604-0,756 | 81,25 | 63,6-92,8 | 54,03 | 44,9-63,0 |
| Urea (160) | 31 | *<0,0001 | 0,784 | 0,712-0,845 | 90,62 | 75,0-98,0 | 53,13 | 44,1-62,0 |
| PSI (162) | 3 | *<0,0001 | 0,835 | 0,768-0,888 | 84,85 | 68,1-94,9 | 72,87 | 64,3-80,3 |
| CURB65 (163) | 1 | *<0,0001 | 0,726 | 0,650-0,793 | 90,91 | 75,7-98,1 | 53,08 | 44,1-61,9 |
p<0,05; GGT: Gamma Glutamil Transferasa; GLU: Glucosa; AST: aspartato amino transferasa; ALT: aminotransferasa; LDH: Lactato deshidrogenasa; PCT: Procalcitonina; PSI: Pneumonia Severity Index; AUC: área bajo la curva ROC; IC 95%: intervalo de confianza 95%; N:total de sospechas de las que se tiene la información de la variable de estudio. En negrita las variables empleadas para conformar el score COVEB (COVID, Edad, perfil Básico).
Figura 1.
Curva ROC de los factores predictores de mortalidad a 30 días.
PCT: Procalcitonina; TNEUT: Neutrófilos totales; GLU: Glucosa; URE: Urea; CRE: creatinina; PSI: Pneumonia Severity Index; Net/Linf ratio: cociente entre Neutrófilos totales y Linfocitos totales; Ure/Creat: Cociente Urea y Creatinina, LEUC: Leucocitos totales.
Respecto a la asociación de las variables con la mortalidad se observaron diferencias estadísticamente significativas para las variables: edad>75 años (p<0,001, OR=9,08 (IC95%: 3,99-20,67)), fiebre >37,8ºC (p=0,042, OR=0.3 (IC95%: 0,29-0,99)); PSI>3 (p<0,001, OR=7,08 (IC95%: 2,88-17,41)); CURB65>1 (p<0,001, OR=11,31 (IC95%: 3,29-38,92); HTA (p<0,001, OR=4,48 (IC95%: 2,06-9,72)), neutrófilos totales >9.000 células/mm3 (p=0,001, OR=3,92 (IC95%: 1,70-9,04)), urea>31 mg/dL (p=<0,001, OR=10,956 (IC95%: 3,18-37,79)), glucosa>126mg/dL (p=0,038, OR=5,68 (IC95%: 2,45-13,17)), creatinina>1,1 mg/dL(p<0,001, OR=4,37 (IC95%: 1,92-9,96)), Ratio neutrófilos totales /linfocitos totales >6 (p<0,001, OR=3,13 (IC95%:1,60-6,15)), cociente urea/creatinina>35 (p<0,001, OR=4,69 (IC95%: 1,73-12,70)); leucocitos totales>11.000 cel/mm3 (p<0,001, OR=2,96 (IC95%: 1,63-5,37)); PCT>0,09 ng/mL (p<0,001, OR=3,65 (IC95%:1,59-8,36)).
Tras el análisis multivariante obtuvimos como posibles factores para conformar un score de riesgo de mortalidad te-ner una edad>75 años (OR ajustada=12,347, IC95%: 4,13836,845 p=0,001), leucocitos totales> 11.000 cél/mm3 (OR ajustada=2,649, IC95%: 0,879-7,981 p=0,083), glucosa> 126 mg/ dL (OR ajustada=3,716, IC95%: 1,247-11,074 p=0,018) y creatinina>1,1 mg/dL (OR ajustada= 2,566, IC95%: 0,889-7,403, p=0,081).
Se construyó un score sumatorio resultado de la presencia de dichos factores y la curva ROC del Score de riesgo se muestra en la figura 2 obteniéndose un AUC 0,874 (IC95%: 0,8160,933, p<0,001; punto de corte= 1 (sensibilidad = 89,66% (IC95%: 72,6%-97,8%), especificidad= 75,59% (IC95%: 67,2%-82,8%). Un score < 1 posee un valor predictivo negativo= 100% (IC95%: 93,51%-100%) y un valor predictivo positivo= 18,59% (IC95%: 12,82%-25,59%).
Figura 2.

Curva ROC del Score de riesgo de mortalidad a 30 días.
El Score de riesgo de mortalidad a 30 días se compone del efecto sumatorio de la presencia de las siguientes variables: Edad>75 años, Glucosa> 126 mg/dL, Leucocitos totales>11.000 cél/mm3 y Creatinina >1,1 mg/dL.
DISCUSIÓN
El ratio de mortalidad a 30 días calculado como fallecidos a 30 días vs sospechas atendidas fue del 20,2% (IC95%: 1426%) similar a otros datos publicados [12]. Los datos respect a la mortalidad se han ido incrementado según ha ido avanzando la epidemia y nuestro dato dobla los primeros publicados [13], sin embargo, se asemeja al ratio actual en España de fallecidos vs hospitalizados 22,4% [14]. La evidencia de fiebre actuó como factor protector de mala evolución dado que la manifestación de síntomas facilitó el diagnóstico temprano. No se observan diferencias estadísticamente significativas entre los que fallecieron por sexo pero si por edad. Es probable que los pacientes que fallecieron pero no obtuvieron un resultado positivo para COVID por PCR correspondan a casos COVID reales pero que debido a la dificultad de la toma de muestra no se obtuviese un resultado positivo que confirmase el diagnóstico. Los 4 casos que fallecieron y no obtuvieron un diagnóstico por PCR-COVID presentaron clínica de infección por COVID e imagen radiográfica sospechosa de infección por COVID. Estos casos pueden ser consecuencia, especialmente al principio de la pandemia, de la falta de experiencia en la toma de muestra y que afecta a la sensibilidad de la técnica.
En nuestros resultados, al igual que en otras publicaciones se demuestra que la HTA, las escalas clínicas de gravedad, los parámetros séricos de función renal como urea y creatinina, así como los parámetros del recuento leucocitario, el dímero D, el ratio neutrófilos totales/linfocitos totales y la PCT son factores de riesgo tempranos de mortalidad en estos pacientes [4, 15]. Destacan las variables edad, urea, PSI y dímero D como mejores predictores de mortalidad a 30 días en sospechas de infección por SARS-CoV-2 si observamos la comparación de las curvas ROC.
Los puntos de corte de las variables en su asociación con el riesgo de fallecer a los 30 días, al corresponder a la primera analítica, no son especialmente muy patológicos en comparación con los rangos de normalidad y sin embargo ya muestran clara significancia estadística para predecir evolución. La población de este estudio no mostró diferencias significativas en las comorbilidades entre positivos y negativos para infección por SARS-CoV-2, hecho que suele influir incrementando los puntos de corte.
El presente estudio muestra que leucocitos totales>11.000 cél/mm3, creatinina>1,1 mg/dL, glucosa >126 mg/dL junto con la edad >75 años de pacientes con sospecha de COVID-19, con independencia del sexo, son factores que podrían utilizarse para crear un Score de riesgo de aplicación en Urgencias por asociarse de manera independiente con la mortalidad global a los 30 días. A partir de aquí denominado como score COVEB (COVID, Edad, perfil Básico). El score COVEB posee un valor predictivo negativo del 100%, es decir, un valor menor de 1 nos indica con un 100% de probabilidad, que el paciente con sospecha de COVID-19 no va a fallecer en los próximos 30 días.
Este score puede ser de gran utilidad a la hora de establecer algoritmos operativos de trabajo, objetivo fundamental que debemos perseguir para optimizar los ingresos hospitalarios y las derivaciones a plantas de vigilancia estrecha o a las Unidades de cuidados intensivos, especialmente ante la amenaza de posibles rebrotes que puedan suponer un nuevo colapso de nuestro sistema sanitario.
Los pacientes con mayor score COVEB tienen más riesgo de fallecer a los 30 días y pudieran ser candidatos de ingreso y tratamiento precoz, así como ingreso en UCI y valorarse el tratamiento con inmunomoduladores. Con un score COVEB de 3 pudieran ser candidatos de ingreso y tratamiento precoz y se valoraría según el caso su ingreso en UCI. Con un score COVEB de 2 serían candidatos de ingreso, tratamiento precoz y se valoraría según el caso su ingreso en plantas habilitadas para vigilancia estrecha. Un score COVEB de 1 se valoraría según el caso la necesidad de ingreso y serían candidatos a tratamiento precoz. Y por último con un score COVEB de 0 serían candidatos a tratamiento y medidas de aislamiento en domicilio.
Este estudio tiene diversas limitaciones. El tamaño muestral fue relativamente pequeño lo cual puede suponer la pérdida de asociación en algunos de los parámetros séricos. Por otro lado, al tratarse del comienzo de la pandemia, la información disponible era más limitada y el manejo de estos pacientes variaba continuamente en relación al conocimiento científico lo cual, en nuestro caso, afecta directamente a la variable Dímero-D pues al principio no se solicitaba en la primera analítica y Rev Esp Quimioter 2020;33(4): 267-273 272
se dispone de ella en solo 41,7% (68 vs 163) de las sospechas incluidas en este estudio, sin embargo se obtiene significancia estadística como pronóstico de mortalidad.
En los pacientes con sospecha de infección por COVID, atendidos en urgencias, los resultados de la primera analítica, junto con algunos datos clínicos pueden ser una ayuda sencilla y eficaz para descartar una mala evolución, o para asignar recursos escasos como unidades de alta vigilancia.
FINANCIACIÓN
Los autores declaran no haber recibido financiación para la realización de este estudio.
CONFILCTO DE INTERESES
Los autores declaran no tener ningún conflicto de intereses.
References
- 1.OMS. Organización Mundial de la Salud. COVID-19: cronología de la actuación de la OMS, 2020. [cited 27 Apr 2020]. Available from: https://www.who.int/es/news-room/detail/27-04-2020-who-ti-meline---covid-19
- 2.Guan W, Ni Z, Hu Y, Liang W, Ou C, He J, et al. Clinical charac-teristics of coronavirus disease 2019 in China. N Engl J Med. 2020;382(18):1708–20. DOI: 10.1056/NEJMoa2002032 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.Zhao J, Yuan Q, Wang H, Liu W, Liao X, Su Y, et al. Antibody Res-ponses to SARS-CoV-2 in Patients of Novel Coronavirus Disease 2019. Clin Infect Dis. 2020; DOI: 10.1093/cid/ciaa344 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.XIANG J, WEN J, YUAN X, Xiong S, ZHOU X, LIU C, et al. Po-tential biochemical markers to identify severe cases among COVID-19 patients. medRxiv 2020031920034447; DOI: 10.1101/2020.03.19.20034447 [DOI] [Google Scholar]
- 5.Han Y, Zhang H, Mu S, Wei W, Jin C, Xue Y, et al. Lactate dehy-drogenase, a Risk Factor of Severe COVID-19 Patients. medRxiv 2020032420040162 DOI: 10.1101/2020.03.24.20040162 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Zhou B, She J, Wang Y, Ma X. Utility of Ferritin, Procalcitonin, and C-reactive Protein in Severe Patients with 2019 Novel Coronavirus Disease. Res Sq. 2019;1–13. DOI: 10.21203/rs.3.rs-18079/v1 [DOI] [Google Scholar]
- 7.Ferrari D, Motta A, Strollo M, Banfi G, Locatelli M. Routine blood tests as a potential diagnostic tool for COVID-19 Clin Chem Lab Med. 2020. June 25;58(7):1095-1099. DOI: 10.1515/cclm-2020-0398. [DOI] [PubMed] [Google Scholar]
- 8.Li J-W, Han T-W, Woodward M, Anderson CS, Zhou H, Chen Y-D, et al. The impact of 2019 novel coronavirus on heart injury: A Sys-tematic review and Meta-analysis. Prog Cardiovasc Dis. 2020. April 16;S0033-0620(20)30080-3. doi: 10.1016/j.pcad.2020.04.008 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.Sarzi-Puttini P, Giorgi V, Sirotti S, Marotto D, Ardizzone S, Rizzardi-ni G, et al. COVID-19, cytokines and immunosuppression: what can we learn from severe acute respiratory syndrome? Clin Exp Rheu-matol. 2020;38(2):337-342. PMid: [PubMed] [Google Scholar]
- 10.Bermejo-Martin JF, Almansa R, Menéndez R, Mendez R, Kelvin DJ, Torres A. Lymphopenic community acquired pneumonia as signa-ture of severe COVID-19 infection. J Infect. 2020;80(5):e23-e24. doi: 10.1016/j.jinf.2020.02.029. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.Pulia MS, O’Brien TP, Hou PC, Schuman A, Sambursky R. Multi-tiered screening and diagnosis strategy for COVID-19: a model for sustainable testing capacity in response to pandemic. Ann Med. 2020;52(5):207-214. doi: 10.1080/07853890.2020.1763449. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.Yin S, Huang M, Li D, Tang N. Difference of coagulation features between severe pneumonia induced by SARS-CoV2 and non-SARS-CoV2. J Thromb Thrombolysis. 2020;1-4. doi: 10.1007/s11239-020-02105-8 [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.Rubino S, Kelvin N, Bermejo-Martin JF, Kelvin D. As COVID-19 ca-ses, deaths and fatality rates surge in Italy, underlying causes re-quire investigation. J Infect Dev Ctries. 2020;14(3):265-267. doi: 10.3855/jidc.12734. [DOI] [PubMed] [Google Scholar]
- 14.Ministerio de sanidad E. Situación de COVID-19 en España. Ministerio de Sanidad. Gobierno de España, 2020. [cited 23 May 2020]. Available from: https://cnecovid.isciii.es/covid19/
- 15.Liu J, Li S, Liu J, Liang B, Wang X, Wang H, et al. Longitudinal cha-racteristics of lymphocyte responses and cytokine profiles in the peripheral blood of SARS-CoV-2 infected patients. EBioMedicine . 2020;55:102763. doi: 10.1016/j.ebiom.2020.102763. [DOI] [PMC free article] [PubMed] [Google Scholar]