Abstract
目的
探讨急性髓系白血病(AML)的克隆异质性特征及其临床价值。
方法
采用高通量测序技术靶向检测2016年1月至2019年6月河南省肿瘤医院收治的465例AML患者的68种相关基因,将检出的基因突变位点根据变异等位基因频率(VAF)及同期流式细胞学结果进行克隆异质性分析,并分析其与预后的关系。
结果
338例(81.4%)初诊患者检出基因突变,其中携带DNMT3A、NRAS和RUNX1突变患者出现2个及以上克隆比例显著增加(DNMT3A:χ2=15.231, P<0.001;NRAS:χ2=19.866, P<0.001;RUNX1:χ2=23.647, P<0.001)。不同年龄组间克隆数差异有统计学意义(χ2=17.505, P=0.022),其中>60岁患者携带2个和≥3个克隆的比例增加。初诊患者与复发或继发AML患者间克隆分布差异具有统计学意义(χ2=11.302, P=0.010),且患者多克隆的比例随预后危险度增加而逐渐增加(χ2=17.505, P=0.022)。而主克隆分析中,RUNX1突变标志的主克隆比例较高(χ2=4.527, P=0.033)。克隆异质性与疗效相关分析显示,携带3个及以上克隆患者的总生存(OS)期和无进展生存(PFS)期均远低于其他患者(OS:χ2=13.533,P=0.004;PFS:χ2=9.817,P=0.020),而在中危组患者中,克隆数目多的患者其PFS期显著缩短(χ2=10.883,P=0.012)。Cox回归多因素分析显示,携带3个及以上克隆为影响预后的独立危险因素,其OS期和PFS期显著短于无克隆患者(OS:HR=3.296,95%CI 1.568~6.932,P=0.002;PFS:HR=3.241,95%CI 1.411~7.440,P=0.006)。
结论
克隆异质性可反映肿瘤的生物学特性,提示其耐药性、难治性及侵袭性,可进一步用来评估疗效和AML中危组患者的预后。
Keywords: 克隆异质性, 基因突变, 白血病,髓样,急性, 高通量测序
Abstract
Objective
This study aimed to explore the characteristics and clinical value of clonal heterogeneity in acute myeloid leukemia (AML).
Methods
A high-throughput sequencing was carried out to detect 68 related genes in 465 AML patients. Clonal heterogeneity was analyzed based on variant allele frequency (VAF) and flow cytometry results combined with clinical data.
Results
Gene mutations were discovered in 338 (81.4%) newly diagnosed patients, and 2 or more clones were significantly increased in patients with DNMT3A, NRAS, and RUNX1 mutations (DNMT3A, χ2=15.23; P<0.001; NRAS, χ2=19.866; P<0.001; RUNX1, χ2=23.647; P<0.001). The number of clones significantly differed between groups at different ages (χ2=17.505, P=0.022). The proportion of carrying 2 and ≥3 clones increased in patients aged more than 60 years old. There was a significant difference in the clonal heterogeneity between newly diagnosed patients and relapsed or secondary patients (χ2=11.302, P=0.010). Moreover, the proportion of patients with clonal heterogeneity gradually increased according to their prognostic risk (χ2=17.505, P=0.022). Based on the clone analysis, the proportion of primary clones of patients with RUNX1 mutation was higher (χ2=4.527, P=0.033). The analysis of clonal heterogeneity and efficacy demonstrated that patients with three or more clones had significantly lower overall survival (OS) and progression-free survival (PFS) compared to other patients (OS, χ2=13.533; P=0.004; PFS, χ2=9.817; P=0.020), while in the intermediate-risk group, patients with a significant clonal heterogeneity also exhibited a significant decrease in PFS (χ2=10.883, P=0.012). Cox regression multivariate analysis revealed that carrying three or more clones was an independent factor affecting prognosis, and OS and PFS were significantly lower than those of patients without clones (OS, HR=3.296; 95% CI, 1.568-6.932; P=0.002; PFS, HR=3.241; 95% CI, 1.411-7.440; P=0.006).
Conclusion
Clonal heterogeneity may reflect the biological characteristics of a tumor, suggesting its drug resistance, refractory, and invasiveness, and further evaluate the treatment effect and prognosis of patients.
Keywords: Clonal heterogeneity; Gene mutation; Leukemia, myeloid, acute; High-throughput sequencing
急性髓系白血病(AML)是以骨髓原始细胞恶性增殖为特征的异质性肿瘤。AML的克隆异质性影响着疾病的治疗和预后。而治疗后的复发可能由于初诊时的亚克隆增殖变为主克隆,也可能由于克隆演变出现新克隆增殖,这时需要临床上对疾病重新认知[1]–[2]。根据染色体核型结果得出的克隆异质性是AML预后的独立危险因素[3]。但是,核型分析作为克隆异质性分析有其自身的局限性,如检测方法敏感性不够、对于染色体核型正常的患者无法进行克隆异质性分析,以及核型检测相对的单一性。随着高通量测序技术的临床应用,80%以上AML患者可以检出至少一种基因突变。而相关基因突变,除一些(如NPM1、FLT3-ITD、C-KIT等)可以明确提示疾病的诊断与预后外,还可以作为鉴定克隆群体的遗传标志,其突变位点的变异等位基因频率(VAF)可以为克隆异质性提供线索[4]。本研究对AML患者的高通量测序结果进行克隆异质性及结构还原性分析,进一步评估AML克隆异质性的特征,以及与危险度分层和预后的关系。
病例与方法
1.病例资料:以2016年1月至2019年6月于河南省肿瘤医院血液科就诊的465例AML患者为研究对象,包括415例初诊AML患者和50例治疗后患者(36例复发,14例继发)。其中男251例,女214例,中位年龄46(2~89)岁。参考《成人急性髓系白血病中国诊疗指南(2017年版)》进行诊断和分型[5]。
2.核酸提取:采集患者骨髓2~3 ml,EDTA抗凝,采用天根生化科技(北京)有限公司血液基因组DNA提取试剂盒提取DNA,采用TRIzol法提取RNA,经微量分光光度计NanoDrop 2000定量,用于后续检测。
3.高通量测序靶向检测基因突变:使用PCR引物扩增目的基因热点区域(68种AML相关基因),采用Ion Torrent PGM测序平台进行测序。测序后数据利用人基因组数据库(HG19)、COSMIC、1 000 genomes和dbSNP等数据库进行分析。平均基因覆盖率大于99%,平均测序深度为1 500×,目标区域测序深度超过1 000×,检测灵敏度5%。
4.融合基因和染色体核型分析:融合基因检测采用上海源奇生物医药科技有限公司43种融合基因筛查试剂盒。染色体核型分析采用常规R显带技术,根据《人类细胞遗传学国际命名体制(ISCN2013)》进行描述。
5.克隆异质性分析:通过基因突变位点的VAF值判断克隆异质性,不同基因突变位点的VAF差异>10%,标记为不同克隆。反之,VAF差异≤10%,标记为同一克隆[6]。克隆结构还原性分析,突变位点VAF值根据同期流式细胞术检测的异常细胞比例进行纠正(纠正VAF值=VAF值/异常细胞比例),以去除检测样本中正常细胞的干扰,突变位点纠正VAF值在41%~59%或>90%的为主克隆,而在1%~40%或60%~90%的为亚克隆[7]。
6.治疗:依据患者年龄、危险度预后分层、依从性等进行综合评价,选择治疗方案。非急性早幼粒细胞白血病(APL)的AML患者接受包含蒽环/蒽醌类、阿糖胞苷和(或)高三尖杉酯碱(HHT)的联合诱导化疗,其中接受标准剂量方案293例,低强度化疗方案51例,含中大剂量阿糖胞苷方案17例。缓解后治疗采用中高剂量阿糖胞苷或标准“3+7”方案巩固化疗,中高危组的患者如果具备条件则行异基因造血干细胞移植。APL患者采用全反式维甲酸(ATRA)、ATRA联合化疗和(或)亚砷酸(ATO)方案的诱导治疗,缓解后给予ATRA联合化疗和(或)ATO方案巩固治疗及维持治疗。
7.随访:对387例接受治疗的初诊患者进行随访,随访截止日期为2019年8月。随访资料来源于住院病历,对随访期间死亡的病例,依据病历记录或电话随访确认。失访83例(21.4%),中位随访时间18(1~43)个月。总生存(OS)期为确诊至死亡或随访截止的时间。无进展生存(PFS)期为确诊至疾病进展、复发或死亡的时间。
8.统计学处理:采用SPSS 20.0软件进行统计分析。数据用均值±标准差或中位数(范围)描述,组间分类资料的比较采用χ2检验或Fisher精确检验,多样本定量资料的比较采用方差分析。生存分析采用Kaplan-Meier法,并采用Log-rank检验进行单因素分析。将影响PFS和OS的因素采用Cox回归模型进行多因素分析,根据克隆数目分组绘制生存曲线。P<0.05为差异具有统计学意义。
结果
1.初诊患者染色体核型和基因突变情况:415例AML初诊患者染色体核型结果中,29例患者未见染色体核型结果,其余386例患者包含t(8;21)47例(12.2%),t(15;17)26例(6.7%),inv(16)/t(16;16)6例(1.6%),正常核型191例(49.5%),复杂核型29例(7.5%),未知核型15例(3.9%),其他核型72例(18.6%)。
初诊患者高通量测序结果显示,338例(81.4%)初诊患者检出基因突变,其中突变比例较高的基因分别为DNMT3A 67例(19.8%)、NPM1 62例(18.3%)、FLT3-ITD 54例(16%)、NRAS 48例(14.2%)、RUNX1 43例(12.7%)、TET2 41例(12.1%)、WT1 35例(10.4%)、KIT 37例(10.9%)、IDH2 35例(10.4%)等(图1A)。根据检出突变基因功能分类,主要为信号传导相关基因(占64.5%,包括FLT3-ITD、NRAS、KIT、PTPN11、FLT3-TKD、KRAS、JAK2、CSF3R、NOTCH1、CDKN2A、CSF1R、CBL、NOTCH2、ROBO2、SH2B3、ROBO1和JAK3)、表观遗传相关基因(占42.6%,包括DNMT3A、TET2、IDH2、IDH1、ASXL1、EZH2、SETBP1、ATRX、SMC3、KMT2C和SMC1A)、转录调节相关基因(占38.2%,包括RUNX1、WT1、CEBPA、EP300、CREBBP、BCOR、GATA2、ETV6、PHF6、PML、CALR、NT5C2、NQO1、RAD21和STAG2 1)、细胞增殖或凋亡相关基因(占25.4%,包括NPM1、TP53、TNFAIP3、STAT3、FBXW7、MPL、BIRC3、PTEN和MLH1)、剪切子相关基因(占10.6%,包括U2AF1、SRSF2、ZRSR2和SF3B1)。
图1. 338例初诊急性髓系白血病患者基因突变结果.

A:携带基因突变的患者例数;B:突变基因患者与野生型基因患者中克隆数目分布分析(aP<0.05,bP<0.001);+:突变基因;−:野生型基因
2.克隆异质性相关因素分析:对突变比例较高基因进行克隆异质性分析,发现携带DNMT3A、NPM1、NRAS、RUNX1、TET2、WT1、CEBPA和ASXL1突变患者出现2个及以上克隆比例明显增加,与其基因野生型患者克隆数目比例差异有统计学意义(DNMT3A:χ2=15.231, P<0.001;NPM1:χ2=13.782,P=0.001;NRAS:χ2=19.866,P<0.001;RUNX1:χ2=23.647,P<0.001;TET2:χ2=12.14,P=0.002;WT1:χ2=6.107,P=0.047;CEBPA:χ2=8.09,P=0.018;ASXL1:χ2=9.446,P=0.009),而FLT3-ITD、C-KIT、IDH2和TP53突变患者与其野生型患者携带克隆数目分布差异无统计学意义(图1B)。
分析性别、年龄与克隆数目间的关系,结果显示不同性别间克隆数目分布差异无统计学意义。而根据年龄分为<30岁、30~60岁、>60岁三组,不同组别间克隆数目分布差异有统计学意义(χ2=17.505,P=0.022)。其中,>60岁患者携带克隆标记的比例明显增加,且携带2个和≥3个克隆的比例明显增加(表1)。根据基因突变数和克隆数分组,发现患者中基因突变数的分布与克隆数的分布差异有统计学意义(χ2=101.671,P<0.001)(图2A)。根据危险度分层,不同危险度组间差异有统计学意义(χ2=17.505,P=0.022),且随着预后危险度的增加,患者多克隆的比例逐渐增加(表1)。
表1. 急性髓系白血病患者临床特征与克隆数目的关系[例(%)].
| 特征 | 例数 | 克隆数目 |
P值 | ||||
| 0个克隆(77例) | 1个克隆(200例) | 2个克隆(104例) | ≥3个克隆(34例) | ||||
| 性别 | 0.689 | ||||||
| 男 | 225 | 41(18.2) | 104(46.2) | 59(26.2) | 21(9.3) | ||
| 女 | 190 | 36(18.9) | 96(50.5) | 45(23.7) | 13(6.8) | ||
| 年龄(岁) | 0.008 | ||||||
| <30 | 115 | 23(20.0) | 61(53.0) | 24(20.9) | 7(6.1) | ||
| 30~60 | 201 | 46(22.9) | 94(46.8) | 46(22.9) | 15(7.5) | ||
| >60 | 99 | 8(8.1) | 44(44.5) | 33(33.3) | 14(14.1) | ||
| 危险度分层 | <0.001 | ||||||
| 低危组 | 49 | 25(51.0) | 20(40.8) | 3(6.1) | 1(2.0) | ||
| 中危组 | 161 | 36(22.4) | 84(52.2) | 35(21.7) | 6(3.7) | ||
| 高危组 | 130 | 7(5.4) | 56(43.1) | 43(33.1) | 24(18.5) | ||
| 不详 | 75 | 10(13.3) | 37(49.3) | 24(32.0) | 4(5.3) | ||
图2. 急性髓系白血病患者克隆异质性分析.
A:初诊患者不同突变个数与不同克隆个数的患者例数;B:初诊患者与治疗后患者(包括复发和继发患者)的克隆数目分布
3.初诊和治疗后克隆结构还原分析:415例初诊患者中,338例(81.4%)携带克隆信息,克隆数目为(1.23±0.86)个;而50例治疗后患者(包括复发或继发患者)中,仅有1例没有检出基因突变,克隆数目为(1.82±0.94)个,3个以上克隆比例明显升高(26%对9%),二者克隆数目分布差异有统计学意义(χ2=11.302,P=0.010)(图2B)。
AML初诊患者中,根据纠正后VAF值判定主克隆和亚克隆,结果发现RUNX1突变位点标记的主克隆比例较高(83.0%),与基因突变阴性的克隆分布比较差异有统计学意义(χ2=4.527,P=0.033)(图3)。
图3. 初诊急性髓系白血病患者携带突变所在的主克隆和亚克隆的分布比例(aP<0.05).

根据纠正后的VAF值还原患者的克隆结构,有利于进一步分析疾病情况。例1初诊时EP300突变处于主克隆中,不同的亚克隆包含NRAS、JAK2和KRAS突变。复发后检测发现新出现TP53突变的主克隆,而包含JAK2和KRAS突变的亚克隆在治疗过程中消失(图4A)。例2初诊时,仅发现包含NPM1突变突变的主克隆,复发后新发现包含DNMT3A、FLT3-ITD和WT1突变的亚克隆(图4B)。
图4. 两例急性髓系白血病患者初诊以及复发时高通量测序检出基因突变结果.
A:例1;B:例2;VAF:变异等位基因频率
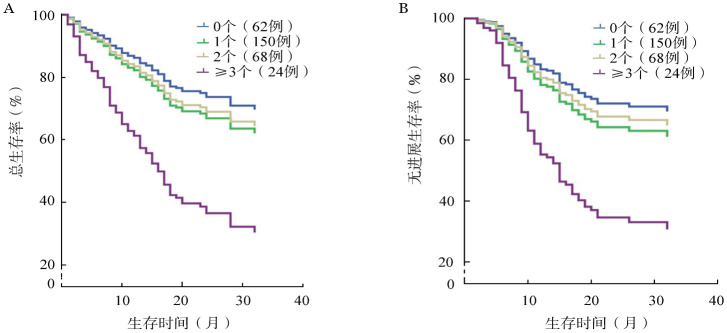
4.患者克隆异质性与预后的关系:针对304例初诊患者进行随访,根据克隆数目分组,未检出克隆62例,1个克隆150例,2个克隆68例,3个及以上克隆24例,其OS期分别为33.7(95%CI 29.9~37.5)、31.4(95%CI 28.7~34.1)、32.7(95%CI 28.8~36.6)、17.9(95%CI 14~21.8)个月(χ2=13.533,P=0.004)。而PFS期分别为31.1(95%CI 27.5~34.8)、30.8(95%CI 27.9~33.7)、32.6(95% CI 28.3~36.9)、14(95%CI 11.3~16.8)个月(χ2=9.817,P=0.020)。
其中,中危组患者120例,其克隆分布分别为25例未检出克隆,67例1个克隆,25例2个克隆,3例3个及以上克隆,其OS期分别为29.1(95%CI 24.8~33.5)、30.1(95%CI 27.7~33.3)、25.2(95%CI 20.2~30.2)、18(95%CI 12.2~23.8)个月(χ2=4.616,P=0.202)。而PFS期分别为29.6(95%CI 25.1~34.1)、29.5(95%CI 26.5~32.6)、28.8(95%CI 24.3~33.3)、9.3(95%CI 6.1~12.6)个月(χ2=10.883,P=0.012)。
将影响患者OS和PFS的相关因素如年龄、性别、危险度分层、克隆数目、诱导化疗方案及是否接受移植纳入Cox回归模型进行多因素分析,并以克隆数目分组绘制生存曲线(图5)。其中,携带3个及以上克隆为影响预后的独立危险因素,其OS期和PFS期显著短于无克隆患者(OS:HR=3.296,95%CI 1.568~6.932,P=0.002;PFS:HR=3.241,95%CI 1.411~7.440,P=0.006)。
图5. 不同克隆数目急性髓系白血病患者总生存(A)和无进展生存(B)曲线.
讨论
肿瘤的异质性是恶行肿瘤的特征之一,其发生过程中的克隆复杂性和演化性是研究肿瘤发病机制及肿瘤治疗的关键环节。而根据肿瘤细胞的生物标志和染色体核型异常的克隆异质性研究也一直是AML疾病发生、发展机制研究的重要组成部分[3],[8]–[9]。近年来,高通量测序技术的应用为我们分析AML的克隆异质性提供了越来越多的分子标志,也为我们进一步认识疾病在治疗过程的克隆演变提供了可能。本研究针对465例AML患者,综合分析其高通量测序、染色体核型和流式细胞术检测等结果,发现AML的克隆异质性及演化性与患者的一般情况、危险度分层以及预后等方面都密切相关。
本研究中初诊AML患者仅有约50%检出染色体核型异常,而81%的AML患者通过高通量测序检测可找到基因突变位点作为克隆研究的分子标志,远较染色体核型异常比例高,提示高通量测序是研究AML克隆异质性的更好的方法。在异常基因相关的克隆异质性分析中发现,具有独立预后危险因素的FLT3-ITD和TP53突变患者与其野生型患者相比克隆数目无明显差异,提示其在AML的发病过程中出现较晚,可能伴随的分子学事件较少。而DNMT3A、RUNX1和NRAS突变的患者携带克隆数目显著高于其野生型患者,提示上述基因可能是AML发病过程中的早期分子学事件,与克隆的多样性和疾病进展关系密切,本研究与以往AML克隆演化研究中不同时间所伴随的分子学变化相近[10]–[12]。综上提示,异常基因在AML发病过程中的出现时间和其作用与克隆异质性相关,疾病早期出现异常基因易导致基因表观遗传修饰和转录调控等遗传信息的不稳定性,易造成克隆异质性,但其具体联系需进一步研究。
本研究发现,虽然克隆异质性分析以基因突变位点为依据,但初诊患者克隆数与基因突变数间存在显著差异,提示疾病相关的克隆异质性分析的必要性。而克隆异质性不仅与异常基因种类相关,也与患者一般情况,如年龄密切相关。研究发现,60岁以下患者其克隆分布差异无统计学意义,而大于60岁患者携带2个及以上克隆的比例明显升高,克隆异质性增加。这符合随着年龄增加,由于内外环境因素的影响导致突变的累积效应。也与Fujiwara等[13]–[15]研究报道相似,不同年龄的患者其基因组学改变具有明显差异,高龄患者出现基因突变的频率较高,这也是导致高龄患者治疗效果差和预后差的重要原因之一。但随年龄增长出现的基因突变种类和数量与克隆异质性的关系,需进一步研究。
肿瘤克隆异质性是肿瘤难治、复发的主要原因,也具有预后提示价值。本研究中,初诊患者携带克隆个数低于治疗后患者携带的克隆个数,其携带的3个及以上的克隆比例远较治疗后患者低,证实克隆的异质性是肿瘤高度危险因素,是其复发、进展的主要原因。而根据纠正VAF值评估克隆异质性,也较好地纠正了因混合样本中肿瘤细胞比例的不同而导致克隆分子标记检出的VAF值的差异,更加有效地对比患者不同时间不同样本的检测结果,分析其疾病的克隆演变过程。而在主克隆分布分析中发现,RUNX1突变较多位于其主克隆中,提示其可能出现较早,并与造血干细胞的发育密切相关,文献报道RUNX1敲除后的胚胎无法检测到功能性的造血干祖细胞。同时也在骨髓中造血干细胞和造血祖细胞数量的平衡中起调节作用[16]–[18]。而克隆特征关联基因,针对基因种类和相关性需要进一步研究。
本研究患者克隆异质性与疗效的相关分析显示,携带3个及以上克隆的患者其OS期和PFS期均远低于其他患者。而且在依据染色体核型及相关基因突变分组的中危组患者中,克隆异质性明显的患者其PFS期也远短于其他患者。以上结果与以往国外研究结果相近[3],[10],克隆异质性信息可反映肿瘤克隆的生物学特性,提示其耐药性、难治性及侵袭性,可用来评估患者的疗效和预测中危组患者的预后。而中危组中携带3个及以上克隆患者其OS期也较其他患者有缩短趋势,但因入组例数较少,差异无统计学意义,尚需扩大样本量进一步验证。
综上所述,AML的克隆异质性可反映肿瘤的耐药性及难治性,可进一步用于评估患者的疗效和预后分层。肿瘤的克隆异质性是其重要特征,现有的实验室检测手段中高通量测序可较好地为我们提供其相关的评估信息,如何利用好测序数据,以及与其他检测手段相结合,更好地针对肿瘤进行诊断和评估,是我们临床检测工作中一直需要思考和探索的。
Funding Statement
基金项目:河南省自然科学基金(182300410371);河南省科技攻关项目(192102310051)
Fund program: Natural Science Foundation of Henan Province (182300410371); Key Scientific and Technological Projects in Henan Province (192102310051)
References
- 1.Walter RB, Laszlo GS, Lionberger JM, et al. Heterogeneity of clonal expansion and maturation-linked mutation acquisition in hematopoietic progenitors in human acute myeloid leukemia[J] Leukemia. 2014;28(10):1969–1977. doi: 10.1038/leu.2014.107. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2.Papaemmanuil E, Gerstung M, Bullinger L, et al. Genomic Classification and Prognosis in Acute Myeloid Leukemia[J] N Engl J Med. 2016;374(23):2209–2221. doi: 10.1056/NEJMoa1516192. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.Bochtler T, Stölzel F, Heilig CE, et al. Clonal heterogeneity as detected by metaphase karyotyping is an indicator of poor prognosis in acute myeloid leukemia[J] J Clin Oncol. 2013;31(31):3898–3905. doi: 10.1200/JCO.2013.50.7921. [DOI] [PubMed] [Google Scholar]
- 4.Hirsch P, Tang R, Abermil N, et al. Precision and prognostic value of clone-specific minimal residual disease in acute myeloid leukemia[J] Haematologica. 2017;102(7):1227–1237. doi: 10.3324/haematol.2016.159681. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.中华医学会血液学分会白血病淋巴瘤学组. 成人急性髓系白血病(非急性早幼粒细胞白血病)中国诊疗指南(2017年版)[J] 中华血液学杂志. 2017;38(3):177–182. doi: 10.3760/cma.j.issn.0253-2727.2017.03.001. [DOI] [Google Scholar]
- 6.Farmanbar A, Firouzi S, Makałowski W, et al. Mutational Intratumor Heterogeneity is a Complex and Early Event in the Development of Adult T-cell Leukemia/Lymphoma[J] Neoplasia. 2018;20(9):883–893. doi: 10.1016/j.neo.2018.07.001. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Leeksma AC, Taylor J, Wu B, et al. Clonal diversity predicts adverse outcome in chronic lymphocytic leukemia[J] Leukemia. 2019;33(2):390–402. doi: 10.1038/s41375-018-0215-9. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.Arber DA, Orazi A, Hasserjian R, et al. The 2016 revision to the World Health Organization classification of myeloid neoplasms and acute leukemia[J] Blood. 2016;127(20):2391–2405. doi: 10.1182/blood-2016-03-643544. [DOI] [PubMed] [Google Scholar]
- 9.Haubner S, Perna F, Köhnke T, et al. Coexpression profile of leukemic stem cell markers for combinatorial targeted therapy in AML[J] Leukemia. 2019;33(1):64–74. doi: 10.1038/s41375-018-0180-3. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.Li S, Mason CE, Melnick A. Genetic and epigenetic heterogeneity in acute myeloid leukemia[J] Curr Opin Genet Dev. 2016;36:100–106. doi: 10.1016/j.gde.2016.03.011. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.Majeti R. Clonal evolution of pre-leukemic hematopoietic stem cells precedes human acute myeloid leukemia[J] Best Pract Res Clin Haematol. 2014;27(3-4):229–234. doi: 10.1016/j.beha.2014.10.003. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.Corces-Zimmerman MR, Hong WJ, Weissman IL, et al. Preleukemic mutations in human acute myeloid leukemia affect epigenetic regulators and persist in remission[J] Proc Natl Acad Sci U S A. 2014;111(7):2548–2553. doi: 10.1073/pnas.1324297111. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.Fujiwara Y, Yamaguchi H, Yui S, et al. Importance of prognostic stratification via gene mutation analysis in elderly patients with acute myelogenous leukemia[J] Int J Lab Hematol. 2019;41(4):461–471. doi: 10.1111/ijlh.13025. [DOI] [PubMed] [Google Scholar]
- 14.Tsai CH, Hou HA, Tang JL, et al. Genetic alterations and their clinical implications in older patients with acute myeloid leukemia[J] Leukemia. 2016;30(7):1485–1492. doi: 10.1038/leu.2016.65. [DOI] [PubMed] [Google Scholar]
- 15.刘 林, 徐 欢, 陈 志妹, et al. 515例急性髓系白血病患者年龄特异的细胞遗传学分析[J] 中华医学遗传学杂志. 2019;36(6):552–555. doi: 10.3760/cma.j.issn.1003-9406.2019.06.005. [DOI] [Google Scholar]
- 16.Sood R, Kamikubo Y, Liu P. Role of RUNX1 in hematological malignancies[J] Blood. 2017;129(15):2070–2082. doi: 10.1182/blood-2016-10-687830. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.North TE, de Bruijn MF, Stacy T, et al. Runx1 expression marks long-term repopulating hematopoietic stem cells in the midgestation mouse embryo[J] Immunity. 2002;16(5):661–672. doi: 10.1016/s1074-7613(02)00296-0. [DOI] [PubMed] [Google Scholar]
- 18.陈 思帆, 王 谈真, 蒋 淑慧, et al. 伴RUNX1突变髓系肿瘤42例临床特征和疗效分析[J] 中华血液学杂志. 2018;39(12):983–988. doi: 10.3760/cma.j.issn.0253-2727.2018.12.003. [DOI] [Google Scholar]