Abstract
目的
探讨异基因造血干细胞移植后复发急性B淋巴细胞白血病(B-ALL)CD19 CAR-T细胞治疗缓解后的维持治疗,观察单独输注供者造血干细胞和供者T淋巴细胞对CD19 CAR-T细胞扩增的影响。
方法
1例难治B-ALL患者,CD19 CAR-T(鼠源,克隆号:FMC63)细胞治疗后桥接同胞全相合异基因造血干细胞移植,后再次复发。接受CD19 CAR-T(可变区人源化的FMC63)细胞治疗再次缓解,缓解后先后接受单独输注供者造血干细胞、供者T淋巴细胞的维持治疗,期间监测患者细胞因子水平、CD19 CAR-T细胞比例、CD19 CAR的DNA表达变化,观察骨髓白血病细胞比例及供者嵌合情况。另外,通过制备小鼠CD19 CAR-T(FMC63)细胞,并将CAR-T细胞注射至同窝小鼠体内,14 d后,再次注射同窝小鼠的B淋巴细胞,在此过程中观察CAR-T细胞、B淋巴细胞比例以及CD19 CAR的DNA表达,以此来模拟临床治疗过程。
结果
①患者输注人源化CD19 CAR-T细胞后第14天,疗效评估达完全缓解(CR),供者嵌合率为99.76%,细胞因子释放综合征1级。②人源化CD19 CAR-T细胞治疗缓解后,单独输注供者造血干细胞维持治疗,输注后第24天出现移植物抗宿主病(GVHD),患者GVHD期间伴有外周血CD19 CAR-T细胞比例及CD19 CAR DNA水平的升高,并随GVHD缓解下降。过程中患者维持CR且供者嵌合率为99.69%。③随后单独输注供者T淋巴细胞维持治疗,回输后第12天患者出现GVHD,而患者外周血CD19 CAR-T细胞比例及CD19 CAR的DNA水平并未出现再次升高。过程中患者维持CR且供者嵌合率为99.87%。④C57小鼠体内试验证实,CAR-T细胞输注后小鼠体内CAR-T细胞扩增及DNA表达上调,同时CD19+ B淋巴细胞耗竭。之后输注CD19+ B淋巴细胞,CD19 CAR-T细胞扩增和CD19 CAR的DNA表达再度上调。
结论
供者造血干细胞、供者T淋巴细胞的单独输注,可作为异基因造血干细胞移植后复发B-ALL接受CD19 CAR-T治疗缓解后的维持治疗手段,且输注供者造血干细胞诱发GVHD同时出现CD19 CAR-T细胞和CD19 CAR的DNA表达上调,有可能进一步清除残留灶。
Keywords: 白血病,淋巴细胞,急性, 复发, CAR-T细胞, 供者造血干细胞, 供者T淋巴细胞, 造血干细胞移植
Abstract
Objective
This study aimed to evaluate the maintenance therapy following an anti-CD19-CAR T-cell therapy for a B-cell acute lymphoblastic leukemia (ALL) patient who relapsed after allogeneic hematopoietic cell transplantation (allo-HSCT) and investigate the effect of donor stem cells and donor T lymphocyte infusion on the amplification of CD19 CAR-T cells.
Methods
One refractory B-ALL patient relapsed after murine CD19 CAR-T cell therapy followed by a sibling allo-HSCT. He underwent a humanized CD19 CAR-T cell therapy followed by donor stem cell and donor T lymphocytes infusions as maintenance therapy in our hospital. The level of cytokines, the proportion of CD19 CAR-T cell, the level of CAR19 DNA expression in the peripheral blood, and the proportion of leukemia cells and donor chimerism in the bone marrow were detected. Correspondingly, T lymphocytes from the C57 spleen were separated to modify the CD19 CAR lentivirus and refused into C57 mice, and after 14 days, the B lymphocytes from C57 mice were separated and refused into the same C57 mice. The CD19 CAR T cells, B cells, and CD19 CAR gene counts in the peripheral blood were evaluated at different time points.
Results
①The patient achieved a complete response (CR) 14 days after a humanized CD19 CAR-T therapy with grade 1 cytokine release syndrome (CRS) and restored a donor chimerism to 99.76%. ② Following the remission from humanized CD19 CAR-T therapy, the patient received a maintenance therapy of donor stem cell infusion. Mild graft-versus-host disease (GVHD) manifested 24 days after infusion with an increased proportion of CD19 CAR-T cells and an increased level of CAR19 DNA expression in the peripheral blood. It fell with the remission of GVHD. The patient maintained CR and 99.69% donor chimerism during this period. ③ Throughout the subsequent donor T lymphocytes maintenance therapy, mild GVHD surfaced12 days after infusion without an increased proportion of CD19 CAR-T cells and an increased level of CAR19 DNA expression in the peripheral blood. The patient maintained CR and 99.87% donor chimerism during this period. ④ In vivo experiments on C57 mice confirmed that the proportion of CD19 CAR-T cells and the level of CAR19 DNA expression were upregulated in mice following CAR-T cell infusion, accompanied by depletion of CD19+ B lymphocyte. After infusion of CD19+ B lymphocyte cells, an increased proportion of CD19 CAR-T cells and an increased level of CAR19 DNA expression in the peripheral blood were observed again.
Conclusion
The infusion of donor stem cells and donor T lymphocytes could be used as a maintenance treatment after CD19 CAR-T cell therapy for B-ALL patients who relapsed after allo-HSCT. Infusion of donor stem cells induced an increased proportion of CD19 CAR-T cells and an increased level of CAR19 DNA expression with the occurrence of GVHD. It might lead to further elimination of minimal residual disease.
Keywords: Leukemia, lymphoblastic, acute; Relapse; CAR-T cell; Donor stem cells; Donor T cells; Hematopoietic cell transplantation
嵌合抗原受体修饰(Chimeric antigen receptor,CAR)T细胞治疗复发/难治急性B淋巴细胞白血病(B-ALL)完全缓解(CR)率为70%~90%[1]。1例复发/难治B-ALL患者经鼠源(m)CD19 CAR-T细胞治疗达到CR,桥接同胞全相合异基因造血干细胞移植(allo-HSCT)治疗,后疾病再次复发,于我科接受人源化CD19 CAR-T细胞治疗再次获得缓解。缓解后为了预防复发,予以输注供者造血干细胞,其后出现急性移植物抗宿主病(aGVHD),同时检测到CD19 CAR-T细胞比例和CD19 CAR基因表达水平的再次升高。而给予患者输注供者淋巴细胞未发生该现象。为了进一步探索该现象的机制,我们设计了小鼠体内试验,首先给予小鼠输注mCD19 CAR-T细胞使体内mCD19+B淋巴细胞消失;其后给予输注供鼠mCD19+B淋巴细胞后,mCD19+B淋巴细胞再度出现,并促进了mCD19 CAR-T细胞比例再次上升。现具体报告如下。
病例与方法
一、病例资料
患者,男,10岁。2017年3月主因“发热4 d”就诊于中国医学科学院血液病医院,诊断为B-ALL(中危组,WT1阳性,IgH重排)。诊断后患者接受1个疗程VDLP(长春地辛、柔红霉素、左旋门冬酰胺酶、地塞米松)、2个疗程CAM(环磷酰胺、阿糖胞苷、6-巯基嘌呤)、1个疗程HR-1(地塞米松、长春地辛、大剂量甲氨蝶呤、环磷酰胺、阿糖胞苷、培门冬酶)、1个疗程DEAL(依托泊苷、地塞米松、阿糖胞苷、左旋门冬酰胺酶)方案化疗,白血病免疫分型提示异常B淋巴细胞占8.03%。于2017年9月入组mCD19 CAR-T细胞治疗临床试验(NCT02975687),治疗后骨髓异常B淋巴细胞0.05%,WT1:0.85%,染色体荧光原位杂交IgH 0.8%。2017年12月13日接受胞姐HLA配型10/10位点相合allo-HSCT。移植后第42天骨髓微小残留病(MRD)阴性,WT1 0.53%,IgH重排阴性,供者嵌合率为99.7%。其后从2018年2月至2018年11月,患儿多次复发,复发及治疗情况见表1。2019年3月患儿再次复发,骨髓白血病细胞比例为70.5%,以难治/复发B-ALL入组我院“人源化CD19 CAR-T治疗复发/难治B细胞淋巴瘤/急性B淋巴细胞白血病”临床试验(ChiCTR1800019622)。
表1. 患者异基因造血干细胞移植后、人源化CD19 CAR-T细胞治疗前的治疗情况.
| 复发时间 | 复发时骨髓白血病细胞比例(%) | 复发时供者嵌合率(%) | 复发后治疗 | 治疗后骨髓白血病细胞比例(%) | 治疗后供者嵌合率(%) |
| 2018年2月26日 | 5.72 | 87.24 | 供者造血干细胞6.5×108/kg | 34.73 | 58.32 |
| 2018年3月20日 | 34.73 | 58.32 | FLAG+CTX联合供者造血干细胞6.5×108/kg | 0 | 99.96 |
| 2018年11月15日 | 68.00 | 49.73 | FLAG+Vp16联合供者造血干细胞3×108/kg | 18.26 | 85.22 |
| 供者造血干细胞3.2×108/kg | 52.67 | 48.34 | |||
| CAM联合供者造血干细胞3.2×108/kg | 31.23 | 60.07 |
注:FLAG:氟达拉滨、阿糖胞苷、G-CSF;CTX:环磷酰胺;Vp16:依托泊苷;CAM:环磷酰胺、阿糖胞苷、6-巯基嘌呤
二、人源化CD19 CAR-T细胞治疗过程及观察方法
1.临床观察指标的检测方法:聚合酶链反应扩增短串联重复序列(PCR-STR)法检测供者嵌合率。流式细胞术检测白血病残留病灶、CD19 CAR-T细胞比例,实时定量聚合酶链反应法检测CD19 CAR DNA水平。
2.移植后复发的人源化CD19 CAR-T细胞治疗:单采移植供者(胞姐)来源外周血单个核细胞制备CD19 CAR-T细胞,磁珠分选单个核细胞中CD3+ T细胞,培养第4天转染人源化CD19 CAR慢病毒(第二代人源化CD19 CAR慢病毒由上海吉倍公司提供),培养第12天收获CD19 CAR-T细胞。为减轻肿瘤负荷,患者于供者单采当日接受FA方案预处理(2019年3月7日):氟达拉滨25 mg/m2(第–12~–9天),阿糖胞苷0.5 g/m2(第–12~–9天);于第0天回输供者人源化CD19 CAR-T细胞2×106/kg。
3.CD19 CAR-T细胞治疗缓解后输注供者造血干细胞/供者T淋巴细胞:患者经人源化CD19 CAR-T细胞治疗达CR,于CAR-T细胞治疗后第36天复查骨髓细胞形态学:增生活跃,原始幼稚淋巴细胞为0;白血病免疫分型:未见明显异常表型原始B淋巴细胞,供者嵌合率为99.94%。未经化疗,回输供者外周血造血干细胞,输注量为单个核细胞3.19×108/kg,CD34+细胞0.6×106/kg。CAR-T细胞治疗后第61天,病情稳定,因患者无剩余供者干细胞冻存,同样未经化疗,回输供者T淋巴细胞0.83×107/kg。
4.供者干细胞和供者T淋巴细胞输注后观察:输注供者造血干细胞与供者T淋巴细胞后,均诱发GVHD,但仅输注供者干细胞后出现CD19 CAR-T细胞比例、CD19 CAR DNA水平的升高现象,为了初步探索发生机制,将输注的供者干细胞及供者T淋巴细胞进行流式细胞术检测,观察其中CD19+ B淋巴细胞比例。
三、动物实验方法
为了探讨上述临床观察到的供者干细胞输注后出现CD19 CAR-T细胞和CD19 CAR的DNA表达上调现象,我们设计了动物试验,验证是否给予小鼠输注mCD19+ B淋巴细胞,会诱发体内CD19 CAR-T细胞对小鼠B细胞的杀伤作用,清除mCD19+ B淋巴细胞,同时出现CD19 CAR-T细胞和CD19 CAR的DNA表达上调。
1.小鼠CD19 CAR-T细胞治疗实验:选择4~5周龄健康C57雌性小鼠20只,体重16~18 g,由北京华阜康生物科技有限公司提供。随机选取8只用于上述实验的观察,另外12只作为该8只小鼠的同窝同种小鼠CAR-T、T、B淋巴细胞供者,相同条件实验室喂养。
取4只供鼠,酒精消毒,超净台取小鼠脾脏,研磨获得脾脏细胞,培养基离心、冲洗3次。鼠抗鼠CD3磁珠分选mCD3+ T细胞,获得的细胞用含有mIL-2、谷氨酰胺的T细胞专用培养基培养,培养第4天使用CD19 CAR慢病毒(FMC63,我们通过实验验证FMC63也能识别小鼠CD19蛋白,亲和力约为人CD19蛋白的1/10)感染小鼠T细胞,第12天收获CD19 CAR-T细胞备用。取上述获得的CD19 CAR-T细胞,调整细胞密度为1×107/ml,8只接受治疗小鼠,每只尾静脉注射0.1 ml。于治疗后第7、14天内眦取血,流式细胞术检测CD19 CAR-T细胞比例(检测抗体为CD19-兔FC融合蛋白)、B淋巴细胞比例以及CD19 CAR的DNA表达。
2.小鼠CD19 CAR-T细胞治疗后再接受CD19+ B淋巴细胞输注:于CAR-T细胞输注后第14天,再次取4只供鼠,酒精消毒,超净台取小鼠脾脏,获取外周血和脾脏细胞。以鼠抗鼠CD19磁珠分选CD19+ B淋巴细胞,调整细胞密度为1×106/ml,8只接受治疗小鼠每只尾静脉注射0.1 ml。于注射后即刻、第7、14天内眦取血,流式细胞术检测CD19 CAR-T细胞比例、B淋巴细胞比例以及CD19 CAR的DNA表达。此后7 d(CAR-T细胞输注后42 d)重复该操作及检测过程。
四、统计学处理
采用SPSS 17.0软件处理结果,计量资料数据均以x±s表示。
结果
一、人源化CD19 CAR-T细胞及供者造血干细胞/供者T淋巴细胞输注疗效观察
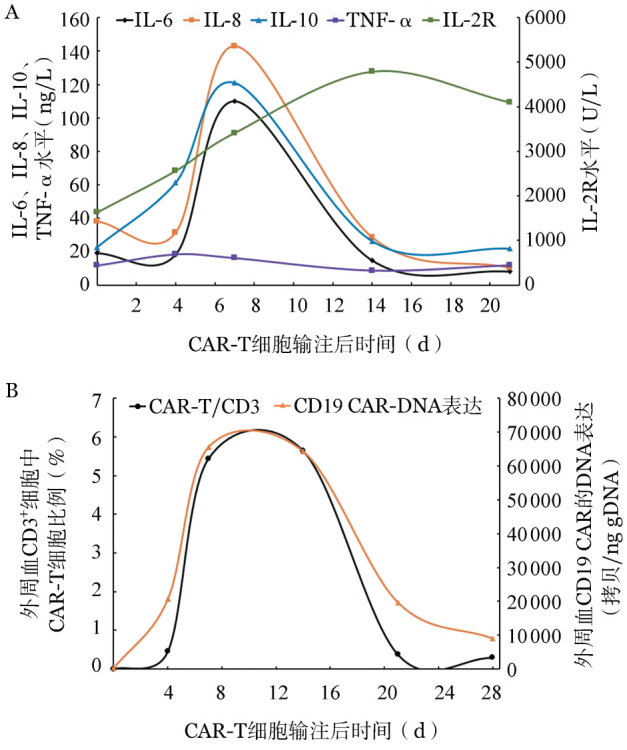
1.移植后复发的人源化CD19 CAR-T细胞治疗:人源化CD19 CAR-T细胞回输第7天体温最高40.0 °C,伴有畏寒、寒战、乏力;C反应蛋白、细胞因子、外周血CD19 CAR-T细胞比例及CD19 CAR的DNA表达均升高(图1)。评估细胞因子释放综合征(CRS)1级,予以非甾体消炎药对症处理及支持治疗。于第14天复查骨髓象:增生活跃,原始幼稚淋巴细胞为0;白血病免疫分型:标本中B淋巴细胞比例极低;血常规:WBC 4.18×109/L,HGB 97 g/L,PLT 112×109/L;供者嵌合率为99.76%。疗效评估达CR。
图1. 移植后复发的急性B淋巴细胞白血病患者CD19 CAR-T治疗后炎症介质(A)、CAR-T细胞及CD9 CAR DNA表达(B).
2.CD19 CAR-T细胞治疗缓解后输注供者造血干细胞/供者T淋巴细胞:回输供者造血干细胞后第24天,即人源化CD19 CAR-T细胞治疗后第50天,患者出现GVHD[肝功能损害(Glucksberg分级2级)、多发皮疹(Glucksberg分级1级)],给予小剂量糖皮质激素及对症治疗后好转,过程中维持CR且供者嵌合率为99.69%。患者回输供者造血干细胞后第21天,外周血CD19 CAR-T细胞比例、CD19 CAR的DNA水平再次升高,出现小高峰,随后7 d左右水平开始下降(图2A)。
图2. CD19 CAR-T细胞治疗后输注供者造血干细胞及供者T淋巴细胞后CAR-T细胞(A)及CD19 CAR DNA表达(B).

回输供者T淋巴细胞后第12天,即人源化CD19 CAR-T细胞治疗后第73天,患者再次出现GVHD,肝功能损害(Glucksberg分级3级),给予对症治疗后好转,过程中维持CR且供者嵌合率为99.87%。此次供者T淋巴细胞输注后,患者外周血CD19 CAR-T细胞比例、CD19 CAR的DNA水平并未出现再次升高(图2B)。
3.供者造血干细胞和供者T淋巴细胞检测:供者干细胞和供者T淋巴细胞解冻后,其CD19+ B淋巴细胞比例均比较低,供者干细胞中CD19+ B淋巴细胞为0.51%,供者T淋巴细胞中CD19+ B淋巴细胞为0.55%。因此临床上供者干细胞或T淋巴细胞输注后,短期内并未引起CD19 CAR-T细胞杀伤体内CD19+ B淋巴细胞而导致的CD19 CAR-T细胞比例、CAR19的DNA水平升高,以及CRS等不良反应的情况。
二、动物实验验证结果
1.小鼠CD19 CAR-T细胞治疗:8只接受CD19 CAR-T细胞输注的小鼠,在细胞输注后第7天CD19 CAR-T细胞比例上升达峰值,随后下降,输注后第14天CD19+ B淋巴细胞在体内消失(图3A)。
图3. 小鼠实验验证细胞输注诱发CD19 CAR-T细胞(A)和CD19 CAR DNA水平(B)升高现象.
2.小鼠CD19 CAR-T细胞治疗后再接受CD19+B淋巴细胞输注:CD19 CAR-T细胞输注后第14天小鼠体内CD19+ B淋巴细胞消失。当给予供鼠CD19+ B淋巴细胞输注后,即刻治疗组小鼠体内CD19+ B淋巴细胞水平再度升高,其后输注供鼠CD19+ B淋巴细胞后第7天,再度消失,且CD19 CAR-T细胞比例上升;输注供鼠CD19+ B淋巴细胞后第14天小鼠体内CD19+ B细胞及CD19 CAR-T细胞比例均呈低水平。过程中,CD19 CAR的DNA表达与CD19 CAR-T细胞比例出现同样的变化趋势。此后第7天(小鼠CAR-T细胞输注后第42天)重复该操作,观察到同样现象,结果见图3B。
讨论
CD19 CAR-T细胞治疗复发/难治B-ALL和B细胞非霍奇金淋巴瘤(NHL)疗效显著,被认为是最有前景的肿瘤治疗方式之一[1]–[3]。而提高CAR-T细胞抗肿瘤活性、维持细胞足够长时间的增殖对抗肿瘤治疗成功和抑制疾病复发有重要意义[4]–[5]。
人源化的单链抗体(scFv)可以减低CAR的免疫原性从而改善CAR-T细胞的存活时间并且增强CAR-T细胞的治疗效果[6]–[7]。人源化CD19 CAR-T细胞体内和体外都能有效清除白血病细胞[6]–[8]。体外实验证明,人源化CD19 CAR-T细胞与mCD19 CAR-T细胞比较,其增殖活性强、杀伤活性高、体内存留时间长,能有效清除白血病细胞,具有良好的抗肿瘤效应[6]–[7]。临床研究证明,mCD19 CAR-T细胞治疗后复发的B-ALL,接受人源化CD19 CAR-T细胞仍然有效[8]。本例患者allo-HSCT前接受mCD19 CAR-T细胞治疗缓解,此后复发,换用人源化CD19 CAR-T细胞治疗再次获得缓解。
allo-HSCT提高了ALL患者的生存率,但allo-HSCT后复发患者预后很差,生存期不足6个月[9],挽救治疗包括化疗、二次移植、供者淋巴细胞输注,但这些治疗可能导致严重的不良反应或GVHD[10]–[11]。B-ALL患者allo-HSCT后复发,供者来源的抗CD19 CAR-T细胞可以有效清除恶性B细胞[12]–[14]。供者来源的抗CD19 CAR-T细胞治疗allo-HSCT后复发B-ALL,可以达到良好的疗效,未发现严重的GVHD[12],[15],亦未发现严重的不良反应,如肿瘤溶解综合征、CRS及中枢神经系统毒性[16]–[17],本例患者CRS亦仅为1级。因此,CD19 CAR-T细胞治疗可以一定程度上克服移植后复发B-ALL的不良预后[16]–[17]。供者来源的CD19 CAR-T细胞可作为allo-HSCT后复发B-ALL的挽救治疗[18]。
本例allo-HSCT后复发的B-ALL患者接受CD19 CAR-T细胞治疗缓解后,为了预防疾病再次复发,并保护体内低水平残留的CD19 CAR-T细胞,采用了单独输注供者造血干细胞和供者T淋巴细胞的治疗手段。我们观察到,输注两种供者细胞后,均未出现CRS表现,而分别于输注后第24天和12天诱发了GVHD。但输注供者造血干细胞后发生GVHD同时出现CD19 CAR-T和CD19 CAR的DNA表达上调,而输注供者T淋巴细胞未发生此现象。分析其可能的原因,表达上调发生于供者干细胞输注后第24天,即供者干细胞有可能在患者体内开始植入、患者体内逐渐出现CD19+ B淋巴细胞的时间,是否为体内残留CD19 CAR-T细胞攻击了此CD19+ B淋巴细胞导致其再度扩增,从而延长了CD19 CAR-T细胞在体内的存留时间,起到更好的清除残留灶作用。我们尚不能证实,供者干细胞输注诱发的GVHD,还是诱发的CD19 CAR-T细胞再扩增,起到了清除残留白血病细胞的作用。而对于所检测到的CAR-T细胞再扩增,无论是针对白血病细胞,还是针对供者的CD19+ B淋巴细胞,只要延长CAR-T细胞在体内存留时间,就将起到进一步清除残留灶的作用。
小鼠体内实验进一步证实这个现象,我们分别用三种可变区的CD19 CAR-T细胞对小鼠进行初步筛选,一个可变区来自鼠源单克隆抗体FMC63和两个针对FMC63人源化的可变区,我们发现FMC63来源CD19 CAR-T细胞有杀伤小鼠B淋巴细胞的作用。我们的实验数据也表明FMC63单克隆抗体也能部分识别小鼠CD19的胞外段,进而该CD19 CAR-T细胞有可能杀伤小鼠B淋巴细胞。在输注CD19 CAR-T细胞后,小鼠体内B淋巴细胞耗竭,CAR-T细胞峰值下降。在随后的CD19+B淋巴细胞输注后,我们观察到CD19 CAR-T细胞再次扩增,CD19 CAR的DNA表达也出现类似规律变化。分析其机制,CAR-T细胞峰值下降后,人为在小鼠体内注射CD19+ B淋巴细胞,体内残留的CD19 CAR-T细胞将会杀伤CD19+ B淋巴细胞而出现再次扩增。对于移植后患者,输注供者造血干细胞维持治疗,造血干细胞在体内植入后,会出现CD19+ B淋巴细胞,此时与小鼠体内实验相同,CD19 CAR-T细胞将会杀伤CD19+ B淋巴细胞而出现再次扩增,而扩增的CD19 CAR-T细胞将进一步杀伤残留白血病细胞。2019年ASH中一个口头报告(ClinicalTrials.gov Identifier: NCT03186118)有类似研究发现,即将CD19抗原转入患者T淋巴细胞,制备CD19+抗原呈递细胞,每28 d给患者输注1次,诱导了CD19 CAR-T细胞的再扩增。
综上,allo-HSCT后复发B-ALL患者接受CD19 CAR-T细胞治疗缓解后,维持治疗采用单独输注供者干细胞/供者T淋巴细胞发生GVHD的同时,我们发现输注供者干细胞可以诱发CD19 CAR-T细胞和CD19 CAR的DNA表达一过性上调,可能起到更好的清除残留灶作用。如何延长移植后复发B-ALL的CD19 CAR-T细胞治疗的疗效,并探索其与供者干细胞、供者T淋巴细胞的协同作用机制,仍需要扩大样本进一步研究。
References
- 1.Luskin MR, DeAngelo DJ. Chimeric Antigen Receptor Therapy in Acute Lymphoblastic Leukemia Clinical Practice[J] Curr Hematol Malig Rep. 2017;12(4):370–379. doi: 10.1007/s11899-017-0394-x. [DOI] [PubMed] [Google Scholar]
- 2.Kochenderfer JN, Dudley ME, Kassim SH, et al. Chemotherapy-refractory diffuse large B-cell lymphoma and indolent B-cell malignancies can be effectively treated with autologous T cells expressing an anti-CD19 chimeric antigen receptor[J] J Clin Oncol. 2015;33(6):540–549. doi: 10.1200/JCO.2014.56.2025. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.Kochenderfer JN, RPT S, Lu T, et al. Long-Duration Complete Remissions of Diffuse Large B Cell Lymphoma after Anti-CD19 Chimeric Antigen Receptor T Cell Therapy[J] Mol Ther. 2017;25(10):2245–2253. doi: 10.1016/j.ymthe.2017.07.004. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.Mirzaei HR, Pourghadamyari H, Rahmati M, et al. Gene-knocked out chimeric antigen receptor (CAR) T cells: Tuning up for the next generation cancer immunotherapy[J] Cancer Lett. 2018;423:95–104. doi: 10.1016/j.canlet.2018.03.010. [DOI] [PubMed] [Google Scholar]
- 5.Turtle CJ, Hanafi LA, Berger C, et al. CD19 CAR-T cells of defined CD4+:CD8+ composition in adult B cell ALL patients[J] J Clin Invest. 2016;126(6):2123–2138. doi: 10.1172/JCI85309. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Qian L, Li D, Ma L, et al. The novel anti-CD19 chimeric antigen receptors with humanized scFv (single-chain variable fragment) trigger leukemia cell killing[J] Cell Immunol. 2016;304-305:49–54. doi: 10.1016/j.cellimm.2016.03.003. [DOI] [PubMed] [Google Scholar]
- 7.Mirzaei HR, Jamali A, Jafarzadeh L, et al. Construction and functional characterization of a fully human anti-CD19 chimeric antigen receptor (huCAR)-expressing primary human T cells[J] J Cell Physiol. 2019;234(6):9207–9215. doi: 10.1002/jcp.27599. [DOI] [PubMed] [Google Scholar]
- 8.Zhao Y, Liu Z, Wang X, et al. Treatment with Humanized Selective CD19CAR-T Cells Shows Efficacy in Highly Treated B-ALL Patients Who Have Relapsed after Receiving Murine-Based CD19CAR-T Therapies[J] Clin Cancer Res. 2019;25(18):5595–5607. doi: 10.1158/1078-0432.CCR-19-0916. [DOI] [PubMed] [Google Scholar]
- 9.Spyridonidis A, Labopin M, Schmid C, et al. Outcomes and prognostic factors of adults with acute lymphoblastic leukemia who relapse after allogeneic hematopoietic cell transplantation. An analysis on behalf of the Acute Leukemia Working Party of EBMT[J] Leukemia. 2012;26(6):1211–1217. doi: 10.1038/leu.2011.351. [DOI] [PubMed] [Google Scholar]
- 10.Roddie C, Peggs KS. Donor lymphocyte infusion following allogeneic hematopoietic stem cell transplantation[J] Expert Opin Biol Ther. 2011;11(4):473–487. doi: 10.1517/14712598.2011.554811. [DOI] [PubMed] [Google Scholar]
- 11.Scarisbrick JJ, Dignan FL, Tulpule S, et al. A multicentre UK study of GVHD following DLI: rates of GVHD are high but mortality from GVHD is infrequent[J] Bone Marrow Transplant. 2015;50(1):62–67. doi: 10.1038/bmt.2014.227. [DOI] [PubMed] [Google Scholar]
- 12.Brudno JN, Somerville RP, Shi V, et al. Allogeneic T Cells That Express an Anti-CD19 Chimeric Antigen Receptor Induce Remissions of B-Cell Malignancies That Progress After Allogeneic Hematopoietic Stem-Cell Transplantation Without Causing Graft-Versus-Host Disease[J] J Clin Oncol. 2016;34(10):1112–1121. doi: 10.1200/JCO.2015.64.5929. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.Cruz CR, Micklethwaite KP, Savoldo B, et al. Infusion of donor-derived CD19-redirected virus-specific T cells for B-cell malignancies relapsed after allogeneic stem cell transplant: a phase 1 study[J] Blood. 2013;122(17):2965–2973. doi: 10.1182/blood-2013-06-506741. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Kochenderfer JN, Dudley ME, Carpenter RO, et al. Donor-derived CD19-targeted T cells cause regression of malignancy persisting after allogeneic hematopoietic stem cell transplantation[J] Blood. 2013;122(25):4129–4139. doi: 10.1182/blood-2013-08-519413. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.Chen Y, Cheng Y, Suo P, et al. Donor-derived CD19-targeted T cell infusion induces minimal residual disease-negative remission in relapsed B-cell acute lymphoblastic leukaemia with no response to donor lymphocyte infusions after haploidentical haematopoietic stem cell transplantation[J] Br J Haematol. 2017;179(4):598–605. doi: 10.1111/bjh.14923. [DOI] [PubMed] [Google Scholar]
- 16.Liu J, Zhong JF, Zhang X, et al. Allogeneic CD19-CAR-T cell infusion after allogeneic hematopoietic stem cell transplantation in B cell malignancies[J] J Hematol Oncol. 2017;10(1):35. doi: 10.1186/s13045-017-0405-3. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.Anwer F, Shaukat AA, Zahid U, et al. Donor origin CAR T cells: graft versus malignancy effect without GVHD, a systematic review[J] Immunotherapy. 2017;9(2):123–130. doi: 10.2217/imt-2016-0127. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18.Magnani CF, Biondi A, Biagi E. Donor-derived CD19-targeted T cells in allogeneic transplants[J] Curr Opin Hematol. 2015;22(6):497–502. doi: 10.1097/MOH.0000000000000178. [DOI] [PubMed] [Google Scholar]



