Abstract
目的
探讨非局限期结外鼻型NK/T细胞淋巴瘤(ENKTL)患者的临床特征及预后影响因素。
方法
回顾性分析北京协和医院2012年1月至2019年12月收治的51例Ⅲ~Ⅳ期ENKTL患者的临床资料。分析其临床特征、疗效、生存情况及预后影响因素,依据起病时是否存在鼻咽部受累分为鼻型与非鼻型,对比分析二者的差异,探讨EB病毒DNA(EBV-DNA)在疗效监测及预后评价中的意义。
结果
所有患者的中位发病年龄为42(14~67)岁,男女比例为2.9∶1。中位随访时间为30(1~78)个月,非局限期患者中位总生存(OS)时间为7个月,1年及3年无进展生存(PFS)率分别为34.1%和24.6%,1年及3年OS率分别为39.9%和26.6%。鼻型与非鼻型患者的比例为1.6∶1。非鼻型患者合并噬血细胞综合征的比例较鼻型患者高(65.0%对35.5%,P=0.039),非鼻型患者一线化疗的完全缓解(CR)率较鼻型患者低(10.0%对45.2%,P=0.008)。非局限期鼻型与非鼻型患者的中位OS时间分别为9个月和4个月,3年PFS率分别为36.0%和10.0%(P=0.029),3年OS率分别为37.9%和11.4%(P=0.050)。EBV-DNA的变化趋势与疗效有良好的相关性。基线EBV-DNA阴性与阳性患者生存曲线的差异无统计学意义。1个疗程化疗后EBV-DNA阴性与阳性患者的3年OS率分别为77.9%和8.1%,差异有统计学意义(P=0.002)。多因素分析结果显示,1个疗程化疗后EBV-DNA阳性为OS不良的独立预后因素。
结论
应用以培门冬酶为基础化疗方案的非局限期ENKTL患者的治疗有效率及远期生存仍较差。非鼻型患者在临床特征、化疗疗效及远期预后方面均较鼻型患者差。1个疗程化疗后EBV-DNA阳性为OS不良的独立预后因素,可用于早期预测疗效及预后。
Keywords: 结外NK/T细胞淋巴瘤, 总生存, 预后因素, EB病毒DNA
Abstract
Objective
This study aimed to explore the clinical characteristics, survival rate, and prognostic factors of advanced-stage extranodal nasal type NK/T cell lymphoma (ENKTL) patients.
Methods
The clinical data of 51 advanced-stage ENKTL patients in Peking Union Medical College Hospital from January 2012 to September 2019 were retrospectively analyzed. The clinical characteristics, treatment responses, survival rate, and prognostic factors were elucidated. The differences between nasal and non-nasal type and the significance of EBV-DNA in treatment response assessment and prognosis analysis were also evaluated.
Results
The male-to-female ratio in the whole group was 2.9∶1 with a median age of 42 years old (range, 14–67 years). The median follow-up time was 30 months (range, 1–78 months). The one- and three-year progression-free survival (PFS) rates for the whole cohort were 34.1% and 24.6%, respectively, and the one- and three-year overall survival (OS) rates were 39.9% and 26.6%, respectively. The ratio of nasal to non-nasal type was 1.6∶1. The proportion of hemophagocytic lymphohistiocytosis (HLH) was significantly higher in non-nasal-type patients than nasal-type (P=0.039), and the complete response (CR) rate of first-line chemotherapy is significantly lower in non-nasal type patients (P=0.008). The median OS for nasal and non-nasal types were nine months and four months, respectively. The three-year PFS rates of nasal and non-nasal type patients were 36.0% and 10.0% (P=0.029), respectively, and the three-year OS rates were 37.9% and 11.4% (P=0.050), respectively. The correlation between the Epstein-Barr virus DNA (EBV-DNA) and treatment response were satisfactory. Survival curve between baseline EBV-DNA-negative and EBV-DNA-positive patients showed no significant difference. The three-year OS rates of EBV-DNA-negative and EBV-DNA-positive patients after one cycle of treatment were 77.9% and 8.1% (P=0.002), respectively. In a multivariate analysis, EBV-DNA-positive following one cycle of treatment was an independent adverse prognostic factor for OS.
Conclusion
The efficacy of pegaspargase-based chemotherapy and long-term survival of advanced-stage ENKTL patients were still poor. Clinical characteristics, treatment response, and long-term survival of non-nasal-type patients were worse than that of nasal-type patients. In a multivariate analysis, EBV-DNA-positive after one cycle of treatment was an independent adverse prognostic factor for OS. It can be used for early prediction of treatment response and prognosis.
Keywords: Extranodal NK/T-cell lymphoma, Overall survival, Prognostic factor, Epstein-Barr virus DNA
结外鼻型NK/T细胞淋巴瘤(ENKTL)属于非霍奇金淋巴瘤(NHL)的一种特殊类型,好发于包括我国在内的东南亚地区及拉丁美洲[1]。ENKTL的发病与EB病毒(EBV)密切相关,具有高度侵袭性,目前尚无国际统一的治疗方案及可靠的预后判断指标。对于局限期患者,放化疗相结合的治疗方式及包含左旋门冬酰胺酶或培门冬酶的化疗方案已显著改善患者的生存。而对于非局限期患者,现有化疗有效率低,预后仍较差,针对非局限期患者临床研究有待深入。本研究回顾性分析了北京协和医院血液内科51例非局限期ENKTL患者的临床资料,探究其临床特征及预后影响因素。同时对非局限期鼻型与非鼻型患者的临床特征、预后及EBV-DNA在疗效监测、预后评价中的作用进行分析。
病例与方法
1.病例:本研究为回顾性研究,纳入2012年1月至2019年12月于北京协和医院诊治的ENKTL患者51例。纳入病例均符合以下标准:①依据世界卫生组织(WHO)造血和淋巴系统肿瘤分类标准[1],由我院病理科医师经组织学及免疫组化确诊。②EBV编码RNA(EBER)原位杂交检测阳性。③Ann Arbor分期为Ⅲ~Ⅳ期,即非局限期。依据起病时是否存在鼻咽部受累分为鼻型与非鼻型。预后评分参照IPI评分标准及PINK-E评分标准[2]。
2.EBV-DNA检测:EBV-DNA的检测方法采用实时荧光定量PCR法。抽取ENKTL患者静脉血2 ml,EDTA抗凝,采用全血基因组提取试剂盒(湖南圣湘生物科技有限公司EBV核酸定量检测试剂盒)及Natch S全自动核酸提取仪器提取DNA,应用Roche LightCycler 480 Ⅱ荧光定量PCR仪测定51例非局限期ENKTL患者全血EBV-DNA水平,测定方法参照试剂盒说明书。EBV-DNA<500拷贝/ml为检测结果阴性,EBV-DNA≥500拷贝/ml为检测结果阳性。
3.治疗及疗效评估:Ⅲ~Ⅳ期ENKTL患者主要采用化疗和(或)自体造血干细胞移植治疗。一线化疗主要应用以培门冬酶为基础的方案,包括SMILE方案[3](异环磷酰胺+甲氨蝶呤+培门冬酶+地塞米松+依托泊苷),GDP+ML方案[4](吉西他滨+顺铂+甲氨蝶呤+培门冬酶+地塞米松)。合并噬血细胞综合征(HLH)的患者应用地塞米松+依托泊苷控制HLH。局部病灶疗效评估采用鼻窦增强CT或MRI,全身评估采用胸腹盆增强CT或PET-CT。疗效评估采用2007年Cheson淋巴瘤疗效评价修订标准[5],分为完全缓解(CR)、部分缓解(PR)、疾病稳定(SD)和疾病进展(PD)。总有效率(ORR)为获得CR或PR患者的比例。
4.随访:随访方式包括住院治疗、门诊复查和电话随访。随访截止时间为2019年12月,中位随访时间30(1~78)个月。总生存(OS)时间指从确诊之日起至因任何原因死亡或随访终止的时间。无进展生存(PFS)时间指从确诊之日起至出现疾病进展、死亡或随访终点的时间。
5.统计学处理:本研究应用SPSS 19.0和Graph-Pad Prism 7.0软件进行统计学分析。生存分析采用Kaplan-Meier法,组间生存率比较采用Log-rank检验。计数资料间的比较采用卡方检验或Fisher精确检验。预后分析采用Cox回归模型,将单因素分析中P<0.1的因素纳入Cox回归多因素分析。P<0.05为差异有统计学意义。
结果
1.临床特征:患者中位发病年龄42(14~67)岁,男38例(74.5%),女13例(25.5%),男女比例为2.9∶1,年龄>60岁者7例(13.7%),存在B症状者45例(88.2%)。EBV-DNA阳性(≥500拷贝/ml)者44例(86.3%),LDH升高(>250 U/L)者36例(70.6%)。结外受累器官数量>1者44例(86.3%),10例(19.6%)患者骨髓受累,7例(13.7%)患者中枢神经系统受累,主要累及皮肤、胃肠道、肝脏、脾脏、肺的患者分别有17例(33.3%)、11例(21.6%)、9例(17.6%)、14例(27.5%)、10例(19.6%)。根据2004年HLH的诊断标准[6],24例(47.1%)患者病程中合并HLH。IPI评分为高危组的患者22例(43.1%),PINK-E评分为高危组的患者37例(72.5%)。
2.治疗方案与疗效评估:本研究51例非局限期患者中,46例患者接受包含培门冬酶的化疗。一线化疗方案包括GDP+ML方案24例、SMILE方案20例、CHOP+L(环磷酰胺+表柔比星+长春地辛+泼尼松+培门冬酶)方案2例。3例患者起病时合并HLH且一般情况差,仅应用地塞米松+依托泊苷方案控制HLH,后因PD短期内死亡。2例患者起病时分别合并消化道出血和脑卒中,仅接受支持治疗。9例患者一线化疗获得CR后行自体造血干细胞移植巩固,1例患者一线化疗获得CR后行异基因造血干细胞移植。一线化疗方案获得CR者16例(包括应用GDP-ML患者8例、SMILE患者7例、CHOP-L患者1例),获得PR的患者7例(包括应用GDP-ML患者6例、SMILE患者1例),ORR为50.0%。21例(45.7%)患者疗效评估为PD。2例患者因中性粒细胞缺乏(粒缺)期感染死亡,未行疗效评估。
3.总体生存情况:51例非局限期患者中,死亡34例,其中包括鼻型17例,非鼻型17例。其中31例患者死亡原因为PD,2例患者死亡原因为化疗后粒缺期出现重症肺部感染、感染性休克,1例患者为非治疗相关性死亡(服用过量苯二氮卓类药物)。非局限期患者中位OS时间为7个月,1年及3年OS率分别为39.9%和26.6%(图1A),1年及3年PFS率分别为34.1%和24.6%(图1B)。
图1. 51例非局限期结外鼻型NK/T细胞淋巴瘤患者的总生存(A)和无进展生存(B)曲线.
4.鼻型患者与非鼻型患者对比:本研究51例非局限期患者中,鼻型31例,非鼻型20例,鼻型与非鼻型患者的比例为1.6∶1。非鼻型患者合并HLH的比例较鼻型患者高(65.0%对35.5%),差异有统计学意义(P=0.039)。非鼻型组与鼻型组在年龄>60岁、B症状、LDH升高、EBV-DNA阳性、骨髓受累方面的差异无统计学意义。非鼻型组与鼻型组患者的一线化疗CR率分别为10.0%和45.2%,差异有统计学意义(P=0.008)(表1)。
表1. 鼻型与非鼻型非局限期结外鼻型NK/T细胞淋巴瘤患者的临床特征比较[例(%)].
| 临床特征 | 鼻型(31例) | 非鼻型(20例) | χ2值 | P值 |
| 年龄>60岁 | 4(12.9) | 3(15.0) | 0.045 | 0.832 |
| 存在B症状 | 26(83.9) | 19(95.0) | 0.576 | 0.494 |
| EBV-DNA阳性 | 27(87.1) | 17(85.0) | 0.045 | 0.832 |
| LDH升高 | 20(64.5) | 16(80.0) | 1.404 | 0.236 |
| 骨髓受累 | 5(16.1) | 5(25.0) | 0.607 | 0.436 |
| 合并HLH | 11(35.5) | 13(65.0) | 4.251 | 0.039 |
| 一线化疗达到CR | 14(45.2) | 2(10.0) | 8.981 | 0.008 |
注:EBV:EB病毒;HLH:噬血细胞综合征;CR:完全缓解
在远期生存方面,鼻型患者的中位OS时间为9个月,1年及3年OS率分别为49.8%和37.9%(图2A),1年及3年的PFS率为47.2%和36%(图2B)。而非鼻型患者的中位OS时间仅为4个月,1年及3年OS率为22.9%和11.4%(图2A),1年及3年PFS率分别为15.0%和10.0%(图2B)。鼻型与非鼻型ENKTL患者的PFS率差异有统计学意义(P=0.029),两者OS率的差异无统计学意义(P=0.050)。
图2. 鼻型与非鼻型非局限期结外鼻型NK/T细胞淋巴瘤患者的总生存(A)和无进展生存(B)曲线.
5.EBV-DNA水平与疗效及生存的关系:51例非局限期患者中,34例患者有完整的EBV-DNA监测数据(包括治疗前、每疗程化疗后及结束治疗后)。以治疗前、化疗1个疗程后、结束治疗后3个时间点记录的EBV-DNA水平作图(图3)。13例疗效评估为CR或PR的患者中,10例患者EBV-DNA水平在化疗1个疗程后迅速下降至阴性,治疗结束时9例患者的EBV-DNA水平为阴性(图3A)。在后续的随访中,4例治疗结束时EBV-DNA仍为阳性的患者均出现疾病复发或PD,9例治疗结束时EBV-DNA阴性的患者中仅1例出现疾病复发。在21例疗效评估为PD的患者中,多数患者EBV-DNA维持高水平阳性,治疗结束时仅1例患者EBV-DNA下降至阴性(图3B)。34例记录了完整的EBV-DNA数据的患者中,26例患者进行了中期评估。中期疗效评估为CR的患者,其EBV-DNA水平均于1个疗程后降至阴性。中期疗效评估为PR的患者,其EBV-DNA水平多显著下降,部分降至阴性。而中期疗效仅为PD的患者,EBV-DNA多维持高水平阳性,无明显下降趋势(图3C)。EBV-DNA的变化趋势与疗效评估呈现良好的对应关系。
图3. 治疗前、1个疗程化疗后及治疗结束时非局限期结外鼻型NK/T细胞淋巴瘤患者EB病毒DNA水平变化趋势.
A:13例治疗结束时疗效评估为完全缓解(CR)或部分缓解(PR)的患者;B:21例治疗结束时疗效评估为进展(PD)的患者;C:34例中期疗效评估为CR、PR和PD的患者
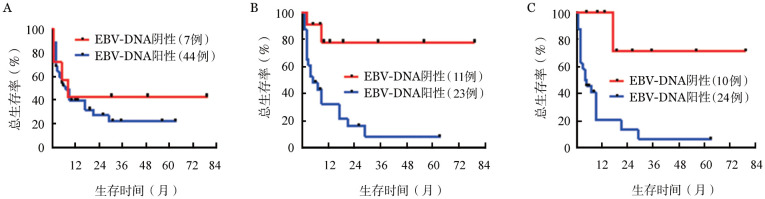
基线EBV-DNA阳性与阴性患者OS率的差异无统计学意义(P=0.538)(图4A)。1个疗程化疗后及治疗结束时EBV-DNA阳性组与阴性组患者的OS率差异有统计学意义(P=0.002和P<0.001)(图4B、4C)。1个疗程化疗后EBV-DNA阴性与阳性患者的3年OS率分别为77.9%和8.1%(P=0.002),结束治疗时EBV-DNA阴性与阳性患者的3年OS率分别为71.4%和6.8%(P<0.001)。1个疗程化疗后及治疗结束时EBV-DNA仍为阳性的患者中位生存期分别为5个月和4.5个月。
图4. 治疗开始前、1个疗程化疗后、治疗结束时EBV-DNA阳性与阴性非局限期结外鼻型NK/T细胞淋巴瘤患者的总生存曲线.
A:基线EBV-DNA阳性组与阴性组患者的总生存曲线;B:1个疗程化疗后EBV-DNA阳性组与阴性组患者的总生存曲线;C:治疗结束时EBV-DNA阳性组与阴性组患者的总生存曲线
6.预后因素分析:对51例非局限期患者进行单因素分析发现,年龄>60岁及1个疗程化疗后EBV-DNA阳性为影响OS的不良预后因素。将单因素分析中P<0.1的3个因素(包括年龄>60岁,1个疗程化疗后EBV-DNA阳性,合并HLH)纳入Cox多因素回归分析,结果显示仅1个疗程化疗后EBV-DNA阳性为OS不良的独立预后因素(P=0.002)(表2)。
表2. 影响51例非局限期结外鼻型NK/T细胞淋巴瘤患者总生存的单因素及多因素分析.
| 因素 | 单因素分析 |
多因素分析 |
||
| HR(95% CI) | P值 | HR(95% CI) | P值 | |
| 年龄(>60岁,≤60岁) | 2.451(1.052~5.708) | 0.038 | ||
| 类型(非鼻型,鼻型) | 1.658(0.825~3.331) | 0.156 | ||
| B症状(有,无) | 1.270(0.433~3.635) | 0.656 | ||
| ECOG评分(≥2分,<2分) | 1.738(0.882~3.425) | 0.110 | ||
| LDH(升高,正常) | 1.743(0.784~3.887) | 0.173 | ||
| 基线EBV-DNA(阳性,阴性) | 1.468(0.509~4.323) | 0.478 | ||
| 1个疗程化疗后EBV-DNA(阳性,阴性) | 6.576(1.523~28.396) | 0.012 | 6.200(1.371~28.048) | 0.012 |
| 噬血细胞综合征(有,无) | 1.798(0.912~3.544) | 0.090 | ||
| 骨髓受累(有,无) | 1.818(0.839~3.991) | 0.131 | ||
| 结外受累脏器(>1,≤1) | 0.953(0.368~2.467) | 0.921 | ||
注:ECOG:美国东部肿瘤协作组;EBV:EB病毒
讨论
ENKTL属于成熟T/NK细胞淋巴瘤的一种类型,以结外受累为特征,具有高度侵袭性。国内的统计发现,ENKTL占所有NHL的比例为6%~17.1%,在T/NK细胞淋巴瘤中占28%~56%[7]–[9]。ENKTL好发于中年男性,多原发于上呼吸道,包括鼻腔、鼻咽、扁桃体,以面部中线部位毁损性病变为特征。ENKTL同样可呈现鼻外器官受累或原发于鼻外,如皮肤、胃肠道、睾丸等。本研究中非局限期ENKTL患者的中位发病年龄为42(14~67)岁,男女比例为2.9∶1。结外器官常见受累部位为皮肤,其次为肝、脾、胃肠道及肺部。本研究非局限期患者中枢神经系统受累比例为13.7%,骨髓受累的比例为19.6%,47.1%的患者病程中合并HLH,以上比例均高于文献中所报道的整体ENKTL患者[10]。
近年来,同步放化疗的应用及以左旋门冬酰胺酶或培门冬酶为基础的化疗已显著改善ENKTL患者的生存。该肿瘤对放疗敏感,对于局限期ENKTL患者,应用同步放化疗或序贯放化疗治疗,长期生存率可达70%~80%[11]–[12]。而疾病一旦进入非局限期,预后明显变差。传统的以蒽环类药物为主的化疗方案有效率低,以左旋门冬酰胺酶或培门冬酶为基础的化疗方案(如SMILE、AspaMetDex、P-GEMOX等)可显著提高疗效。虽多数文献报道化疗的ORR可达60%~80%[13]–[15],但由于疾病的高度侵袭性,疗效为PR的患者多数仍因PD死亡,复发/难治的患者缺乏有效的二线化疗方案。非局限期ENKTL患者1年OS率仍不足50%[13]。本研究中非局限期可耐受化疗的患者均应用包含培门冬酶的化疗方案,一线化疗的CR率为34.8%,ORR为50.0%,1年OS率为39.9%。虽已应用以培门冬酶为基础的化疗方案,非局限期患者的疗效与生存情况仍无法令人满意。近年来免疫治疗和分子靶向治疗(如PD-1抑制剂、CD38单抗等[16]–[17])的开展有望为ENKTL患者提供更多的治疗选择。
在Au等[10]的研究中,非鼻型ENKTL患者较鼻型患者具有更高比例提示不良预后的临床特征,如LDH升高、巨大肿块、体能状态差、合并贫血及血小板减低。非鼻型患者化疗的CR率较鼻型患者低(26%对50%),远期生存情况更差(中位OS时间分别为0.36年和2.96年)。但此研究中纳入的鼻型患者63%为局限期,非鼻型患者仅32%为局限期,两组预后的差异受到不同临床分期的影响。本研究纳入病例全部为非局限期患者,排除了临床分期的干扰。本研究发现,在临床特征方面,鼻型与非鼻型患者存在B症状、LDH升高、EBV-DNA阳性、骨髓受累的比例的差异均无统计学意义,非鼻型患者合并HLH的比例显著高于鼻型患者。在治疗反应方面,非鼻型患者一线化疗的CR率显著低于鼻型患者。远期预后方面,非鼻型患者1年的PFS率及OS率分别为15.0%和22.9%,中位OS时间仅为4个月。排除临床分期的影响后,非鼻型患者在化疗疗效及远期预后方面仍劣于鼻型患者。后续研究有待于在生物学特征及发病机制方面进一步揭示两者的差异。
ENKTL的发病与EBV感染密切相关。外周血循环EBV-DNA来源于坏死和凋亡的肿瘤细胞,EBV-DNA拷贝水平与肿瘤增殖水平相关。既往多项研究证实,治疗前EBV-DNA高拷贝与ENKTL患者的不良预后相关,治疗后EBV-DNA水平对于疗效评估、监测疾病的复发、预后评估同样具有重要价值[18]–[21]。本研究发现,EBV-DNA变化趋势与化疗疗效呈现一定的相关性。获得CR的患者EBV-DNA水平多在化疗1个疗程后降至阴性,并维持阴性至化疗结束,而对化疗无反应的患者EBV-DNA持续高水平或下降后迅速反弹。远期生存方面,基线EBV-DNA是否阳性并不能显著影响患者的生存,而化疗1个疗程后及治疗结束时EBV-DNA阳性与阴性组患者OS率的差异均有统计学意义(P均<0.001)。在影响预后的多因素分析中,1个疗程化疗后EBV-DNA阳性为唯一可筛选出的独立预后不良因素。化疗1个疗程后EBV-DNA仍未能降至阴性可能提示其肿瘤负荷过大或对化疗敏感性欠佳。对于此类患者,能否通过后续强化治疗或尽早行自体造血干细胞移植改善患者生存有待进一步研究证实。
综上,本研究结果显示,非局限期ENKTL患者应用以培门冬酶为基础化疗方案的有效率及远期生存率仍不佳。非鼻型的患者在临床特征、化疗疗效及远期预后方面均劣于鼻型患者。EBV-DNA水平与化疗疗效及预后密切相关。1个疗程化疗后EBV-DNA阳性为多因素分析中唯一的独立不良预后因素,可用于早期预测疗效及预后。
References
- 1.Aozasa K, Ohsawa M, Tajima K, et al. Nation-wide study of lethal mid-line granuloma in Japan: frequencies of wegener's granulomatosis, polymorphic reticulosis, malignant lymphoma and other related conditions[J] Int J Cancer. 1989;44(1):63–66. doi: 10.1002/ijc.2910440112. [DOI] [PubMed] [Google Scholar]
- 2.Kim SJ, Yoon DH, Jaccard A, et al. A prognostic index for natural killer cell lymphoma after non-anthracycline-based treatment: a multicentre, retrospective analysis[J] Lancet Oncol. 2016;17(3):389–400. doi: 10.1016/S1470-2045(15)00533-1. [DOI] [PubMed] [Google Scholar]
- 3.Yamaguchi M, Kwong YL, Kim WS, et al. Phase II study of SMILE chemotherapy for newly diagnosed stage IV, relapsed, or refractory extranodal natural killer (NK)/T-cell lymphoma, nasal type: the NK-Cell Tumor Study Group study[J] J Clin Oncol. 2011;29(33):4410–4416. doi: 10.1200/JCO.2011.35.6287. [DOI] [PubMed] [Google Scholar]
- 4.Cheson BD, Pfistner B, Juweid ME, et al. Revised response criteria for malignant lymphoma[J] J Clin Oncol. 2007;25(5):579–586. doi: 10.1200/JCO.2006.09.2403. [DOI] [PubMed] [Google Scholar]
- 5.Zhang Y, Zhang W, Li J, et al. Gemcitabine, cisplatin, and dexamethasone (GDP) in combination with methotrexate and pegaspargase is active in newly diagnosed peripheral T cell lymphoma patients: a phase 2, single-center, open-label study in China[J] Ann Hematol. 2019;98(1):143–150. doi: 10.1007/s00277-018-3488-1. [DOI] [PubMed] [Google Scholar]
- 6.Henter JI, Horne A, Aricó M, et al. HLH-2004: Diagnostic and therapeutic guidelines for hemophagocytic lymphohistiocytosis[J] Pediatr Blood Cancer. 2007;48(2):124–131. doi: 10.1002/pbc.21039. [DOI] [PubMed] [Google Scholar]
- 7.Li YX, Liu QF, Fang H, et al. Variable clinical presentations of nasal and Waldeyer ring natural killer/T-cell lymphoma[J] Clin Cancer Res. 2009;15(8):2905–2912. doi: 10.1158/1078-0432.CCR-08-2914. [DOI] [PubMed] [Google Scholar]
- 8.Yang QP, Zhang WY, Yu JB, et al. Subtype distribution of lymphomas in Southwest China: analysis of 6,382 cases using WHO classification in a single institution[J] Diagn Pathol. 2011;6:77. doi: 10.1186/1746-1596-6-77. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.Sun J, Yang Q, Lu Z, et al. Distribution of lymphoid neoplasms in China: analysis of 4,638 cases according to the World Health Organization classification[J] Am J Clin Pathol. 2012;138(3):429–434. doi: 10.1309/AJCP7YLTQPUSDQ5C. [DOI] [PubMed] [Google Scholar]
- 10.Au WY, Weisenburger DD, Intragumtornchai T, et al. Clinical differences between nasal and extranasal natural killer/T-cell lymphoma: a study of 136 cases from the International Peripheral T-Cell Lymphoma Project[J] Blood. 2009;113(17):3931–3937. doi: 10.1182/blood-2008-10-185256. [DOI] [PubMed] [Google Scholar]
- 11.Yamaguchi M, Tobinai K, Oguchi M, et al. Phase I/II study of concurrent chemoradiotherapy for localized nasal natural killer/T-cell lymphoma: Japan Clinical Oncology Group Study JCOG0211[J] J Clin Oncol. 2009;27(33):5594–5600. doi: 10.1200/JCO.2009.23.8295. [DOI] [PubMed] [Google Scholar]
- 12.Kim SJ, Kim K, Kim BS, et al. Phase II trial of concurrent radiation and weekly cisplatin followed by VIPD chemotherapy in newly diagnosed, stage IE to IIE, nasal, extranodal NK/T-Cell Lymphoma: Consortium for Improving Survival of Lymphoma study[J] J Clin Oncol. 2009;27(35):6027–6032. doi: 10.1200/JCO.2009.23.8592. [DOI] [PubMed] [Google Scholar]
- 13.Yamaguchi M, Kwong YL, Kim WS, et al. Phase II study of SMILE chemotherapy for newly diagnosed stage IV, relapsed, or refractory extranodal natural killer (NK)/T-cell lymphoma, nasal type: the NK-Cell Tumor Study Group study[J] J Clin Oncol. 2011;29(33):4410–4416. doi: 10.1200/JCO.2011.35.6287. [DOI] [PubMed] [Google Scholar]
- 14.Jaccard A, Gachard N, Marin B, et al. Efficacy of L-asparaginase with methotrexate and dexamethasone (AspaMetDex regimen) in patients with refractory or relapsing extranodal NK/T-cell lymphoma, a phase 2 study[J] Blood. 2011;117(6):1834–1839. doi: 10.1182/blood-2010-09-307454. [DOI] [PubMed] [Google Scholar]
- 15.Wang JH, Wang L, Liu CC, et al. Efficacy of combined gemcitabine, oxaliplatin and pegaspargase (P-gemox regimen) in patients with newly diagnosed advanced-stage or relapsed/refractory extranodal NK/T-cell lymphoma[J] Oncotarget. 2016;7(20):29092–29101. doi: 10.18632/oncotarget.8647. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.Kwong YL, Chan T, Tan D, et al. PD1 blockade with pembrolizumab is highly effective in relapsed or refractory NK/T-cell lymphoma failing l-asparaginase[J] Blood. 2017;129(17):2437–2442. doi: 10.1182/blood-2016-12-756841. [DOI] [PubMed] [Google Scholar]
- 17.Hari P, Raj RV, Olteanu H. Targeting CD38 in Refractory Extranodal Natural Killer Cell-T-Cell Lymphoma[J] N Engl J Med. 2016;375(15):1501–1502. doi: 10.1056/NEJMc1605684. [DOI] [PubMed] [Google Scholar]
- 18.Liang JH, Wang L, Peter Gale R, et al. Efficacy of pegaspargase, etoposide, methotrexate and dexamethasone in newly diagnosed advanced-stage extra-nodal natural killer/T-cell lymphoma with the analysis of the prognosis of whole blood EBV-DNA[J] Blood Cancer J. 2017;7(9):e608. doi: 10.1038/bcj.2017.88. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.Wang ZY, Liu QF, Wang H, et al. Clinical implications of plasma Epstein-Barr virus DNA in early-stage extranodal nasal-type NK/T-cell lymphoma patients receiving primary radiotherapy[J] Blood. 2012;120(10):2003–2010. doi: 10.1182/blood-2012-06-435024. [DOI] [PubMed] [Google Scholar]
- 20.Suzuki R, Yamaguchi M, Izutsu K, et al. Prospective measurement of Epstein-Barr virus-DNA in plasma and peripheral blood mononuclear cells of extranodal NK/T-cell lymphoma, nasal type[J] Blood. 2011;118(23):6018–6022. doi: 10.1182/blood-2011-05-354142. [DOI] [PubMed] [Google Scholar]
- 21.Kim SJ, Choi JY, Hyun SH, et al. Risk stratification on the basis of Deauville score on PET-CT and the presence of Epstein-Barr virus DNA after completion of primary treatment for extranodal natural killer/T-cell lymphoma, nasal type: a multicentre, retrospective analysis[J] Lancet Haematol. 2015;2(2):e66–74. doi: 10.1016/S2352-3026(15)00002-2. [DOI] [PubMed] [Google Scholar]