Abstract
Die „coronavirus disease 2019“ (COVID-19) stellt weiterhin eine große Bedrohung von globalem Ausmaß dar. Auch wenn inzwischen eine Reihe von Organmanifestationen beschrieben ist, steht im Infektionsverlauf weiterhin das respiratorische System im Vordergrund. Es kann zur Entwicklung einer schweren Pneumonie kommen, die in der Regel prognostisch bestimmend ist. Im Folgenden werden die aktuell bekannten Besonderheiten der pulmonalen Manifestation aus pathophysiologischer, klinischer und radiologischer Sicht beschrieben. Bezüglich der Pathophysiologie wird auf den komplexen Charakter der akuten Lungenerkrankung mit schwerer Schädigung des Alveolarepithels und pulmonal-vaskulären Endothels mit der Folge einer schweren respiratorischen Insuffizienz bei einem Teil der Patienten eingegangen. Die Unterschiede zum „klassischen“ „acute respiratory distress syndrome“ mit ihren erheblichen Auswirkungen auf die Therapie von COVID-19 werden herausgearbeitet. Nach einer kurzen Beschreibung der Polymerase-Kettenreaktion(PCR)-gestützten Erregeridentifikation und Angaben zu typischen Laborbefunden wird die bildgebende Darstellung der COVID-19-Pneumonie genauer beschrieben (typische Befunde, Differenzialdiagnosen, Klassifizierung der Wahrscheinlichkeit einer COVID-19-Pneumonie). Daran schließt sich eine Beschreibung der Klinik mit ihren drei Phasen an. Bezüglich der Therapie werden zunächst supportive und intensivmedizinische Ansätze unter Berücksichtigung von O2-Gabe, antibiotischer Therapie sowie (nicht-)invasiver Beatmung diskutiert. Der Beitrag schließt mit einer Zusammenfassung der Erkenntnisse zu medikamentösen Therapien – einerseits zur Thromboseprophylaxe, andererseits zur spezifischen antiviralen und immunmodulatorischen Therapie (Remdesivir, Tocilizumab, Anakinra, Dexamethason).
Schlüsselwörter: „Acute respiratory distress syndrome“, Computertomographie, Mechanische Beatmung, Virostatika, Dexamethason
Abstract
Coronavirus disease 2019 (COVID-19) continues to pose a major global threat. Although a wide range of organ manifestations have now been described, the respiratory system remains in the forefront in terms of the course of infection. Severe pneumonia can develop and is generally prognostically relevant. The following article discusses currently known features of these pulmonary manifestations from a pathophysiological, symptomatological, and radiological perspective. With regard to pathophysiology, the complex nature of the acute pulmonary disease involving severe injury to the alveolar epithelium and pulmonary vascular endothelium resulting in severe respiratory failure in a proportion of patients is discussed. The differences from “classic” acute respiratory distress syndrome and the major effects these have on the treatment of COVID-19 are elucidated. Following a brief description of PCR-based pathogen identification and information on typical laboratory findings, imaging of COVID-19 pneumonia is described in greater details (typical findings, differential diagnoses, grading of the likelihood of COVID-19 pneumonia). This is followed by a description of symptoms, which develop in three phases. With regard to treatment, supportive and intensive care approaches are discussed, including O2 administration and (non-)invasive ventilation. The article concludes with a summary of the insights gained into pharmacological therapies: thrombosis prevention on the one hand, and specific antiviral and immunomodulatory therapies (remdesivir, tocilizumab, anakinra, dexamethasone) on the other.
Keywords: Acute respiratory distress syndrome; Tomography, X‑ray computed; Ventilation, mechanical; Antiviral agents; Dexamethasone
Der erste bestätigte Fall einer Infektion mit dem „severe acute respiratory syndrome coronavirus 2“ (SARS-CoV-2) in Deutschland wurde am 27.01.2020 berichtet. Ab diesem Zeitpunkt verbreitete sich das Virus in ganz Deutschland, wobei sich die Infektionszahlen in den einzelnen Bundesländern unterschiedlich entwickelten. Die meisten Fälle sind in Bayern, Nordrhein-Westfalen und Baden-Württemberg aufgetreten. Im Gegensatz zu den Severe-acute-respiratory-syndrome(SARS)- und Middle-East-respiratory-syndrome(MERS)-Infektionen, die regional beschränkt blieben und zeitnah unter Kontrolle gebracht werden konnten, breitete sich die Infektion mit SARS-CoV‑2 pandemisch aus. Die Erkrankung mit dem Namen „coronavirus disease 2019“ (COVID-19) stellt, trotz sinkender Zahlen in Europa und Teilen Asiens, weiterhin eine große Bedrohung dar, zumal die Zahl der Neuinfektionen in Nordamerika und Südamerika weiterhin ansteigt.
COVID-19 unterscheidet sich in vielerlei Hinsicht im Verlauf zu anderen respiratorischen Virusinfektionen
Auch wenn inzwischen eine Reihe von Organmanifestationen beschrieben ist, steht bezüglich des Infektionsverlaufs weiterhin das respiratorische System im Vordergrund. Es kann zur Entwicklung einer schweren Pneumonie kommen, die in der Regel prognostisch bestimmend ist. Sehr früh nach den ersten Beschreibungen zeigte sich, dass sich der Verlauf von COVID-19 in vielerlei Hinsicht von den bekannten respiratorischen Virusinfektionen unterscheidet. Dabei muss die teilweise dramatische Entwicklung einer schweren respiratorischen Insuffizienz pathophysiologisch wie auch hinsichtlich der daraus abzuleitenden therapeutischen Möglichkeiten neu bewertet werden. Im Folgenden wird auf die aktuell bekannten Besonderheiten der pulmonalen Manifestation der Erkrankung aus pathophysiologischer, klinischer und radiologischer Sicht eingegangen.
Pathophysiologie
Die Übertragung von SARS-CoV‑2 erfolgt überwiegend durch eine Tröpfcheninfektion („droplet transmission“) und ist prinzipiell auch über Aerosole durch Tröpfchenkerne („airborne transmission“) möglich [1, 2]. Inwieweit Schmierinfektionen ausgehend von kontaminierten Oberflächen eine zusätzliche Rolle spielen, ist ungeklärt.
Primär sind die oberen Atemwege im Bereich des Nasopharynx betroffen, mit einer weiteren Multiplikation der Virusinfektion im Bereich der unteren Atemwege und in der gastrointestinalen Mukosa [3, 4].
Bei der überwiegenden Zahl der Patienten stabilisiert sich die Erkrankung in diesem Stadium. Allerdings ist unklar, wie hoch der Anteil der Patienten, die eine Pneumonie entwickeln, tatsächlich ist. Nach einer aktuellen Berechnung aus Frankreich müssen etwa 2–3 % alle infizierten Patienten stationär wegen eines schweren Verlaufs mit Pneumonie behandelt werden [5].
Nach der aktuellen Vorstellung verläuft die COVID-19-Erkrankung mit Pneumonie in drei Phasen [6]:
Frühe Infektion
Pulmonale Manifestation
Schwere hyperinflammatorische Phase
In der frühen infektiösen Phase proliferiert das Virus im Alveolarepithel, was zu einer Entzündungsreaktion mit lokaler Vasodilatation, erhöhter endothelialer Permeabilität und „recruitment“ von Leukozyten führt [7]. Die sogenannte Herdpneumonie hat eine Hypoxämie zur Folge, wobei der Patient dabei meist noch keine schwere Atemnot verspürt. Erst im weiteren Verlauf, wenn sich die Entzündung weiter verstärkt, berichten die Patienten neben den allgemeinen Krankheitszeichen wie Fieber, Müdigkeit oder Gliederschmerzen über Atemnot und entwickeln dann die Zeichen eines „respiratorischen Stresses“.
Schon zu Beginn der Pandemie wurde als wesentlicher Risikofaktor für einen schweren Verlauf eine systemische Entzündungsreaktion mit Anstieg von proinflammatorischen Mediatoren wie Interleukin(IL)-6, IL‑2, IL‑7, Tumor-Nekrose-Faktor α (TNF-α), Interferon‑γ, „inducible protein 10“ (IP-10), „monocyte chemoattractant protein 1“ (MCP-1), „macrophage inflammatory protein 1α“ (MIP-1α), granulozytenkoloniestimulierendem Faktor (G-CSF), C‑reaktivem Protein (CRP), Prokalzitonin und Ferritin beschrieben [8–11]. Von prognostischer Relevanz ist dabei eine erhöhte bzw. ansteigende Konzentration von IL‑1 und -6 sowie Ferritin [9, 10]. In retrospektiven Untersuchungen wurden bei verstorbenen COVID-19-Patienten signifikant höhere Werte von IL‑6, Ferritin und CRP beschrieben [10]. Weitere prognostische Marker sind D‑Dimere und Troponin [9, 10].
Dieser Anstieg der Zytokine wurde auch als „Zytokinsturm“ bezeichnet, wobei dieser Begriff nicht eindeutig definiert ist. Der Begriff Zytokinsturm impliziert jedoch eine den Gesamtorganismus schädigende, unkontrollierte systemische Entzündungsreaktion. Allerdings ist der Zytokinanstieg bei COVID-19-Pneumonie deutlich geringer als beim klassischen „acute respiratory distress syndrome“ (ARDS), bei dem um ein Vielfaches höhere Zytokinkonzentrationen gemessen wurden [12]. Damit unterscheidet sich COVID-19 zumindest in der Anfangsphase entscheidend vom Verlauf eines hyperinflammatorischen ARDS. Neben der Infektion des Alveolarepithels besitzt die vaskuläre Entzündung mit thromboembolischen Ereignissen, die im Zusammenhang mit COVID-19 beschrieben wurde (lIT), eine höhere Relevanz im Vergleich zu Patienten mit ARDS und Influenzainfektionen. In einer vergleichenden Post-mortem-Untersuchung wurde eine schwere vaskuläre Schädigung der pulmonalen Gefäße einschließlich Mikrothrombosen beschrieben, die deutlich über das bei einer schweren ARDS-Erkrankung im Rahmen einer Influenzainfektion beschriebene Ausmaß hinausgeht [13].
Trotz signifikanter Hypoxämie empfinden viele Patienten keine oder nur eine geringe Atemnot
Auffallend ist dabei, dass viele Patienten keine oder nur eine geringe Atemnot empfinden, obwohl bereits eine signifikante Hypoxämie vorliegt. Die Definition eines ARDS kann dabei nach den Berlin-Kriterien schon erfüllt sein [14]. Die Befunde sprechen dafür, dass die schwere COVID-19-Pneumonie anfangs wesentliche Unterschiede zu den bekannten Veränderungen eines ARDS aufweist, wie sie beispielsweise im Rahmen eines septischen Schocks oder einer bakteriellen Pneumonie zu beobachten sind. Im Gegensatz zum klassischen ARDS, z. B. bei schwerer bakterieller Pneumonie, ist die Compliance der Lunge bei COVID-19 lange erhalten, sodass keine erhöhte Atemarbeit vom Patienten geleistet werden muss, um die respiratorische Insuffizienz zu kompensieren. Die zunehmende Hypoxämie ist dabei am ehesten durch eine ausgeprägte Ventilations-Perfusions-Verteilungsstörung zu erklären. Dabei scheinen die vaskulären Schäden eine erhebliche Rolle zu spielen mit einem zu postulierenden Verlust der hypoxischen Vasokonstriktion (Euler-Liljestrand-Reflex) mit maximal dilatierten Gefäßen [15–17] und möglicher Störung der Mikrozirkulation durch In-situ-Thrombosen [13, 18]. Am ehesten ist dies Folge des Endothelschadens sowie einer aktiven Relaxation der glatten Gefäßmuskulatur durch vasoaktive und inflammatorische Mediatoren. Die physiologische Antwort auf die Hypoxämie ist eine mehr oder weniger ausgeprägte Hyperventilation mit erhöhter Atemfrequenz und erniedrigten arteriellen pCO2-Werten. Trotzdem empfindet der Patient keinen „Atemstress“. Eine andauernde Hyperventilation wiederum belastet mechanisch über Scherkraftbildung und hohe intrapleurale Druckamplituden die Lunge und kann zu einer weiteren Schädigung der Lunge führen – ein Phänomen, das als „patient self-inflicted lung injury“ (P-SILI) bezeichnet wird [19–23].
Innerhalb weniger Stunden kann sich die Situation destabilisieren, wenn der Lungenschaden weiter fortschreitet und der Organismus nicht mehr in der Lage ist, die schwere Hypoxämie auszugleichen. Als wesentlicher Surrogatparameter der zunehmenden Atemarbeit in dieser Phase ist die regelmäßige Messung der Atemfrequenz wichtig, die bei Anstieg ein früher Hinweis für eine mögliche Dekompensation der respiratorischen Situation sein kann. Die spezifischere, aber deutlich aufwendigere Bestimmung der Atemarbeit und der intrathorakalen Druckveränderungen über eine Ösophagusdruckmessung [24, 25] ist in der klinischen Routine nur schwer zu etablieren, zumal sie nur in wenigen Zentren zur Verfügung steht. In dieser Phase kann bis zu einem gewissen Grad mit der Zufuhr von O2 eine ventilatorische Entlastung erreicht werden. Aufgrund eines anzunehmenden Shunts ist die Effizienz der O2-Gabe jedoch eingeschränkt. Aus pathophysiologischer Sicht kann in dieser Phase zur Verhinderung eines möglichen selbstinduzierten Lungenschadens eine mechanische Unterstützung mittels nichtinvasiver Beatmung oder „continuous positive airway pressure“ (CPAP) über ein Maskensystem oder einen Helm unterstützend sein.
Die Erkrankung verläuft dynamisch. Entsprechend der Entwicklung der Infektion kommt es entweder zu einer Stabilisierung in dieser Phase oder zu einer Zunahme der Lungenschädigung mit einer Verstärkung der Hypoxämie und zu einer zunehmenden entzündlichen Infiltration von immer mehr Lungenarealen, sodass die Erkrankung dann einem schweren pneumogenen ARDS entspricht. Es finden sich dann auch die pathologischen Zeichen eines diffusen Alveolarschadens [26] mit den entsprechenden pathophysiologischen Veränderungen eines hohen Lungengewichts, einer geringen Compliance und eines ausgeprägten Rechts-links-Shunts [24, 25]. Das Bild entspricht einer Lungenschädigung, die auch bei Patienten gesehen wurde, die an SARS [27] und MERS [28] verstorben sind.
Erhöhte Troponinwerte müssen als Ausdruck der kardialen Schädigung gedeutet werden
Für die Prognose wesentlich sind mögliche weitere Organschäden wie ein Nierenversagen oder eine kardiale Erkrankung. Die ersten Daten aus China zeigten frühzeitig zu Beginn der Pandemie einen hohen Anteil kardial erkrankter Patienten von 20 bis 30 % der hospitalisierten Patienten – Zahlen, die sich auch in den europäischen Patientenkollektiven bestätigten [11, 29]. Als Ausdruck der kardialen Schädigung müssen die in Studien regelmäßig beschriebenen erhöhten Werte für Troponin gewertet werden, die mit einer eingeschränkten Prognose assoziiert sind [9, 30]. Die Analyse verstorbener Patienten in der Wuhan-Kohorte fand in 34 % der Fälle eine kardiale Schädigung bzw. in 40 % eine kardiale Insuffizienz, entweder als alleinige Ursache oder in Kombination mit einer respiratorischen Insuffizienz [9, 31–33]. Das assoziierte Letalitätsrisiko einer akuten kardialen Schädigung war dabei höher als das von Alter, Diabetes, chronisch-obstruktiver Lungenerkrankung und vorbestehenden kardialen Erkrankungen.
Zudem muss von einer erhöhten Koagulopathie ausgegangen werden, was auch von den regelmäßig gefundenen erhöhten D‑Dimeren reflektiert wird. Die Erkrankung ist mit einem erhöhten Risiko für thrombotische Ereignisse und Störungen des Gerinnungssystems assoziiert [18, 34, 35]. Allerdings ist unklar, ob es sich um thromboembolische Ereignisse oder In-situ-Thrombosen handelt.
Aus pathophysiologischer Sicht handelt es sich bei der COVID-19-Pneumonie somit um eine komplexe akute Erkrankung der Lunge mit einer schweren Schädigung des Alveolarepithels und des pulmonal-vaskulären Endothels mit der Folge einer schweren respiratorischen Insuffizienz bei einem Teil der Patienten. Auch wenn bei respiratorischer Insuffizienz nach der Berlin-Definition funktionell und radiologisch ein ARDS vorliegt, unterscheidet sich die Erkrankung doch von einem „klassischen“ ARDS, was erhebliche Auswirkungen auf die Therapie bei COVID-19 hat, insbesondere auf die Indikationsstellung zur invasiven Beatmung.
Diagnostik
Die Diagnose einer COVID-19-Pneumonie beruht auf der Klinik, dem Nachweis von SARS-CoV‑2 in der Polymerase-Kettenreaktions(PCR)-Diagnostik im Rachen- oder Nasenabstrich und den radiologischen Befunden. Zu berücksichtigen ist dabei, dass die Sensitivität des Tests eingeschränkt ist; somit kann er bei einem nicht kleinen Teil der Patienten falsch-negativ sein [36]. Daher ist es bei weiterhin bestehendem klinischem Verdacht erforderlich, einen zweiten Test zu veranlassen. Bei Patienten, die schon mehrere Tage Symptome zeigen, kann unter Umständen das Virus im Rachen nicht mehr nachgewiesen werden, während in den unteren Atemwegen noch eine Viruslast vorliegt, sodass es sinnvoll ist, Sekret aus Trachea oder Bronchien zu gewinnen. Wenn der Test trotz des klinischen Verdachts einer SARS-CoV-2-Infektion negativ bleibt, ist es umso wichtiger, die anderen Befunde, insbesondere die radiologischen Veränderungen zu berücksichtigen.
Laborchemisch findet sich bei etwa 80 % eine Lymphopenie sowie bei einem Teil der Patienten eine Leukopenie. Meist ist das CRP erhöht, während der Prokalzitoninwert noch normal bleibt. Steigt der Prokalzitoninwert jedoch im Verlauf deutlich, kann dies Ausdruck einer bakteriellen Superinfektion sein [37]. Etwa 40 % der Patienten, die stationär behandelt werden, zeigen zudem erhöhte Laktatdehydrogenase(LDH)-Werte, eine Thrombozytopenie oder erhöhte D‑Dimer-Werte. Erhöhte D‑Dimer-Werte wiederum weisen neben einer persistierenden Lymphopenie und hohen LDH-Werten auf eine kritische Prognose hin [38].
Bildgebende Darstellung der COVID-19-Pneumonie
Die Thoraxübersichtsaufnahme ist in ihrer Sensitivität für die COVID-19-Pneumonie limitiert, sie kann jedoch für Verlaufskontrollen eingesetzt werden [39]. Als bildgebende Modalität der ersten Wahl empfehlen die thoraxradiologischen Gesellschaften national und international die Computertomographie (CT; [40–42]). Die Untersuchung sollte dabei bevorzugt als native Dünnschicht-CT in Niedrigdosistechnik durchgeführt werden. Aufgabe der CT ist es, die Diagnosestellung zu unterstützen, den Schweregrad der Lungenparenchymveränderungen zu erfassen und gegebenenfalls im Verlauf zu kontrollieren sowie Komplikationen wie eine Lungenembolie oder Superinfektion zu detektieren. Je nach klinischer Einschätzung muss für einige dieser Fragestellungen von der nativen Niedrigdosisstrategie abgewichen und Kontrastmittel verabreicht werden.
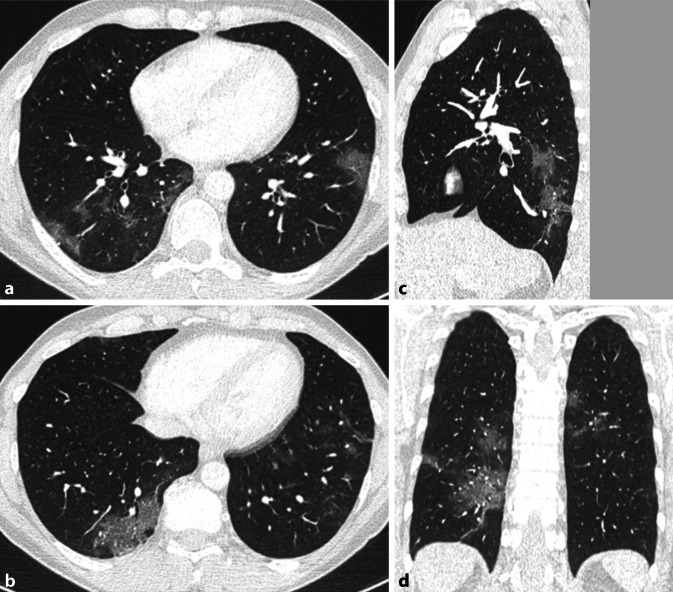
Die Sensitivität der CT für die COVID-19-Pneumonie liegt bei über 90 % [43]. In den allermeisten Fällen äußert sich die COVID-19-Pneumonie in Form eines Mischbilds aus Milchglastrübungen und Konsolidierungen [44, 45]. Die Verdichtungen sind häufig rund oder geografisch konfiguriert und zeigen zumindest anteilig eine scharfe Berandung zur umgebenden gesunden Lunge. Bereits initial sind meist mehrere Läsionen in beiden Lungen zu erkennen. Bevorzugt sind die Peripherie der Lunge und die Unterlappen betroffen. Innerhalb der Verdichtungen zeigt sich ein Aerobronchogramm (Abb. 1). Mit zunehmender Schwere der Erkrankung nimmt das Ausmaß der Verdichtungen zu [30, 46]. Ein Teil der Milchglastrübungen geht in Konsolidierungen über. In dieser Phase tritt auch vermehrt ein Befund auf, der als „crazy paving“ bezeichnet wird. Hierunter versteht man Milchglastrübungen, die durch glatt berandete Retikulationen überlagert sind. Bei einem benignen Verlauf ist das Maximum an Parenchymveränderungen 6–13 Tage nach Krankheitsbeginn zu erwarten [30, 47]. Danach bilden sich die Verdichtungen zurück, wobei sie temporär eine streifige Konfiguration annehmen können. Bei einem malignen Verlauf entwickelt sich das Bild eines diffusen Alveolarschadens. Wie die Langzeitfolgen einer COVID-19-Pneumonie im Lungenparenchym konfiguriert sind, werden erst die kommenden Monate zeigen.
Auch wenn die Morphologie der COVID-19-Pneumonie gerade in der Frühphase bei vielen Patienten erstaunlich ähnlich ist, liegt die Spezifität der CT je nach Umgebungsprävalenz zwischen 25 und 56 % [43]. Wichtige Differenzialdiagnosen sind
Pneumonien verursacht durch andere Viren oder Bakterien,
die (kryptogen) organisierende Pneumonie,
die sterile Pneumonitis und
die alveoläre Hämorrhagie.
Um eine Abgrenzung gegenüber diesen Erkrankungen zu erleichtern, ist es hilfreich zu wissen, welche CT-Befunde noch nie oder nur sehr selten bei der COVID-19-Pneumonie gesehen wurden. Hierzu gehören Noduli, das Tree-in-bud-Zeichen, Kavernen, Bronchialwandverdickungen und „mucus plugging“. Pleuraergüsse und eine Lymphadenopathie treten, wenn überhaupt, erst in späteren Stadien und bei schwereren Verläufen auf.
Die Arbeitsgemeinschaft Thoraxdiagnostik der Deutschen Röntgengesellschaft hat eine Kategorisierung der CT-Befunde vorgeschlagen, anhand derer der Radiologe die Wahrscheinlichkeit für das Vorliegen einer COVID-19-Pneumonie klassifizieren kann (Tab. 1; [40]). Die Kategorien lauten:
CT-Veränderungen suggestiv für eine COVID-19-Pneumonie
CT-Veränderungen unklar, COVID-19-Pneumonie jedoch möglich
CT-Veränderungen suggestiv für eine alternative Diagnose
In der CT kein Hinweis auf pneumonische Verdichtungen
| Kategorie | CT-Veränderungen |
|---|---|
| 1. CT-Veränderungen suggestiv für COVID-19-Pneumonie (bei hoher lokaler Prävalenz und/oder individueller Prätestwahrscheinlichkeit) |
a. Früh: dominante Milchglasverdichtungen („ground glass“) b. Später dominantes „crazy paving“/Konsolidierungen c. Zeichen der organisierenden Pneumonie (z. B. arkadenförmige Konsolidierung/Milchglastrübung, umgekehrtes Halozeichen) d. Peripher und posterior betont e. Rund oder geografisch konfiguriert f. Bilateral, multifokal g. Intraläsional erweiterte Gefäße h. Fehlende mediastinale/hiläre Lymphadenopathie |
| 2. CT-Veränderungen unklar, COVID-19-Pneumonie jedoch möglich |
a. Milchglas/„crazy paving“/Konsolidierung anders verteilt als unter Kategorie 1 („suggestive CT-Veränderungen für COVID-19“) spezifiziert b. Zentral betont c. Nicht rund oder nicht geografisch konfiguriert |
| 3. CT-Veränderungen suggestiv für eine alternative Diagnose (z. B. bakterielles Erregerspektrum) |
a. Noduli b. „Tree in bud“ c. Peribronchiale Verdichtung d. Lobäre/segmentale Konsolidierung e. Kaverne f. Bronchialwandverdickungen g. „Mucus plugging“ h. Pleuraerguss |
| 4. In CT kein Hinweis auf pneumonische Verdichtungen | – |
COVID-19 „Coronavirus disease 2019“, CT Computertomographie
In dem Statement wird ausdrücklich darauf hingewiesen, dass die CT nur während der Pandemie, also bei hoher Umgebungsprävalenz als Hilfestellung für die Artdiagnose der pulmonalen Veränderungen herangezogen werden darf.
Klinischer Verlauf
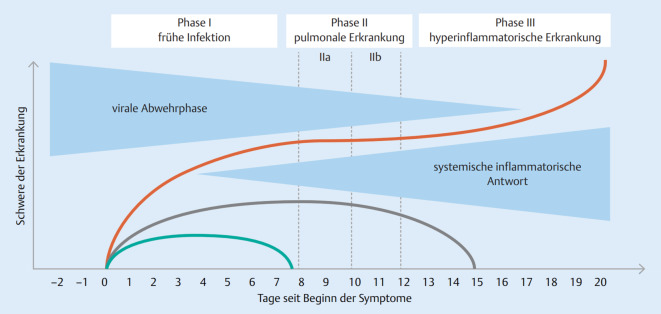
Der Verlauf der COVID-19-Erkrankung lässt sich in drei Phasen unterteilen (Abb. 2). Die Symptome entsprechen in der Anfangsphase dem Bild eines schweren viralen Infekts mit Fieber, verbunden mit trockenem Husten und Müdigkeit. In einer Metaanalyse von 148 Arbeiten mit 24.410 COVID-19-Patienten waren die häufigsten Symptome und Befunde Fieber (78 %; 95 %-Konfidenzintervall [KI] 78,4–87,7 %), Husten (57 %; 95 %-KI 54–60 %) und Fatigue (31,0 %; 95 %-KI 29,8–46,5 %). Viele Patienten gaben Thoraxschmerzen, Kopfschmerzen und Durchfall an [48]. Die Schwere wie auch die Art der Symptome kann dabei stark variieren. Eine Besonderheit sind Geschmacks- und Riechstörungen, die mehr als 50 % der Patienten mit bestätigter Infektion angeben und die Tage bis Wochen anhalten können [49].
Die pulmonale COVID-19-Erkrankung als virale Pneumonie manifestiert sich erst mit Replikation in der Lunge
In den ersten Tagen der Erkrankung lässt sich das Virus im Rachen nachweisen, die pulmonale Erkrankung als virale Pneumonie manifestiert sich jedoch erst mit der Replikation des Virus in der Lunge. Mit der Infektion des pulmonalen Systems geben die Patienten Atemnot, anfänglich bei Belastung später auch in Ruhe an (Phase 2). Im Median tritt die Dyspnoe 6,5 Tage nach den ersten Symptomen auf. Dabei findet sich oft schon ein eingeschränkter Gasaustausch mit erniedrigten O2-Sättigungen, erniedrigtem O2-Partialdruck und einer Hypokapnie als Ausdruck der Hyperventilation. Wie bereits beschrieben, besteht oft eine Diskrepanz zwischen der Schwere der gemessenen Gasaustauschstörung und der subjektiv empfundenen Atemnot. Als Folge der zunehmenden pulmonalen Belastung beginnen die Patienten subklinisch zu hyperventilieren, was meist nur durch einen Anstieg der Atemfrequenz zu erfassen ist. In den arteriellen Blutgaswerten findet sich dann eine Minderung des CO2-Partialdrucks mit Werten unter 30 mm Hg.
In dieser Phase kann sich eine Hyperinflammation entwickeln mit einer weiteren schweren Lungenschädigung im Sinne eines ARDS und dem Auftreten eines Multiorganversagens. Patienten mit ARDS im weiteren Verlauf entwickeln dies innerhalb von Stunden bis wenigen Tagen [50]. Daher ist es erforderlich, Patienten mit Dyspnoe engmaschig zu überwachen, um frühzeitig notwendige therapeutische Schritte einleiten zu können.
In einer Studie mit 138 COVID-19-Patienten, die stationär aufgenommen wurden, zeigten 26 % einen komplizierten Verlauf und mussten intensivmedizinisch behandelt werden. Von diesen litten 61 % an einem ARDS und wurden invasiv beatmet. Andere Ursachen für die Intensivbehandlung waren Arrhythmien (44 %) oder eine hämodynamische Instabilität mit den Zeichen eines Schocks (31 %).
Im britischen Intensiv-Care-National-Audit-and-Research-Center(ICNARC)-Register wurden bis Mitte Juni die Daten von 9777 intensivmedizinisch behandelten COVID-19-Patienten in Großbritannien ausgewertet [51]. Im Median waren die Patienten 60 Jahre alt, 70 % waren Männer, 29 % Frauen. 60,9 % der Patienten mussten innerhalb von 24 h nach Aufnahme mechanisch invasiv oder nichtinvasiv beatmet werden. 6395 Patienten wurden intubiert, 2194 erhielten O2, High-flow‑O2 oder eine nichtinvasive Beatmung. Bei 2287 Patienten wurde eine Dialyse durchgeführt. Von 8891 abgeschlossenen Fällen waren 3701 Patienten (41,6 %) verstorben und 5190 Patienten (58,4 %) konnten aus der Intensivstation verlegt werden. Eine ungünstige Prognose hatten besonders die Patienten, deren Zustand sich rasch verschlechterte und die innerhalb der ersten 24 h nach Aufnahme auf der Intensivstation intubiert werden mussten. Im Mittel verstarben 50 % der Patienten mit invasiver Beatmung, mit der höchsten Sterblichkeit in der Altersgruppe über 80 Jahre mit einer Letalität von 81,3 %. Ähnliche Verläufe wurden auch in Deutschland in einer Studie gefunden, die in Kürze publiziert wird.
Die Autoren des britischen ICNARC-Register-Berichts verglichen zudem die Daten mit Patienten, die in den Jahren 2017–2019 wegen anderer viraler Pneumonien stationär behandelt wurden. Sie fanden einen signifikant ungünstigeren Verlauf für Intensivpatienten mit COVID-19 im Vergleich zu Patienten mit viraler Non-COVID-19-Pneumonie, eine höhere Intubationsrate (72 % vs. 48 %) und eine signifikant höhere Sterblichkeit von 42 % vs. 21 %. Dieser Vergleich zeigt eindrucksvoll, dass eine COVID-19-Pneumonie auch im Vergleich zu anderen viralen Infektionen eine ungünstige Prognose aufweist.
Therapie
Supportive und intensivmedizinische Therapie
Das Ausmaß der supportiven Therapie richtet sich nach der Schwere der Erkrankung. Bei Zeichen der respiratorischen Insuffizienz mit zunehmender Atemnot ist der erste Schritt die Applikation von O2 über eine Nasenbrille. Bei etwa 5–6 % der Patienten entwickelt sich jedoch eine schwere Hypoxämie mit der Notwendigkeit der Verlegung auf die Intensivstation. Dies wird empfohlen, wenn eine Hypoxämie mit einer Sättigung <90 % unter 2–4 l O2/min und Atemnot, eine Atemfrequenz >25–30/min, ein systolischer Blutdruck ≤100 mm Hg und eine Erhöhung des Laktat vorliegt [52]. Die Graduierung der Schwere der respiratorischen Insuffizienz wird nach den Berlin-Kriterien für das ARDS vorgenommen [14], in Abhängigkeit vom paO2/FiO2-Quotienten (paO2 arterieller Sauerstoffpartialdruck, FiO2 Fraktion des Sauerstoffs im Einatmungsgasgemisch) erfolgt eine Einteilung in leicht (≤300 mmHg) und moderat (100–200 mmHg) und schwer (≤100 mmHg).
Die Behandlung der Patienten auf der Intensivstation folgt allgemeinen Vorgaben [53]. Dazu gehört, wenn noch nicht geschehen, die Abnahme von mindestens 2 Blutkulturproben. Bei Patienten mit Verdacht auf eine Super- oder Begleitinfektion sollte eine kalkulierte antibiotische Therapie frühzeitig begonnen werden. Aktuell liegen keine Hinweise vor, dass ein höheres Risiko für Superinfektionen besteht, sodass eine prophylaktische Antibiotikagabe nicht empfohlen wird. Die Flüssigkeitssubstitution sollte eher konservativ zurückhaltend durchgeführt werden und richtet sich nach der hämodynamischen Situation.
Grundsätzlich gelten auch bei der schweren COVID-19-Pneumonie die Therapieempfehlungen, die für die schwere hypoxische respiratorische Insuffizienz in der S2k-Leitlinie [53] formuliert sind, mit Ausnahme der Intubationsempfehlung. Während bei ARDS-Patienten mit moderater und schwerer Gasaustauschstörung eine frühe Intubation empfohlen wird, richtet sich die Indikation zur invasiven Beatmung bei Patienten mit COVID-19-Pneumonie nicht allein nach der Schwere der Gasaustauschstörung, sondern insbesondere auch nach den klinischen Befunden. Für die Bewertung der Schwere der hypoxischen respiratorischen Insuffizienz schafft dabei die gleichzeitige Berücksichtigung des O2-Gehalts eine höhere Transparenz. Bisher gibt es keine sichere Evidenz, wann eine Intubation bei schwerer COVID-19-Pneumonie erfolgen soll [50]. Es wird ein abgestuftes Vorgehen (Abb. 3) mit Nutzung von CPAP, nichtinvasiver Beatmung und High-flow‑O2-Therapie empfohlen [54]. Bei diesen Methoden jedoch muss auf den Eigenschutz des medizinischen Personals durch die Anwendung der Schutzausrüstung geachtet werden. Bei Tragen entsprechender Schutzkleidung fanden sich bisher keine Hinweise für ein erhöhtes Risiko einer Infektion der Behandler. Müssen die Patienten intubiert und invasiv beatmet werden, gelten aufgrund fehlender randomisierter Studien zur Beatmungstherapie bei COVID-19 die gleichen Empfehlungen wie bei der Behandlung des ARDS [44, 45]. Allerdings sollte dabei berücksichtigt werden, dass die COVID-19-Pneumonie in der Frühphase einige Besonderheiten und Unterschiede zum klassischen ARDS zeigt, wie bereits ausgeführt. Die Lungencompliance ist in der Regel weniger stark eingeschränkt, sodass die Hypoxämie anfänglich weniger durch ein fehlendes „recruitment“ als durch ein ausgeprägtes Ventilations-Perfusions-Mismatch verursacht wird, aggraviert durch eine zusätzliche vaskuläre Komponente mit einer Störung der Mikrozirkulation [13, 24, 25].
Medikamentöse Therapie
Thromboseprophylaxe/Antikoagulation
Thromboembolische Ereignisse wurden schon früh nach den ersten bekannten COVID-19-Fällen beschrieben und sind eine der häufigsten Komplikationen. Vorwiegend ist das venöse System betroffen, jedoch sind auch Thrombosen in arteriellen Gefäßen beschrieben [18, 55]. Daher ist es unabdingbar, dass stationär behandelte Patienten eine Prophylaxe venöser Thromboembolien erhalten. Empfohlen wird, diese mit niedermolekularem Heparin in einer für den Hochrisikobereich zugelassenen Dosierung durchzuführen. Eine therapeutisch dosierte Antikoagulation wird aktuell nicht routinemäßig empfohlen, wenn keine thromboembolischen Ereignisse vorliegen. Sie kann jedoch im Einzelfall erwogen werden, zum Beispiel bei schnell ansteigenden D‑Dimeren oder bei klinischem Verdacht auf thromboembolische Ereignisse, wenn eine weiterführende Diagnostik nicht zur Verfügung steht. Die regelmäßige Bestimmung hämostaseologischer Parameter (Thrombozytenzahl, Quick/International Normalized Ratio, Fibrinogen, D‑Dimere, Antithrombin) wird insbesondere bei Patienten mit COVID-19 im fortgeschrittenen Stadium empfohlen.
Spezifische medikamentöse Therapie
Für die medikamentöse Therapie schwerer Verlaufsformen von COVID-19-Pneumonien stehen grundsätzlich zwei Prinzipien zur Verfügung: antiviral und immunmodulatorisch. Viel Hoffnung setzte man am Anfang in die Kombination von Chloroquin oder Hydroxychloroquin mit Azithromycin. Diese Kombination wird aktuell nicht empfohlen, da einerseits keine signifikante Wirkung nachzuweisen war und andererseits erhebliche Nebenwirkungen beschrieben wurden. Auch für die Substanzen Interferon-β-1b und Lopinavir/Ritonavir, allein oder in Kombination gegeben, konnte bisher keine sichere klinische Wirksamkeit nachgewiesen werden [52].
In der Gruppe der antiviral wirkenden Substanzen konnte dagegen für Remdesivir in vitro [56] wie auch klinisch in randomisierten Studien eine Wirksamkeit insbesondere bei Patienten mit schwerem Verlauf gezeigt werden. In einer randomisierten, kontrollierten Studie mit 1063 Patienten zeigten sich eine Verkürzung der Erkrankungszeit im Median von 15 auf 11 Tage (p < 0,001) sowie eine tendenzielle, jedoch nicht signifikante Reduktion der Mortalität nach 14 Tagen von 11,9 % auf 7,1 % (Hazard Ratio 0,70; 95 %-KI 0,47–1,04; [57]). In einer weiteren Studie fand sich eine tendenzielle, jedoch nicht signifikante Verkürzung der Krankheitsdauer [58]. Inwieweit jedoch durch eine frühzeitige Gabe dieser Substanz ein komplizierter Verlauf der COVID-19-Pneumonie verhindert werden kann, muss in weiteren Studien untersucht werden.
Als immunmodulatorische Substanzen wurden frühzeitig Tocilizumab als Anti-IL-6- und Anakinra als Anti-IL-1-Rezeptor-Antagonist in Heilversuchen [59–62] eingesetzt. Die Begründung für die Therapie ist die Reduktion der Hyperinflammationsreaktion [63, 64]. Beide Substanzen wurden bereits in der Indikation ARDS in präklinischen Studien untersucht und zeigten dabei positive Effekte. Für beide Substanzen konnte jedoch bisher bei COVID-19 keine gesicherte klinische Wirksamkeit gezeigt werden, sodass noch auf die Ergebnisse der aktuell laufenden Studien gewartet werden muss.
Auch Steroide wurden trotz fehlender Evidenz in vielen Institutionen bei schweren Verläufen frühzeitig eingesetzt, insbesondere bei Patienten mit hämodynamischer Instabilität. Allerdings zeigte sich in einer kürzlich publizierten Studie aus Spanien [65] ein deutlicher Effekt der Gabe von Dexamethason bei beatmeten Patienten mit einem ARDS. Diese Studie zeigte eine signifikante Reduktion der Beatmungstage in der Dexamethasongruppe im Vergleich zu einer Kontrollgruppe (−4,8 Tage; 95 %-KI 2,57–7,03 Tage; p < 0,0001). In die Studie wurden 277 ARDS-Patienten eingeschlossen. Davon wurden 139 Patienten über 5 Tage mit 20 mg Dexamethason therapiert, gefolgt von einer Behandlung mit 10 mg bis Tag 10. Die Mortalität in der mit Dexamethason behandelten Gruppe war nach 60 Tagen mit 21 % signifikant niedriger als in der unbehandelten Kontrollgruppe mit 36 % (−15,3 %; 95 %-KI −25,9 %–−4,9 %; p = 0,0047).
Die RECOVERY-Studie [66], eine offene, randomisierte Studie aus Großbritannien, fand dann bei stationär behandelten COVID-19-Patienten unter Dexamethason (6 mg/Tag p.o. oder i.v. bis zu 10 Tage) einen ähnlichen ausgeprägt positiven Effekt [66]. Die Autoren beschreiben eine relative Reduktion der 28-Tages-Letalität in der Gesamtkohorte um 17 % von 24,6 % auf 21,6 % (relatives Risiko [RR] 0,83; 95 %-KI 0,74–0,92; p < 0,001), eine relative Reduktion der 28-Tages-Letalität bei initial beatmeten Patienten um 35 % von 40,7 % auf 29,0 % (RR 0,65; 95 %-KI 0,51–0,82; p < 0,001), eine Reduktion der 28-Tages-Letalität bei Patienten mit initialer O2-Therapie um 20 % von 25,0 % auf 21,5 % (RR 0,80; 95 %-KI 0,70–0,92; p = 0,002) und einen relativen, jedoch nicht signifikanten Anstieg der 28-Tages-Letalität bei Patienten ohne initiale O2-Therapie um 22 % von 13,2 % auf 17 % (RR 1,22; 95 %-KI 0,93–1,61; p = 0,14).
Aufgrund der aktuellen Ergebnisse wird die Behandlung mit einer Dosis von 6 mg/Tag p.o. oder i.v. bis zu 10 Tage für Patienten mit COVID-19 empfohlen, die eine manifeste schwere respiratorische Insuffizienz mit Indikation zur O2-Gabe oder Beatmung aufweisen, sofern keine Kontraindikationen vorliegen [67].
Fazit für die Praxis
Kommt es bei COVID-19 zu einer schweren Pneumonie, ist diese in der Regel prognostisch bestimmend.
Die Diagnose einer COVID-19-Pneumonie beruht auf der Klinik, dem Nachweis von „severe acute respiratory syndrome coronavirus 2“ (SARS-CoV-2) in der Polymerase-Kettenreaktions(PCR)-Diagnostik und den radiologischen Befunden.
Als bildgebende Modalität der ersten Wahl wird die Computertomographie (CT) empfohlen, bevorzugt als native Dünnschicht-CT in Niedrigdosistechnik.
Bei Zeichen der respiratorischen Insuffizienz mit zunehmender Atemnot ist der erste supportive Schritt die O2-Applikation über eine Nasenbrille.
Bei Patienten mit Verdacht auf eine Super- oder Begleitinfektion sollte eine kalkulierte antibiotische Therapie frühzeitig begonnen werden. Eine prophylaktische Antibiotikagabe wird aktuell nicht empfohlen.
Die Indikation zur invasiven Beatmung richtet sich bei COVID-19-Pneumonie nicht allein nach der Schwere der Gasaustauschstörung, sondern insbesondere auch nach den klinischen Befunden.
Aufgrund aktueller Studienergebnisse wird die Behandlung mit Dexamethason für Patienten mit COVID-19 empfohlen, die eine manifeste schwere respiratorische Insuffizienz mit Indikation zur O2-Gabe oder Beatmung aufweisen, sofern keine Kontraindikationen vorliegen.
Einhaltung ethischer Richtlinien
Interessenkonflikt
M. Pfeifer und O.W. Hamer geben an, dass kein Interessenkonflikt besteht.
Für diesen Beitrag wurden von den Autoren keine Studien an Menschen oder Tieren durchgeführt. Für die aufgeführten Studien gelten die jeweils dort angegebenen ethischen Richtlinien.
Literatur
- 1.Yang Y, Shang W, Rao X. Facing the COVID-19 outbreak: What should we know and what could we do? J Med Virol. 2020 doi: 10.1002/jmv.25720. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2.Zhu N, Zhang D, Wang W, Li X, Yang B, Song J, et al. A novel Coronavirus from patients with pneumonia in China, 2019. N Engl J Med. 2020;382(8):727–733. doi: 10.1056/NEJMoa2001017. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.Cheung KS, Hung IF, Chan PP, Lung KC, Tso E, Liu R, et al. Gastrointestinal manifestations of SARS-coV-2 infection and virus load in fecal samples from the Hong Kong cohort and systematic review and meta-analysis. Gastroenterology. 2020 doi: 10.1053/j.gastro.2020.03.065. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.Lin L, Jiang X, Zhang Z, Huang S, Zhang Z, Fang Z, et al. Gastrointestinal symptoms of 95 cases with SARS-CoV-2 infection. Gut. 2020 doi: 10.1136/gutjnl-2020-321013. [DOI] [PubMed] [Google Scholar]
- 5.Salje H, Kiem TC, Lefrancq N, Courtejoie N, Bosetti P, Paireau J, et al. Estimating the burden of SARS-CoV-2 in France. Science. 2020;369(6500):208–211. doi: 10.1126/science.abc3517. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Channappanavar R, Perlman S. Pathogenic human coronavirus infections: causes and consequences of cytokine storm and immunopathology. Semin Immunopathol. 2017;39(5):529–539. doi: 10.1007/s00281-017-0629-x. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Peiris JS, Chu CM, Cheng VC, Chan KS, Hung IF, Poon LL, et al. Clinical progression and viral load in a community outbreak of coronavirus-associated SARS pneumonia: a prospective study. Lancet. 2003;361(9371):1767–1772. doi: 10.1016/S0140-6736(03)13412-5. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.Wang D, Hu B, Hu C, Zhu F, Liu X, Zhang J, et al. Clinical characteristics of 138 hospitalized patients with 2019 novel Coronavirus-infected pneumonia in Wuhan, China. JAMA. 2020 doi: 10.1001/jama.2020.1585. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.Ruan Q, Yang K, Wang W, Jiang L, Song J. Clinical predictors of mortality due to COVID-19 based on an analysis of data of 150 patients from Wuhan, China. Intensive Care Med. 2020 doi: 10.1007/s00134-020-05991-x. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.Zhou F, Yu T, Du R, Fan G, Liu Y, Liu Z, et al. Clinical course and risk factors for mortality of adult inpatients with COVID-19 in Wuhan, China: a retrospective cohort study. Lancet. 2020;395(10229):1054–1062. doi: 10.1016/S0140-6736(20)30566-3. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.Huang C, Wang Y, Li X, Ren L, Zhao J, Hu Y, et al. Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China. Lancet. 2020;395(10223):497–506. doi: 10.1016/S0140-6736(20)30183-5. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.Sinha P, Matthay MA, Calfee CS. Is a “cytokine storm” relevant to COVID-19? JAMA Intern Med. 2020 doi: 10.1001/jamainternmed.2020.3313. [DOI] [PubMed] [Google Scholar]
- 13.Ackermann M, Verleden SE, Kuehnel M, Haverich A, Welte T, Laenger F, et al. Pulmonary vascular endothelialitis, thrombosis, and angiogenesis in Covid-19. N Engl J Med. 2020 doi: 10.1056/nejmoa2015432. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Force ADT, Ranieri VM, Rubenfeld GD, Thompson BT, Ferguson ND, Caldwell E, et al. Acute respiratory distress syndrome: the Berlin Definition. JAMA. 2012;307(23):2526–2533. doi: 10.1001/jama.2012.5669. [DOI] [PubMed] [Google Scholar]
- 15.Han R, Huang L, Jiang H, Dong J, Peng H, Zhang D. Early clinical and CT manifestations of Coronavirus disease 2019 (COVID-19) pneumonia. AJR Am J Roentgenol. 2020 doi: 10.2214/ajr.20.22961. [DOI] [PubMed] [Google Scholar]
- 16.Zhao W, Zhong Z, Xie X, Yu Q, Liu J. Relation between chest CT findings and clinical conditions of Coronavirus disease (COVID-19) pneumonia: a multicenter study. AJR Am J Roentgenol. 2020 doi: 10.2214/ajr.20.22976. [DOI] [PubMed] [Google Scholar]
- 17.Li Y, Xia L. Coronavirus disease 2019 (COVID-19): role of chest CT in diagnosis and management. AJR Am J Roentgenol. 2020 doi: 10.2214/ajr.20.22954. [DOI] [PubMed] [Google Scholar]
- 18.Wichmann D, Sperhake JP, Lutgehetmann M, Steurer S, Edler C, Heinemann A, et al. Autopsy findings and venous thromboembolism in patients with COVID-19. Ann Intern Med. 2020 doi: 10.7326/m20-2003. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.Brochard L, Slutsky A, Pesenti A. Mechanical ventilation to minimize progression of lung injury in acute respiratory failure. Am J Respir Crit Care Med. 2017;195(4):438–442. doi: 10.1164/rccm.201605-1081CP. [DOI] [PubMed] [Google Scholar]
- 20.Barach A, Martin J, Eckman M. Positive pressure respiration and its application to the treatment of acute pulmonary edema. Ann Intern Med. 1938;12:754–759. doi: 10.7326/0003-4819-12-6-754. [DOI] [Google Scholar]
- 21.Barach AL, Eckman M, et al. Studies on positive pressure respiration; general aspects and types of pressure breathing; effects on respiration and circulation at sea level. J Aviat Med. 1946;17:290–232. [PubMed] [Google Scholar]
- 22.Mascheroni D, Kolobow T, Fumagalli R, Moretti MP, Chen V, Buckhold D. Acute respiratory failure following pharmacologically induced hyperventilation: an experimental animal study. Intensive Care Med. 1988;15(1):8–14. doi: 10.1007/BF00255628. [DOI] [PubMed] [Google Scholar]
- 23.Yoshida T, Grieco DL, Brochard L, Fujino Y. Patient self-inflicted lung injury and positive end-expiratory pressure for safe spontaneous breathing. Curr Opin Crit Care. 2020;26(1):59–65. doi: 10.1097/MCC.0000000000000691. [DOI] [PubMed] [Google Scholar]
- 24.Gattinoni L, et al. COVID-19 pneumonia: different respiratory treatment for different phenotypes? Intensive Care Med. 2020. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 25.Gattinoni L, Coppola S, Cressoni M, Busana M, Rossi S, Chiumello D. Covid-19 does not lead to a “typical” acute respiratory distress syndrome. Am J Respir Crit Care Med. 2020 doi: 10.1164/rccm.202003-0817le. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 26.Xu Z, et al. Pathological findings of COVID-19 associated with acuterespiratory distress syndrome. Lancet Respir Med. 2020 doi: 10.1016/s2213-2600(20)30076-x. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 27.Ding Y, Wang H, Shen H, Li Z, Geng J, Han H, et al. The clinical pathology of severe acute respiratory syndrome (SARS): a report from China. J Pathol. 2003;200(3):282–289. doi: 10.1002/path.1440. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 28.Ng DL, Al Hosani F, Keating MK, Gerber SI, Jones TL, Metcalfe MG, et al. Clinicopathologic, Immunohistochemical, and Ultrastructural Findings of a Fatal Case of Middle East Respiratory Syndrome Coronavirus Infection in the United Arab Emirates, April 2014. Am J Pathol. 2016;186(3):652–658. doi: 10.1016/j.ajpath.2015.10.024. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 29.Grasselli G, Pesenti A, Cecconi M. Critical care utilization for the COVID-19 outbreak in Lombardy, Italy: early experience and forecast during an emergency response. JAMA. 2020 doi: 10.1001/jama.2020.4031. [DOI] [PubMed] [Google Scholar]
- 30.Wang Y, Dong C, Hu Y, Li C, Ren Q, Zhang X, et al. Temporal changes of CT findings in 90 patients with COVID-19 pneumonia: a longitudinal study. Radiology. 2020 doi: 10.1148/radiol.2020200843. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 31.Shi S, Qin M, Shen B, Cai Y, Liu T, Yang F, et al. Association of cardiac injury with mortality in hospitalized patients with COVID-19 in Wuhan, China. JAMA Cardiol. 2020 doi: 10.1001/jamacardio.2020.0950. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 32.Guo T, Fan Y, Chen M, Wu X, Zhang L, He T, et al. Cardiovascular Implications of Fatal Outcomes of Patients With Coronavirus Disease 2019 (COVID-19) JAMA Cardiol. 2020 doi: 10.1001/jamacardio.2020.1017. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 33.Gao C, Wang Y, Gu X, Shen X, Zhou D, Zhou S, et al. Association between cardiac injury and mortality in hospitalized patients infected with avian influenza A (H7N9) virus. Crit Care Med. 2020;48(4):451–458. doi: 10.1097/CCM.0000000000004207. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 34.Cui S, Chen S, Li X, Liu S, Wang F. Prevalence of venous thromboembolism in patients with severe novel coronavirus pneumonia. J Thromb Haemost. 2020 doi: 10.1111/jth.14830. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 35.Fox SE, Akmatbekov A, Harbert JL, Li G, Quincy Brown J, Vander Heide RS. Pulmonary and cardiac pathology in African American patients with COVID-19: an autopsy series from New Orleans. Lancet Respir Med. 2020 doi: 10.1101/2020.04.06.20050575. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 36.Dohla M, Boesecke C, Schulte B, Diegmann C, Sib E, Richter E, et al. Rapid point-of-care testing for SARS-CoV-2 in a community screening setting shows low sensitivity. Public Health. 2020;182:170–172. doi: 10.1016/j.puhe.2020.04.009. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 37.Guan WJ, Ni ZY, Hu Y, Liang WH, Ou CQ, He JX, et al. Clinical characteristics of coronavirus disease 2019 in China. N Engl J Med. 2020 doi: 10.1101/2020.02.06.20020974. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 38.Cummings MJ, Baldwin MR, Abrams D, Jacobson SD, Meyer BJ, Balough EM, et al. Epidemiology, clinical course, and outcomes of critically ill adults with COVID-19 in New York City: a prospective cohort study. Lancet. 2020;395(10239):1763–1770. doi: 10.1016/S0140-6736(20)31189-2. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 39.Wong HYF, Lam HYS, Fong AH, Leung ST, Chin TW, Lo CSY, et al. Frequency and distribution of chest radiographic findings in COVID-19 positive patients. Radiology. 2019 doi: 10.1148/radiol.2020201160. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 40.Vogel-Claussen J, Ley-Zaporozhan J, Agarwal P, Biederer J, Kauczor HU, Ley S, et al. Recommendations of the Thoracic Imaging Section of the German Radiological Society for clinical application of chest imaging and structured CT reporting in the COVID-19 pandemic. Rofo. 2020;192(7):633–640. doi: 10.1055/a-1174-8378. [DOI] [PubMed] [Google Scholar]
- 41.Revel MP, Parkar AP, Prosch H, Silva M, Sverzellati N, Gleeson F, et al. COVID-19 patients and the radiology department—advice from the European Society of Radiology (ESR) and the European Society of Thoracic Imaging (ESTI) Eur Radiol. 2020 doi: 10.1007/s00330-020-06865-y. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 42.Simpson S, Kay FU, Abbara S, Bhalla S, Chung JH, Chung M, et al. Radiological society of north America expert consensus statement on reporting chest CT findings related to COVID-19. Endorsed by the society of thoracic radiology, the American college of radiology, and RSNA—secondary publication. J Thorac Imaging. 2020;35(4):219–227. doi: 10.1097/RTI.0000000000000524. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 43.Kim H, Hong H, Yoon SH. Diagnostic performance of CT and reverse transcriptase-polymerase chain reaction for Coronavirus disease 2019: a meta-analysis. Radiology. 2020 doi: 10.1148/radiol.2020201343. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 44.Schaible J, Meiler S, Poschenrieder F, Scharf G, Maintz D, Pregler B, et al. Radiology of COVID-19 Pneumonia—Pictorial Essay and Structured Reporting. Rofo. 2020;192(6):513–517. doi: 10.1055/a-1164-7001. [DOI] [PubMed] [Google Scholar]
- 45.Ye Z, Zhang Y, Wang Y, Huang Z, Song B. Chest CT manifestations of new coronavirus disease 2019 (COVID-19): a pictorial review. Eur Radiol. 2020;30(8):4381–4389. doi: 10.1007/s00330-020-06801-0. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 46.Zhou S, Wang Y, Zhu T, Xia L. CT features of Coronavirus disease 2019 (COVID-19) pneumonia in 62 patients in Wuhan, China. AJR Am J Roentgenol. 2020;214(6):1287–1294. doi: 10.2214/AJR.20.22975. [DOI] [PubMed] [Google Scholar]
- 47.Kanne JP, Little BP, Chung JH, Elicker BM, Ketai LH. Essentials for radiologists on COVID-19: an update-radiology scientific expert panel. Radiology. 2020 doi: 10.1148/radiol.2020200527. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 48.Grant MC, Geoghegan L, Arbyn M, Mohammed Z, McGuinness L, Clarke EL, et al. The prevalence of symptoms in 24,410 adults infected by the novel coronavirus (SARS-CoV-2; COVID-19): A systematic review and meta-analysis of 148 studies from 9 countries. PLoS ONE. 2020;15(6):e0234765. doi: 10.1371/journal.pone.0234765. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 49.Lechien JR, Chiesa-Estomba CM, Hans S, Barillari MR, Jouffe L, Saussez S. Loss of smell and taste in 2013 European patients with mild to moderate COVID-19. Ann Intern Med. 2020 doi: 10.7326/m20-2428. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 50.Fan E, Beitler JR, Brochard L, Calfee CS, Ferguson ND, Slutsky AS, et al. COVID-19-associated acute respiratory distress syndrome: is a different approach to management warranted? Lancet Respir Med. 2020 doi: 10.1016/s2213-2600(20)30304-0. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 51.ICNARC . ICNARC report on COVID-19. 2020. [Google Scholar]
- 52.Kluge S, Janssens U, Welte T, Weber-Carstens S, Schälte G, Salzberger B, et al. Empfehlungen zur intensivmedizinischen Therapie von Patienten mit COVID-19 (S1-Leitlinie) 2020. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 53.Fichtner F, Moerer O, Laudi S, Weber-Carstens S, Nothacker M, Kaisers U, et al. Mechanical Ventilation and Extracorporeal Membrane Oxygena tion in Acute Respiratory Insufficiency. Dtsch Arztebl Int. 2018;115(50):840–847. doi: 10.3238/arztebl.2018.0840. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 54.Pfeifer M, Ewig S, Voshaar T, Randerath W, Bauer T, Geiseler J, et al. Positionspapier zur praktischen Umsetzung der apparativen Differenzialtherapie der akuten respiratorischen Insuffizienz bei COVID-19. Pneumologie. 2020;74(06):337–357. doi: 10.1055/a-1157-9976. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 55.Langer F, Kluge S, Klamroth R, Oldenburg J. Coagulopathy in COVID-19 and Its Implication for Safe and Efficacious Thromboprophylaxis. Hamostaseologie. 2020 doi: 10.1055/a-1178-3551. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 56.Wang M, Cao R, Zhang L, Yang X, Liu J, Xu M, et al. Remdesivir and chloroquine effectively inhibit the recently emerged novel coronavirus (2019-nCoV) in vitro. Cell Res. 2020;30(3):269–271. doi: 10.1038/s41422-020-0282-0. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 57.Beigel JH, Tomashek KM, Dodd LE, Mehta AK, Zingman BS, Kalil AC, et al. Remdesivir for the treatment of Covid-19—preliminary report. N Engl J Med. 2020 doi: 10.1056/nejmc2022236. [DOI] [PubMed] [Google Scholar]
- 58.Wang Y, Zhang D, Du G, Du R, Zhao J, Jin Y, et al. Remdesivir in adults with severe COVID-19: a randomised, double-blind, placebo-controlled, multicentre trial. Lancet. 2020;395(10236):1569–1578. doi: 10.1016/S0140-6736(20)31022-9. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 59.Cala-Garcia JD, Sierra-Breton JD, Cavelier-Baiz JE, Faccini-Martinez AA, Perez-Diaz CE. Recovery of COVID-19 acute respiratory distress syndrome with tocilizumab: successful outcome in two critically ill patients. Immunotherapy. 2020 doi: 10.2217/imt-2020-0154. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 60.Coyle J, Igbinomwanhia E, Sanchez-Nadales A, Danciu S, Chu C, Shah N. A recovered case of COVID-19 Myocarditis and ARDS treated with corticosteroids, tocilizumab, and experimental AT-001. JACC Case Rep. 2020 doi: 10.1016/j.jaccas.2020.04.025. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 61.Toniati P, Piva S, Cattalini M, Garrafa E, Regola F, Castelli F, et al. Tocilizumab for the treatment of severe COVID-19 pneumonia with hyperinflammatory syndrome and acute respiratory failure: a single center study of 100 patients in Brescia, Italy. Autoimmun Rev. 2020;19(7):102568. doi: 10.1016/j.autrev.2020.102568. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 62.Cavalli G, De Luca G, Campochiaro C, Della-Torre E, Ripa M, Canetti D, et al. Interleukin-1 blockade with high-dose anakinra in patients with COVID-19, acute respiratory distress syndrome, and hyperinflammation: a retrospective cohort study. Lancet Rheumatol. 2020;2(6):e325–e331. doi: 10.1016/S2665-9913(20)30127-2. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 63.Fu B, Xu X, Wei H. Why tocilizumab could be an effective treatment for severe COVID-19? J Transl Med. 2020;18(1):164. doi: 10.1186/s12967-020-02339-3. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 64.Munoz-Jimenez A, Rubio-Romero E, Marenco de la Fuente JL. Proposal for the use of anakinra in acute respiratory distress secondary to COVID-19. Reumatol Clin. 2020 doi: 10.1016/j.reuma.2020.04.009. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 65.Villar J, Ferrando C, Martinez D, Ambros A, Munoz T, Soler JA, et al. Dexamethasone treatment for the acute respiratory distress syndrome: a multicentre, randomised controlled trial. Lancet Respir Med. 2020;8(3):267–276. doi: 10.1016/S2213-2600(19)30417-5. [DOI] [PubMed] [Google Scholar]
- 66.The RECOVERY Collaborative Group. Dexamethasone in hospitalized patients with Covid-19—preliminary report. N Engl J Med. 2020 doi: 10.1056/NEJMoa2021436. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 67.Kolditz M, Dellweg D, Geerdes-Fenge H, Lepper PM, Schaberg T, Ewig S, et al. Treatment with dexamethasone in patients with COVID-19—a position paper of the German respiratory society (DGP) Pneumologie. 2020 doi: 10.1055/a-1216-5739. [DOI] [PMC free article] [PubMed] [Google Scholar]