Abstract
目的
检测PI3K、NF-κB和STAT1在支气管哮喘儿童外周血单个核细胞(PBMC)中的表达,探讨其在哮喘发病机制的临床意义。
方法
选取30例急性发作期的支气管哮喘患儿作为哮喘组,随机选取同期健康儿童20例作为对照组。应用RT-PCR和Westernblot方法检测PBMC中PI3K、NF-κB和STAT1的mRNA和蛋白表达,肺功能仪检测两组肺功能,并分析支气管哮喘儿童PI3K、NF-κB和STAT1的mRNA水平与其肺功能的相关性。
结果
哮喘组的PI3K、NF-κB和STAT1的mRNA和蛋白水平均高于对照组(P < 0.05)。与对照组相比,哮喘组FEV1%、FEV1/FVC、PEF%等肺功能指标均下降(P < 0.05)。哮喘儿童的PI3K、NF-κB和STAT1的mRNA表达水平与FEV1%、FEV1/FVC、PEF%均呈负相关(P < 0.05)。
结论
哮喘患儿的PI3K、NF-κB和STAT1表达上调并与肺功能呈负相关,三者可能共同参与儿童支气管哮喘的发生、发展。
Keywords: 支气管哮喘, PI3K, NF-κB, STAT1, 肺功能, 儿童
Abstract
Objective
To study the expression profiles of PI3K, NF-κB, and STAT1 in peripheral blood mononuclear cells (PBMCs) in children with bronchial asthma, as well as their roles in the pathogenesis of asthma.
Methods
Thirty children with acute exacerbation of bronchial asthma were enrolled as the asthma group, and 20 healthy children were enrolled as the control group. RT-PCR and Western blot were used to measure the mRNA and protein expression levels of PI3K, NF-κB, and STAT1 in PBMCs. A spirometer was used to compare the pulmonary function between the two groups. The correlations between the mRNA expression of PI3K, NF-κB, and STAT1 and pulmonary function in children with bronchial asthma were analyzed.
Results
The asthma group had significantly higher mRNA and protein expression levels of PI3K, NF-κB, and STAT1 than the control group (P < 0.05). Compared with the control group, the asthma group showed significant reductions in pulmonary function indices such as FEV1%, FEV1/FVC, and PEF% (P < 0.05). In children with bronchial asthma, the mRNA expression levels of PI3K, NF-κB, and STAT1 were negatively correlated with FEV1%, FEV1/FVC, and PEF% (P < 0.05).
Conclusions
The expression levels of PI3K, NF-κB, and STAT1 increase in children with asthma, and are negatively correlated with pulmonary function indices, suggesting that PI3K, NF-κB and STAT1 are involved in the development and progression of bronchial asthma in children.
Keywords: Bronchial asthma, PI3K, NF-κB, STAT1, Pulmonary function, Child
支气管哮喘是由多种细胞和细胞因子共同参与的气道慢性炎症性疾病,伴随着慢性气道炎症、气道高反应性和气道重塑[1]。PI3K是细胞内信号蛋白的总称,广泛参与协调体内细胞增殖、分化、凋亡、蛋白质合成和代谢过程,主要在气道上皮和气道平滑肌表达,有促进支气管平滑肌增生的作用[2]。NF-κB是一种具有多项调节作用的转录因子家族,影响机体细胞粘附、增生、分化、凋亡、免疫和炎症反应及肿瘤生长等,NF-κB诱导的多种细胞因子(TNF-α、IL-4、IL-5、IL-6、IL-8、IL-9、IL-13)、生长因子、粘附因子及其受体均与哮喘发病相关[3]。STAT是JAK/STAT信号转导的核心,STAT磷酸化后可以进入核内,调节相关基因表达,产生相应生物学效应。STAT1活化可以增强细胞间粘附分子-1(intercellular cell adhesion molecule-1, ICAM-1)基因的转录,同时ICAM-1基因的异常表达可以导致淋巴细胞聚集增多、加重炎症反应[4]。以上表明PI3K、NF-κB、STAT1均可能在哮喘发病中起重要作用。因此,本文分析哮喘患儿的血清PI3K、NF-κB和STAT1的基因和蛋白表达及其与肺功能的相关性,旨在探讨PI3K、NF-κB、STAT1在哮喘发病中的临床意义。
1. 资料与方法
1.1. 研究对象及分组
选取2013年6月至2015年4月,我院儿科门诊和住院的支气管哮喘急性发作期患儿30例作为哮喘组,其中男19例、女11例,年龄4~12岁,平均年龄6.2±1.6岁。另随机选取20例同期健康儿童作为对照组,包括男12例、女8例,年龄4~10岁,平均年龄5.4±1.8岁。对照组近期无感染史、无个人及家族过敏性疾病。哮喘组和对照组在性别、年龄构成比上差异无统计学意义(P > 0.05)。本研究获得研究对象监护人的知情同意。
诊断符合中华医学会儿科学会诊断标准[5]。排除标准:排除支气管异物、支气管肺发育不良和胃食管反流等其他疾病所引起的喘息、咳嗽、气促和胸闷。
1.2. 标本采集
采集空腹静脉血5 mL,EDTA抗凝,采用Ficoll密度梯度离心法提取外周血单个核细胞(peripheral blood mononuclear cell, PBMC),分离出PBMC后置于冰箱保存待用。
1.3. RT-PCR检测PI3K、NF-κB和STAT1 mRNA表达
无菌条件下提取PBMC中的总RNA,采用逆转录试剂盒合成cDNA。引物序列见表 1。PCR反应体系共20 μL,包括cDNA 0.5 μL,2×SYBR Green PCR MasterMix 10 μL,上下游引物各0.5 μL,Nuclear-free水补足体积至20 μL。于LightCycler 480 Ⅱ DNA扩增仪上进行扩增反应。扩增反应条件:95℃预变性1 min,95℃变性5 s,60℃退火30 s,60℃延伸30 s,共40个循环。实时荧光定量PCR反应结束后,拷贝数据,分析扩增效率,获取Ct值。用2-ΔΔCt值相对定量法分析数据(哮喘组ΔCt=哮喘组目的基因Ct值-哮喘组内参Ct值;对照组ΔCt=对照组目的基因Ct值-对照组内参Ct值;ΔΔCt=哮喘组ΔCt-对照组ΔCt)。实验重复3次。
1.
PCR引物序列及长度
 |
1.4. Western blot检测PI3K、NF-κB和STAT1蛋白表达
提取PBMC中的总蛋白,BCA法测定蛋白浓度。10% SDS-PAGE分离胶电泳,电转至PVDF膜;5%脱脂牛奶常温下封闭3 h,加一抗于4℃孵育过夜,洗膜后加入二抗常温孵育1 h;洗膜后将现配的ECL发光液滴于PVDF膜上,凝胶成像仪成像并检测其OD值。结果以目的蛋白条带/内参GAPDH条带的OD比值表示。实验重复3次。
1.5. 肺功能检测
采用德国MS-IOS JAEGER肺功能检测仪检测相关肺功能。如第1秒用力呼气容积占预计值百分比(forced expiratory volume in one second/predictor ratio, FEV1%)、第1秒用力呼气容积与用力肺活量比(FEV1/FVC)、最大呼气峰流速占预计值百分比(peak expiratory flow/predictor ratio, PEF%)。测量至少3次,取最佳值作为测定结果进行比较。
1.6. 统计学分析
应用SPSS 19.0软件进行统计学处理。正态分布计量资料以均数±标准差(x±s)表示,组间比较采用t检验,相关性分析采用Pearson相关分析。P < 0.05为差异具有统计学意义。
2. 结果
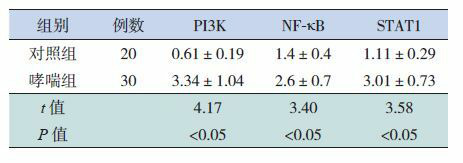
2.1. PI3K、NF-κB和STAT1 mRNA的表达
哮喘患儿的PI3K、NF-κB和STAT1的mRNA相对表达量均高于对照组,差异有统计学意义(P < 0.05),见表 2。
2.
两组PI3K、NF-κB和STAT1的mRNA相对表达量(x±s)
 |
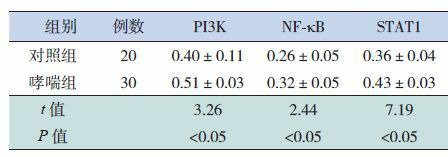
2.2. PI3K、NF-κB和STAT1的蛋白表达
哮喘组PI3K、NF-κB和STAT1的蛋白表达水平均高于对照组,差异有统计学意义(P < 0.05),见表 3。
3.
两组PI3K、NF-κB和STAT1的蛋白相对表达量(x±s)
 |
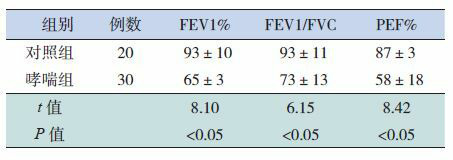
2.3. 两组肺功能比较
哮喘组的FEV1、FEV1/FVC、PEF%等肺功能指标较对照组降低,差异有统计学意义(P < 0.05),见表 4。
4.
两组肺功能比较(x±s)
 |
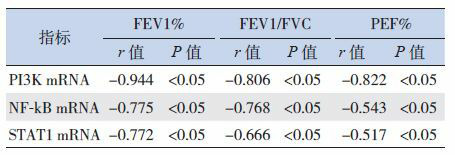
2.4. 哮喘儿童PI3K、NF-κB和STAT1的mRNA表达与肺功能的相关性
经Pearson相关分析,哮喘组的PI3K mRNA、NF-κB mRNA和STAT1 mRNA表达与FEV1%、FEV1/FVC、PEF%等肺功能指标均呈负相关(P < 0.05),见表 5。
5.
哮喘组PI3K、NF-κB和STAT1的mRNA表达与肺功能的相关性
 |
3. 讨论
支气管哮喘是以气道高反应性、慢性气道炎症和气道重塑为特征的多基因遗传变态反应性疾病,免疫和炎症因子在哮喘发病中起着至关重要的作用,而信号转导通路是调控炎症介质的关键环节[6, 7]。
有研究证实PI3K/AKT信号转导通路在支气管平滑肌增殖和气道重塑中发挥了重要作用[8]。T细胞协调刺激因子CD28在T细胞受体信号转导中能诱导共刺激分子产生,通过PI3K途经激活AKT,活化的AKT调节Th细胞分化,使IL-4、NF-κB等升高,导致哮喘发生[9]。Takeda等[10]使用PI3K选择性抑制剂(IC87114)作用于哮喘小鼠,肺泡灌洗液中白细胞总数、嗜酸性粒细胞增多,中性粒细胞、淋巴细胞明显减少,血清IL-4、IL-5、IL-13和嗜酸性粒细胞趋化因子也相应减少,IgE水平也显著降低。本研究结果显示哮喘急性发作期的PI3K mRNA和蛋白表达水平均显著高于对照组,且与FEV1%、FEV1/FVC、PEF%肺功能存在高度负相关。说明哮喘儿童PI3K信号通路可能被激活,并可能参与了哮喘的发生、发展。
有研究发现孟鲁司特通过抑制NF-κB信号通路,减少IL-6、IL-8等炎症介质的产生和释放,起到减轻气道炎症的作用[11-12]。Toledo等[13]研究发现,樱花亭(二氢黄酮类)能够抑制哮喘小鼠气道炎症细胞中NF-κB的表达,减少了促炎细胞因子的合成和释放,减轻了气道炎症、气道重塑和气道的氧化应激。本研究哮喘患儿的NF-κB mRNA和蛋白表达均较对照组上调,且与FEV1%、FEV1/FVC、PEF%肺功能指标均呈负相关。提示儿童哮喘中NF-κB的表达上调,NF-κB信号途经可能被激活,在哮喘中起作用。
Sampath等[4]发现哮喘患者上皮细胞中存在STAT1异常活化和过度表达,而STAT1的异常活化和过度表达会增加ICAM1的表达,调节Th2优势应答,促进NO合成,加重哮喘的气道炎症。Quarcoo等[14]在卵清蛋白致敏小鼠气道激发前局部使用STAT1的诱导型寡核苷酸(Decoy ODN),结果应用了Decoy ODN的小鼠较对照组BALF中嗜酸性细胞、淋巴细胞显著减少,IL-5水平降低,血管内皮细胞ICAM-1明显减少,气道高反应性也降低,证明抑制STAT1的表达可以有效减轻哮喘气道炎症和气道高反应性。Fan等[15]研究发现STAT1反义寡核苷酸(STAT1 ASON)、地塞米松可使肺泡巨噬细胞中STAT1和ICAM1的mRNA及蛋白表达明显降低,分泌TNF-a、IL-8和NO能力下降,并且STAT1 ASON作用强于地塞米松。
总之,PI3K、NF-κB和STAT1可能在哮喘中发挥重要作用,共同参与哮喘的病理、生理过程。干扰或阻断PI3K、NF-κB和STAT1的表达,可能可以阻止支气管哮喘的发生、发展,为支气管哮喘的诊断和治疗研究提供新的思路。
Biography
石惠玲, 女, 硕士, 住院医师
References
- 1.Shiri T, Mikamo M, Tsuchiya T, et al. Real-world effct of gastroesophageal reflux disease on coughed quality of life and disease status in asthma and COPD. Allergol Int. 2015;64(1):79–83. doi: 10.1016/j.alit.2014.08.001. [DOI] [PubMed] [Google Scholar]
- 2.Thomas CF Jr, Limper AH. Phosphatidylinositol kinase regulation of airway smooth muscle cell proliferation. Am J Respir Cell Mol Biol. 2000;23(4):429–430. doi: 10.1165/ajrcmb.23.4.f200. [DOI] [PubMed] [Google Scholar]
- 3.Hayden MS, Ghosh S. NF-κB in immunobiology. Cell Res. 2011;21(2):223–244. doi: 10.1038/cr.2011.13. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.Sampath D, Castro M, Look DC, et al. Consititutive activation of an epithelial signal transducer of activator of transcription(STAT) pathway in asthma. J Clin Invest. 1999;103(9):1353–1361. doi: 10.1172/JCI6130. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.中华医学会儿科学会呼吸学组, 《中华儿科杂志》编辑委员 儿童支气管哮喘诊断与防治指南. 中华儿科杂志. 2008;46(10):745–753. [Google Scholar]
- 6.Świerczyńska-Machura D, Walusiak-Skorupa J, NowakowskaŚwirta E, et al. Immunological determinants in a murine model of toluene diisocyanate-induced asthma. Int J Occup Med Environ Health. 2012;25(4):492–498. doi: 10.2478/s13382-012-0063-1. [DOI] [PubMed] [Google Scholar]
- 7.Waserman S, Nair P, Snider D, et al. Local and systemic immunological parameters associated with remission of asthma symptoms in children. Allergy Asthma Clin Immunol. 2012;8(1):16. doi: 10.1186/1710-1492-8-16. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.Zhang W, Nie Y, Chong L, et al. PI3K and Notch signal pathways coordinately regulate the activation and proliferation of T lymphocytes in asthma. Life Sci. 2013;92(17-19):890–895. doi: 10.1016/j.lfs.2013.03.005. [DOI] [PubMed] [Google Scholar]
- 9.So L, Fruman DA. PI3K signalling in B and T-lymphocytes:new developments and therapeutic advances. Biochem J. 2012;442(3):465–481. doi: 10.1042/BJ20112092. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.Takeda M, Ito W, Tanabe M, et al. The pathophysiologic roles of PI3Ks and therapeutic potential of selective inhabitors in allergic inflammation. Int Arch Allergy Immunol. 2010;152(Suppl 1):90–95. doi: 10.1159/000312132. [DOI] [PubMed] [Google Scholar]
- 11.Mullol J, Callejas FB, Mendez-Arancibia E, et al. Montelukast reduced eosinophilic inflammation by inhibting both epithelial cell cytokine secretion (GM-CSF, IL-6, IL-8) and eosinophil survival. J Biol Regulators Homeostatic Agents. 2010;24(4):403–411. [PubMed] [Google Scholar]
- 12.Fogli S, Stefanelli F, Neri T, et al. Montelukast prevents micro Particle-induced inflammatory and functional alternation in human bronchial smooth muscle cells. Pharmacol Res. 2013;76(10):149–156. doi: 10.1016/j.phrs.2013.08.001. [DOI] [PubMed] [Google Scholar]
- 13.Toledo AC, Sakoda CPP, Perini A, et al. Flavonone treatment reverses airway inflammation and remodelling in an asthma murine model. Br J Pharmacol. 2013;168(7):1736–1749. doi: 10.1111/bph.12062. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Quarcoo D, Weixler S, Groneberg D, et al. Inhibition of signal transducer of activator of transcription1 attenuates allergeinduceded airway inflammation and hyperrelativity. J Allergy Clin Immunol. 2001;114(2):288–295. doi: 10.1016/j.jaci.2004.03.055. [DOI] [PubMed] [Google Scholar]
- 15.Fan XM, Wang ZL. STAT1 antisense oligonucleotides attenute the proinflamtory cytokine release of alveolar macrophages in bleomycin-Induced fibrosis. Cell Mol Immunol. 2005;2(3):211–217. [PubMed] [Google Scholar]


