Abstract
目的
探讨组蛋白乙酰化和甲基化修饰对心脏发育的交互调控作用,为先天性心脏病的防治提供新的理论基础。
方法
将24只昆明孕小鼠随机分为胚胎14.5 d(ED 14.5)组、胚胎16.5 d(ED 16.5)组、新生0.5 d(PND 0.5)组及新生7 d(PND 7)组,采集各组胎鼠及新生小鼠心脏,每组检测标本数为6。运用比色法检测心肌组织组蛋白乙酰化酶(HATs)及组蛋白甲基转移酶(HMTs)活性;Western blot法检测心肌组织组蛋白H3第9位赖氨酸乙酰化(H3K9ac)及组蛋白H3第9位赖氨酸三甲基化(H3K9me3)表达水平。
结果
比色法结果表明:HATs和HMTs活性在出生前均呈现高表达,出生后均呈现低表达;且PND 0.5和PND7时小鼠心肌组织HATs活性与ED 14.5时相比,以及PND 7时小鼠心肌组织HATs活性与ED 16.5时相比差异均有统计学意义(P < 0.05);小鼠心肌组织HMTs活性在PND 7时与ED 14.5和ED 16.5时相比差异有统计学意义(P < 0.05)。Western blot结果显示:组蛋白H3K9ac和H3K9me3在出生前呈现高表达,出生后呈现低表达,且PND 0.5和PND 7时小鼠心肌组织组蛋白H3K9ac和H3K9me3分别与ED 14.5和ED 16.5时相比差异均有统计学意义(P < 0.05)。
结论
在心脏发育过程中HATs、HMTs及组蛋白H3K9ac、H3K9me3呈现动态表达,提示HATs和HMTs介导的组蛋白H3K9ac乙酰化及H3K9me3甲基化修饰在心脏发育过程中可能发挥了交互调控作用。
Keywords: 心脏发育, 乙酰化, 甲基化, 交互调控, 小鼠
Abstract
Objective
To study the interactive regulatory effect of histone acetylation and methylation on cardiomyogenesis, and to provide a theoretical basis for the prevention and treatment of congenital heart disease.
Methods
A total of 24 Kunming mice were randomly divided into embryo day 14.5 (ED 14.5) group, embryo day 16.5 (ED 16.5) group, postnatal day 0.5 (PND 0.5) group, and postnatal day 7 (PND 7) group, with 6 mice in each group, and the heart tissue of fetal and neonatal mice was collected. Colorimetry was used to measure the activities of histone acetylases (HATs) and histone methyltransferases (HMTs) in the myocardium. Western blot was used to measure the expression of H3K9ac and H3K9me3 in the myocardium.
Results
Colorimetry showed that the activities of HATs and HMTs were higher before birth and were lower after birth. There was a significant difference in the activity of HATs in the myocardium between the PND 0.5 and PND 7 groups and the ED 14.5 group (P < 0.05), as well as between the PND 7 group and the ED 16.5 group (P < 0.05). There was also a significant difference in the activity of HMTs in the myocardium between the PND 7 group and the ED 14.5 and ED 16.5 groups (P < 0.05). Western blot showed higher expression of H3K9ac and H3K9me3 before birth and lower expression of H3K9ac and H3K9me3 after birth, and there were significant differences in the expression H3K9ac and H3K9me3 in the myocardium between the PND 0.5 and PND 7 groups and the ED 14.5 and ED 16.5 groups (P < 0.05).
Conclusions
The dynamic expression of HATs, HMTs, H3K9ac, and H3K9me3 is observed during cardiomyogenesis, suggesting that histone H3K9ac acetylation and histone H3K9me3 methylation mediated by HATs and HMTs may play a role in interactive regulation during cardiomyogenesis.
Keywords: Cardiomyogenesis, Acetylation, Methylation, Interactive regulation, Mice
心脏发育是一个极其复杂而又精细的过程[1]。当前先天性心脏病(简称先心病)的发病率居高不下,虽然随着外科手术技术的改进及介入手术的运用,大多数单纯型先心病患者都能得到治愈,但对于一些复杂型先心病患者及发生了严重肺动脉高压、心力衰竭等并发症的患者,外科治疗效果不好,预后仍较差[2-5]。因此,如何防治先心病就成为各国科学家关注的重点。要解决这一难题,首先需要明确心脏正常发育的调控因素。国外及本课题组前期研究证实[6-9],表观遗传修饰是心脏发育过程中的一种重要调控方式,全程参与了心脏的正常发育,但不同的发育时间点其调控方式可能并不一致。本课题组前期研究发现组蛋白H3总乙酰化水平在胚胎发育过程中呈现动态表达[10],国外研究表明组蛋白乙酰化酶(histone acetylases, HATs)介导的组蛋白H3第9位赖氨酸乙酰化(H3K9ac)的乙酰化修饰及组蛋白甲基转移酶(histone methyltransferases, HMTs)介导的组蛋白H3第9位赖氨酸三甲基化(H3K9me3)的甲基化修饰在心脏发育及心血管疾病中发挥着重要作用[11-12],且在心脏发育过程中组蛋白H3多个氨基酸位点的乙酰化及甲基化修饰处于交互调控的状态从而逐步促进心脏发育[13],但二者之间在心脏发育早期的交互调控方式目前仍少见报道。故本研究以小鼠心脏为研究对象,深入探讨组蛋白乙酰化修饰与组蛋白甲基化修饰对心脏发育的交互调控作用,为进一步明确胚胎心脏发育的调控因素提供一定的理论基础。
1. 材料与方法
1.1. 实验动物及分组
成年SPF级昆明雌性小鼠24只,雄性小鼠12只,购于第三军医大学动物中心,动物批号:SCXK(渝)2012-0005。按雌︰雄= 2 : 1合笼交配,发现阴栓的雌鼠胎龄计为孕0.5 d,计算孕鼠妊娠天数,分笼饲养,自由进食饮水。依据胎龄(embyro day, ED)和出生后日龄(postnatal day, PND)将所有孕鼠按随机数字表法随机分为胚胎期组(ED 14.5组、ED 16.5组)和新生期组(PND 0.5组、PND 7组),其子代小鼠均对应纳入上述各组。
1.2. 心脏标本的制备
选取妊娠14.5 d(ED 14.5组)和16.5 d(ED 16.5组)孕鼠,二氧化碳麻醉处死,75%乙醇消毒并剖腹,分离胚胎,解剖显微镜下剖开胎鼠胸腔,分离心脏,同时选取新生0.5 d(PND 0.5组)及7 d(PND 7组)的新生小鼠,二氧化碳麻醉处死,75%乙醇消毒后剖开胸腔,分离心脏,将完整的心脏放入预冷PBS中清洗后置于-80℃冰箱保存备用。ED 14.5组取60只胎鼠,每10只胎鼠心脏作为一个检测标本,ED 16.5组取48只胎鼠,每8只胎鼠心脏作为一个检测标本。PND 0.5组取36只新生小鼠,每6只新生小鼠心脏作为一个检测标本,PND 7组取24只新生小鼠,每4只新生小鼠心脏作为一个检测标本,四组小鼠中每组各6个检测标本。
1.3. 主要试剂
组蛋白乙酰化酶及组蛋白甲基转移酶试剂盒(GENMED,美国);兔来源的抗H3K9ac单克隆抗体和抗H3K9me3单克隆抗体(Abcam,英国);兔来源的抗β-actin多克隆抗体及辣根过氧化物酶(HRP)标记的山羊抗兔二抗(北京中杉金桥生物技术有限公司);MinuteTM胞质胞核分离试剂盒(Invent,美国);SDS-PAGE凝胶试剂盒(上海碧云天生物技术有限公司)。
1.4. 比色法检测心肌组织中HATs和HMTs活性
分别提取各组小鼠心肌组织核蛋白,BCA法测定蛋白浓度后,运用比色法测定心肌组织中HATs和HMTs活性,实验步骤严格按照HATs和HMTs试剂盒操作说明进行。
1.5. Western blot法检测心肌组织H3K9ac、H3K9me3表达
提取小鼠心肌组织核蛋白,12%SDS-PAGE凝胶分离核蛋白,PVDF膜半干转膜后,5%脱脂牛奶封闭2 h后分别加入兔来源的抗H3K9ac、H3K9me3单克隆抗体(1 : 1 000)及兔来源的抗β-actin多克隆抗体(1 : 1 000),4℃孵育过夜,TBST洗涤3次,每次15 min,然后加入HRP标记的山羊抗兔二抗(1 : 5 000),脱色摇床上孵育2 h,TBST洗涤3次,每次15 min,运用Bio-Rad图像分析仪进行图像扫描;采用Quantity One 4.4软件进行分析,以H3K9ac和H3K9me3与β-actin的灰度值之比分别表示组蛋白H3K9ac和H3K9me3的相对表达量。
1.6. 统计学分析
应用SPSS 21.0统计软件对数据进行统计学分析,计量资料用均数±标准差(x±s)表示,多组间比较进行单因素方差分析,组间两两全面比较采用SNK-q检验,P < 0.05为差异有统计学意义。
2. 结果
2.1. 小鼠心脏发育过程中心肌组织HATs表达情况
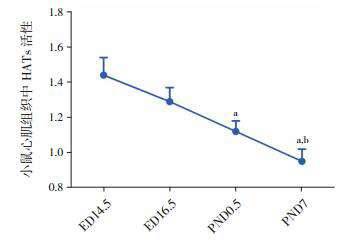
比色法结果显示:在小鼠胚胎发育的4个时间点中,心肌组织的HATs活性呈现动态变化,在胚胎发育的ED 14.5时呈高表达,随着心脏的发育成熟HATs活性逐渐降低,在PND 7小鼠心肌组织中呈低表达,且小鼠心肌组织中HATs活性在PND 0.5与ED 14.5时相比差异有统计学意义(P < 0.05),PND 7小鼠心肌组织中HATs活性分别与ED 14.5和ED 16.5时相比差异均有统计学意义(均P < 0.05),见图 1。
1.
小鼠心脏发育不同时间点心肌组织中HATs活性比较(n=6)
a示与ED 14.5组比较;P<0.05;b示与ED 16.5组比较,P<0.05。
2.2. 小鼠心脏发育过程中心肌组织HMTs表达情况
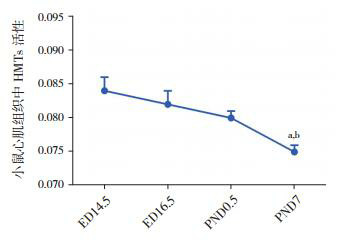
比色法结果显示:在小鼠胚胎发育的4个时间点中,心肌组织中HMTs活性呈现动态变化,在胚胎发育ED 14.5时呈高表达,随着胚胎发育成熟HMTs活性逐渐降低,在PND 7小鼠心肌组织中呈低表达,且小鼠心肌组织中HMTs活性在PND 7时分别与ED 14.5和ED 16.5时相比差异均有统计学意义(均P < 0.05),见图 2。
2.
小鼠心脏发育不同时间点心肌组织中HMTs活性比较(n=6)
a示与ED 14.5组比较,P<0.05;b示与ED 16.5组比较,P<0.05。
2.3. 小鼠心脏发育过程中心肌组织组蛋白H3K9ac乙酰化修饰水平的变化
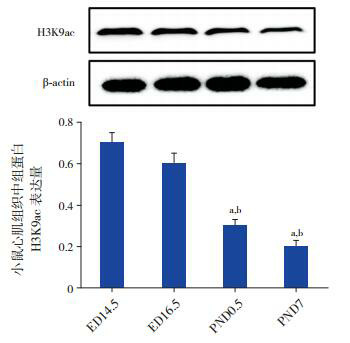
Western blot结果显示:小鼠心脏发育过程中心肌组织组蛋白H3K9ac乙酰化水平随着心脏发育成熟,其乙酰化水平逐渐降低,在ED 14.5时组蛋白H3K9ac乙酰化水平呈现高表达,在PND 7时呈现低表达,且组蛋白H3K9ac乙酰化水平在PND 0.5和PND 7时分别与ED 14.5和ED 16.5时相比差异均有统计学意义(均P < 0.05),见图 3。
3.
小鼠心脏发育不同时间点组蛋白H3K9ac表达水平
上图为电泳图;下图为统计图(n=6):a示与ED 14.5组比较,P<0.05;b示与ED 16.5组比较,P<0.05。
2.4. 小鼠心脏发育过程中心肌组织组蛋白H3K9me3甲基化水平的变化
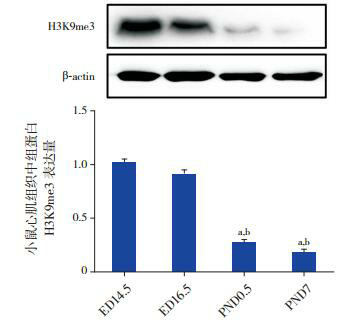
Western blot结果显示:小鼠心脏发育过程中心肌组织组蛋白H3K9me3甲基化水平随着心脏发育成熟,其甲基化水平逐渐降低,在ED 14.5时组蛋白H3K9me3呈现高甲基化,在PND 7时呈现低甲基化,且组蛋白H3K9me3甲基化水平在PND 0.5和PND 7时分别与ED 14.5和ED 16.5时相比差异均有统计学意义(均P < 0.05),见图 4。
4.
小鼠心脏发育不同时间点组蛋白H3K9me3表达水平
上图为电泳图;下图为统计图(n=6):a示与ED 14.5组比较,P<0.05;b示与ED 16.5组比较,P<0.05。
3. 讨论
心脏发育是个极其复杂的过程,涉及到众多的调控因素[1]。表观遗传修饰是翻译后修饰的一种重要调控方式,近年来受到广大研究学者的广泛关注[14-15]。本课题组及国外研究证实[10, 16-18],组蛋白乙酰化修饰参与了心脏发育的调控。组蛋白修饰主要包括组蛋白乙酰化修饰及组蛋白甲基化修饰;其中的组蛋白乙酰化修饰主要受到HATs和组蛋白去乙酰化酶(histone deacetylases, HDACs)的调控,高乙酰化可以使染色质核小体结构疏松利于基因的转录,开启或活化相关基因的表达,低乙酰化则沉默或抑制相关基因的表达;而组蛋白甲基化主要受到HMTs和组蛋白去甲基转移酶(histone demethylases, HDMTs)的调控,组蛋白甲基化的调控作用正好与乙酰化相反,高甲基化抑制或沉默相关基因的表达,低甲基化则开启或活化相关基因的表达。且甲基化修饰和乙酰化修饰之间的变化趋势仍有待进一步阐明。因此,本研究选取小鼠胚胎发育的几个关键时间点,运用表观遗传学的相关检测手段检测小鼠心肌组织中组蛋白乙酰化和甲基化修饰的相关指标来探讨组蛋白修饰在小鼠心脏发育中的表达情况,为进一步防治先心病提供一定的理论基础。
本研究结果证实在小鼠心脏发育过程中HATs及HMTs呈现动态表达,且组蛋白H3K9ac和H3K9me3在这一过程中也呈现动态表达,其变化趋势也与HATs和HMTs的变化趋势基本一致,这可能提示HATs介导的H3K9ac的乙酰化修饰及HMTs介导的H3K9me3的甲基化修饰均参与了小鼠心脏发育的调控。同时,本研究发现组蛋白H3K9ac随着小鼠心脏发育的成熟其表达水平逐渐降低,也就是说其促进心脏发育相关基因表达的作用越来越弱;而组蛋白H3K9me3的甲基化水平随着心脏发育成熟其表达水平逐渐降低,表明其抑制心脏发育相关基因表达的作用越来越弱。上述结果提示在胚胎心脏发育的早期可能主要是乙酰化修饰调控作用促进心脏发育相关基因的表达,而在心脏发育后期可能主要是甲基化修饰的抑制作用减弱从而促进心脏发育相关基因的表达。这与其他研究团队的报道相类似,即在心脏发育的早期及晚期组蛋白H3多个氨基酸位点的乙酰化及甲基化修饰处于交互调控的状态从而逐步促进心脏发育[13],但本研究所探讨的氨基酸调控位点与其他团队研究的不同。本研究的不足在于只是检测了心脏发育过程中的几个时间点,并没有全程监控其修饰水平。因此,心脏发育更早期的乙酰化及甲基化的调控修饰方式仍不清楚,且调控组蛋白乙酰化修饰及甲基化修饰的酶有众多亚型,具体哪些亚型在这一过程中发挥了关键作用仍有待进一步研究明确。
Biographies
李硕, 女, 硕士研究生
Peng C, Email: pengchang_2006@126.com
Funding Statement
国家自然科学基金(81560040);贵州省科技计划项目(黔科合基础2016[1177]); 遵义医学院博士启动基金项目[院字(2015)4号]; 遵义医学院与科技学院大学生创新训练项目(遵医科院[2015]3108)
References
- 1.Zhu H. Forkhead box transcription factors in embryonic heart development and congenital heart disease. Life Sci. 2016;144:194–201. doi: 10.1016/j.lfs.2015.12.001. [DOI] [PubMed] [Google Scholar]
- 2.Dellborg M, Björk A, Pirouzi Fard MN, et al. High mortality and morbidity among adults with congenital heart disease and type 2 diabetes. http://cn.bing.com/academic/profile?id=90f6495e87261701d5b5421afa520ab2&encoded=0&v=paper_preview&mkt=zh-cn. Scand Cardiovasc J. 2015;49(6):344–350. doi: 10.3109/14017431.2015.1085595. [DOI] [PubMed] [Google Scholar]
- 3.Freud LR, Tworetzky W. Fetal interventions for congenital heart disease. Curr Opin Pediatr. 2016;28(2):156–162. doi: 10.1097/MOP.0000000000000331. [DOI] [PubMed] [Google Scholar]
- 4.Begic E, Begic Z, Jahic D, et al. Tetralogy of fallot-clinical course and treatment as a mirror of contemporary cardiology/cardiac surgery development in correction of congenital heart disease in the adults. Med Arch. 2018;72(3):224–226. doi: 10.5455/medarh.2018.72.224-226. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Madeira M, Ranchordas S, Oliveira P, et al. Pulmonary hypertension in valvular heart disease surgery:risk and prognosis. http://d.old.wanfangdata.com.cn/OAPaper/oai_doaj-articles_805d2064e296c3eae31988d67a3855f2. Rev Port Cir Cardiotorac Vasc. 2017;24(3-4):117. [PubMed] [Google Scholar]
- 6.Coppola A, Romito A, Borel C, et al. Cardiomyogenesis is controlled by the miR-99a/let-7c cluster and epigenetic modifications. Stem Cell Res. 2014;12(2):323–337. doi: 10.1016/j.scr.2013.11.008. [DOI] [PubMed] [Google Scholar]
- 7.Zhao W, Liu L, Pan B, et al. Epigenetic regulation of cardiac myofibril gene expression during heart development. Cardiovasc Toxicol. 2015;15(3):203–209. doi: 10.1007/s12012-014-9278-7. [DOI] [PubMed] [Google Scholar]
- 8.徐 君, 林 怡翔, 顾 若漪, et al. 法洛四联症患儿组蛋白乙酰化及其酶的表达. 中国当代儿科杂志. 2013;15(10):817–821. doi: 10.7499/j.issn.1008-8830.2013.10.003. [DOI] [PubMed] [Google Scholar]
- 9.彭 昌, 赵 唯安, 张 维华, et al. 姜黄素通过抑制p300/CBP下调酒精诱导的胎鼠心脏GATA4及NKX2.5过表达. http://www.cnki.com.cn/Article/CJFDTOTAL-LCXB201502023.htm 临床心血管病杂志. 2015;31(2):198–202. [Google Scholar]
- 10.彭 昌, 张 维华, 潘 博, et al. 组蛋白乙酰化酶对心脏发育核心转录因子Mef2c的动态调控作用. http://www.zgddek.com/CN/abstract/abstract13350.shtml. 中国当代儿科杂志. 2014;16(4):418–423. [PubMed] [Google Scholar]
- 11.Vallaster M, Vallaster CD, Wu SM. Epigenetic mechanisms in cardiac development and disease. Acta Biochim Biophys Sin (Shanghai) 2012;44(1):92–102. doi: 10.1093/abbs/gmr090. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.Zhang QJ, Liu ZP. Histone methylations in heart development, congenital and adult heart diseases. Epigenomics. 2015;7(2):321–330. doi: 10.2217/epi.14.60. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.Zhao W, Liu L, Pan B, et al. Epigenetic regulation of cardiac myofibril gene expression during heart development. Cardiovasc Toxicol. 2015;15(3):203–209. doi: 10.1007/s12012-014-9278-7. [DOI] [PubMed] [Google Scholar]
- 14.Ooi JY, Tuano NK, Rafehi H, et al. HDAC inhibition attenuates cardiac hypertrophy by acetylation and deacetylation of target genes. Epigenetics. 2015;10(5):418–430. doi: 10.1080/15592294.2015.1024406. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.Greco CM, Condorelli G. Epigenetic modifications and noncoding RNAs in cardiac hypertrophy and failure. Nat Rev Cardiol. 2015;12(8):488–497. doi: 10.1038/nrcardio.2015.71. [DOI] [PubMed] [Google Scholar]
- 16.Zhang QJ, Liu ZP. Histone methylations in heart development, congenital and adult heart diseases. Epigenomics. 2015;7(2):321–330. doi: 10.2217/epi.14.60. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.Chaturvedi P, Kalani A, Givvimani S, et al. Differential regulation of DNA methylation versus histone acetylation in cardiomyocytes during HHcy in vitro and in vivo:an epigenetic mechanism. Physiol Genomics. 2014;46(7):245–255. doi: 10.1152/physiolgenomics.00168.2013. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18.潘 博, 孙 慧超, 吕 铁伟, et al. 酒精致小鼠胚胎心脏组蛋白H3K9高乙酰化失衡及其表突变. http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=QKC20132013062700092476 临床心血管病杂志. 2013;29(5):395–398. [Google Scholar]


