Abstract
目的
探讨小泛素相关修饰物(SUMO)化修饰CCAAT增强子结合蛋白α(C/EBPα)在支气管肺发育不良(BPD)早产大鼠中的表达及其作用。
方法
将18只早产大鼠随机分为空气组和高氧组(n=9),建立高氧暴露早产大鼠BPD模型。分别在4 d、7 d及14 d,每组各取3只大鼠采集肺组织,糖原染色观察肺组织分化情况;免疫组化检测Ki67表达;Western blot检测SUMO1及C/EBPα蛋白表达;免疫共沉淀检测SUMO化C/EBPα表达。
结果
与同时间点空气组相比,高氧组大鼠肺组织糖原染色强度4 d时减弱,7 d及14 d时明显增强;随高氧暴露时间延长,高氧组大鼠肺组织中Ki67表达逐渐升高,且均高于同时间点空气组;与空气组相比,高氧组C/EBPα蛋白4 d时表达增加,7 d及14 d时表达降低(P < 0.05);高氧组SUMO1及SUMO化C/EBPα蛋白表达呈逐渐上升趋势,均明显高于同时间点空气组(P < 0.05)。高氧组SUMO化C/EBPα表达与糖原染色强度及核增殖抗原Ki67均呈正相关(r=0.529、0.671,P < 0.05)。
结论
高氧暴露所致早产大鼠BPD模型中,肺泡上皮细胞过度增殖与分化障碍可能与SUMO化C/EBPα表达增加相关。
Keywords: 支气管肺发育不良, CCAAT增强子结合蛋白α, 小泛素相关修饰物, 大鼠
Abstract
Objective
To study the expression of SUMO-modified CCAAT enhancer binding protein α (C/EBPα) in preterm rat model of bronchopulmonary dysplasisa (BPD) induced by hyperoxia exposure and its role.
Methods
Eighteen preterm rats were randomly divided into an air group and a hyperoxia group (n=9 each). The model of BPD was prepared in preterm rats exposed to hyperoxia. The rats from the two groups were sacrificed on postnatal days 4, 7 and 14 respectively (3 rats at each time) and lung tissues were harvested. Periodic acid-Schiff (PAS) staining was used to observe the differentiation of rat lung tissues. Ki67 expression was detected by immunohistochemistry. Western blot was used to measure the protein expression of small ubiquitin-related modifier-1(SUMO1) and C/EBPα. A co-immunoprecipitation assay was performed to measure the protein expression of SUMO-modified C/EBPα.
Results
Compared with the air group, the hyperoxia group showed a decreased glycogen content in the lung tissue on postnatal day 4, and an increased content on postnatal days 7 and 14. Over the time of hyperoxia exposure, the hyperoxia group showed an increased expression of Ki67 in the lung tissue compared with the air group at all time points. Compared with the air group, the protein expression of C/EBPα increased on postnatal day 4 and decreased on postnatal days 7 and 14 in the hyperoxia group (P < 0.05). The hyperoxia group had significantly upregulated expression of SUMO1 and SUMO-modified C/EBPα compared with the air group at all time points (P < 0.05). In the hyperoxia group, the protein expression of SUMO-modified C/EBPα was positively correlated with the glycogen content (r=0.529, P < 0.05) and the expression of Ki67 (r=0.671, P < 0.05).
Conclusions
Hyperoxia may induce over-proliferation and differentiation disorders of alveolar epithelial cells in preterm rat model of BPD, possibly through an increased expression of SUMO-modified C/EBPα.
Keywords: Bronchopulmonary dysplasis, CCAAT enhancer binding protein α, Small ubiquitin-related modifier, Rats
支气管肺发育不良(bronchopulmonary dysplasis, BPD)是一种慢性肺部疾病,常见于长期氧疗、机械通气早产儿[1]。目前BPD发病机制尚未完全清楚,亦缺乏特异有效治疗手段。因此探讨BPD发病机制及防治手段,对指导临床治疗具有重要意义。
CCAAT增强子结合蛋白(CCAAT/enhancer-binding proteins, C/EBP)属碱性亮氨酸拉链蛋白转录因子超家族,现已发现6种C/EBP家族成员,包括C/EBPα、C/EBPβ、C/EBPγ、C/EBPδ、C/EBPε及C/EBPζ。其中,C/EBPα在妊娠晚期呼吸道上皮细胞成熟中起重要作用,并参与肺泡表面活性物质合成[2]。C/EBPα基因缺失新生小鼠在出生时即引起呼吸衰竭及肺结构成熟障碍[3]。
小泛素相关修饰物(small ubiquitin-related modifier, SUMO)化修饰是新近发现的一种蛋白质翻译后修饰。哺乳动物体内现已发现4种SUMO蛋白亚型,在肺脏中起主要调控作用的是SUMO1。相关研究表明,抑制SUMO特异性蛋白酶1可减轻急性肺损伤,提示SUMO化修饰可能对肺损伤发生发展起重要调节作用[4]。研究发现,C/EBPα可被SUMO化修饰,C/EBPα序列中协同调控基序SCM(synery control motifs)为SUMO结合位点。文献报道,C/EBPα的SUMO化修饰导致肝细胞增殖抑制功能失活,并抑制C/EBPα抗有丝分裂能力[5]。在SUMO敲除胚胎中,加入SUMO-C/EBPα融合蛋白可恢复正常造血功能[6]。目前,有关C/EBPα的SUMO化修饰研究较少,本课题组前期研究表明,在肺发育过程中,C/EBPα的SUMO化修饰可能与肺分化、肺泡表面活性蛋白表达及磷脂酰胆碱分泌息息相关,提示SUMO化修饰参与C/EBPα介导的分化与增殖[7]。但C/EBPα的SUMO化修饰是否影响高氧暴露所致早产大鼠肺组织细胞分化及增殖,是否参与了BPD的病理生理过程,目前尚不明确。本研究以高氧暴露所致早产大鼠BPD模型为对象,探索SUMO化修饰C/EBPα在BPD中的表达及其动态改变与肺分化及增殖的关系。
1. 材料与方法
1.1. 实验材料
RIPA裂解液(强)、NP40裂解液(上海碧云天生物技术有限公司),SDS-PAGE配胶试剂盒(长沙艾佳生物技术有限公司),兔抗大鼠SUMO1单克隆抗体、兔抗大鼠Ki67多克隆抗体(Abcam公司,美国),山羊抗大鼠C/EBPα多克隆抗体(Santa cruz公司,美国),小鼠抗大鼠β-actin多克隆抗体(CST公司,美国),辣根过氧化物酶标记山羊抗兔单克隆IgG、兔抗山羊单克隆IgG、山羊抗鼠单克隆IgG(CST公司,美国),ECL检测试剂盒(Millipore公司,美国),预染蛋白Marker(Fermentas公司,立陶宛),Protein A/G Plus-Agarose(Santa cruz公司,美国),糖原PAS染色试剂盒(Solarbio公司,美国)。
1.2. 高氧暴露早产大鼠BPD模型建立及分组
Sprague-Dawley(SD)孕鼠孕19 d(预产期为22 d)行剖宫产,提前娩出的新生大鼠为早产鼠。将早产鼠随机分为空气组及高氧组;利用高氧暴露复制BPD模型[8],高氧组大鼠置于氧箱中,氧浓度维持在85%,空气组大鼠置于同一室内常压空气中;代母鼠每24 h在空气组和高氧组间更换一次,以避免氧中毒并排除不同组间代母鼠的影响,每日观察大鼠情况并记录。分别于空气或高氧暴露后4 d、7 d及14 d每组各取3只大鼠麻醉,气管插管,4%多聚甲醛气管内注射原位固定,取出肺组织,左肺用于制作石蜡切片,观察肺组织形态,右肺组织冰冻保存用于相关蛋白检测。
1.3. 糖原染色检测肺组织分化
取标本切片以过碘酸雪夫氏染色法(PAS)处理,切片脱腊至水,室温置于过碘酸溶液中10 min,Schiff Reagent溶液反应至变色后双蒸水冲洗,苏木素染核,光镜下观测,IPP软件评估组织中糖原含量,了解肺细胞分化情况。
1.4. 免疫组化技术检测肺组织中Ki67表达
以细胞增殖标记物Ki67观察肺组织细胞增殖情况。切片常规脱蜡至水,抗原修复后血清封闭30 min,滴加兔抗大鼠Ki67多克隆一抗(1 : 500),4℃过夜,PBS充分洗涤后加入辣根过氧化物酶标记的山羊抗兔单克隆IgG,室温孵育30 min,DAB显色,苏木素染核,1%盐酸乙醇分化返蓝,梯度酒精脱水,二甲苯透明,中性树胶固定封片后镜下观察,IPP软件分析Ki67表达量,了解肺细胞增殖情况。
1.5. Western blot技术检测肺组织中SUMO1及C/EBPα蛋白表达
RIPA裂解液(含PMSF、蛋白酶抑制剂)提取各组肺组织细胞总蛋白,按每泳道取15 μg总蛋白进行SDS-PAGE凝胶电泳,湿式电转至PVDF膜上,5%脱脂奶粉37℃封闭1 h后,分别加入兔抗大鼠SUMO1单克隆抗体(1 : 1 000)、山羊抗大鼠C/EBPα多克隆抗体(1 : 1 000)、小鼠抗大鼠β-actin多克隆抗体(1 : 1 000)一抗,4℃孵育过夜。洗膜,以辣根过氧化物酶标记的单克隆IgG(1 : 5 000)孵育1 h,ECL化学发光显色。以目的蛋白与β-actin条带积分吸光度的比值表示目的蛋白相对表达水平。
1.6. 免疫共沉淀技术(CO-IP)检测肺组织中SUMO化C/EBPα表达
利用NP40裂解液(含PMSF、NEM和蛋白酶抑制剂)分别提取各组肺组织细胞总蛋白,4℃12 000 r/min离心取上清。取20 µL裂解液作为input,加入5×SDS电泳上样缓冲液煮沸10 min,用于检测免疫沉淀的蛋白量。向剩余裂解液中加入0.5 µg山羊抗大鼠C/EBPα多克隆抗体(1 : 100),4℃温和摇摆4 h,加入20 µL protein A/G beads,4℃孵育过夜,2 500 r/min离心,去上清,反复洗涤后加5×SDS电泳上样缓冲液煮沸,后续参照上述操作行SUMO1的免疫印迹实验,了解SUMO化C/EBPα表达情况。实验结果以SUMO化C/EBPα与β-actin的比值表示。
1.7. 统计学分析
采用SPSS 18.0统计软件对数据进行统计学分析,计量资料以均数±标准差( x±s)表示,两组样本间比较采用t检验;组内各时间点比较采用单因素方差分析,两两时间点比较采用SNK-q检验;两样本间相关性采用Pearson相关分析。P < 0.05为差异有统计学意义。
2. 结果
2.1. 肺组织分化情况
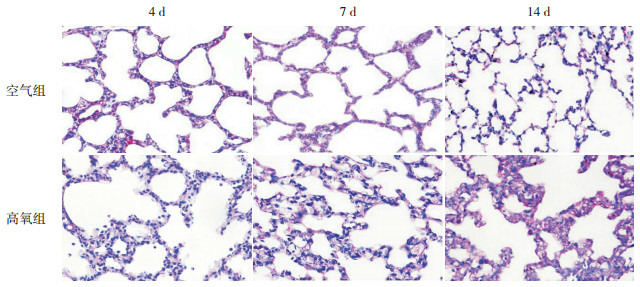
肺上皮细胞内糖原经过PAS染色后呈紫红色,定位在胞浆。空气组大鼠肺组织糖原染色强度在生后逐渐减弱;与同时间点空气组相比,高氧组糖原染色强度4 d时减弱,7 d时增强,14 d时肺泡上皮细胞以立方上皮为主,胞浆内糖原染色强度明显增强。见图 1。
1.
糖原染色检测两组大鼠肺组织分化情况(PAS,×200)
空气组糖原染色强度随时间递减。与空气组比较,高氧组4 d时糖原染色强度减弱,7 d及14 d逐渐增强,提示肺损伤晚期存在肺泡上皮细胞分化成熟障碍。糖原染色后呈紫红色。
2.2. 肺组织细胞增殖变化
Ki67阳性信号表现为定位于胞核的棕黄色颗粒,主要表达在呼吸道和肺泡上皮细胞,肺泡间隔内也可见表达。空气组Ki67于4 d时表达最弱,以后逐渐增加;高氧组肺组织中Ki67表达呈逐渐升高趋势,且均高于同时间点空气组。见图 2。
2.
免疫组化检测肺组织Ki67表达(DAB,×200;左下角方框内,×400)
空气组Ki67表达随时间逐渐增加;高氧组随时间亦呈升高趋势,且均高于同时间点空气组。Ki67阳性信号表现为定位于胞核的棕黄色颗粒。

2.3. 两组不同时间点SUMO1及C/EBPα蛋白表达
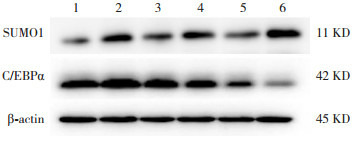
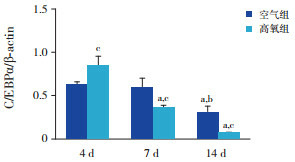
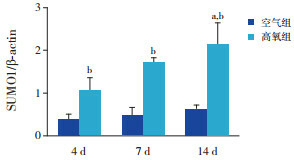
Western blot结果表明,空气组SUMO1蛋白表达在各个时间点比较差异无统计学意义(P > 0.05)。随高氧暴露时间延长,高氧组SUMO1蛋白表达呈逐渐上升趋势(P < 0.05),且均明显高于同时间点空气组(P < 0.05)。空气组与高氧组C/EBPα蛋白表达均呈逐渐下降趋势(P < 0.05);与空气组相比,高氧组4 d时C/EBPα蛋白表达增加,7 d及14 d时表达降低(P < 0.05)。见图 3~5及表 1。
3.
Western blot检测C/EBPα、SUMO1蛋白表达
1:空气组4 d;2:高氧组4 d;3:空气组7 d;4:高氧组7 d;5:空气组14 d;6:高氧组14 d。
5.
两组各时间点C/EBPα蛋白表达比较(n=3)
a示与同组4 d比较,P < 0.05;b示与同组7 d比较,P < 0.05;c示与同时间空气组比较,P < 0.05。
1.
两组各时间点C/EBPα及SUMO1蛋白相对表达量比较 (x±s,n=3)
| 组别 | SUMO1 | C/EBPα | |||||||||
| 4 d | 7 d | 14 d | F值 | P值 | 4 d | 7 d | 14 d | F值 | P值 | ||
| 注:a示与同组4 d比较,P < 0.05;b示与同组7 d比较,P < 0.05。[SUMO1]小泛素相关修饰物1;[C/EBPα] CCAAT增强子结合蛋白。 | |||||||||||
| 空气组 | 0.38±0.13 | 0.50±0.14 | 0.56±0.09 | 2.119 | > 0.05 | 0.628±0.033 | 0.594±0.110 | 0.306±0.071a, b | 15.551 | < 0.05 | |
| 高氧组 | 1.29±0.16 | 1.71±0.11 | 2.14±0.51a | 7.168 | < 0.05 | 0.846±0.108 | 0.357±0.031a | 0.067±0.016a | 13.505 | < 0.05 | |
| t值 | 3.573 | 9.582 | 5.012 | 3.361 | 3.596 | 5.724 | |||||
| P值 | < 0.05 | < 0.01 | < 0.01 | < 0.05 | < 0.05 | < 0.01 | |||||
4.
两组各时间点SUMO1蛋白表达比较(n=3)
a示与同组4 d比较,P < 0.05;b示与同时间空气组比较,P < 0.05。
2.4. 肺组织中SUMO化C/EBPα表达情况
CO-IP结果显示,生后4 d、7 d及14 d时,空气组SUMO化C/EBPα表达量少,但随着时间延长逐渐增加(P < 0.05),14 d时表达水平高于4 d及7 d时;高氧组SUMO化C/EBPα表达呈逐渐上升趋势(P < 0.05),14 d时表达水平高于4 d时,且均明显高于同时间点空气组(P < 0.05)。见图 6~7及表 2。
6.
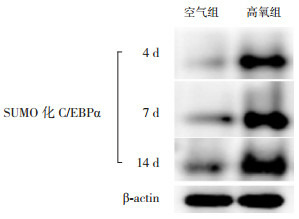
CO-IP检测SUMO化C/EBPα蛋白表达
7.
两组各时间点SUMO化C/EBPα蛋白相对表达量比较(n=3)
a示与同组4 d比较,P < 0.05;b示与同组7 d比较,P < 0.05;c示与同时间空气组比较,P < 0.05。
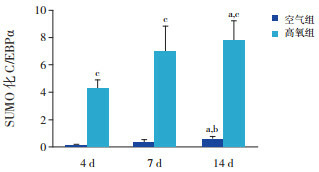
2.
两组各时间点SUMO化C/EBPα蛋白相对表达量比较(x ±s,n=3)
| 组别 | SUMO化C/EBPα | F值 | P值 | ||
| 4 d | 7 d | 14 d | |||
| 注:a示与同组4 d比较,P < 0.05;b示与同组7 d比较,P < 0.05。 | |||||
| 空气组 | 0.13±0.08 | 0.34±0.19 | 0.63±0.13a, b | 9.349 | < 0.05 |
| 高氧组 | 4.31±0.61 | 7.00±1.82 | 7.80±1.44a | 5.198 | < 0.05 |
| t值 | 11.808 | 6.284 | 8.563 | ||
| P值 | < 0.01 | < 0.05 | < 0.05 | ||
2.5. 相关性分析
高氧暴露BPD模型中,肺组织SUMO化C/EBPα表达与糖原染色强度及核增殖抗原Ki67表达均呈正相关(r=0.529、0.671,均P < 0.05)。见图 8~9。
8.
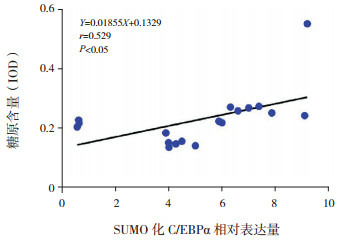
SUMO化C/EBPα表达与糖原含量相关分析图
9.
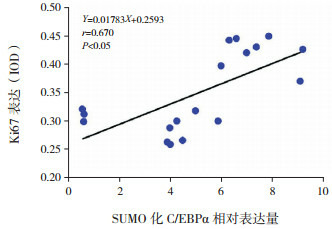
SUMO化C/EBPα表达与Ki67表达相关分析图
3. 讨论
Pan等[9]利用新生大鼠BPD模型研究发现,BPD组大鼠肺泡间隔中断增多,肺泡分化阻滞。糖原富集于不成熟肺泡上皮细胞内,随着肺发育,糖原逐渐消耗,当肺泡上皮细胞分化受阻时出现糖原累积,因此糖原代谢情况可作为肺分化重要参考指标之一。本实验研究结果显示,高氧暴露后,早产大鼠发生肺泡数目减少,体积变大,肺泡结构简单化等改变,与BPD病理改变相似。高氧肺损伤晚期,肺泡上皮细胞内糖原堆积,提示高氧可致肺泡上皮细胞分化成熟障碍。与同时间点空气组比较,高氧组Ki67表达均明显增加,说明高氧诱导肺组织细胞增殖。
近年研究发现,C/EBPα作为调节细胞增殖与分化的关键转录因子,在呼吸道上皮细胞增殖和分化过程中发挥至关重要作用,并参与肺泡表面活性蛋白(surfactant protein, SP)、板层小体相关蛋白及前体脂肪酸的合成,维持肺功能稳态[10]。利用原代培养肺泡上皮细胞(AEC)Ⅱ高氧暴露细胞损伤模型,前期研究发现[11],高氧暴露后C/EBPα表达呈先增加后减少趋势,提示C/EBPα在损伤早期可能通过代偿增加参与保护性应激机制,而随着损伤加重,最终表现为后期失代偿。本实验研究结果显示,在高氧暴露BPD模型中,4 d时C/EBPα表达增加,Torres等[12]发现高氧环境下,早期肺组织中SP-A及SP-B mRNA表达增加,与C/EBPα表达时空一致,提示早期肺损伤时C/EBPα代偿性增加可能通过上调SP表达,保护肺泡上皮细胞。随着高氧暴露时间延长,C/EBPα表达减少,肺泡上皮细胞以立方上皮为主,肺泡上皮细胞内糖原堆积,提示AECⅡ向AECⅠ分化障碍,肺泡化不能顺利完成,C/EBPα表达减少与肺组织发育成熟障碍趋势一致,提示高氧暴露导致的肺分化障碍与C/EBPα表达减少有关。
SUMO化修饰可通过与目标靶蛋白结合发挥调节作用,并与许多肺脏疾病的发生发展有所关联。低氧肺动脉高压大鼠模型中,SUMO1 mRNA及蛋白表达均升高,提示SUMO1可能在低氧肺动脉高压中发挥作用[13]。本实验研究结果显示,高氧组大鼠肺组织中SUMO1表达较空气组显著增加,且随高氧暴露时间延长而逐步升高,提示SUMO1过表达可能参与BPD发生发展。研究发现,C/EBPα可发生SUMO化修饰,SUMO1可修饰C/EBPα Lys159的赖氨酸残基,并抑制其转录活性[14-15]。Hankey等[16]证实,在嗜中性粒细胞发育过程中,C/EBPα的SUMO化修饰水平改变可能有助于调节其转录活性。另外,Sato等[5]发现,SWI/SNF染色质重塑复合物BRG1可增强C/EBPα介导的反式激活,而SUMO化修饰可抑制此过程减少C/EBPα转录。前期研究发现,肺发育过程中,随着肺分化,SUMO化C/EBPα表达逐渐降低,并与肺表面活性物质表达呈负相关,暗示SUMO化修饰可能抑制C/EBPα介导的肺分化[7]。本实验中,高氧肺损伤早期,C/EBPα及SUMO化C/EBPα表达均增加,随着氧暴露时间延长,SUMO化C/EBPα继续呈现增加趋势,而C/EBPα表达降低,提示SUMO化修饰可能抑制C/EBPα的转录活性,导致后期C/EBPα表达量减少。为进一步明确SUMO化C/EBPα是否与BPD肺分化障碍有关,利用相关分析,本研究发现,高氧暴露下,SUMO化C/EBPα表达与糖原含量呈正相关,提示SUMO化C/EBPα可能与BPD中肺泡分化阻滞存在密切关系。
已有研究表明,C/EBPα是一种强有力的细胞增殖抑制剂[17],C/EBPα缺陷新生小鼠AECⅡ增殖旺盛[18]。SUMO化修饰可破坏C/EBPα与其他蛋白质相互作用,从而减少增殖抑制复合物形成[19],促进细胞增殖。本实验中,生理状态下SUMO化C/EBPα表达量极低,高氧暴露后SUMO化C/EBPα表达明显增加,且随高氧暴露时间延长,SUMO化C/EBPα表达逐渐升高,并与Ki67表达呈显著正相关,进一步证明高氧下SUMO化C/EBPα表达增加,可能钝化C/EBPα介导的增殖抑制,促进细胞增殖。
综上所述,高氧暴露所致早产大鼠BPD中,肺泡上皮细胞过度增殖与分化障碍可能与SUMO化C/EBPα表达增加相关。应用基因敲除技术或拮抗剂抑制SUMO功能,或调控SUMO化修饰C/EBPα水平,对于高氧暴露所致BPD肺损伤是否具有保护作用有待进一步研究。
Biographies
朱玥,女,硕士研究生
Lu H-Y, Email: lhy5154@163.com
Funding Statement
国家自然科学基金(81741052);江苏省自然科学基金(BK20161356)
References
- 1.Kalikkot Thekkeveedu R, Guaman MC, Shivanna B. Bronchopulmonary dysplasia:A review of pathogenesis and pathophysiology. Respir Med. 2017;132:170–177. doi: 10.1016/j.rmed.2017.10.014. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2.Xue M, Li X, Chen W. Hypoxia regulates the expression and localization of CCAAT/enhancer binding protein α by hypoxia inducible factor-1α in bladder transitional carcinoma cells. https://www.researchgate.net/publication/274319278_Hypoxia_regulates_the_expression_and_localization_of_CCAATenhancer_binding_protein_a_by_hypoxia_inducible_factor-1a_in_bladder_transitional_carcinoma_cells. Mol Med Rep. 2015;21(3):345–351. doi: 10.3892/mmr.2015.3563. [DOI] [PubMed] [Google Scholar]
- 3.Yang G, Hinson MD, Bordner JE, et al. Silencing hyperoxiainduced C/EBPα in neonatal mice improves lung architecture via enhanced proliferation of alveolar epithelial cells. Am J Physiol Lung Cell Mol Physiol. 2011;301(2):L187–L196. doi: 10.1152/ajplung.00082.2011. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.马 禕文, 吕 翔. 抑制SUMO特异性蛋白酶1在小鼠急性肺损伤中的保护作用. http://www.cnki.com.cn/Article/CJFDTOTAL-LCYX201506008.htm 中国临床医学. 2015;22(6):738–740. [Google Scholar]
- 5.Sato Y, Miyake K, Kaneoka H, et al. Sumoylation of CCAAT/enhancer-binding protein alpha and its functional roles in hepatocyte differentiation. J Biol Chem. 2006;281(31):21629–21639. doi: 10.1074/jbc.M600852200. [DOI] [PubMed] [Google Scholar]
- 6.Yuan H, Zhang T, Liu X, et al. Sumoylation of CCAAT/enhancer-binding protein α is implicated in hematopoietic stem/progenitor cell development through regulating runx1 in zebrafish. Sci Rep. 2015;5:9011. doi: 10.1038/srep09011. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Chen YD, Liu JY, Lu YM, et al. Functional roles of C/EBPα and SUMO-modification in lung development. Int J Mol Med. 2017;40(4):1037–1046. doi: 10.3892/ijmm.2017.3111. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.Warner BB, Stuart LA, Papes RA, et al. Functional and pathological effects of prolonged hyperoxia in neonatal mice. https://www.ncbi.nlm.nih.gov/pubmed/9688942. Am J Physiol. 1998;275(1 Pt 1):L110–L117. doi: 10.1152/ajplung.1998.275.1.L110. [DOI] [PubMed] [Google Scholar]
- 9.Pan B, Xue X, Zhang D, et al. SOX4 arrests lung development in rats with hyperoxia-induced bronchopulmonary dysplasia by controlling EZH2 expression. https://www.spandidos-publications.com/10.3892/ijmm.2017.3171/download. Int J Mol Med. 2017;40(6):1691–1698. doi: 10.3892/ijmm.2017.3171. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.Roos AB, Berg T, Barton JL, et al. Airway epithelial cell differentiation during lung organogenesis requires C/EBPα and C/EBPβ. Dev Dyn. 2012;241(5):911–923. doi: 10.1002/dvdy.23773. [DOI] [PubMed] [Google Scholar]
- 11.卢 衍敏, 卢 红艳, 刘 姜艳, et al. 高氧调节早产大鼠肺泡Ⅱ型上皮细胞CCAAT增强子结合蛋白α和肺泡表面活性蛋白的表达. http://www.cnki.com.cn/Article/CJFDTotal-SDYY201221005.htm. 细胞与分子免疫学杂志. 2017;33(6):767–771. [PubMed] [Google Scholar]
- 12.Torres F, González-Candia A, Montt C, et al. Melatonin reduces oxidative stress and improves vascular function in pulmonary hypertensive newborn sheep. J Pineal Res. 2015;58(3):362–373. doi: 10.1111/jpi.2015.58.issue-3. [DOI] [PubMed] [Google Scholar]
- 13.Jiang Y, Wang J, Tian H, et al. Increased SUMO-1 expression in response to hypoxia:Interaction with HIF-1α in hypoxic pulmonary hypertension. Int J Mol Med. 2015;36(1):271–281. doi: 10.3892/ijmm.2015.2209. [DOI] [PubMed] [Google Scholar]
- 14.Geletu M, Balkhi MY, Peer Zada AA, et al. Target proteins of C/EBPalphap30 in AML:C/EBPalphap30 enhances sumoylation of C/EBPalphap42 via up-regulation of Ubc9. Blood. 2007;110(9):3301–3309. doi: 10.1182/blood-2007-01-071035. [DOI] [PubMed] [Google Scholar]
- 15.Mackert JR, Qu P, Min Y, et al. Dual negative roles of C/EBPα in the expansion and pro-tumor fuctions of MDSCs. Sci Rep. 2017;7(1):14048. doi: 10.1038/s41598-017-12968-2. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.Hankey W, Silver M, Sun BS, et al. Differential effects of sumoylation on the activities of CCAAT enhancer binding protein alpha (C/EBPα) p42 versus p30 may contribute in part, to aberrant C/EBPα activity in acute leukemias. Hematol Rep. 2011;3(1):e5. doi: 10.4081/hr.2011.e5. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.Gerlach JC, Over P, Foka HG, et al. Role of transcription factor CCAAT/enhancer-binding protein alpha in human fetal liver cell types in vitro. Hepatol Res. 2015;45(8):919–932. doi: 10.1111/hepr.12420. [DOI] [PubMed] [Google Scholar]
- 18.Xu Y, Saegusa C, Schehr A, et al. C/EBPalpha is required for pulmonary cytoprotection during hyperoxia. Am J Physiol Lung Cell Mol Physiol. 2009;297(2):L286–L298. doi: 10.1152/ajplung.00094.2009. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.Lu GD, Leung CH, Yan B, et al. C/EBPalpha is up-regulated in a subset of hepatocellular carcinomas and plays a role in cell growth and proliferation. Gastroenterology. 2010;139(2):632–643. doi: 10.1053/j.gastro.2010.03.051. [DOI] [PubMed] [Google Scholar]


