Abstract
目的
探讨体内沉默PAX2基因对肾间质纤维化大鼠肾小管上皮细胞转分化(EMT)的影响。
方法
64只Wistar大鼠麻醉后, 单侧输尿管结扎法制作肾间质纤维化大鼠模型, 随机分为阴性对照组和PAX2基因沉默组, 每组32只。将200 μL NC-siRNA-in vivo jetPEITM混合液转染阴性对照组大鼠, 将200 μL PAX2-siRNA-in vivo jetPEITM混合液转染PAX2基因沉默组大鼠, 各组分别于转染后3、5、7、14 d分为4个亚组, 每组8只。留取各组肾组织标本, 应用Real-Time PCR及Western blot法检测肾皮质PAX2 mRNA及其蛋白的沉默情况, 以及E-钙粘连素(E-cadherin)、α-平滑肌肌动蛋白(α-SMA)mRNA和蛋白表达情况。
结果
PAX2基因沉默组PAX2 mRNA和蛋白表达量较阴性对照组均降低(P < 0.05)。随着梗阻时间的延长, 两组E-cadhelin mRNA和蛋白表达量逐渐下降, α-SMA mRNA和蛋白表达量逐渐升高; 在转染14 d时, PAX2基因沉默组E-cadhelin mRNA和蛋白相对表达量明显高于阴性对照组(P < 0.05), 而α-SMA mRNA和蛋白相对表达量明显低于阴性对照组(P < 0.05)。
结论
沉默PAX2基因在肾间质纤维化晚期大鼠中可明显抑制肾小管EMT进程, 可能对肾间质纤维化有治疗作用。
Keywords: PAX2基因, 基因沉默, 肾间质纤维化, 大鼠
Abstract
Objective
To investigate the influence of silencing PAX2 gene in vivo on epithelial-mesenchymal transition (EMT) of renal tubular cells in rats with renal interstitial fibrosis.
Methods
A total of 64 Wistar rats were anaesthetized, and unilateral ureteral obstruction (UUO) was performed to establish a rat model of renal interstitial fibrosis. The 64 rats were randomly divided into negative control and PAX2 gene silencing groups (n=32 each). The rats in the control group were transfected with 200 μL NC-siRNA-in vivo jetPEITM solution. Those in the PAX2 gene silencing group were transfected with 200 μL PAX2-siRNA-in vivo jetPEITM solution. Each group was further divided into 4 subgroups based on the post-transfection time (3, 5, 7 and 14 days after transfection), with 8 rats in each subgroup. Renal tissue samples were harvested in each group. Real-time PCR and Western blot were used to measure the mRNA and protein expression of PAX2 in the renal cortex, as well as the mRNA and protein expression of E-cadherin and α-SMA.
Results
Compared with the control group, the PAX2 gene silencing group showed significantly lower mRNA and protein expression of PAX2 (P < 0.05). In the two groups, the mRNA and protein expression levels of E-cadherin were gradually reduced over the time of obstruction, while those of α-SMA gradually increased. At 14 days after transfection, the PAX2 gene silencing group had significantly higher mRNA and protein expression of E-cadherin but lower mRNA and protein expression of α-SMA compared with the control group (P < 0.05).
Conclusions
PAX2 gene silencing can significantly inhibit the process of EMT of renal tubular cells in rats with advanced fibrosis, suggesting that PAX2 gene silencing may have a therapeutic effect on renal interstitial fibrosis.
Keywords: PAX2 gene, Gene silencing, Renal interstitial fibrosis, Rats
肾间质纤维化(renal interstitial fibrosis, RIF)是指由多种原因引起的细胞外基质成分在肾间质过度沉积和肾间质纤维的增生变化;是各种慢性肾脏疾病发展至终末期肾功能不全的统一通路和重要原因[1]。单侧输尿管结扎(unilateral ureteralobstruction, UUO)模型是RIF最经典的动物模型[2]。RIF的发病机制是复杂的病理过程,目前认为肾小管上皮细胞转分化(epithelial-mesenchymaltransition, EMT)在该过程中发挥重要作用[3-4]。E-钙粘连素(E-cadherin)是肾小管上皮细胞特征性标志[5],在EMT时首先消失;α-平滑肌肌动蛋白(α-smooth activator protein, α-SMA)是公认的肌成纤维细胞标志性蛋白,是EMT的重要标志[6]。RIF的发生发展机制尚未完全阐明,临床上治疗效果不理想,缺乏治疗方案,因而阻滞或延缓RIF病理过程是阻止肾功能进行性衰竭的关键。
PAX2(paired box 2)基因编码核转录因子,参与了肾脏胚胎发育的基因调控,肾单位发育成熟后PAX2表达即消失。近年来研究发现PAX2在肾脏疾病中出现重新表达,本课题组前期的工作证实PAX2重新表达参与了RIF过程[7]。RNA干扰技术是一种新的基因阻断技术,广泛应用于哺乳细胞体外研究,随着研究的深入,如何把小分子干扰RNA(small interfering RNA, siRNA)导入动物或是人体内研究却遇到一定困难,jetPEI纳米颗粒是具有极低的毒性、高重复性的基因载体,可用于体内蛋白功能的研究、临床前研究、以及RNA干扰研究[8-11]。目前关于RIF的RNA干扰研究,仅限于转染体外细胞,本实验前期已成功筛选出PAX2-siRNA用于大鼠体内转染[10],有效沉默PAX2基因,PAX2基因沉默是否通过参与EMT过程,延缓肾小管EMT进程,目前体内动物实验尚未见报道,本实验应用jetPEI纳米颗粒介导PAX2-siRNA转染UUO大鼠体内,明确PAX2基因沉默对RIF肾小管EMT的影响。
1. 材料与方法
1.1. 实验动物与试剂
4~6周龄雄性Wistar大鼠64只,体重120~150 g,购于中国医科大学实验动物中心,合格证号:SYXK(辽)2003-0019。PAX2单克隆抗体购于美国Zymed公司;TRIzol购于美国Invitrogen公司;Prime ScriptTM RT Reagent Kit和Realtime quantitive PCR(SYBRR Premix Ex TaqTM)试剂盒购于TaKaRa大连宝生物工程有限公司;PCR引物经大连宝生物公司合成;E-cadherin和α-SMA单克隆抗体购于美国Santa Cruz公司;2'F修饰的PAX2-siRNA和NC-siRNA(阴性对照)由上海吉玛公司合成;in vivo-jetPEITM购于法国PolyPlusTransfection公司。
1.2. siRNA设计合成
首先从NCBI数据库中获取大鼠PAX2基因编码序列全长(GeneID: 293992,mRNA:NM_001106361),由上海吉玛公司合成干扰PAX2基因的PAX2-siRNA和随机的不靶向任何基因的阴性对照NC-siRNA,序列见表 1。
1.
PAX2-siRNA和NC-siRNA的siRNA序列表

|
1.3. 转染液配制
siRNA与in vivo jetPEITM混合液的配制严格按照操作说明进行,详见参考文献[10]。即:(1)将80 μg siRNA粉末(NC-siRNA或PAX2-siRNA)离心后加入5%葡萄糖溶液100 μL,充分混合;(2)取8 μL in vivo-jetPEITM加入5%葡萄糖溶液92 μL,充分混合;将(1)溶液立刻加入到(2)溶液中,共200 μL,室温孵育15 min。
1.4. 制作UUO动物模型及体内转染
64只Wistar大鼠用水合氯醛麻醉后,沿左耻骨上切开,在左肾下方找到并分离出输尿管,将输尿管上、下结扎两处,从中间进行剪断[7]。随机分为阴性对照组和PAX2基因沉默组,每组32只。将200 μL NC-siRNA-in vivo jetPEITM混合液分成4份(每份50 μL),在每只阴性对照组大鼠肾脏上、下极和肾脏两侧缘的中央分别进行肾脏被膜下注射,分层缝合后关闭腹腔;将200 μLPAX2-siRNA-in vivo jetPEITM混合液分成4份(每份50 μL)给每只PAX2基因沉默组大鼠进行注射,注射部位同阴性对照组。再将两组大鼠按转染后3、5、7、14 d分为4个亚组,每亚组8只大鼠。
1.5. 标本采集
各组大鼠分别于转染后3、5、7、14 d进行水合氯醛麻醉,脊椎脱臼法处死大鼠。消毒、留取左侧梗阻肾,行盐水反复冲洗,将脂肪剥去,滤纸充分吸干,分离出皮质和髓质,放于液氮罐内,移至-80℃冰箱,待行Real-Time PCR和Westernblot检测。
1.6. Real-Time PCR检测PAX2、E-cadherin和α-SMA mRNA表达
取两组转染后3、5、7、14 d大鼠肾皮质100 mg,TRIzol试剂提取总RNA,经37℃ 15 min,85℃ 5 s,逆转录合成cDNA,以此为模板用相应引物经PCR方法进行扩增。各基因引物序列见表 2。
2.
各基因的引物序列表

|
扩增条件为:95℃预变性10 s;95℃变性5 s,60℃退火34 s,共40个循环。融解曲线条件(ABI7500机器自行设定):95℃ 15 s,60℃1 min,95℃ 15 s。以前期实验中CT值最大的样品为标准样品,用EAZY Dilution依次稀释成4个梯度,与所有样品同时进行扩增。利用ABI 7500Real-Time PCR system(美国应用生物系统公司),根据标准曲线自动进行分析,同时显示实验结果,用△△ CT法进行计算。
1.7. Western blot检测PAX2、E-cadherin和α-SMA蛋白表达
取两组转染后3、5、7、14 d大鼠肾皮质100 mg,加入裂解液500 μL研磨,离心10 min,取上清,测各样品中蛋白含量;取50 μg蛋白进行聚丙烯酰胺凝胶电泳,转至PVDF膜;脱脂奶粉行封闭,在4℃过夜;加PAX2(1:1 000)、α-SMA(1:1 000)和E-cadherin(1:1 000)以及内参β-actin(1:1 000)37℃ 2 h;TBST洗膜3次,每次10 min;加HRP标记的羊抗兔IgG(1:5 000,美国Santa Cruz提供),37℃ 2 h,洗膜;DAB显色液铺于膜上,避光放置,约3 min后可出现蛋白显色带,将膜上条带扫描存入电脑,应用QuantityOne-4.4.0分析软件,分析每条带的灰度值,结果用β-actin校正。
1.8. 统计学分析
采用SPSS 17.0统计软件对数据进行统计学分析,计量资料以均数±标准差(x±s)表示,两组间比较采用t检验,P < 0.05为差异有统计学意义。
2. 结果
2.1. 转染后各时间点两组PAX2 mRNA的沉默效果
Real-Time PCR检测转染后不同时间点PAX2mRNA的表达,通过所得出的扩增曲线,利用标准曲线算出CT值,结果各时间点PAX2基因沉默组与阴性对照组比较PAX2 mRNA的表达量明显下降(P < 0.05),见表 3和图 1。
3.
转染后不同时间点两组PAX2 mRNA相对表达量比较(x±s,n=8)

|
1.
Real-Time PCR法检测转染后不同时间点两组PAX2 mRNA相对表达量比较(n=8)
a示与阴性对照组比较,P < 0.05。

2.2. 转染后各时间点两组PAX2蛋白的沉默效果
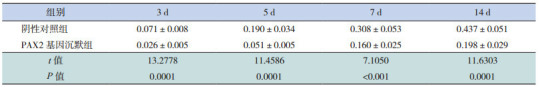
Western blot检测转染后不同时间点两组PAX2蛋白的表达,结果显示各条泳道都在43 kD及46 kD处出现条带,说明β-actin及PAX2蛋白为特异性条带。各时间点PAX2基因沉默组PAX2蛋白表达量与阴性对照组相比明显降低(P < 0.05),表明PAX2-siRNA-in vivo jetPEITM复合物转染后各时间点PAX2蛋白的表达均受抑制,见表 4和图 2。
4.
转染后不同时间点两组PAX2蛋白相对表达量比较(x±s,n=8)
|
2.
Western blot法检测转染后不同时间点两组PAX2蛋白相对表达量比较
上图为电泳条带图;下图为统计图(n=8),a示与阴性对照组比较,P < 0.05。

2.3. PAX2基因沉默后E-cadherin mRNA表达
Real-Time PCR检测各组E-cadherin mRNA的表达,溶解曲线的溶解温度一致,提示产物是特异的;通过扩增曲线与标准曲线所得的CT值,用2- △△ CT法进行计算。阴性对照组和PAX2基因沉默组在转染后3、5、7 d,E-cadherin mRNA相对表达量逐渐减少,且两组相比差异无统计学意义(P > 0.05);在转染后14 d时,PAX2基因沉默组E-cadherin mRNA的相对表达量与阴性对照组相比明显升高(P < 0.05)。见表 5和图 3。
5.
PAX2基因沉默后两组大鼠各时间点E-cadherin mRNA相对表达量比较(x±s,n=8)

|
3.
Real-Time PCR法检测PAX2基因沉默后两组大鼠各时间点E-cadherin mRNA相对表达量比较(n=8)
a示与阴性对照组比较,P < 0.05。

2.4. PAX2沉默后E-cadherin蛋白的表达
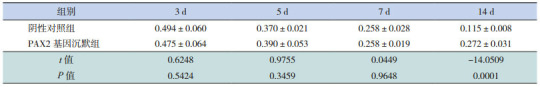
Western blot结果显示,各组β-actin条带的亮度相似,而E-cadherin条带的亮度不相同,在转染后3、5、7 d,阴性对照组和PAX2基因沉默组E-cadherin/β-actin蛋白相对表达量逐渐下降,且两组比较差异无统计学意义(P > 0.05);在转染后14 d时,PAX2基因沉默组E-cadherin/β-actin蛋白表达量增加,与同期阴性对照组相比明显升高(P < 0.05)。见表 6和图 4~5。
6.
PAX2基因沉默后两组大鼠不同时间点E-cadherin蛋白相对表达量比较(x±s,n=8)
|
4.

Western blot法检测PAX2基因沉默后两组大鼠各时间点E-cadherin和α-SMA蛋白相对表达量电泳图
5.
Western blot法检测PAX2基因沉默后两组大鼠不同时间点E-cadherin蛋白相对表达量比较(n=8)
a示与阴性对照组比较,P < 0.05。

2.5. PAX2基因沉默后α-SMA mRNA表达
Real-Time PCR法检测α-SMA mRNA的表达,两组在转染后3、5、7 d时α-SMA mRNA表达均呈上升趋势,且PAX2基因沉默组与同期阴性对照组相比差异无统计学意义(P > 0.05);在转染后14 d时,PAX2基因沉默组α-SMA mRNA相对表达量较同期阴性对照组明显减少(P < 0.05)。见表 7和图 4、6。
7.
PAX2基因沉默后两组大鼠不同时间点α-SMA mRNA相对表达量比较(x±s,n=8)

|
6.
Real-Time PCR法检测PAX2基因沉默后两组大鼠不同时间点α-SMA mRNA相对表达量比较(n=8)
a示与阴性对照组比较,P < 0.05。

2.6. PAX2基因沉默后α-SMA蛋白的表达
Western blot检测α-SMA蛋白的表达,两组在转染后3、5、7 d,α-SMA/β-actin蛋白相对表达量均呈上升趋势,且PAX2基因沉默组与阴性对照组相比差异无统计学意义(P > 0.05);在转染14 d时,PAX2基因沉默组α-SMA蛋白相对表达量较同期阴性对照组明显减少(P < 0.05)。见表 8和图 4、7。
8.
PAX2基因沉默后两组大鼠不同时间点α-SMA蛋白相对表达量比较(x±s,n=8)

|
7.
Western blot法检测PAX2基因沉默后两组大鼠不同时间点α-SMA蛋白相对表达量比较(n=8)
a示与阴性对照组比较,P < 0.05。

3. 讨论
UUO模型制作简单,有较好的重复性和较高的成功率,是诱导RIF最经典的公认模型,虽然许多学者通过体内外实验对RIF进行了大量的研究,但其具体发病机制尚未明了,对抗纤维化的治疗,尚无有效的方案。因此,研究RIF的发病机制、干预RIF的进程、寻找合理的治疗方法是当前肾脏病界的研究热点。
PAX2基因是发育调控基因家族成员之一,所编码的蛋白作为核转录因子及信号分子参与胚胎的发育调控,具有促进细胞增殖及分化的功能,成熟肾单位其表达消失。有研究表明PAX2在病理肾中出现胚胎期的回归表达,再表达部位主要位于肾小管,其可能诱导肾小管EMT,进而参与肾脏的损伤过程,致RIF[12-13]。PAX2质粒转染NRK52E后导致NRK52E表型纤维化,说明PAX2在体外可以介导RIF[14]。本课题组的前期研究证明,在UUO大鼠模型肾组织中出现PAX2再表达,PAX2蛋白表达量与RIF程度呈正相关[7]。
本次实验应用RNA干扰技术,通过体内转染,沉默PAX2基因表达,目前细胞转染是研究基因功能、表达与调控、蛋白功能和疾病生物治疗中最基本的实验技术。基因治疗的载体可以分为病毒性与非病毒性载体。病毒载体具有潜在毒性,制备复杂、生产困难、相对来说,非病毒载体无传染性、易于构建、稳定性好、安全性较高、使用方法简单易行。目前大多数研究利用体外细胞进行转染,体内研究较少。阳离子聚合物多聚乙酰亚胺[15](polyethylenimine, PEI)是公认的体内外有效的传递基因[16-18]和RNA干扰技术中用于转运非病毒的载体[19],转染率较高,已被用于多种器官。JetPEI转染试剂是基因的体内外转染试剂,该试剂是阳离子化的大分子PEI衍生物,其与外源基因结合形成颗粒状,与细胞表面的蛋白多糖结合,通过细胞内吞作用进入细胞。PEI-复合体具有质子海绵的特性,吸收溶酶体的H+,保护DNA免受核酸酶的降解,特点是转染效率高,重复性好,极低的细胞毒性,方法简便,省时省力。本课题组前期已将in vivo jetPEI体内转染试剂与siRNA复合物成功转染至大鼠肾被膜下,明显减轻肾脏纤维化[10],但PAX2基因沉默是否影响EMT进程,目前国内外未见报道。
本研究成功制作UUO大鼠RIF模型,并通过转染试剂成功将PAX2-siRNA片段导入UUO大鼠体内,同时应用Real-Time PCR及Western blot进行检测,结果显示各时间点PAX2基因沉默组与阴性对照组比较,PAX2 mRNA和蛋白表达量明显降低,提示PAX2基因被沉默。
目前认为,EMT是RIF的重要发病机制之一[20-21],本实验选择E-cadherin和α-SMA两种细胞表型特异性标志物作为判断肾小管EMT的指标。本研究Real-Time PCR结果表明,随着梗阻时间的延长,两组E-cadhelin mRNA表达量逐渐下降,α-SMA mRNA表达量逐渐升高;且两组各指标在转染3、5、7 d差异无统计学意义,在转染14 d时,PAX2基因沉默组E-cadhelin mRNA表达量明显高于阴性对照组,α-SMA mRNA表达量明显低于阴性对照组。Western blot检测E-cadhelin和α-SMA蛋白结果与Real-Time PCR结果一致。说明PAX2基因沉默在纤维化早期对EMT过程无影响,在纤维化晚期可明显抑制肾小管EMT的过程,延缓RIF的进程。
PAX2是人类肾发育必不可少的转录因子,其基因突变和再表达与RIF紧密联系,但有关PAX2确切的功能作用,尤其是在后天性肾脏疾病中的表达方面研究还不足,是需要进一步探讨和研究的方面,而且PAX2上游调控分子及下游靶基因还未完全明确,PAX2是否参与RIF信号传导通路,仍需进一步研究,因此,依靠目前日益先进的组织细胞培养、遗传、分子生物学技术就这些方面深入研究,终将揭示PAX2在肾脏疾病中的作用与地位,为肾脏疾病预防与治疗带来新的途径。
Biography
李丽, 女, 博士, 副教授
Funding Statement
黑龙江省青年科学基金项目(QC2012C119);黑龙江省卫生厅项目(2012-198);佳木斯大学科学技术项目-重点项目(Sz2014-011)
References
- 1.Hewitson TD. Fibrosis in the kidney: is a problem shared a problem halved? Fibrogenesis Tissue Repair. 2012;5(Suppl 1):S14. doi: 10.1186/1755-1536-5-S1-S14. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2.Picard N, Baum O, Vogetseder A, et al. Origin of renal myofibroblasts in the model of unilateral ureter obstruction in the rat. Histochem Cell Biol. 2008;130(1):141–155. doi: 10.1007/s00418-008-0433-8. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.Liu Y. New insights into epithelial-mesenchymal transition in kidney fibrosis. J Am Soc Nephrol. 2010;21(2):212–222. doi: 10.1681/ASN.2008121226. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.Kim MK, Maeng YI, Sung WJ, et al. The differential expression of TGF-β1, ILK and wnt signaling inducing epithelial to mesenchymal transition in human renal fibrogenesis: an immunohistochemical study. Int J Clin Exp Pathol. 2013;6(9):1747–1758. [PMC free article] [PubMed] [Google Scholar]
- 5.Xiong H, Hong J, Du W, et al. Roles of STAT3 and ZEB1 proteins in E-cadherin down-regulation and human colorectal cancer epithelial-mesenchymal transition. J Biol Chem. 2012;287(8):5819–5832. doi: 10.1074/jbc.M111.295964. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Satish L, Gallo PH, Baratz ME, et al. Reversal of TGF-β1 stimulation of α-smooth muscle actin and extracellular matrix components by cyclic AMP in Dupuytren's-derived fibroblasts. BMC Musculoskelet Disord. 2011;12:113. doi: 10.1186/1471-2474-12-113. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Li L, Wu Y, Zhang W. PAX2 re-expression in renal tubular epithelial cells and correlation with renal interstitial fibrosis of rats with obstructive nephropathy. Ren Fail. 2010;32(5):603–611. doi: 10.3109/08860221003778049. [DOI] [PubMed] [Google Scholar]
- 8.André ND, Silva VA, Ariza CB, et al. In vivo knockdown of CXCR4 using jetPEI/CXCR4 shRNA nanoparticles inhibits the pulmonary metastatic potential of B16 F10 melanoma cells. Mol Med Rep. 2015;12(6):8320–8326. doi: 10.3892/mmr.2015.4487. [DOI] [PubMed] [Google Scholar]
- 9.Liu H, Wang Y, Wang M, et al. Fluorinated poly(propylenimine) dendrimers as gene vectors. Biomaterials. 2014;35(20):5407–5413. doi: 10.1016/j.biomaterials.2014.03.040. [DOI] [PubMed] [Google Scholar]
- 10.Li L, Wu Y, Wang C, et al. Inhibition of PAX2 gene expression by siRNA (polyethylenimine) in experimental model of obstructive nephropathy. Ren Fail. 2012;34(10):1288–1296. doi: 10.3109/0886022X.2012.723662. [DOI] [PubMed] [Google Scholar]
- 11.Lee TY, Chang CI, Lee D, et al. RNA interference-mediated simultaneous silencing of four genes using cross-shaped RNA. Mol Cells. 2013;35(4):320–326. doi: 10.1007/s10059-013-2316-7. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.Sharma R, Sanchez-Ferras O, Bouchard M. Pax genes in renal development, disease and regeneration. Semin Cell Dev Biol. 2015;44:97–106. doi: 10.1016/j.semcdb.2015.09.016. [DOI] [PubMed] [Google Scholar]
- 13.Zhou TB. Signaling pathways of PAX2 and its role in renal interstitial fibrosis and glomerulosclerosis. J Recept Signal Transduct Res. 2012;32(6):298–303. doi: 10.3109/10799893.2012.738231. [DOI] [PubMed] [Google Scholar]
- 14.Li L, Wu Y, Yang Y. Paired box 2 induces epithelial-mesenchymal transition in normal renal tubular epithelial cells of rats. Mol Med Rep. 2013;7(5):1549–1554. doi: 10.3892/mmr.2013.1365. [DOI] [PubMed] [Google Scholar]
- 15.Yan X, Zhang Y, Zhang H, et al. Amphiphilic polyethylenimine (PEI) as highly efficient non-viral gene carrier. Org Biomol Chem. 2014;12(12):1975–1982. doi: 10.1039/c3ob42279h. [DOI] [PubMed] [Google Scholar]
- 16.Liang W, Gong H, Yin D, et al. High-molecular-weight polyethyleneimine conjuncted pluronic for gene transfer agents. Chem Pharm Bull (Tokyo) 2011;59(9):1094–1101. doi: 10.1248/cpb.59.1094. [DOI] [PubMed] [Google Scholar]
- 17.Liu C, Liu F, Feng L, et al. The targeted co-delivery of DNA and doxorubicin to tumor cells via multifunctional PEI-PEG based nanoparticles. Biomaterials. 2013;34(10):2547–2564. doi: 10.1016/j.biomaterials.2012.12.038. [DOI] [PubMed] [Google Scholar]
- 18.Huang X, Hartley AV, Yin Y, et al. AAV2 production with optimized N/P ratio and PEI-mediated transfection results in low toxicity and high titer for in vitro and in vivo applications. J Virol Methods. 2013;193(2):270–277. doi: 10.1016/j.jviromet.2013.06.008. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.Shao W, Paul A, Abbasi S, et al. A novel polyethyleneimine-coated adeno-associated virus-like particle formulation for efficient siRNA delivery in breast cancer therapy: preparation and in vitro analysis. Int J Nanomedicine. 2012;7:1575–1586. doi: 10.2147/IJN.S26891. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20.Thakur S, Viswanadhapalli S, Kopp JB, et al. Activation of AMP-activated protein kinase prevents TGF-β1-induced epithelial-mesenchymal transition and myofibroblast activation. Am J Pathol. 2015;185(8):2168–2180. doi: 10.1016/j.ajpath.2015.04.014. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 21.Winbanks CE, Darby IA, Kelynack KJ, et al. Explanting is an ex vivo model of renal epithelial-mesenchymal transition. J Biomed Biotechnol. 2011;2011:212819. doi: 10.1155/2011/212819. [DOI] [PMC free article] [PubMed] [Google Scholar]


