Abstract
目的
系统评价维生素A补充对儿童肺炎的疗效和安全性。
方法
检索Cochrane Library、EMbase、PubMed、中国生物医学文献数据库、中国知网和万方数据库等中英文数据库,选择其中关于维生素A辅助治疗儿童肺炎的随机对照试验。由2位评价者独立阅读文献,按纳入及排除标准提取效应量并评价研究质量,采用Revman5.3软件进行Meta分析。
结果
最终纳入15个临床随机对照试验,包括3 021例患者。Meta分析结果显示,加用维生素A不能降低肺炎患儿病死率(P > 0.05),但可提高其临床总有效率(P < 0.05),可缩短患儿发热、咳嗽持续时间、体征及胸片转阴时间、住院时间(P < 0.05),且未增加不良反应如恶心、呕吐、腹泻、过敏、前囟膨隆等的发生。
结论
现有证据表明,辅以维生素A治疗儿童肺炎有助于缓解其临床症状体征,缩短住院时间,且不会增加不良反应的发生。
Keywords: 维生素A, 肺炎, Meta分析, 随机对照试验, 儿童
Abstract
Objective
To investigate the effect and safety of vitamin A supplementation in children with pneumonia through a systematic review.
Methods
Cochrane Library, EMbase, PubMed, China Biology Medicine disc, CNKI, and Wanfang Data were searched for randomized controlled trials (RCTs) on vitamin A as an adjuvant therapy for pneumonia in children. Two reviewers independently screened the studies and evaluated their quality according to the inclusion and exclusion criteria. RevMan5.3 was used for the Meta analysis.
Results
A total of 15 RCTs with 3 021 patients were included. The Meta analysis showed that vitamin A supplementation did not reduce the mortality of children with pneumonia (P > 0.05), but it increased the overall clinical response rate (P < 0.05) and shortened the duration of pyrexia and cough, clearance time of signs and abnormal chest X-ray results, and length of hospital stay (P < 0.05). As an adjuvant therapy, vitamin A did not increase the incidence rates of adverse reactions such as nausea, vomiting, diarrhea, allergy, and bregma bulging.
Conclusions
Current evidence shows that in the treatment of pneumonia in children, vitamin A supplementation helps to relieve clinical symptoms and signs and shorten the length of hospital stay.The adjuvant therapy does not increase the incidence rates of adverse reactions.
Keywords: Vitamin A, Pneumonia, Meta analysis, Randomized controlled trial, Child
在发展中国家,儿童肺炎和维生素A(vitamin A, VA)缺乏都是重要的公共健康问题[1-2]。尽管近年儿童肺炎的发病率和病死率均有所下降,但仍是儿童的主要死亡原因,每年将近180万儿童死于肺炎[3-5]。据世界卫生组织统计,5岁以下死亡儿童中有20%死于肺炎[6]。VA是人体必需营养素,在维持上皮细胞完整性及免疫功能的调节方面起着重要的作用,VA缺乏时,儿童抗感染能力下降,易患各种感染性疾病[7-8]。Swami等[9]研究发现,VA缺乏儿童呼吸道感染的发病率为正常儿童的2倍。Imdad等[10]的Meta分析得出结论,补充VA可降低儿童腹泻病的发病率和病死率,也可降低儿童麻疹的发病率。在设计良好的对照试验中发现VA还能减轻0.5~5岁疟疾患儿的病情,减少发热次数,减轻脾肿大[11]。然而,根据目前的研究,补充VA对儿童肺炎治疗是否有利仍存在较大争议。吕文清[12]研究发现,补充VA可提高患儿肺炎临床治愈率。张继山[13]研究发现,加用VA治疗可加快肺炎患儿病情好转并减少复发。Mohamed等[14]研究发现,补充β胡萝卜素有利于改善肺炎患儿气促情况。但也有许多研究得出了不同的结论:Rodríguez等[15]研究发现,补充VA对降低肺炎患儿病死率、改善肺炎症状体征等均无明显作用;Mahalanabis等[16]研究发现补充VA不能改善下呼吸道感染患儿病情与缩短热程,给予VA制剂并不能影响儿童呼吸道感染的发生。因此,本研究采用Meta分析的方法对有关VA辅助治疗儿童肺炎的随机对照试验(randomized controlled trial, RCT)进行分析,评价VA补充在儿童肺炎中的作用,进一步明确补充VA对于儿童肺炎的临床应用价值。
1. 资料与方法
1.1. 文献检索
检索Cochrane Library、EMbase、PubMed、中国生物医学文献数据库、中国知网和万方数据库等中英文数据库。选择各数据库建库至2017年10月公开发表的有关VA辅助治疗儿童肺炎的RCT。
中文检索词为:肺炎、肺部感染、肺感染、肺泡炎、维生素A、维他命A、视黄醇、视黄醛、胡萝卜素、儿童、幼儿、小儿。英文检索词为:pneumonia、pneumon*、pulmonary inflammat*、lung Inflammat*、pulmonary Infect*、lung Infect*、respiratory tract infections、respiratory infect*、vitamin A、aquasol A、retinol、retinal、carotene、carotenoid、retinoid、child*、kid*。
1.2. 纳入标准
(1)研究对象:明确诊断肺炎的儿童,无性别、种族及地域的限制;(2)干预措施:试验组在常规治疗的基础上加用VA制剂辅助治疗,其VA来源明确,给予剂型、给予途径、给予剂量明确;对照组仅为常规治疗或加用同等剂量安慰剂治疗;(3)研究类型:RCT;(4)报道了Meta分析设定的结局指标。
1.3. 排除标准
(1)研究对象为成人,或伴有结核感染、免疫缺陷、重度营养不良、哮喘及其他慢性疾病,存在心、肺、肝、肾等器质性疾病,近期有呼吸道感染或炎症性疾病,近期曾使用维生素等药物可能影响研究结果者;(2)未设立对照组或未说明随机方法的临床试验;(3)未提供充分原始数据。
1.4. 观察指标
观察指标包括:(1)病死率;(2)临床总有效率;(3)发热、咳嗽、肺部罗音持续时间及胸片转阴时间;(4)住院时间;(5)不良反应(恶心、呕吐、腹泻、过敏、前囟膨隆);(6)再患病情况。
1.5. 资料提取及文献质量评价
分别由2人按文献纳入及排除标准独立阅读文献,并对入选研究进行资料提取和文献质量评价,若意见不一致,由具有相关专业知识的第三人参与解决。提取的资料包括:文献的基本特征、所纳入文献研究对象的基本特征、干预措施和结局指标。质量评估参考Cochrane手册5.1.0关于纳入RCT文献质量评价部分(Revman5.3软件自带),主要是对随机方法的产生、分配方案的隐藏与否、盲法的采用、对失访的报告、选择性偏倚及其他偏倚等方面进行评价。若所有质量标准均为低风险,则为低偏倚风险研究(low risk of bias),其质量最高;一类或多类偏倚风险未知为未知偏倚风险研究(unclear risk of bias),质量为中等;一类或多类偏倚为高风险,则为高偏倚风险研究(high risk of bias),其质量较低。
1.6. 统计学分析
采用Revman5.3软件进行数据处理与分析。二分类变量资料采用危险比(RR)及其95%置信区间(CI)为效应量。连续变量资料采用均数差(MD)及其95%CI为效应量。采用卡方检验对各研究结果进行异质性检验,根据Cochrane系统评价,I2 > 50%可认为研究间存在异质性。对无异质性的研究,选用固定效应模型;对有异质性的研究,当异质性来源不能用临床异质性和方法学异质性来解释时,选用随机效应模型。若效应指标纳入研究数大于10篇,则使用RevMan5.3软件生成漏斗图,评价是否存在发表偏倚。若数据无法进行Meta分析则进行描述性分析。
2. 结果
2.1. 纳入文献特征
共检索到1 251篇文献(Cochrane Library 119篇、EMbase 576篇、PubMed 217篇、中国生物医学文献数据库106篇、中国知网134篇、万方数据库99篇)。通过阅读标题、摘要,排除重复、综述、个案报道、流行病学、与主题不相符研究等1 216篇,进一步阅读全文后排除非RCT、无确切疗效评定指标文献、重复数据、无单一VA制剂分组文献20篇,最终15个RCT纳入分析。共纳入3 021例患儿,其中VA治疗组1 523例,对照组1 498例。纳入的15项研究的基本特征见表 1。
1.
纳入文献的基本情况
| 研究 | 国家 | 患儿年龄 | 研究设计 | 例数(治疗组/对照组) | VA剂量 | 评价指标 |
| 注:“/”表示原始研究未具体说明纳入患儿的具体年龄。评价指标:①病死率;②临床总有效率;③发热持续时间;④咳嗽持续时间;⑤肺部罗音转阴时间;⑥胸片转阴时间;⑦住院时间;⑧不良反应(恶心、呕吐、腹泻、过敏等);⑨再患病情况。 | ||||||
| 吕文清2003[12] | 中国 | 2~9岁 | 随机对照 | 30/24 | 25 000 IU×7 d | ② |
| 张继山1999[13] | 中国 | / | 随机对照 | 40/40 | 20 000 IU×6 d后减量至1 500 IU×20 d | ②⑨ |
| Rodríguez 2005[15] | 厄瓜多尔 | 2~59月 | 双盲、随机对照 | 145/142 | < 1岁:50 000 IU; > 1岁:100 000 IU | ①③⑤ |
| Stephensen 1998[17] | 秘鲁 | 3月~10岁 | 双盲、随机对照 | 48/47 | < 1岁:首日100 000 IU,第2天开始50 000 IU; > 1岁:首日200 000 IU,第2天开始100 000 IU | ⑦⑨ |
| Si 1997[18] | 越南 | 1~59月 | 双盲、随机对照 | 280/312 | < 1岁:200 000 IU; > 1岁:400 000 IU | ①③⑦ |
| Nacul 1997[19] | 巴西 | 6~59月 | 双盲、随机对照 | 239/233 | < 1岁:200 000 IU; > 1岁:400 000 IU | ①③⑧ |
| Fawzi 1998[20] | 坦桑尼亚 | 6~60月 | 双盲、随机对照 | 346/341 | < 1岁:200 000 IU; > 1岁:400 000 IU | ①③⑤⑦ |
| 考验1996[21] | 中国 | 1月~12岁 | 随机对照 | 70/70 | 25 000 IU×7 d | ⑤⑦ |
| 耿刚2009[22] | 中国 | 1月~2岁 | 随机对照 | 60/61 | < 1岁:50 000 IU; > 1岁:100 000 IU | ⑨ |
| 黄爱莲2009[23] | 中国 | / | 随机对照 | 40/40 | 2 500 IU×1个月 | ③⑤ |
| 马彩云2000[24] | 中国 | / | 随机对照 | 42/36 | 1 500 IU | ③④⑤ |
| 顾素芳2001[25] | 中国 | / | 随机对照 | 60/60 | 婴儿:1 500 IU;儿童:2 000 IU | ③④⑤ |
| 王卫平2003[26] | 中国 | 4月~8岁 | 双盲、随机对照 | 68/40 | 5 000 IU/(kg. d),明显VA缺乏者肌注0.5~1 mL×3 d后减量至5 000 IU/(kg. d) | ③④⑤⑥⑦ |
| 刘晓红1997[27] | 中国 | / | 双盲、随机对照 | 23/21 | 150 000 IU | ③④⑤ |
| 秦西林1999[28] | 中国 | 1~36月 | 随机对照 | 32/31 | < 2岁:2.5万IU,bid×5 d; > 2岁:2.5万IU,tid×5 d | ② |
2.2. 文献偏倚风险评估
采用Cochrane风险偏倚评估工具进行文献偏倚风险评估。5篇文章报道了随机序列产生的方法,2篇文章实现了分配隐藏,7篇文章实现了对研究者和受试者实施盲法,6篇文章实现了研究结局盲法评价,11篇文章报道了失访、随访情况,所有纳入文章均未报道其他偏倚情况(表 2)。
2.
纳入研究的偏倚风险评价
| 研究 | 随机方法 | 分配隐藏 | 研究者和受试者施盲 | 研究结局盲法 | 结局数据的完整性 | 选择性报告 | 其他偏倚 |
| 注:“+”表示“低风险偏倚”;“-”表示“高风险偏倚”;“?”表示“未知风险偏倚”。 | |||||||
| 吕文清2003[12] | ? | ? | ? | ? | + | ? | ? |
| 张继山1999[13] | - | - | ? | ? | + | ? | ? |
| Rodríguez 2005[15] | + | + | + | + | + | + | ? |
| Stephensen 1998[17] | + | ? | + | + | + | + | ? |
| Si 1997[18] | + | ? | + | + | ? | + | ? |
| Nacul 1997[19] | + | + | + | + | + | + | ? |
| Fawzi 1998[20] | + | ? | + | + | + | + | ? |
| 考验1996[21] | ? | - | ? | ? | + | + | ? |
| 耿刚2009[22] | ? | - | ? | ? | + | ? | ? |
| 黄爱莲2009[23] | ? | - | ? | ? | + | ? | ? |
| 马彩云2000[24] | ? | - | ? | ? | + | ? | ? |
| 顾素芳2001[25] | ? | ? | ? | ? | ? | ? | ? |
| 王卫平2003[26] | ? | - | + | ? | ? | ? | ? |
| 刘晓红1997[27] | ? | - | + | + | - | + | ? |
| 秦西林1999[28] | ? | ? | ? | ? | + | ? | ? |
2.3. 结果评价
2.3.1. 病死率
4个研究[15, 18-20]比较了试验组和对照组患儿的病死率,各研究具有同质性(P=0.58,I2=0%),采用固定效应模型。Meta分析结果示两组病死率差异无统计学意义(P=0.73,RR =1.12,95%CI:0.58~2.19)。
2.3.2. 临床总有效率
3个研究[12-13, 28]比较了试验组和对照组患儿治疗的临床总有效率,各研究具有同质性(P=0.25,I2=28%),采用固定效应模型。Meta分析结果示试验组临床总有效率高于对照组,差异有统计学意义(P < 0.0001),见图 1。
1.
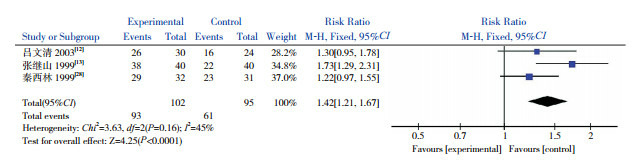
两组临床总有效率比较的Meta分析图
2.3.3. 肺炎的症状、体征及胸片转阴时间
9个研究[15, 18-20, 23-27]比较了两组患儿发热持续时间,Meta分析显示试验组患儿发热时间较对照组短(P =0.02)。4个研究[24-27]比较了患儿咳嗽持续时间,Meta分析显示试验组咳嗽时间较对照组短(P =0.0007)。6个研究[15, 23-27]比较了患儿肺部罗音消失时间,Meta分析显示试验组患儿肺部罗音消失时间较对照组短(P < 0.0001)。2个研究[25-26]比较了患儿胸片转阴时间,Meta分析显示治疗组患儿胸片转阴时间较对照组短(P =0.002)。但异质性分析显示,各研究之间均有不同程度的异质性,均采用随机效应模型,见图 2。
2.
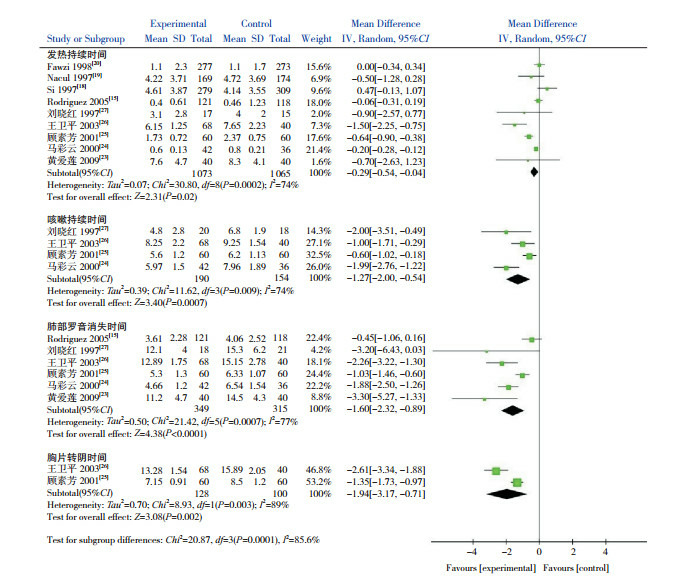
两组临床症状、体征及胸片转阴时间比较的Meta分析图
2.3.4. 住院时间
5个研究[17-18, 20-21, 26]比较了两组患儿住院时间。Meta分析结果示试验组患儿住院时间更短,差异有统计学意义(P < 0.00001)。各研究结果之间有异质性(I2=97%),采用随机效应模型,见图 3。
3.
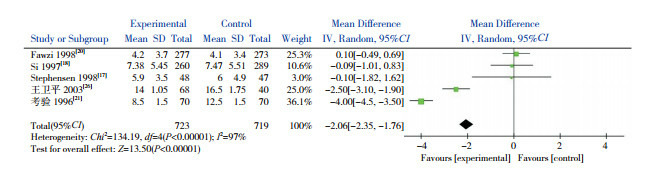
两组住院时间比较的Meta分析图
2.3.5. 安全性评价
2个研究[17, 19]比较了VA治疗可能出现的呕吐的情况,1个研究[17]比较了发生恶心的情况,1个研究[19]比较了出现腹泻、过敏、前囟膨隆的情况。Meta分析结果显示:治疗组和对照组发生呕吐的情况差异无统计学意义(P =0.32,RR=0.80,95%CI:0.51~1.25);两组发生恶心的情况差异无统计学意义(P =0.96,RR=0.93,95%CI:0.06~14.48);两组发生腹泻的情况差异无统计学意义(P =0.07,RR=0.61,95%CI:0.36~1.05);两组出现过敏的情况差异无统计学意义(P =0.07,RR=0.71,95%CI:0.48~1.03);两组出现前囟膨隆的情况差异无统计学意义(P =0.16,RR=7.92,95%CI:0.43~145.05)。
2.3.6. 再患病情况
2个研究[13, 22]随访了患儿肺炎好转后再患呼吸道感染的情况,其中1个研究[22]比较了随访6个月内再患呼吸道感染的次数和患呼吸道感染的平均持续时间。Meta分析结果显示试验组患儿6个月内再患呼吸道感染的次数较对照组少(P =0.04,MD=-0.61,95%CI:-1.19~-0.03),再患呼吸道感染的持续时间较对照组短(P =0.002,MD=-4.94,95%CI:-8.02~ -1.86)。另一个研究[13]比较了患儿随访1年内再患肺炎的次数,结果显示VA治疗患儿再发生肺炎的次数较对照组少(P =0.002,RR=1.54,95%CI:1.18~2.02)。
2.4. 敏感性分析
对纳入研究数量≥2的结局指标进行敏感性分析,分别采用固定效应模型和随机效应模型进行Meta分析。其结果的一致性可在一定程度上反映合并结果的可靠性。结果显示(表 3):病死率、临床总有效率、发热持续时间、咳嗽持续时间、肺部罗音消失时间、胸片转阴时间及发生呕吐的情况,两结果效应强度相差较小,提示该结果稳定性较好。住院时间的两结果差异较大,结果稳定性较差。
3.
随机效应模型和固定效应模型计算
| 评价指标 | 随机效应模型 | 固定效应模型 | |||
| RR/MD值 | 95%CI | RR/MD值 | 95%CI | ||
| 病死率 | 1.15 | 0.58~2.29 | 1.12 | 0.58~2.19 | |
| 临床总有效率 | 1.39 | 1.12~1.72 | 1.42 | 1.21~1.67 | |
| 发热持续时间 | -0.29 | -0.54~-0.04 | -0.22 | -0.29~-0.15 | |
| 咳嗽持续时间 | -1.27 | -2.00~-0.54 | -0.98 | -1.30~-0.66 | |
| 肺部罗音消失时间 | -1.60 | -2.32~-0.89 | -1.26 | -1.54~-0.97 | |
| 胸片转阴时间 | -1.94 | -3.17~-0.71 | -1.62 | -1.96~-1.28 | |
| 住院时间 | -1.36 | -3.19~0.47 | -2.06 | -2.35~-1.76 | |
| 不良反应(呕吐) | 0.80 | 0.51~1.25 | 0.81 | 0.51~1.27 | |
2.5. 异质性分析
采用逐一剔除文献法未发现明确异质性来源。进一步按不同年代(2000年之前与2000年之后)、地区(亚非地区与欧美地区)对异质性较大的结果(发热持续时间、咳嗽持续时间、肺部罗音消失时间、胸片转阴时间、住院时间)进行亚组分析,若分层后某研究因素的文献数 < 1则不纳入分析。结果表明:两组在咳嗽持续时间及肺部罗音消失时间的比较中,研究年代不同可解释其异质性来源(表 4)。两组在发热持续时间的比较中,研究地区不同可解释部分异质性来源(表 5)。两组住院时间、胸片转阴时间的比较未找到明确的异质性来源。
4.
按不同年代亚组分析结果
| 指标/年代 | 篇数 | 异质性检验结果 | 效应估计值 | |||
| I2 | P值 | 95%CI | P值 | |||
| 注:共 2 个研究比较了胸片转阴时间,均为 2000 年后的文献,分层后 2000 年前的文献数为 0,故未纳入此亚组分析。 | ||||||
| 发热持续时间 | ||||||
| 2000年前 | 5 | 44% | 0.13 | -0.41~0.47 | 0.44 | |
| 2000年后 | 4 | 84% | 0.0003 | -1.21~-0.07 | 0.03 | |
| 咳嗽持续时间 | ||||||
| 2000年前 | 2 | 0% | 0.99 | -2.68~-1.31 | < 0.00001 | |
| 2000年后 | 2 | 0% | 0.34 | -1.06~-0.34 | 0.0001 | |
| 肺部罗音消失时间 | ||||||
| 2000年前 | 2 | 0% | 0.43 | -2.54~-1.32 | < 0.00001 | |
| 2000年后 | 4 | 80% | 0.002 | -1.32~-0.57 | 0.001 | |
| 住院时间 | ||||||
| 2000年前 | 4 | 98% | < 0.00001 | -2.25~-1.56 | < 0.00001 | |
| 2000年后 | 1 | / | / | -3.10~-1.90 | < 0.00001 | |
5.
按地区不同进行亚组分析结果
| 指标/地区 | 篇数 | 异质性检验结果 | 效应估计值 | |||
| I2 | P值 | 95%CI | P值 | |||
| 注:对咳嗽持续时间、胸片转阴时间2个指标进行比较的研究均为亚非地区的研究,分层后欧美地区的文献数为0,故未纳入此亚组分析。 | ||||||
| 发热持续时间 | ||||||
| 亚非 | 7 | 79% | < 0.0001 | -0.69~-0.01 | 0.04 | |
| 欧美 | 2 | 9% | 0.29 | -0.41~0.17 | 0.43 | |
| 肺部罗音消失时间 | ||||||
| 亚非 | 5 | 69% | 0.01 | -2.66~-1.14 | < 0.00001 | |
| 欧美 | 1 | / | / | -1.06~0.16 | 0.15 | |
| 住院时间 | ||||||
| 亚非 | 4 | 98% | < 0.00001 | -2.42~-1.81 | < 0.00001 | |
| 欧美 | 1 | / | / | -1.82~1.62 | 0.91 | |
3. 讨论
VA缺乏已成为世界性营养问题,肺炎患儿常伴有VA缺乏[29-30]。VA有维持气道上皮完整性和调节机体免疫等作用[31]。当机体缺乏VA时,使得机体免疫功能及气道上皮细胞完整性受损,从而增加了儿童肺炎的患病率及严重程度。本研究在整理以往研究结果的基础上,运用循证医学方法对VA辅助治疗儿童肺炎的疗效和安全性进行了系统评价。
本研究表明,VA对提高肺炎患儿治疗临床总有效率、缓解临床症状(发热、咳嗽)、体征及胸片恢复、缩短住院时间及预防复发等方面均显示出了有效性,对减少肺炎儿童病死率方面未显示出有效性,VA作为辅助治疗手段治疗肺炎暂未发现明显的不良反应。对本研究的研究结果行敏感性分析表明,其中住院时间结果分析稳定性较差,其他结果稳定性较好,可信度较高。
本Meta分析显示,VA作为辅助手段治疗儿童肺炎,对降低肺炎患儿病死率未显示出有效性,与Imadad等[10]的Meta分析结果一致。
本Meta分析显示,补充VA对缓解肺炎患儿临床症状及体征、影像学表现及缩短住院时间显示出了有效性。但各研究之间异质性较大,主要可能有以下几方面原因:(1)各研究的研究人群不同、时间不同、样本量大小不同、VA剂量不同;(2)各研究对结局指标的测量方式不完全相同;(3)各研究关于儿童肺炎的诊断标准不完全相同。对其进行亚组分析后发现,发热持续时间、咳嗽持续时间、肺部罗音消失时间的部分异质性得到解释,2000年前的研究发现治疗组患儿发热及咳嗽持续时间较对照组均明显缩短,可能与2000年前VA缺乏更严重更普遍有关;欧美地区人群治疗组患儿发热持续时间与对照组无差异,该结果与合并效应量结果相反,这可能与欧美地区儿童常规补充VA更积极,VA缺乏或亚临床缺乏发生率较低有关。但住院时间及胸片转阴时间未找到明确异质性来源,尚需更多高质量大样本研究对此进一步解释及验证。
大剂量VA的不良反应包括头痛、食欲下降、恶心、呕吐、前囟膨隆等[32]。本研究纳入了2个研究[17, 19]对此进行了比较,显示两组患儿不良反应的发生无明显差异,即目前研究示短期使用大剂量VA不会增加毒性反应的发生。
本Meta分析纳入了2个研究比较了患儿肺炎好转后的随访情况:耿刚等[22]对患儿随访6个月,发现使用VA辅助治疗的患儿肺炎恢复后,6个月内再发生呼吸道感染的平均次数、发生呼吸道感染的平均天数均较对照组少,即对2岁以下的肺炎患儿使用VA辅助治疗,可减少呼吸道感染的再患病率和再患病的病程;张继山[13]发现患儿肺炎恢复后,VA治疗组患儿随访1年内再发生肺炎的次数更少。说明加用VA治疗儿童肺炎,可降低呼吸道感染的再发率及呼吸道感染的严重程度。但本Meta分析所纳入随访研究较少,病例数有限,尚需更多大样本的随机对照试验支持此结论。
综上,本Meta分析显示,补充VA可提高儿童肺炎临床总有效率,缩短发热持续时间、咳嗽持续时间、肺部罗音消失时间、胸片转阴时间、住院时间,减少呼吸道感染再患病率,且未发现治疗过程中明显不良反应的发生,故本研究建议,对于儿童肺炎,可加用VA辅助治疗。但本文结局指标较多,部分结果纳入的研究较少,研究的病例数有限,仍有待高质量、大样本的临床随机对照研究进行进一步的验证。
Biographies
胡楠, 女, 硕士研究生
Li Q-B, Email:liqubei@126.com
References
- 1.Song P, Wang J, Wei W, et al. The prevalence of vitamin A deficiency in Chinese children:a systematic review and Bayesian meta-analysis. http://mdpi.com/2072-6643/9/12/1285. Nutrients. 2017;9(12) doi: 10.3390/nu9121285. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2.Donà D, Luise D, Dalt LD, et al. Treatment of community-acquired pneumonia:are all countries treating children in the same way? A literature review. https://www.uptodate.com/contents/treatment-of-community-acquired-pneumonia-in-adults-who-require-hospitalization#! Int J Pediatr. 2017;2017:4239268. doi: 10.1155/2017/4239268. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.Dekker LH, Mora-Plazas M, Marín C, et al. Stunting associated with poor socioeconomic and maternal nutrition status and respiratory morbidity in Colombian schoolchildren. Food Nutr Bull. 2010;31(2):242–250. doi: 10.1177/156482651003100207. [DOI] [PubMed] [Google Scholar]
- 4.黄 建宝, 孟 燕妮, 陈 璐, et al. 儿童大叶性肺炎344例临床分析. http://doi.med.wanfangdata.com.cn/10.3969/j.issn.1007-614x.2012.25.176 中国临床医生. 2012;40(2):41–43. [Google Scholar]
- 5.Liu L, Johnson HL, Cousens S, et al. Global, regional, and national causes of child mortality:an updated systematic analysis for 2010 with time trends since 2000. http://www.who.int/.../tetanus/Lancet-2013-Global-child-mortality.pdf. Lancet. 2012;376(9832):2151–2161. doi: 10.1016/S0140-6736(12)60560-1. [DOI] [PubMed] [Google Scholar]
- 6.Ferreira S, Sant'anna CC, March Mde F, et al. Lethality by pneumonia and factors associated to death. J Pediatr (Rio J) 2014;90(1):92–97. doi: 10.1016/j.jped.2013.05.008. [DOI] [PubMed] [Google Scholar]
- 7.李 廷玉, 黄 鸿眉. 维生素A缺乏的诊断治疗及预防. http://m.medlive.cn/guide/2/3273 实用儿科临床杂志. 2010;25(11):867–868. [Google Scholar]
- 8.Spinas E, Saggini A, Kritas SK, et al. Can vitamin A mediate immunity and inflammation? https://www.researchgate.net/publication/274902011_Can_vitamin_a_mediate_immunity_and_inflammation. J Biol Regul Homeost Agents. 2015;29(1):1–6. [PubMed] [Google Scholar]
- 9.Swami HM, Thakur JS, Bhatia SP. Impact of mass supplementation of vitamin A. Indian J Pediatr. 2007;74(5):443–447. doi: 10.1007/s12098-007-0074-2. [DOI] [PubMed] [Google Scholar]
- 10.Imdad A, Mayo-Wilson E, Herzer K, et al. Vitamin A supplementation for preventing morbidity and mortality in children from six months to five years of age. http://www.who.int/elena/titles/review_summaries/vitaminA-children/en. Cochrane Database Syst Rev. 2017;3:CD008524. doi: 10.1002/14651858.CD008524.pub3. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.陶 月红, 杨 毅. 维生素A与儿童抗感染免疫研究进展. https://www.wenkuxiazai.com/doc/c77b181bcc7931b765ce1509.html 国外医学儿科学分册. 2005;32(4):249–251. [Google Scholar]
- 12.吕 文清. 中剂量维生素A多次口服佐治迁延性肺炎疗效观察. https://www.wenkuxiazai.com/doc/0389ea4c2e3f5727a5e962c5.html 临床医学. 2003;23(1):10–11. [Google Scholar]
- 13.张 继山. 维生素A佐治小儿反复支气管肺炎40例疗效观察. 济宁医学院学报. 1999;22(2):55. [Google Scholar]
- 14.Mohamed MS, Mougi MTE, Mansour EH, et al. Administration of lycopene and beta-carotene decreased risks of pneumonia among children. Pakistan J Nutr. 2008;7(2):273–277. doi: 10.3923/pjn.2008.273.277. [DOI] [Google Scholar]
- 15.Rodríguez A, Hamer DH, Rivera J, et al. Effects of moderate doses of vitamin A as an adjunct to the treatment of pneumonia in underweight and normal-weight children:a randomized, double-blind, placebo-controlled trial. https://www.researchgate.net/publication/7488685_Effects_of_moderate_doses_of_vitamin_A_as_an_adjunct_to_the_treatment_of_pneumonia_in_underweight_and_normal-weight_children_A_randomized_double-blind_placebo-controlled_trial. Am J Clin Nutr. 2005;82(5):1090–1096. doi: 10.1093/ajcn/82.5.1090. [DOI] [PubMed] [Google Scholar]
- 16.Mahalanabis D, Lahiri M, Paul D, et al. Randomized, double-blind, placebo-controlled clinical trial of the efficacy of treatment with zinc or vitamin A in infants and young children with severe acute lower respiratory infection. Am J Clin Nutr. 2004;79(3):430–436. doi: 10.1093/ajcn/79.3.430. [DOI] [PubMed] [Google Scholar]
- 17.Stephensen CB, Franchi LM, Hernandez H, et al. Adverse effects of high-dose vitamin A supplements in children hospitalized with pneumonia. Pediatrics. 1998;101(5):E3. doi: 10.1542/peds.101.5.e3. [DOI] [PubMed] [Google Scholar]
- 18.Si NV, Grytter C, Vy NN, et al. High dose vitamin A supplementation in the course of pneumonia in Vietnamese children. Acta Paediatr. 1997;86(10):1052–1055. doi: 10.1111/apa.1997.86.issue-10. [DOI] [PubMed] [Google Scholar]
- 19.Nacul LC, Kirkwood BR, Arthur P, et al. Randomised, double blind, placebo controlled clinical trial of efficacy of vitamin A treatment in non-measles childhood pneumonia. BMJ. 1997;315(7107):505–510. doi: 10.1136/bmj.315.7107.505. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20.Fawzi WW, Mbise RL, Fataki MR, et al. Vitamin A supplementation and severity of pneumonia in children admitted to the hospital in Dar es Salaam, Tanzania. Am J Clin Nutr. 1998;68(1):187–192. doi: 10.1093/ajcn/68.1.187. [DOI] [PubMed] [Google Scholar]
- 21.考 验, 俞 锡林, 李 中跃. 维生素A佐治小儿肺炎疗效观察. http://doi.med.wanfangdata.com.cn/10.3969/j.issn.1006-5725.2008.05.089 浙江预防医学. 1996;8(6):39–40. [Google Scholar]
- 22.耿刚, 符州. 维生素A在儿童肺炎患病中的作用研究[D]. 重庆: 重庆医科大学, 2009.
- 23.黄 爱莲, 龙 湘鹏. 维生素A对婴幼儿肺炎的辅助治疗作用以及对免疫功能的影响. 国际医药卫生导报. 2009;15(13):77–80. doi: 10.3760/cma.j.issn.1007-1245.2009.13.034. [DOI] [Google Scholar]
- 24.马 彩云. 维生素A辅助治疗呼吸道合胞病毒性肺炎疗效观察. http://www.cnki.com.cn/Article/CJFDTotal-EBED200003035.htm 临床医学. 2000;20(3):45–46. [Google Scholar]
- 25.顾 素芳. 维生素A治疗小儿肺炎60例疗效观察. http://www.cqvip.com/qk/85550X/200105/7026512.html 中华综合医学杂志. 2001;2(5):429. [Google Scholar]
- 26.王 卫平, 谢 术明. 维生素A佐治迁延性肺炎68例疗效分析. http://d.old.wanfangdata.com.cn/Periodical/nhdxxb-yxb200301043 南华大学学报(医学版) 2003;31(1):103–104. [Google Scholar]
- 27.刘 晓红, 李 贵, 高 慧英, et al. 硒和维生素A对支原体肺炎的治疗效果观察. http://www.cnki.com.cn/Article/CJFDTotal-ERTO199704011.htm 中华儿童保健杂志. 1997;5(4):239–243. [Google Scholar]
- 28.秦 西琳. 维生素A辅佐治疗婴幼儿肺炎疗效观察. http://d.old.wanfangdata.com.cn/Periodical/gxykdx199904048 广西医科大学学报. 1999;16(4):492–493. [Google Scholar]
- 29.姚 夏娟, 顾 岚. 血清维生素A水平与儿童社区获得性肺炎相关性的初步研究. http://www.cnki.net/kcms/doi/10.14033/j.cnki.cfmr.2016.14.004.html 中外医学研究. 2016;14(14):10–12. [Google Scholar]
- 30.Amaral CT, Pontes NN, Maciel BL, et al. Vitamin A deficiency alters airway resistance in children with acute upper respiratory infection. Pediatr Pulmonol. 2013;48(5):481–489. doi: 10.1002/ppul.v48.5. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 31.丁 媛慧, 孙 中厚. 维生素A缺乏与儿童感染性疾病. 中国儿童保健杂志. 2016;24(1):48–50. doi: 10.11852/zgetbjzz2016-24-01-14. [DOI] [Google Scholar]
- 32.Swami HM, Thakur JS, Bhatia SP. Impact of mass supplementation of Vitamin A. Indian J Pediatr. 2007;74(5):443–447. doi: 10.1007/s12098-007-0074-2. [DOI] [PubMed] [Google Scholar]


