Abstract
目的
探讨不同镇静、镇痛策略对机械通气患儿的辅助治疗效果及不良反应。
方法
将80例进行机械通气且需镇静镇痛治疗的危重患儿随机分为咪达唑仑组(40例)和瑞芬太尼+咪达唑仑组(40例),采用Ramsay及FLACC量表评估镇静、镇痛效果,记录治疗期间生命体征、呼吸机参数动态变化、脏器功能指标、瑞芬太尼及咪达唑仑应用总量、机械通气时间、PICU住院时间及费用、不良反应发生情况等。
结果
2组患儿均能达到满意镇痛镇静效果。与咪达唑仑组比较,瑞芬太尼+咪达唑仑组达到镇静镇痛效果所需时间更短,Ramsay评估3~4级所占百分比增高,咪达唑仑用量降低,差异均有统计学意义(P < 0.05)。2组患儿治疗后心率、平均动脉压及自主呼吸频率均降低,但瑞芬太尼+咪达唑仑组在用药后3~24 h的心率、3~12 h的平均动脉压和自主呼吸频率下降更明显(P < 0.05)。与咪达唑仑组比较,瑞芬太尼+咪达唑仑组患儿用药后的6 h和12 h呼吸机潮气量及经皮氧饱和度均明显增高,呼气末二氧化碳水平明显降低,差异有统计学意义(P < 0.05)。瑞芬太尼+咪达唑仑组停药至苏醒的时间、拔管时间、机械通气以及PICU住院时间均明显低于咪达唑仑组(P < 0.05)。2组患儿PICU住院费用、不良反应发生率以及用药前后肝肾功能差异均无统计学意义(P > 0.05),但空腹血糖比镇静前明显降低(P < 0.05)。
结论
PICU机械通气患儿采用瑞芬太尼+咪达唑仑治疗方案能迅速达到镇痛、镇静目标,改善通气效果,减少镇静剂用量,耐受性良好。
Keywords: 瑞芬太尼, 咪达唑仑, 镇痛, 镇静, 机械通气, 重症监护病房, 儿童
Abstract
Objective
To compare the efficacy and safety of different analgesic and sedative treatments in children with mechanical ventilation in the pediatric intensive care unit (PICU).
Methods
Eighty children with mechanical ventilation in the PICU who needed analgesic and sedative treatments were equally and randomly divided into midazolam group and remifentanil+midazolam group. The sedative and analgesic effects were assessed using the Ramsay Scale and the Face, Legs, Activity, Cry and Consolability (FLACC) Scale. The following indices were recorded for the two groups:vital signs, ventilator parameters, organ function, total doses of remifentanil and midazolam, duration of mechanical ventilation, length of PICU stay, PICU cost, and incidence of adverse events.
Results
Satisfactory sedation was achieved in the two groups, but the remifentanil+midazolam group had a significantly shorter time to analgesia and sedation than the midazolam group. The remifentanil+midazolam group had a significantly higher percentage of patients with grade 3-4 on the Ramsay Scale and a significantly lower dose of midazolam than the midazolam group (P < 0.05). Both groups showed decreases in heart rate (HR), mean arterial pressure (MAP), and spontaneous breathing frequency (RRs) after treatment. However, the remifentanil+midazolam group had significantly greater decreases in HR at 3-24 hours after treatment and MAP and RRs at 3-12 hours after treatment than the midazolam group (P < 0.05). Compared with the midazolam group, the remifentanil+midazolam group had significantly higher ventilator tidal volume and transcutaneous oxygen saturation at 6 and 12 hours after treatment and significantly lower end-tidal carbon dioxide partial pressure at 6 and 12 hours after treatment (P < 0.05). The remifentanil+midazolam group had significantly shorter time to awake, extubation time, duration of mechanical ventilation, and length of PICU stay than the midazolam group (P < 0.05). There were no significant differences in PICU cost, incidence of adverse events, and hepatic and renal functions before and after treatment between the two groups (P > 0.05). Both groups showed a significant decrease in fasting blood glucose level after treatment (P < 0.05).
Conclusions
For children with mechanical ventilation in the PICU, remifentanil+midazolam treatment can rapidly achieve analgesia and sedation, improve the effect of mechanical ventilation, and reduce the dose of sedative compared with midazolam alone, and is well tolerated.
Keywords: Remifentanil, Midazolam, Analgesia, Sedation, Mechanical ventilation, Intensive Care Unit, Child
镇痛镇静治疗已成为重症监护病房(intensive care unit, ICU)以患者为整体的整合医学救治模式中重要组成部分[1]。任何引起成人疼痛的刺激均可造成儿童更强烈的痛觉[2]。气管插管、机械通气是抢救呼吸衰竭的有效方法,但也可引起疼痛、焦虑、躁动等生理、心理不良反应,进而诱发或加重机体应激反应,造成呼吸、循环、神经内分泌和免疫等多系统功能障碍。镇痛镇静治疗可提高气管插管机械通气患儿舒适度并减轻应激反应,进而降低多器官功能障碍的发生,且安全、有效[3]。瑞芬太尼作为一种新型强力选择性μ1型阿片受体激动剂,起效快且无药物累积,在成人ICU镇痛治疗中已取得良好疗效,而在儿童重症监护病房(pediatric intensive care unit, PICU)使用经验尚不足[4-5]。本文通过对比研究瑞芬太尼+咪达唑仑镇痛镇静和咪达唑仑镇静催眠的疗效及不良反应情况,为儿童镇痛镇静治疗的选择提供理论依据。
1. 资料与方法
1.1. 研究对象
选择2016年1~12月武汉儿童医院PICU收治的符合下述标准的80例患儿为研究对象,纳入标准:行机械通气且在气管插管后需镇痛镇静治疗或预防人机不协调的危重患儿。排除标准:(1)严重血流动力学不稳定或严重肝肾功能不全者;(2)镇痛镇静时间不足48 h及治疗期间行连续性血液净化治疗者;(3)Ⅱ°或以上房室传导阻滞者;(4)昏迷者[格拉斯哥昏迷评分(GCS) < 8分];(5)急性迟缓性瘫痪或接受肌肉松弛剂治疗者;(6)对阿片类及苯二氮卓类药物过敏者。
本研究获得医院伦理委员会批准及患儿家属知情同意。
1.2. 镇静镇痛效果评估
采用Ramsay镇静分级评估镇静效果[6],1级:患者焦虑、躁动不安;2级:患者合作,清醒安静;3级:患者仅对指令有反应;4级:患者入睡,轻叩眉间反应敏捷;5级:患者入睡,轻叩眉间反应迟钝;6级:患者呈深睡眠或麻醉状态。机械通气患儿理想的镇静深度为3~4级。
采用FLACC量表[6],包括表情(face)、腿部运动(legs)、活动度(activity)、哭闹(cry)、可安慰性(consolability)5个方面,评估镇痛效果,每项分值2分,总分10分,得分越高疼痛程度越重。0~3分为最佳镇痛状态。
初始每30 min对患者进行一次评估,根据评估结果调整药物剂量,直至达到满意的镇痛镇静效果;以后每隔2 h进行一次评估,调整药物维持剂量,维持镇静状态为Ramsay 3~4级水平。在治疗过程中Ramsay评估达3~4级的百分比越高镇静效果越好[7]。
1.3. 镇静镇痛方案及分组
将80例患儿按随机数字表分为2组,每组40例。(1)咪达唑仑组:以咪达唑仑(国药准字H20113433,浙江九旭药业有限公司)镇静催眠为基础,负荷量0.2 mg/kg,维持剂量以每分钟1~6 μg/kg静脉持续泵入,根据Ramsay评分3~4分的标准调整维持剂量,以每分钟1 μg/kg增减,直到理想状态。(2)咪达唑仑+瑞芬太尼组:参照文献[8]瑞芬太尼(国药准字H20030200,人福药业)起始剂量为每分钟0.05 μg/kg静脉泵入,不予负荷剂量。根据FLACC评分≤3分的标准调整泵速,以每分钟0.025 μg/kg增减,剂量达每分钟0.1 μg/kg时给予咪达唑仑镇静处理(方法同咪达唑仑组)。
1.4. 机械通气治疗
所有入选对象均予以多功能监护仪监测心率(HR)、呼吸频率(RR)及脉搏血氧饱和度(SpO2);行桡动脉穿刺置管,监测动脉收缩压(SBP)、舒张压(DBP)和平均动脉压(MAP);均在丙泊酚(2 mg/kg)静脉注射诱导下经口气管插管,连接呼吸机行机械辅助通气,同时行呼气末二氧化碳分压(PetCO2)监测。机械通气仪器均为德国MAQUET servo-i呼吸机,初设呼吸机参数如下:通气模式为压力控制通气(pressure control ventilation, PCV),氧浓度(FiO2)为40%~60%,气道峰压(PIP)为15~30 cm H2O,目标潮气量(VT/kg)维持在6~8 mL/kg,呼气末正压(PEEP)为4~5 cm H2O,RR为20~40次/min。
2组采用相同的脱机指征,包括实行每日唤醒,Ramsay评分3~4级、能通过2 h自主呼吸筛查实验者拔出气管导管。
1.5. 观察指标
记录2组患儿镇痛镇静治疗期间生命体征及呼吸机相关参数:HR、SBP、DBP、MAP、RR、潮气量、PetCO2、SpO2等,脏器功能(包括肝肾功能、心肌酶谱、电解质、空腹血糖等),小儿危重病例评分(参考文献[9]进行),镇痛镇静评分,瑞芬太尼及咪达唑仑应用时间及总量,清醒时间(停药后Ramsay评分≤3级的时间)、机械通气时间、停用镇痛镇静药物直至拔出气管导管时间、PICU住院时间及费用,不良反应发生率(如肌强直、肌无力、低血压、心动过缓、呼吸抑制/暂停、恶心呕吐、谵妄等)。
1.6. 统计学分析
采用SPSS 17.0统计软件进行数据处理。计量资料以均数±标准差(x±s)表示,组间比较采用t检验;计数资料采用百分比(%)表示,组间比较采用χ2检验。P < 0.05为差异有统计学意义。
2. 结果
2.1. 治疗前一般资料比较
2组患儿治疗前年龄、性别、体重、小儿危重病例评分、GCS评分以及基础疾病所占比例等差异均无统计学意义(P>0.05)。见表 1。
1.
2组治疗前的一般资料及临床特征比较
| 项目 | 咪达唑仑组 (n=40) |
瑞芬太尼+咪达唑仑组 (n=40) |
t(χ2)值 | P值 |
| 性别[男, 例(%)] | 28(70) | 25(62) | (0.50) | 0.48 |
| 年龄(x±s, 月) | 6±3 | 6±4 | 0.78 | 0.44 |
| 体重(x±s, kg) | 8.4±2.9 | 8.5±3.0 | 0.21 | 0.83 |
| 小儿危重病例评分(x±s) | 78±8 | 79±7 | 0.54 | 0.59 |
| 格拉斯哥昏迷评分(x±s) | 12.2±1.8 | 12.4±1.6 | 0.6 | 0.55 |
| 基础病[例(%)] | ||||
| 重症肺炎 | 23(58) | 21(52) | (0.20) | 0.65 |
| 先天性心脏病 | 11(28) | 9(22) | (0.27) | 0.60 |
| 急性呼吸窘迫综合征 | 9(22) | 8(20) | (0.07) | 0.79 |
| 哮喘持续状态 | 6(15) | 7(17.5) | (0.09) | 0.76 |
| 脓毒症 | 2(5) | 2(5) | (0.26) | 0.69 |
| 急性喉炎并喉梗阻 | 2(5) | 2(5) | (0.26) | 0.69 |
| 支气管异物 | 1(2) | 1(2) | (0.51) | 0.48 |
| 淹溺综合征 | 1(2) | 1(2) | (0.51) | 0.48 |
| 先天性喉软骨发育不良 | 1(2) | 1(2) | (0.51) | 0.48 |
| 先天性喉囊肿术后 | 1(2) | 1(2) | (0.51) | 0.48 |
2.2. 治疗效果及生命体征监测结果比较
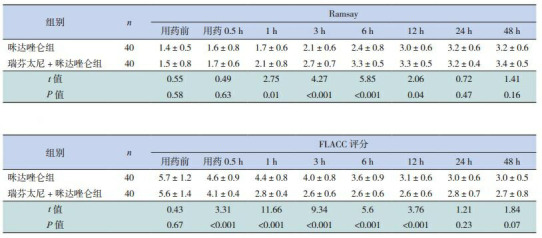
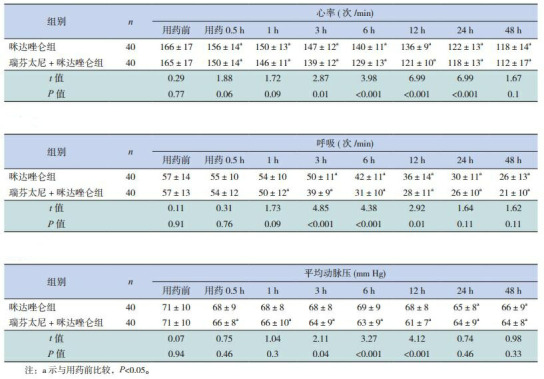
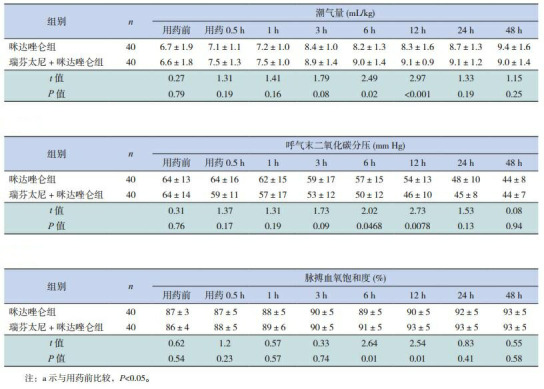
2组患儿治疗前的Ramsay分级、FLACC评分以及VT、SpO2、PETCO2、HR、RR、MAP的差异均无统计学意义(P>0.05),见表 2、3。与咪达唑仑组比较,瑞芬太尼+咪达唑仑组用药后0.5~12 h的FLACC评分均明显降低、用药后1~12 h的Ramsay评分明显增高,差异有统计学意义(P < 0.05),见表 2。与咪达唑仑组比较,瑞芬太尼+咪达唑仑组用药6 h、12 h的VT及SpO2明显增高、PetCO2水平明显降低(P < 0.05);2组患儿的HR于治疗后0.5 h起较治疗前下降;咪达唑仑组的MAP于用药后24 h、48 h,瑞芬太尼+咪达唑仑组的MAP于治疗后0.5 h起较治疗前下降;咪达唑仑组的RR于治疗后3 h起,及瑞芬太尼+咪达唑仑组的RR于治疗后1 h起较治疗前均有下降;与咪达唑仑组比较,瑞芬太尼+咪达唑仑组患儿治疗后HR(3~24 h)、MAP及RR(3~12 h)下降更明显(P < 0.05)。见表 3~4。
2.
2组患儿Ramsay分级、FLACC评分比较 (x±s)
| 组别 | n | Ramsay | FLACC评分 | |||||||||||||||
| 用药前 | 用药0.5 h | 1 h | 3 h | 6 h | 12 h | 24 h | 48 h | 用药前 | 用药0.5 h | 1 h | 3 h | 6 h | 12 h | 24 h | 48 h | |||
| 咪达唑仑组 | 40 | 1.4±0.5 | 1.6±0.8 | 1.7±0.6 | 2.1±0.6 | 2.4±0.8 | 3.0±0.6 | 3.2±0.6 | 3.2±0.6 | 5.7±1.2 | 4.6±0.9 | 4.4±0.8 | 4.0±0.8 | 3.6±0.9 | 3.1±0.6 | 3.0±0.6 | 3.0±0.5 | |
| 瑞芬太尼+咪达唑仑组 | 40 | 1.5±0.8 | 1.7±0.6 | 2.1±0.8 | 2.7±0.7 | 3.3±0.5 | 3.3±0.5 | 3.2±0.4 | 3.4±0.5 | 5.6±1.4 | 4.1±0.4 | 2.8±0.4 | 2.6±0.6 | 2.6±0.6 | 2.6±0.6 | 2.8±0.7 | 2.7±0.8 | |
| t值 | 0.55 | 0.49 | 2.75 | 4.27 | 5.85 | 2.06 | 0.72 | 1.41 | 0.43 | 3.31 | 11.66 | 9.34 | 5.6 | 3.76 | 1.21 | 1.84 | ||
| P值 | 0.58 | 0.63 | 0.01 | < 0.001 | < 0.001 | 0.04 | 0.47 | 0.16 | 0.67 | < 0.001 | < 0.001 | < 0.001 | < 0.001 | < 0.001 | 0.23 | 0.07 | ||
3.
2组患儿生命体征比较 (x±s)
| 组别 | n | 心率(次/min) | 呼吸(次/min) | 平均动脉压(mm Hg) | |||||||||||||||||||||||
| 用药前 | 用药0.5 h | 1 h | 3 h | 6 h | 12 h | 24 h | 48 h | 用药前 | 用药0.5 h | 1 h | 3 h | 6 h | 12 h | 24 h | 48 h | 用药前 | 用药0.5 h | 1 h | 3 h | 6 h | 12 h | 24 h | 48 h | ||||
| 注:a示与用药前比较,P < 0.05。 | |||||||||||||||||||||||||||
| 咪达唑仑组 | 40 | 166±17 | 156±14a | 150±13a | 147±12a | 140±11a | 136±9a | 122±13a | 118±14a | 57±14 | 55±10 | 54±10 | 50±11a | 42±11a | 36±14a | 30±11a | 26±13a | 71±10 | 68±9 | 68±8 | 68±8 | 69±9 | 68±8 | 65±8a | 66±9a | ||
| 瑞芬太尼+咪达唑仑组 | 40 | 165±17 | 150±14a | 146±11a | 139±12a | 129±13a | 121±10a | 118±13a | 112±17a | 57±13 | 54±12 | 50±12a | 39±9a | 31±10a | 28±11a | 26±10a | 21±10a | 71±10 | 66±8a | 66±10a | 64±9a | 63±9a | 61±7a | 64±9a | 64±8a | ||
| t值 | 0.29 | 1.88 | 1.72 | 2.87 | 3.98 | 6.99 | 6.99 | 1.67 | 0.11 | 0.31 | 1.73 | 4.85 | 4.38 | 2.92 | 1.64 | 1.62 | 0.07 | 0.75 | 1.04 | 2.11 | 3.27 | 4.12 | 0.74 | 0.98 | |||
| P值 | 0.77 | 0.06 | 0.09 | 0.01 | < 0.001 | < 0.001 | < 0.001 | 0.1 | 0.91 | 0.76 | 0.09 | < 0.001 | < 0.001 | 0.01 | 0.11 | 0.11 | 0.94 | 0.46 | 0.3 | 0.04 | < 0.001 | < 0.001 | 0.46 | 0.33 | |||
4.
2组患儿呼吸机参数比较
| 组别 | n | 潮气量(mL/kg) | 呼气末二氧化碳分压(mm Hg) | 脉搏血氧饱和度(%) | |||||||||||||||||||||||
| 用药前 | 用药0.5 h | 1 h | 3 h | 6 h | 12 h | 24 h | 48 h | 用药前 | 用药0.5 h | 1 h | 3 h | 6 h | 12 h | 24 h | 48 h | 用药前 | 用药0.5 h | 1 h | 3 h | 6 h | 12 h | 24 h | 48 h | ||||
| 注:a示与用药前比较,P < 0.05。 | |||||||||||||||||||||||||||
| 咪达唑仑组 | 40 | 6.7±1.9 | 7.1±1.1 | 7.2±1.0 | 8.4±1.0 | 8.2±1.3 | 8.3±1.6 | 8.7±1.3 | 9.4±1.6 | 64±13 | 64±16 | 62±15 | 59±17 | 57±15 | 54±13 | 48±10 | 44±8 | 87±3 | 87±5 | 88±5 | 90±5 | 89±5 | 90±5 | 92±5 | 93±5 | ||
| 瑞芬太尼+咪达唑仑组 | 40 | 6.6±1.8 | 7.5±1.3 | 7.5±1.0 | 8.9±1.4 | 9.0±1.4 | 9.1±0.9 | 9.1±1.2 | 9.0±1.4 | 64±14 | 59±11 | 57±17 | 53±12 | 50±12 | 46±10 | 45±8 | 44±7 | 86±4 | 88±5 | 89±6 | 90±5 | 91±5 | 93±5 | 93±5 | 93±5 | ||
| t值 | 0.27 | 1.31 | 1.41 | 1.79 | 2.49 | 2.97 | 1.33 | 1.15 | 0.31 | 1.37 | 1.31 | 1.73 | 2.02 | 2.73 | 1.53 | 0.08 | 0.62 | 1.2 | 0.57 | 0.33 | 2.64 | 2.54 | 0.83 | 0.55 | |||
| P值 | 0.79 | 0.19 | 0.16 | 0.08 | 0.02 | < 0.001 | 0.19 | 0.25 | 0.76 | 0.17 | 0.19 | 0.09 | 0.0468 | 0.0078 | 0.13 | 0.94 | 0.54 | 0.23 | 0.57 | 0.74 | 0.01 | 0.01 | 0.41 | 0.58 | |||
2.3. 其他住院指标及不良事件发生情况比较
与咪达唑仑组比较,瑞芬太尼+咪达唑仑组患儿Ramsay评估3~4级所占百分比明显增高(P < 0.05),咪达唑仑使用总量以及停药至苏醒时间、拔管时间、机械通气以及ICU住院时间均较少(P < 0.05);2组患儿PICU住院费用的差异无统计学意义(P>0.05);不良反应如低血压、心动过缓以及恶心、呕吐、谵妄、呼吸抑制、气管插管移位或脱出等在2组患儿中均有发生,但差异无统计学意义(P>0.05)。见表 5。2组患儿均无肌无力或肌强直、低血糖发生。
5.
2组患儿其他住院指标及不良反应情况比较
| 项目 | 咪达唑仑组 (n=40) |
瑞芬太尼+咪达唑仑组 (n=40) |
t(χ2)值 | P值 |
| 注:*拔管时间指停用镇痛镇静药物直至拔出气管导管的时间。 | ||||
| Ramsay评估3~4级所占百分比(%) | 66±9 | 78±6 | 7.13 | < 0.001 |
| 咪达唑仑用量(x±s, mg) | 392±40 | 303±28 | 11.48 | < 0.001 |
| 停药至苏醒时间(x±s, min) | 61±5 | 45±3 | 19.67 | < 0.001 |
| 拔管时间(x±s, min)* | 93±7 | 54±6 | 26.11 | < 0.001 |
| 机械通气时间(x±s, h) | 132±31 | 119±23 | 2.12 | 0.04 |
| PICU住院时间(x±s, h) | 192±51 | 171±38 | 2.10 | 0.04 |
| PICU住院费用(x±s, 万元) | 2.8±1.1 | 3.0±1.0 | 0.76 | 0.45 |
| 不良事件发生情况[例(%)] | ||||
| 气管插管移位或脱出 | 9(22) | 7(18) | (0.31) | 0.578 |
| 心动过缓 | 5(12) | 12(30) | (3.66) | 0.056 |
| 低血压 | 4(10) | 10(25) | (3.12) | 0.077 |
| 拔管前呼吸抑制/暂停 | 1(2) | 1(2) | (0.51) | 0.48 |
| 恶心呕吐 | 1(2) | 3(8) | (0.26) | 0.61 |
| 谵妄 | 4(10) | 2(5) | (0.18) | 0.68 |
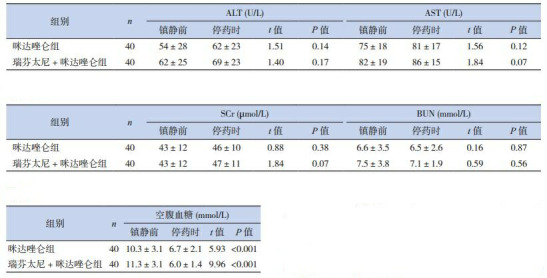
2.4. 治疗前后生化指标比较
2组患儿在镇痛镇静药物使用前后的ALT、AST、SCr、BUN差异均无统计学意义(P>0.05);但停药时2组患儿的空腹血糖比镇静前均明显降低(P < 0.05)。见表 6。
6.
2组患儿治疗前后肝肾功能比较 (x±s)
| 组别 | n | ALT (U/L) | AST (U/L) | SCr (µmol/L) | BUN (mmol/L) | 空腹血糖(mmol/L) | |||||||||||||||||||
| 镇静前 | 停药时 | t值 | P值 | 镇静前 | 停药时 | t值 | P值 | 镇静前 | 停药时 | t值 | P值 | 镇静前 | 停药时 | t值 | P值 | 镇静前 | 停药时 | t值 | P值 | ||||||
| 咪达唑仑组 | 40 | 54±28 | 62±23 | 1.51 | 0.14 | 75±18 | 81±17 | 1.56 | 0.12 | 43±12 | 46±10 | 0.88 | 0.38 | 6.6±3.5 | 6.5±2.6 | 0.16 | 0.87 | 10.3±3.1 | 6.7±2.1 | 5.93 | < 0.001 | ||||
| 瑞芬太尼+咪达唑仑组 | 40 | 62±25 | 69±23 | 1.40 | 0.17 | 82±19 | 86±15 | 1.84 | 0.07 | 43±12 | 47±11 | 1.84 | 0.07 | 7.5±3.8 | 7.1±1.9 | 0.59 | 0.56 | 11.3±3.1 | 6.0±1.4 | 9.96 | < 0.001 | ||||
3. 讨论
气管插管、机械通气及多种有创操作可导致机体产生过度应激反应,包括植物神经反应(心率增快、血压升高、氧耗增加等),激素水平改变(儿茶酚胺、胰高血糖素、皮质醇、醛固酮分泌增加,胰岛素分泌减少等)以及焦虑、恐惧和躁动等;进而增加机体氧耗,引起心肺并发症、意外脱管等不良事件发生。本研究显示,所有患儿在接受机械通气而未行镇静镇痛治疗前,其FLACC评分较高、Ramsay评分较低、空腹血糖较高,提示患儿处于过度应激反应状态;在接受镇静镇痛治疗后,FLACC评分明显降低,Ramsay评分明显增高,血糖逐渐下降,说明适当镇静镇痛可降低应激反应,确保治疗顺利进行。
相对于成人,儿童患者难以准确表达疼痛,疼痛问题易被忽视,导致镇痛镇静治疗处于相对滞后状态[2]。在早期临床治疗理念中,以咪达唑仑镇静催眠为基础的单纯镇静治疗取得一定疗效[10]。随着疼痛研究深入,认为对于ICU患者以镇痛为基础的镇痛镇静治疗策略可能疗效更佳[11-12]。
咪达唑仑是一种新型苯二氮卓类镇静药物,已在PICU镇静治疗中广泛应用[13]。瑞芬太尼是一种人工合成的新型强力选择性μ1型阿片受体激动剂,起效快(大约1 min起效),在人体内可迅速被非特异性酯酶水解,不受肝肾等器官功能影响;代谢速度快(半衰期约2~3 min),不受输注时间影响;不存在药物累积或药效消除延迟风险,可长期静脉给药,这些特征使瑞芬太尼成为成人ICU镇痛镇静治疗理想用药[4-5]。本研究提示与咪达唑仑组比较,瑞芬太尼+咪达唑仑组达镇静目标的时间明显缩短,Ramsay评估3~4级所占百分比明显增高,说明联合应用瑞芬太尼可明显缩短达到稳定镇静水平所需的时间,有利于快速减少人机对抗。Cho等[4]研究发现,与阿片类药物联合应用时咪达唑仑需求量减小,并且不随时间发生显著变化。本研究结论与之相似。联合瑞芬太尼时咪达唑仑用量明显减少,有利于降低大剂量苯二氮卓类药物导致的呼吸抑制、谵妄等不良反应[14]。
本研究结果显示,与咪达唑仑组相比,瑞芬太尼+咪达唑仑组的RR降低更明显,人机同步性更好;VT及SpO2较高、PetCO2水平较低,改善通气效果更佳;而且停药后患儿清醒时间、拔管时间、机械通气时间均明显缩短。可能主要与瑞芬太尼代谢速度快,以及联合用药使咪达唑仑用量减少有关,减少了长期插管和机械通气导致的并发症,缩短了PICU住院时间,降低了医疗费用。与Lebherz-Eichinger等研究一致[15]。
不良反应监测方面,2组在气管插管移位、脱管、拔管前呼吸抑制、恶心呕吐、谵妄等方面的差异均无统计学意义。有研究[16]表明,瑞芬太尼输注速度超过每分钟0.1 µg/kg能明显降低血浆肾上腺素水平、导致心动过缓和低血压,因此瑞芬太尼使用剂量不宜超过每分钟0.1 µg/kg。本研究中瑞芬太尼+咪达唑仑组患儿HR和MAP下降过于显著时,仅需调整瑞芬太尼输注速度即可缓解,无需停药或其他干预治疗,患儿耐受性良好。
综上所述,在PICU机械通气患儿中实行以瑞芬太尼镇痛为基础的镇静治疗方案,能迅速达到镇静镇痛目标,减少镇静剂用量,改善通气效果,缩短机械通气和PICU住院时间,值得推广应用。
Biography
蔡小芳, 女, 硕士, 主任医师
Funding Statement
武汉市临床医学科研项目(WX16E13)
References
- 1.邱 海波. 重症患者的镇痛和镇静:以疾病为导向. http://www.emedicine.org.cn/neike20135204/390143.htm. 中华内科杂志. 2013;52(4):279–281. [PubMed] [Google Scholar]
- 2.钱 素云. 镇痛镇静治疗的发展历史与现状. http://med.wanfangdata.com.cn/Paper/Detail/PeriodicalPaper_xejjyx201402001 中国小儿急救医学. 2014;21(2):65–67. [Google Scholar]
- 3.Bugedo G, Tobar E, Aguirre M, et al. The implementation of an analgesia-based sedation protocol reduced deep sedation and proved to be safe and feasible in patients on mechanical ventilation. Rev Bras Ter Intensiva. 2013;25(3):188–196. doi: 10.5935/0103-507X.20130034. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.Cho YJ, Kim TK, Hong DM, et al. Effect of desflurane-remifentanil vs. propofol-remifentanil anesthesia on arterial oxygenation during one-lung ventilation for thoracoscopic surgery:a prospective randomized trial. BMC Anesthesiol. 2017;17(1):9. doi: 10.1186/s12871-017-0302-x. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Rocco M, Conti G, Alessandri E, et al. Rescue treatment for noninvasive ventilation failure due to interface intolerance with remifentanil analgosedation:a pilot study. Intensive Care Med. 2010;36(12):2060–2065. doi: 10.1007/s00134-010-2026-y. [DOI] [PubMed] [Google Scholar]
- 6.王 荃, 钱 素云. 危重儿童常用镇静镇痛评估方法. 中国小儿急救医学. 2014;21(2):79–83. [Google Scholar]
- 7.Dahaba AA, Grabner T, Rehak PH, et al. Remifentanil versus morphine analgesia and sedation for mechanically ventilated critically ill patients:a randomized double blind study. Anesthesiology. 2004;101(3):640–646. doi: 10.1097/00000542-200409000-00012. [DOI] [PubMed] [Google Scholar]
- 8.Kato T, Koitabashi T, Ouchi T, et al. The utility of bispectral index monitoring for sedated patients treated with low-dose remifentanil. J Clin Monit Comput. 2012;26(6):459–463. doi: 10.1007/s10877-012-9379-4. [DOI] [PubMed] [Google Scholar]
- 9.任 晓旭, 宋 国维. 第3代小儿死亡危险评分和小儿危重病例评分的应用. http://med.wanfangdata.com.cn/Paper/Detail/PeriodicalPaper_syeklczz200606035 实用儿科临床杂志. 2006;21(6):382–384. [Google Scholar]
- 10.Jenkins IA, Playfor SD, Bevan C, et al. Current United Kingdom sedation practice in pediatric intensive care. Paediatr Anaesth. 2007;17(7):675–83. doi: 10.1111/pan.2007.17.issue-7. [DOI] [PubMed] [Google Scholar]
- 11.Barr J, Fraser GL, Puntillo K, et al. Clinical practice guidelines for the management of pain, agitation, and delirium in adult patients in the intensive care unit. Crit Care Med. 2013;41(1):263–306. doi: 10.1097/CCM.0b013e3182783b72. [DOI] [PubMed] [Google Scholar]
- 12.Vincent JL, Shehabi Y, Walsh TS, et al. Comfort and patient-centred care without excessive sedation:the eCASH concept. Intensive Care Med. 2016;42(6):962–971. doi: 10.1007/s00134-016-4297-4. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.Shehabi Y, Chan L, Kadiman S, et al. Sedation depth and long-term mortality in mechanically ventilated critically ill adults:a prospective longitudinal multicentre cohort study. Intensive Care Med. 2013;39(5):910–918. doi: 10.1007/s00134-013-2830-2. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Patel SB, Kress JP. Sedation and analgesia in the mechanically ventilated patient. Am J Respir Crit Care Med. 2012;185(5):486–497. doi: 10.1164/rccm.201102-0273CI. [DOI] [PubMed] [Google Scholar]
- 15.Lebherz-Eichinger D, Tudor B, Krenn CG, et al. Impact of different sedation protocols and perioperative procedures on patients admitted to the intensive care unit after maxillofacial tumor surgery of the lower jaw:A retrospective study. J Craniomaxillofac Surg. 2016;44(4):506–511. doi: 10.1016/j.jcms.2015.12.018. [DOI] [PubMed] [Google Scholar]
- 16.Wujtewicz MA, Hasak L, Twardowski P, et al. Evaluation of the relationship between baseline autonomic tone and the vagotonic effect of a bolus dose of remifentanil. Anaesthesia. 2016;71(7):823–828. doi: 10.1111/anae.2016.71.issue-7. [DOI] [PubMed] [Google Scholar]


