Abstract
目的
探讨冬凌草甲素对人急性T淋巴细胞白血病Jurkat细胞的作用及其机制。
方法
体外培养Jurkat细胞株,用不同浓度冬凌草甲素(0、1.25、2.5、5和10 μmol/L)作用Jurkat细胞不同时间(24、48、72 h),MTT实验观察细胞增殖情况,荧光显微镜观察不同浓度冬凌草甲素处理Jurkat细胞12 h后的细胞核形态变化。采用Western blot半定量法检测不同浓度冬凌草甲素作用Jurkat细胞24 h,以及5 μmol/L冬凌草甲素处理Jurkat细胞不同时间(0、2、6、12和24 h)后的Brg1、P53和C-myc蛋白表达。用siRNA沉默Jurkat细胞的Brg1,观察其对P53、C-myc蛋白表达以及对增殖的影响。
结果
与无处理组相比,冬凌草甲素对Jurkat细胞增殖有抑制作用(P < 0.05),且呈浓度和时间依赖性;荧光显微镜下发现,冬凌草甲素处理后的Jurkat细胞出现细胞核浓集、固缩等典型凋亡形态变化。与无处理组相比,5 μmol/L冬凌草甲素作用下,Jurkat细胞的Brg1和C-myc表达下降,而P53表达上升。siRNA沉默Jurkat细胞的Brg1后,P53表达升高,C-myc蛋白表达下降,细胞生长明显受抑(P < 0.05)。
结论
冬凌草甲素对Jurkat细胞生长具有抑制作用,其机制可能通过影响Brg1信号通路起作用。
Keywords: 冬凌草甲素, Brg1, P53, C-myc, 急性淋巴细胞白血病, Jurkat细胞
Abstract
Objective
To investigate the effect of oridonin on the human acute lymphocytic leukemia cell line Jurkat and its mechanism.
Methods
Jurkat cells were cultured in vitro and treated with various concentrations (0, 1.25, 2.5, 5, and 10 μmol/L) of oridonin for different lengths of time (24, 48, and 72 hours). The proliferation of Jurkat cells was analyzed by MTT assay. The changes in nuclear morphology were evaluated by fluorescence microscopy at 12 hours after treatment with various concentrations of oridonin. The expression levels of Brg1, P53, and C-myc were determined by semi-quantitative Western blot in Jurkat cells treated with various concentrations of oridonin for 24 hours or 5 μmol/L oridonin for various lengths of time (0, 2, 6, 12, and 24 hours). The expression levels of P53 and C-myc and proliferation of Jurkat cells were evaluated after Brg1 expression was knocked down by Brg1-specific siRNA.
Results
Compared with the control group, the proliferation of oridonin-treated Jurkat cells was significantly inhibited in a concentration-and time-dependent manner (P < 0.05). According to the florescence microscopic analysis, oridonin treatment led to nuclear pyknosis in Jurkat cells. Compared with the control group, Jurkat cells treated with 5 μmol/L oridonin had reduced expression of Brg1 and C-myc but elevated expression of P53. Brg1 knock-down led to a significant reduction in proliferation of Jurkat cells (P < 0.05), up-regulated expression of P53, and down-regulated expression of C-myc.
Conclusions
Oridonin can inhibit the proliferation of Jurkat cells, probably via the Brg1 signaling pathway.
Keywords: Oridonin, Brg1, P53, C-myc, Acute lymphocytic leukemia, Jurkat cell
急性淋巴细胞白血病(acute lymphoblastic leukemia, ALL)是儿童常见的血液系统肿瘤,严重威胁儿童的生命健康。目前儿童ALL治愈率达80%,但仍有20%左右的复发,且化疗副反应严重,因此探索高效低毒药物具有重要的意义[1-2]。冬凌草甲素是从唇形香茶属植物冬凌草中提取的一种四环二萜类天然有机化合物,有抗菌、清除氧自由基、抗突变等多种生物学活性,而且该成分具有较强的抗肿瘤活性,对消化系统、神经系统、泌尿生殖系统和血液系统等多种肿瘤的生长具有抑制作用[3-4]。冬凌草甲素能抑制多种白血病细胞增殖及诱导白血病细胞凋亡,与柔红霉素联合可提高对Jurkat细胞增殖的抑制作用[5]。另有研究提示,冬凌草甲素联用伊马替尼对诱导SUP-B15细胞凋亡有协同作用,其机制与抑制LYN/mTOR信号通路有关[6]。冬凌草甲素在抑制白血病中发挥重要作用,但具体机制仍不明。既往研究提示染色质重塑因子Brg1(Brahma-related gene 1)在急性白血病细胞的生长和自我更新中起重要作用[7]。因此,本实验通过观察冬凌草甲素作用于人急性T淋巴细胞白血病Jurkat细胞后Brg1蛋白表达的变化,探讨其在冬凌草甲素抑制Jurkat细胞生长增殖中的作用,为ALL治疗提供新的思路。
1. 材料与方法
1.1. 实验细胞和主要试剂
Jurkat细胞株购自中国科学院上海生命科学研究院细胞资源中心;冬凌草甲素购自西安旭煌生物公司,溶于DMSO溶剂;RPMI 1640培养基、胎牛血清和DPBS购自Gibco公司;抗Brg1抗体、Control siRNA和Bgr1 siRNA购自Santa cruz公司;抗P53抗体、抗C-myc抗体购自Cell Signaling Technology(CST)公司;抗Actin抗体购自Proteintech公司;Lipofectamine 2000脂质体转染试剂和Opti-MEM少血清培养基购自Thermo Fisher科技公司;MTT为Sigma公司产品,溶于DPBS溶液;DAPI染色液、HRP标记的山羊抗兔抗体和HRP标记的山羊抗小鼠抗体均购自碧云天公司。
1.2. 细胞培养
用含10 %胎牛血清的RPMI 1640培养液于37℃、5% CO2的饱和湿度培养箱中培养,隔天换液传代一次。
1.3. MTT法检测细胞增殖情况
Jurkat细胞按1×105/mL密度接种于96孔培养板,分为空白组(仅含培养液,无细胞成分)、无处理组(即药物浓度为0 μmol/L)和实验组,实验组参照文献[5]将冬凌草甲素终浓度设置为:1.25、2.5、5和10 μmol/L。每组设3个复孔,分别培养24、48和72 h,加入MTT溶液,4 h后加入10 % SDS过夜,用酶标仪在562 nm波长下测定吸光度(OD)值,实验重复3次。
细胞存活率(%)=(实验组OD值/无处理组OD值)×100%。无处理组和实验组的OD值均需减去空白组OD值。
1.4. DAPI染色
Jurkat细胞按1×106/mL的密度接种于12孔培养板,每孔1 mL。用终浓度1.25、2.5、5和10 μmol/L的冬凌草甲素处理12 h(每个浓度组设3个复孔),参照说明书进行DAPI荧光染色,并在200倍倒置荧光显微镜下观察细胞核形态。实验重复3次。
1.5. siRNA沉默Jurkat细胞的Brg1
将1×105/mL密度的Jurkat细胞接种于12孔培养板中,每孔2 mL,培养24 h,用Opti-MEM培养基洗涤,1 000 rpm离心后备用。A溶液(8 μL siRNA+100 μL Opti-MEM)与B溶液(8 μL Lipofectamine 2000脂质体+100 μL Opti-MEM)混合并室温孵育30 min,再与800 μL的Opti-MEM培养基混合,加入离心后的Jurkat细胞中培养6 h,再加入含20%胎牛血清的RPMI 1640培养液1 mL,继续培养24 h。实验重复3次。
1.6. Western blot法检测蛋白表达
提取各组Jurkat细胞的蛋白,BCA法测定蛋白浓度。各取50 μg蛋白样品,加入十二烷基硫酸钠-聚丙烯酰胺凝胶(SDS-PAGE)中电泳,湿转至PVDF膜上,5%脱脂奶粉常温下封闭2 h,分别孵育一抗:抗Actin抗体(1 : 2 000)、抗Brg1抗体(1 : 1 000)、抗P53抗体(1 : 1 000),抗C-myc抗体(1 : 1 000),4℃过夜,洗膜,加入二抗:HRP标记的山羊抗小鼠抗体或山羊抗兔抗体,浓度均为1 : 1 000,室温下孵育1 h,洗膜后加显影剂显影,用Image Lab 2.0.1进行条带灰度分析,目的蛋白灰度值除以内参Actin蛋白校准,再除以无处理组灰度值作为相对表达量。实验重复3次。
1.7. 统计学分析
采用SPSS 19.0软件进行数据处理。计量资料采用均数±标准差(x±s)表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验。P < 0.05表示差异有统计学意义。
2. 结果
2.1. 冬凌草甲素对Jurkat细胞增殖的影响
不同浓度(1.25、2.5、5和10 μmol/L)冬凌草甲素处理24、48或72 h后的细胞生存率均随浓度增大而降低;而且1.25 μmol/L组细胞存活率随处理时间延长而降低(P < 0.05),5 μmol/L及10 μmol/L组处理48 h、72 h后的细胞存活率低于24 h(P < 0.05)、但72 h与48 h之间的差异无统计学意义(P>0.05)。见表 1和图 1。
1.
不同浓度冬凌草甲素处理Jurkat细胞不同时间后细胞存活率的变化 (x±s,%)
| 浓度(μmol/L) | n | 24h | 48h | 72h | F值 | P值 |
| 0 | 3 | 100 | 100 | 100 | ||
| 1.25 | 3 | 97.7±4.0 | 75.3±4.4a, e | 66.7±2.8a, e, f | 52.6 | < 0.05 |
| 2.5 | 3 | 86.9±2.3a, b | 61.8±5.0a, b, e | 57.0±2.4a, b, e | 64.8 | < 0.05 |
| 5 | 3 | 43.6±0.8a, b, c | 24.9±2.3a, b, c, e | 20.9±2.9a, b, c, e | 92.2 | < 0.05 |
| 10 | 3 | 11.3±1.6a, b, c, d | 1.3±0.1a, b, c, d, e | 0.3±0.1a, b, c, d, e | 133.7 | < 0.05 |
| F值 | 933.3 | 469.8 | 1032.5 | |||
| P值 | < 0.05 | < 0.05 | < 0.05 |
1.
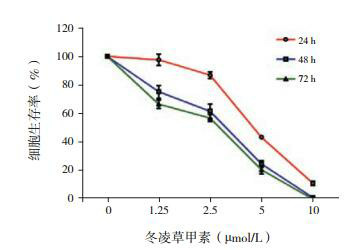
不同浓度冬凌草甲素处理不同时间对Jurkat细胞生长增殖的影响
2.2. 冬凌草甲素引起Jurkat细胞核形态变化
不同浓度冬凌草甲素处理Jurkat细胞12 h,DAPI荧光染色后进行荧光显微镜观察:无处理组(图 2A)细胞核核形完整,呈均匀蓝色荧光,细胞核固缩和染色质浓集少见;随着冬凌草甲素浓度升高细胞核固缩,提示染色质浓集的紧密蓝色荧光也增加,见图 2B-E。
2.
冬凌草甲素处理12 h后对Jurkat细胞核的影响(200×)
随着药物浓度增加,细胞核出现固缩以及染色质浓集(如箭头所指)。

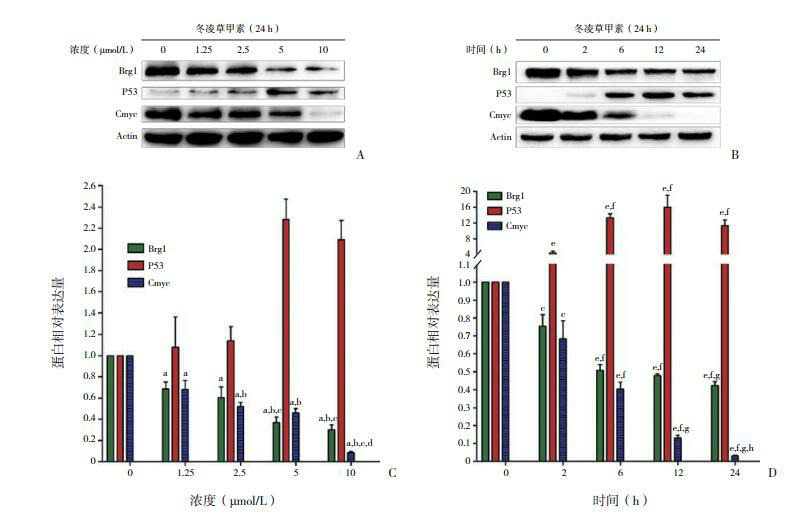
2.3. 冬凌草甲素引起Jurkat细胞内Brg1、P53和C-myc蛋白的变化
不同浓度冬凌草甲素(1.25,2.5,5和10 μmol/L)作用Jurkat细胞24 h后,Brg1、C-myc蛋白表达随着药物浓度提高呈下降趋势,P53表达则呈上升趋势(P < 0.05),见图 3A、C。5 μmol/L的冬凌草甲素处理Jurkat细胞,Brg1和C-myc表达随处理时间延长而下降,P53表达则呈上升趋势(P < 0.05),见图 3B、D。
3.
冬凌草甲素处理后Jurkat细胞的Brg1、P53、C-myc蛋白表达
A、C(n=3):不同浓度冬凌草甲素作用Jurkat细胞24 h后的蛋白变化;B、D(n=3):5 μmol/L冬凌草甲素作用Jurkat细胞不同时间后的蛋白变化。a示与同时间点0浓度组比较,P < 0.05;b示与同时间点1.25 μmol/L组比较,P < 0.05;c示与同时间点2.5 μmol/L组比较,P < 0.05;d示与同时间点5 μmol/L组比较,P < 0.05;e示与同浓度0 h组比较,P < 0.05;f示与同浓度2 h组比较,P < 0.05;g示与同浓度6 h组比较,P < 0.05;h示与同浓度12 h组比较,P < 0.05。
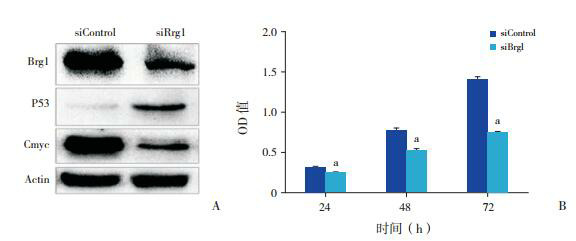
2.4. siRNA沉默Brg1对Jurkat细胞蛋白表达和生长的影响
siRNA沉默Brg1后,P53蛋白表达较对照组升高、C-myc蛋白表达下降(图 4A);细胞生长明显受抑(P < 0.05)(图 4B)。
4.
siRNA沉默Brg1对Jurkat细胞蛋白表达和生长的影响
a示与siControl比较,P < 0.05。
3. 讨论
随着诊疗水平提高,儿童ALL的5年生存率显著提高,但许多高危及复发病例仍缺乏有效治疗手段,且耐药问题成为治疗中的主要挑战之一,探寻新药迫在眉睫[8-9]。冬凌草甲素是冬凌草中提取的有效抗癌成分,对多种实体瘤和血液系统肿瘤均有抑制作用,机制可能与诱导细胞凋亡、细胞周期阻滞和自噬等有关[10-12]。
Brg1是染色质重塑复合体SWI/SNF中三磷酸腺苷(ATP)酶催化亚单位之一,SWI/SNF是基因表达的主要调节因子,在细胞周期调控、DNA修复和肿瘤的发生发展中发挥重要作用[13-14]。关于Brg1在肿瘤中的作用还存在争议。既往有研究表明,Brg1作为一个抑癌基因,在部分肿瘤细胞系和人类实体肿瘤存在突变或缺失现象[15-16]。然而,目前一些研究提示Brg1对一些肿瘤的生长必不可少,如胶质瘤、乳腺癌和血液肿瘤等[17-18]。
本研究发现,冬凌草甲素能有效抑制Jurkat细胞增殖,而且细胞核出现固缩、紧密等凋亡的典型形态,这提示冬凌草甲素可能通过诱导Jurkat细胞凋亡而抑制细胞增殖。C-myc是一种重要的原癌基因,其过度表达与多种肿瘤发生发展有关。既往研究提示Brg1促进Myc转录而维持白血病细胞的自我更新能力[7]。P53是抑癌基因,在调节细胞周期和细胞凋亡中发挥中作用。有学者发现,在乳腺癌和肾癌等细胞系中,Brg1通过与组蛋白乙酰转移酶CBP协作抑制P53的活性,从而促进肿瘤细胞增殖[19]。本实验通过siRNA技术沉默Jurkat细胞Brg1的表达后P53表达上升、C-myc表达下降,Jurkat的细胞增殖受抑。提示冬凌草甲素对Jurkat细胞的抑制可能与抑制Brg1的表达有关。
综上所述,冬凌草甲素对Jurkat细胞的生长增殖起抑制作用,机制可能与其抑制Brg1表达相关,这为急性淋巴细胞白血病的治疗提供了新的思路和治疗靶点。
Biography
叶珍珍, 女, 硕士研究生
Funding Statement
国家自然科学基金青年项目(81600645);皖南医学院中青年科研基金(WK2016F17)
References
- 1.Siegel RL, Miller KD, Jemal A. Cancer Statistics, 2017. CA Cancer J Clin. 2017;67(1):7–30. doi: 10.3322/caac.21387. [DOI] [PubMed] [Google Scholar]
- 2.林 愈灯, 宗 飒. 儿童恶性血液肿瘤性疾病诊疗进展. http://www.jebm.cn/CN/abstract/abstract1573.shtml 循证医学. 2017;17(1):25–28. [Google Scholar]
- 3.Zhao Z, Chen Y. Oridonin, a promising antitumor natural product in the chemotherapy of hematological malignancies. Curr Pharm Biotechnol. 2014;15(11):1083–1092. doi: 10.2174/1389201015666141111115608. [DOI] [PubMed] [Google Scholar]
- 4.Ding Y, Ding C, Ye N, et al. Discovery and development of natural product oridonin-inspired anticancer agents. Eur J Med Chem. 2016;122:102–117. doi: 10.1016/j.ejmech.2016.06.015. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.张 晓芬, 周 丽. 冬凌草甲素及联合柔红霉素对Jurkat细胞增殖抑制作用的观察. http://www.cqvip.com/QK/98569B/201216/43354536.html 中华肿瘤防治杂志. 2012;19(16):1227–1230. [Google Scholar]
- 6.Guo Y, Shan Q, Gong Y, et al. Oridonin in combination with imatinib exerts synergetic anti-leukemia effect in Ph+ acute lymphoblastic leukemia cells in vitro by inhibiting activation of LYN/mTOR signaling pathway. Cancer Biol Ther. 2012;13(13):1244–1254. doi: 10.4161/cbt.21460. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Shi J, Whyte WA, Zepeda-Mendoza CJ, et al. Role of SWI/SNF in acute leukemia maintenance and enhancer-mediated Myc regulation. Genes Dev. 2013;27(24):2648–2662. doi: 10.1101/gad.232710.113. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.王 慧慧, 文 飞球. 儿童急性淋巴细胞白血病治疗进展. http://www.chinaqking.com/yc/2016/594577.html 中国实用儿科杂志. 2012;27(10):791–794. [Google Scholar]
- 9.马 晶晶, 陈 月, 于 亮. 急性淋巴细胞白血病耐药机制的研究进展. http://www.cnki.com.cn/Article/CJFDTotal-XYSY201601053.htm. 中国实验血液学杂志. 2016;24(1):261–265. doi: 10.7534/j.issn.1009-2137.2016.01.050. [DOI] [PubMed] [Google Scholar]
- 10.Tian W, Chen SY. Recent advances in the molecular basis of anti-neoplastic mechanisms of oridonin. Chin J Integr Med. 2013;19(4):315–320. doi: 10.1007/s11655-013-1437-3. [DOI] [PubMed] [Google Scholar]
- 11.Yao Z, Xie F, Li M, et al. Oridonin induces autophagy via inhibition of glucose metabolism in p53-mutated colorectal cancer cells. Cell Death Dis. 2017;8(2):e2633. doi: 10.1038/cddis.2017.35. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.Xu S, Yao H, Luo S, et al. A novel potent anticancer compound optimized from a natural oridonin scaffold induces apoptosis and cell cycle arrest through the mitochondrial pathway. J Med Chem. 2017;60(4):1449–1468. doi: 10.1021/acs.jmedchem.6b01652. [DOI] [PubMed] [Google Scholar]
- 13.张 颖, 郑 燕芳. BRG1在非小细胞肺癌中的作用研究进展. 广东医学. 2016;37(21):3283–3286. doi: 10.3969/j.issn.1001-9448.2016.21.042. [DOI] [Google Scholar]
- 14.Wu Q, Lian JB, Stein JL, et al. The BRG1 ATPase of human SWI/SNF chromatin remodeling enzymes as a driver of cancer. Epigenomics. 2017;9(6):919–931. doi: 10.2217/epi-2017-0034. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.Weissman B, Knudsen KE. Hijacking the chromatin remodeling machinery:impact of SWI/SNF perturbations in cancer. Cancer Res. 2009;69(21):8223–8230. doi: 10.1158/0008-5472.CAN-09-2166. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.Lu P, Roberts CW. The SWI/SNF tumor suppressor complex:Regulation of promoter nucleosomes and beyond. Nucleus. 2013;4(5):374–378. doi: 10.4161/nucl.26654. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.Bai J, Mei PJ, Liu H, et al. BRG1 expression is increased in human glioma and controls glioma cell proliferation, migration and invasion in vitro. J Cancer Res Clin Oncol. 2012;138(6):991–998. doi: 10.1007/s00432-012-1172-8. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18.Bai J, Mei P, Zhang C, et al. BRG1 is a prognostic marker and potential therapeutic target in human breast cancer. PLoS One. 2013;8(3):e59772. doi: 10.1371/journal.pone.0059772. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.Naidu SR, Love IM, Imbalzano AN, et al. The SWI/SNF chromatin remodeling subunit BRG1 is a critical regulator of p53 necessary for proliferation of malignant cells. Oncogene. 2009;28(27):2492–2501. doi: 10.1038/onc.2009.121. [DOI] [PMC free article] [PubMed] [Google Scholar]


