Abstract
目的
探讨儿童急性播散性脑脊髓炎(ADEM)的临床特征及复发因素。
方法
回顾性分析2011年11月至2017年1月住院的73例ADEM患儿的临床资料及转归情况。
结果
73例患儿中,发病前41例(56%)有感染病史,7例(10%)有疫苗接种史。所有患儿均具有脑病表现,其中意识改变47例(64%),精神行为异常54例(74%);余以发热(53例,73%)、运动障碍(47例,64%)、头痛(47例,64%)、呕吐(40例,55%)等多见。头颅MRI检查以皮层下白质(83%,54/65)、深部核团(60%,39/65)、脑干(58%,38/65)、小脑(42%,27/65)受累多见。47%(20/43)患儿脊髓受累。随访发现共15例患儿复发。与未复发患儿比较,复发患儿更多出现深部核团受累(P < 0.05),≥ 3个脊髓节段损伤者更多见(P < 0.01),丙种球蛋白和/或激素治疗时间距起病>2周的比例更高(P < 0.05)。
结论
ADEM临床表现多样,少数患儿可复发。MRI深部核团受累、≥ 3个节段的长节段脊髓病变、丙种球蛋白和/或激素治疗时间较晚(>2周)可能与ADEM复发相关。
Keywords: 急性播散性脑脊髓炎, 临床特征, 复发, 儿童
Abstract
Objective
To study the clinical features of children with acute disseminated encephalomyelitis (ADEM) and related recurrence factors.
Methods
A retrospective analysis was performed for the clinical data and prognosis of 73 children with ADEM who were hospitalized from November 2011 to January 2017.
Results
Among the 73 children, 41 (56%) had a history of infection before onset and 7 (10%) had a history of vaccination. All children had the symptoms of encephalopathy, including disturbance of consciousness in 47 children (64%) and mental and behavioral disorders in 54 children (74%). Pyrexia was observed in 53 children (73%), dyskinesia in 47 children (64%), headache in 47 children (64%) and vomiting in 40 children (55%). Brain MRI was performed for 65 children and the results showed involvement of the subcortical white matter (83%, 54/65), the deep nuclei (60%, 39/65), the brain stem (58%, 38/65) and the cerebellum (42%, 27/65). Spinal cord involvement was observed in 20 children (20/43, 47%). A total of 15 children experienced recurrence during follow-up. Compared with the non-recurrence group, the recurrence group had signifcantly higher percentages of children with deep nucleus involvement (P < 0.05), with injury in ≥ 3 spinal segments (P < 0.01) and with a time from disease onset to gamma-globulin/hormone treatment of >2 weeks (P < 0.05).
Conclusions
ADEM in children have various clinical manifestations. A small number of children may experience recurrence. Deep nucleus involvement on MRI, long spinal segmental injury (≥ 3 segments) and late treatment with gamma-globulin/hormone (>2 weeks) may be associated with the recurrence of ADEM.
Keywords: Acute disseminated encephalomyelitis, Clinical feature, Recurrence, Child
急性播散性脑脊髓炎(acute disseminated encephalomyelitis, ADEM)是一种急性的免疫介导的中枢神经系统炎性脱髓鞘疾病,好发于儿童,目前发病机制尚不十分明确。临床特征以脑病、多灶性神经系统症状和体征为主,伴多灶性脱髓鞘病灶。大多数ADEM患儿预后良好并完全康复,但约10%~30%患儿会复发[1],最终诊断为多相性播散性脑脊髓炎(MDEM)、多发性硬化(MS)或视神经脊髓炎谱系疾病(NMOSD)。目前ADEM复发的危险因素及转归预测仍存在困难。本研究对73例首次发生多灶性临床中枢神经系统事件,并符合2012版IPMSSG标准中ADEM诊断标准[2]患儿的临床资料及转归情况进行回顾性分析,以进一步深入认识ADEM的临床特征,探讨其复发因素及转归情况。
1. 资料与方法
1.1. 研究对象
回顾性收集2011年11月至2017年1月于我院住院的152例首次发生多灶性中枢神经系统脱髓鞘患儿的临床资料,其中完全符合2012版IPMSSG修订标准中ADEM诊断标准的73例纳入本研究,并获得患儿监护人知情同意。
ADEM诊断标准包括[2]:(1)首次发作的多灶性中枢神经系统炎性脱髓鞘疾病。(2)具有不能由发热解释的脑病(意识障碍和/或精神行为异常)。(3)发病急性期(3个月内)具有异常的MRI表现,典型的MRI表现为:①弥漫性、边界模糊的较大的病灶(> 1~2 cm),且白质受累为主;②脑白质区T1低信号病灶较少见;③深部灰质病灶(如丘脑或基底节)可能受累。(4)发病3个月或以上无新发的症状、体征或MRI表现。
自起病起3个月后出现新的或旧的神经系统症状或MRI病灶定义为复发。参考2012版IPMSSG修订标准中MDEM及MS的诊断标准对复发进行临床诊断[2]。NMOSD的诊断标准参考2015版视神经脊髓炎谱系障碍国际共识[3]。而对于仅出现MRI病灶的复发,没有进一步临床事件发生的ADEM患者,目前尚无明确可归类疾病[2]。
1.2. 研究方法
对符合纳入标准的73例患儿的临床特征、辅助检查、治疗情况等进行回顾性分析,并通过返院或电话随访他们的转归及预后情况。随访时间定义为起病至最后一次随访的时间。根据患者转归情况将患儿分为单相ADEM组(未复发组)和复发组,比较两组在临床特征等方面的差异性,以探讨ADEM的复发因素。
1.3. 统计学分析
采用SPSS 19.0统计软件进行数据处理与分析。符合正态分布的数据采用均数±标准差(x±s)表示,非正态分布数据采用中位数(范围)表示。两组间正态分布的计量资料比较采用成组t检验。计数资料采用例数和百分率(%)表示,组间比较采用χ2检验。P < 0.05表示差异有统计学意义。
2. 结果
2.1. 一般资料
73例ADEM患儿中,男35例,女38例;起病年龄1岁至16岁11个月,平均年龄7±3岁。出院后随访11~69个月,平均随访时间为49±16个月。
2.2. 临床特征
73例患儿中,43例(59%)具有前驱事件,其中41例(56%)有前驱感染,7例(10%)有疫苗接种史,均在起病前3 d至1个月内发生,以起病前1周内发生较多见。
所有ADEM患儿均具有脑病表现,其中47例(64%)表现为意识改变,54例(74%)表现为精神行为异常。余以发热(53例,73%)、运动障碍(47例,64%)、头痛(47例,64%)、呕吐(40例,55%)表现较为多见。其他常见的临床表现包括自主神经功能障碍(29例,40%)、感觉障碍(26例,36%)、共济失调(26例,36%)、视神经受累症状(23例,32%)、惊厥(17例,23%)等。体格检查发现41例(56%)患儿病理征阳性,仅有24例(33%)患儿脑膜刺激征阳性。
2.3. 辅助检查结果
(1)脑脊液检查:67例患儿行脑脊液检查,19例(28%)脑脊液白细胞升高[(18~260)×106/L,中位数36×106/L],多以单核细胞升高(84%)为主;14例(21%)脑脊液蛋白升高(0.46~2.22 g/L,中位数0.73 g/L)。
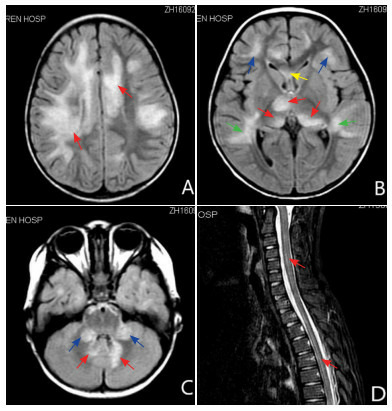
(2)影像学检查:所有患儿均完善了头颅MRI检查,但8例于外院行头颅MRI检查,仅见报告,描述为多灶性脱髓鞘病变,无原始图片溯源和分析。为便于对影像学特征进行详细分析,排除这8例患儿,选取于我院进行头颅MRI检查的65例患儿进行统计分析。其中60例(92%)的患儿表现为双侧受累。病灶边界较模糊、病灶范围较大,病灶部位常以皮层下白质(54例,83%)、丘脑及基底节等深部核团(60%,39例)、脑干(38例,58%)、小脑(27例,42%)受累较多见,而侧脑室旁白质(25例,38%)、胼胝体(17例,26%)、皮层灰质(11例,17%)、半卵圆中心(6例,9%)等部位受累相对少见。共43例患儿完成脊髓MRI检查,20例(47%)患儿有脊髓受累,主要表现为颈髓和/或胸髓受累,其中13例患儿表现为多节段受累(≥3个节段),7例患儿脊髓受累≤2个节段。截取其中几例患儿的头颅/脊髓的影像学图像,其影像学特征见图 1。
1.
ADEM患儿脑/脊髓MRI图像
A:脑MRI,FLAIR相显示双侧半卵圆中心大片状异常信号(红色箭头所示);B:脑MRI,FLAIR相显示双侧丘脑(红色箭头)、额叶皮层下白质(蓝色箭头)、脑室旁深部白质(绿色箭头)、胼胝体(黄色箭头)异常信号;C:脑MRI,FLAIR相显示双侧小脑半球(红色箭头)及小脑中脚(蓝色箭头)异常信号;D:脊髓MRI,T2相显示颈胸段脊髓长节段异常信号(红色箭头)。
(3)特异性抗体检查:24例患儿完成血及脑脊液寡克隆抗体(OB)检查,其中血清OB检查均阴性,仅4例(17%)脑脊液OB阳性。9例患儿完成血及脑脊液NMO抗体检查,均阴性。
(4)诱发电位检查:50例患儿完成视觉诱发电位(VEP)检查,其中异常者占74%,主要表现为P100波波幅降低/缺失、潜伏期延长;18例患儿完成了脑干听觉诱发电位(BEAP)检查,异常者占61%(11例),主要表现为潜伏期延长或听阈增高;29例患儿完成了体感诱发电位(SEP)检查,异常者占66%(19例),主要表现为中枢性异常。
(5)脑电图检查:60例患儿完善了脑电图检查,44例(73%)患儿脑电图异常,以非特异性θ、δ波弥漫性增多较多见,仅4患儿有痫性放电,其中3例患者有惊厥发作表现。另有6例(10%)患儿为界限性脑电图,10例(17%)患儿为正常脑电图。
2.4. 治疗
患儿首次发病后主要予糖皮质激素和/或静脉用丙种球蛋白(IVIG)冲击治疗,其中43例(59%)予IVIG联合激素治疗;22例(30%)单用激素治疗;5例(7%)单用IVIG冲击治疗。还有3例(4%)为外院诊治后转入我院患儿,因病程已超过2周,且入院时临床症状已明显好转,故未使用激素/IVIG治疗。本研究中共31例患儿因病初院外诊断不明,导致至我院明确诊断后予以激素和/或IVIG治疗的时间较晚(距起病时间 > 2周)。
2.5. ADEM预后及复发因素分析
随访时间为11~69个月(49±16个月)。随访发现1例患儿死亡,该患儿病情危重,具有严重脑病,伴惊厥、视神经炎、头痛等表现,院外予IVIG及甲强龙冲击治疗后转入我院,住院1 d家属放弃治疗,出院3 d后死亡。有2例患儿遗留神经系统后遗症,1例癫痫难以控制,1例遗留智力低下。上述3例患儿开始激素和/或IVIG治疗时间均较晚(> 2周)。
随访期间共15例(21%)患儿复发,最终4例诊断为MDEM,7例诊断为MS,2例诊断为NMOSD,余下2例目前尚无可归类疾病。复发时间为3~34个月,平均复发时间为9个月,其中14例在2年以内复发。
与单相ADEM组比较,复发组IVIG和/或激素治疗时间距起病 > 2周的比例更高(P=0.033);复发组较单相ADEM组更易出现深部核团受累(P=0.043);复发组脊髓损伤时更多表现为长节段脊髓(≥3个节段)损伤(P=0.005)。见表 1~3。
1.
单相ADEM组与复发组治疗情况的比较[n(%)]
| 变量 | 单相ADEM组(n=58) | ADEM复发组(n=15) | χ2值 | P值 |
| 治疗方式 | ||||
| 丙种球蛋白+激素 | 34(59) | 9(60) | 1.358 | 0.594 |
| 单用激素 | 16(28) | 6(40) | ||
| 单用丙种球蛋白 | 5(9) | 0(0) | ||
| 未治疗 | 3(5) | 0(0) | ||
| IVIG和/或激素治疗 距起病 > 2周 |
21(36) | 10(67) | 4.526 | 0.033 |
| 激素总疗程 < 6周 (含未使用激素) |
10(17) | 3(20) | 0.062 | 0.723 |
3.
单相ADEM组与复发组辅助检查结果的比较[%(阳性数/总数)]
| 变量 | 单相ADEM组 | ADEM复发组 | χ2值 | P值 |
| 头颅MRI | ||||
| 大病灶(> 2 cm) | 48(25/52) | 62(8/13) | 0.754 | 0.385 |
| 幕上+幕下受累 | 54(28/52) | 62(8/13) | 0.249 | 0.618 |
| 皮层下白质受累 | 81(42/52) | 92(12/13) | 0.985 | 0.439 |
| 深部核团受累 | 54(28/52) | 85(11/13) | 4.103 | 0.043 |
| 脑干受累 | 60(31/52) | 54(7/13) | 0.143 | 0.706 |
| 小脑受累 | 38(20/52) | 54(7/13) | 1.014 | 0.314 |
| 侧脑室旁白质受累 | 33(17/52) | 62(8/13) | 3.656 | 0.056 |
| 胼胝体受累 | 21(11/52) | 46(6/13) | 3.366 | 0.085 |
| 皮层灰质受累 | 19(10/52) | 8(1/13) | 0.985 | 0.439 |
| 半卵圆中心受累 | 10(5/52) | 8(1/13) | 0.046 | 1.000 |
| 脊髓MRI | ||||
| ≥3个节段受累 | 53(8/15) | 100(5/5) | 9.479 | 0.005 |
| ≤2个节段受累 | 47(7/15) | 0(0/5) | ||
| 脑脊液 | ||||
| 细胞数增多 | 25(13/52) | 40(6/15) | 1.289 | 0.332 |
| 蛋白增加 | 23(12/52) | 13(2/15) | 0.669 | 0.719 |
| 寡克隆抗体阳性 | 7(1/15) | 33(3/9) | 2.880 | 0.130 |
| 视觉诱发电位异常 | 78(28/36) | 64(9/14) | 0.954 | 0.474 |
| 脑干听觉诱发电位异常 | 75(9/12) | 33(2/6) | 2.922 | 0.141 |
| 体感诱发电位异常 | 58(14/24) | 100(5/5) | 3.180 | 0.134 |
2.
单相ADEM组与复发组临床特征的比较
| 变量 | 单相ADEM组(n=58) | ADEM复发组(n=15) | t/χ2值 | P值 |
| 发病年龄(x±s, 岁) | 7±4 | 6±2 | 1.107 | 0.272 |
| 性别[男, n(%)] | 31(53) | 4(27) | 3.425 | 0.064 |
| 前驱事件[n(%)] | 35(60) | 8(53) | 0.242 | 0.623 |
| 症状/体征[n(%)] | ||||
| 精神行为异常 | 41(71) | 13(87) | 1.580 | 0.325 |
| 发热 | 43(74) | 10(67) | 0.334 | 0.537 |
| 意识改变 | 39(67) | 8(53) | 1.005 | 0.316 |
| 运动障碍 | 39(67) | 8(53) | 1.005 | 0.316 |
| 头痛 | 38(66) | 9(60) | 0.158 | 0.691 |
| 呕吐 | 34(59) | 6(40) | 1.668 | 0.196 |
| 自主神经功能障碍 | 24(41) | 5(33) | 0.322 | 0.570 |
| 共济失调 | 19(33) | 7(47) | 1.005 | 0.316 |
| 感觉障碍 | 22(38) | 4(27) | 0.659 | 0.417 |
| 视神经受累症状 | 18(31) | 5(33) | 0.029 | 1.000 |
| 惊厥 | 13(22) | 4(27) | 0.121 | 0.739 |
| 其他颅神经受累 | 13(22) | 2(13) | 0.602 | 0.721 |
| 病理征 | 31(53) | 10(67) | 0.846 | 0.358 |
| 脑膜刺激征 | 19(43) | 5(33) | 0.002 | 1.000 |
3. 讨论
ADEM是常见的中枢神经系统脱髓鞘疾病之一,不同国家发病率有所不同,这可能与种族、环境、气候的不同有关,相关研究报道国内ADEM每年的发病率约为0.3/10万[4]。ADEM临床表现复杂多样,且轻重不一,与炎症脱髓鞘累及的部位和严重程度有关[5]。其临床症状以急性脑病伴多灶性神经功能障碍为特征,病初常有发热、头痛、呕吐等非特异性表现,随着病情进展,逐渐出现神经系统症状,如脑病、锥体征、共济失调、急性偏瘫、视神经炎或其他脑神经损害、惊厥、脊髓炎综合征及言语障碍[6-7]。
ADEM发病高峰为5~9岁,男女发病率无显著差异[4, 8]。发病前常有前驱感染或疫苗接种史,以前驱感染较多见,但并不是所有ADEM患儿都具有前驱事件,有无前驱事件并不是诊断ADEM的特异指标[9-10]。前驱事件发生的时间目前尚无定论,可以是发病前2~30 d,甚或更久[11]。本研究纳入的患儿男女比例相当,发病年龄为7±3岁,56%有前驱感染,10%有疫苗接种史,多于发病前1周内发生。
根据ADEM诊断标准,脑病(意识障碍/精神行为异常)是其诊断的必要条件。本研究纳入的所有患儿均具脑病表现。但近年来关于ADEM是否必须具有脑病表现及脑病表现如何明确界定的争议越来越多。Koelman等[12]进行的一项关于ADEM的多中心大样本研究中,将无脑病但有其他典型ADEM表现的患者纳入分析,发现符合IPMSSG诊断标准的儿童患者仅占70%。有研究回顾性分析了52例2008~2015年按照丹麦实施的临床ADEM诊断标准(脑病及多灶性神经功能障碍并不是诊断ADEM的先决条件)诊断的丹麦病人,平均随访4.5年,与IPMSSG的ADEM诊断标准对比,发现仅71%的病人有脑病,50%的病人有多灶性神经功能障碍,而完全符合IPMSSG诊断标准的患者仅占35%。因此,该学者认为目前IPMSSG的ADEM诊断标准过于严格,当MRI及其他临床特征符合ADEM时,脑病及多灶性神经系统损害支持诊断,但并不是必须的,IPMSSG诊断标准的下一次更新将需要考虑这些发现[13-14]。本研究中,除了脑病外,以发热、运动障碍、头痛、呕吐表现较为多见,其他常见的临床症状包括自主神经功能障碍、感觉障碍、共济失调、视神经受累症状、惊厥等。
ADEM各实验室检查缺乏特异性,但影像学对诊断具有重要意义。头颅MRI相比于CT扫描,其特异性和敏感性更好,是诊断ADEM及病情随访、判断预后的重要证据。典型的头颅MRI表现为双侧多灶性、非对称性长T1长T2异常信号影,病变主要累及皮层下白质、脑干、小脑、丘脑及基底节[5-6]。与以往报道一致,本研究中以皮层下白质、丘脑/基底节等深部核团、脑干、小脑受累为主。ADEM亦可累及脊髓,相关文献报道脊髓受累率为11%~28%,通常累及颈胸髓[15]。而本研究中脊髓病变率高达47%,这可能与患者选择性完善脊髓检查有关,即更多是在临床考虑可能有脊髓病变情况下再行脊髓MRI检查,导致阳性率明显升高。
目前尚无ADEM标准治疗方案,目前公认的首选治疗方案是糖皮质激素及IVIG冲击治疗[6]。本研究中ADEM患者经正规治疗后,大多预后良好,仅3例患儿预后差,这3例患儿治疗时间均较晚,提示免疫治疗的时机对预后有重要影响,但还需进一步研究进行验证。
对ADEM复发危险因素的探讨一直是研究的热点,早在2004年Mikaeloff等[16]就对脱髓鞘疾病的复发危险因素进行探讨,发现MRI病变累及脊髓与疾病复发相关。陈小青等[17]回顾性分析34例ADEM患儿,发现视觉诱发电位异常、发病距大剂量糖皮质激素治疗时间延迟可能是ADEM复发的高危因素。Suppiej等[1]研究发现,脑脊液OB阳性及VEP异常可能是MDEM患儿慢性病程的早期征兆。还有研究发现,MRI幕下病变(小脑、脑干)、深部灰质受累患儿更有可能发生第二次脱髓鞘事件[18-19]。本研究经对比分析发现,≥3个节段的长节段脊髓受累、深部核团受累,以及IVIG和/或激素治疗的时间距起病 > 2周者更容易复发。
近年来越来越多的研究探讨髓鞘少突胶质细胞糖蛋白(MOG)抗体在ADEM中的作用。Duignan等[20]研究报道约64.3% ADEM患儿血清MOG抗体阳性,而在复发ADEM患儿中,血清MOG抗体阳性率高达96%,提示MOG抗体亦可能是ADEM复发的危险因素。
综上所述,ADEM并不是一种罕见的脱髓鞘疾病,当临床出现急性脑病症状及多灶性神经功能障碍时,需高度警惕此病,但当不具有典型脑病,而具有其他ADEM的典型表现是否可诊断为ADEM还需进一步探讨。目前就ADEM复发的危险因素尚无明确定论,不同研究得出的结果有所不同。本研究经对比分析发现,MRI深部核团受累、≥3个节段的长节段脊髓病变、IVIG和/或激素治疗时间较晚(> 2周)可能与ADEM复发相关,但尚需更多大样本的研究深入探讨ADEM复发的危险因素。
Biography
阮进, 女, 硕士, 住院医师
Funding Statement
重庆市卫生局医学科学技术研究项目(2012-2-086)
References
- 1.Suppiej A, Vittorini R, Fontanin M, et al. Acute disseminated encephalomyelitis in children:focus on relapsing patients. Pediatr Neurol. 2008;39(1):12–17. doi: 10.1016/j.pediatrneurol.2008.03.009. [DOI] [PubMed] [Google Scholar]
- 2.Krupp LB, Tardieu M, Amato MP, et al. International Pediatric Multiple Sclerosis Study Group criteria for pediatric multiple sclerosis and immune-mediated central nervous system demyelinating disorders:revisions to the 2007 definitions. Mult Scler. 2013;19(10):1261–1267. doi: 10.1177/1352458513484547. [DOI] [PubMed] [Google Scholar]
- 3.Wingerchuk DM, Banwell B, Bennett JL, et al. International consensus diagnostic criteria for neuromyelitis optica spectrum disorders. Neurology. 2015;85(2):177–189. doi: 10.1212/WNL.0000000000001729. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.Xiong CH, Yan Y, Liao Z, et al. Epidemiological characteristics of acute disseminated encephalomyelitis in Nanchang, China:a retrospective study. BMC Public Health. 2014;14:111. doi: 10.1186/1471-2458-14-111. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Giri PP, Bhattyacharya S, Das D, et al. Acute disseminated encephalomyelitis:a clinical and neuroradiological profile of pediatric patients. Neurol India. 2016;64(6):1187–1192. doi: 10.4103/0028-3886.193808. [DOI] [PubMed] [Google Scholar]
- 6.Pohl D, Alper G, Van Haren K, et al. Acute disseminated encephalomyelitis:updates on an inflammatory CNS syndrome. http://www.tandfonline.com/servlet/linkout?suffix=CIT0056&dbid=16&doi=10.1080%2F09297049.2017.1339785&key=10.1212%2FWNL.0000000000002825. Neurology. 2016;87(9 Suppl 2):S38–S45. doi: 10.1212/WNL.0000000000002825. [DOI] [PubMed] [Google Scholar]
- 7.Wender M. Acute disseminated encephalomyelitis (ADEM) J Neuroimmunol. 2011;231(1-2):92–99. doi: 10.1016/j.jneuroim.2010.09.019. [DOI] [PubMed] [Google Scholar]
- 8.Pohl D. Epidemiology, immunopathogenesis and management of pediatric central nervous system inflammatory demyelinating conditions. Curr Opin Neurol. 2008;21(3):366–372. doi: 10.1097/WCO.0b013e3282fd172b. [DOI] [PubMed] [Google Scholar]
- 9.Karussis D, Petrou P. The spectrum of post-vaccination inflammatory CNS demyelinating syndromes. Autoimmun Rev. 2014;13(3):215–224. doi: 10.1016/j.autrev.2013.10.003. [DOI] [PubMed] [Google Scholar]
- 10.Young NP, Weinshenker BG, Lucchinetti CF. Acute disseminated encephalomyelitis:current understanding and controversies. Semin Neurol. 2008;28(1):84–94. doi: 10.1055/s-2007-1019130. [DOI] [PubMed] [Google Scholar]
- 11.Steiner I, Kennedy PG. Acute disseminated encephalomyelitis:current knowledge and open questions. J Neurovirol. 2015;21(5):473–479. doi: 10.1007/s13365-015-0353-z. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.Koelman DL, Chahin S, Mar SS, et al. Acute disseminated encephalomyelitis in 228 patients:a retrospective, multicenter US study. Neurology. 2016;86(22):2085–2093. doi: 10.1212/WNL.0000000000002723. [DOI] [PubMed] [Google Scholar]
- 13.Hardy TA. How should we diagnose acute disseminated encephalomyelitis? Dev Med Child Neurol. 2018;60(11):1070. doi: 10.1111/dmcn.2018.60.issue-11. [DOI] [PubMed] [Google Scholar]
- 14.Boesen MS, Blinkenberg M, Koch-Henriksen N, et al. Implications of the International Paediatric Multiple Sclerosis Study Group consensus criteria for paediatric acute disseminated encephalomyelitis:a nationwide validation study. Dev Med Child Neurol. 2018;60(11):1123–1131. doi: 10.1111/dmcn.2018.60.issue-11. [DOI] [PubMed] [Google Scholar]
- 15.Javed A, Khan O. Acute disseminated encephalomyelitis. Handb Clin Neurol. 2014;123:705–717. doi: 10.1016/B978-0-444-53488-0.00035-3. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.Mikaeloff Y, Adamsbaum C, Husson B, et al. MRI prognostic factors for relapse after acute CNS inflammatory demyelination in childhood. http://d.old.wanfangdata.com.cn/NSTLQK/10.1093-brain-awh218/ Brain. 2004;127(Pt 9):1942–1947. doi: 10.1093/brain/awh218. [DOI] [PubMed] [Google Scholar]
- 17.陈 小青, 王 治平, 江 帆. 急性播散性脑脊髓炎临床特征及复发因素分析. http://cdmd.cnki.com.cn/Article/CDMD-10248-1016789936.htm 华南国防医学杂志. 2014;28(11):1076–1079. [Google Scholar]
- 18.Kariyawasam S, Singh RR, Gadian J, et al. Clinical and radiological features of recurrent demyelination following acute disseminated encephalomyelitis (ADEM) Mult Scler Relat Disord. 2015;4(5):451–456. doi: 10.1016/j.msard.2015.06.013. [DOI] [PubMed] [Google Scholar]
- 19.Verhey LH, Branson HM, Shroff MM, et al. MRI parameters for prediction of multiple sclerosis diagnosis in children with acute CNS demyelination:a prospective national cohort study. Lancet Neurol. 2011;10(12):1065–1073. doi: 10.1016/S1474-4422(11)70250-2. [DOI] [PubMed] [Google Scholar]
- 20.Duignan S, Wright S, Rossor T, et al. Myelin oligodendrocyte glycoprotein and aquaporin-4 antibodies are highly specifc in children with acquired demyelinating syndromes. Dev Med Child Neurol. 2018;60(9):958–962. doi: 10.1111/dmcn.13703. [DOI] [PubMed] [Google Scholar]


