Abstract
目的
探讨新生儿百日咳抗菌药物的可选方案,阐明致病株的抗原基因型。
方法
以2013年5月至2018年7月分离到的32株新生儿百日咳鲍特菌为研究对象。采用E-test法检测红霉素、磺胺甲基异噁唑-甲氧苄啶(SMZ)、氨苄西林等共18种抗菌药物的最低抑菌浓度(MIC);扩增分离株23S rRNA基因并测序,检测红霉素耐药基因的突变位点,分析菌株抗原相关的7个基因型(ptxA、ptxC、ptxP、prn、fim2、fim3和tcfA)。
结果
25株(25/32,78%)百日咳鲍特菌对红霉素、阿奇霉素、克拉霉素、克林霉素的MIC值均>256 mg/L,且23S rRNA基因均有红霉素耐药A2047G突变。所有菌株对SMZ的MIC值均≤ 0.064 mg/L。氨苄西林、阿莫西林、阿莫西林‐克拉维酸和头孢曲松的MIC值波动在0.032~1 mg/L。大环内酯类耐药菌株的抗原基因型均为ptxA1/ptxC1/ptxP1/prn1/fim2-1/fim3-1/tcfA2。
结论
新生儿百日咳鲍特菌对大环内酯类抗菌药物耐药常见,体外试验支持超说明书使用磺胺类抗菌药物是治疗大环内酯类耐药的新生儿百日咳的可靠方案。耐药菌流行更加强调了免疫预防的重要性。
Keywords: 百日咳, 耐药性, 抗菌药物, 新生儿
Abstract
Objective
To investigate the alternative antimicrobial drugs for the treatment of neonatal pertussis and the antigen genotypes of Bordetella pertussis (B. pertussis) strains.
Methods
A total of 32 B. pertussis strains isolated from neonates between May 2013 and July 2018 were used in this study. E-test stripes were used to measure the minimal inhibitory concentration (MIC) of 18 antimicrobial drugs including erythromycin, sulfamethoxazole-trimethoprim (SMZ) and ampicillin. The 23S rRNA gene of isolated strains was amplifed and sequenced to identify the mutation site of erythromycin resistance gene, and the seven antigen genotypes of B. pertussis strains (ptxA, ptxC, ptxP, prn, fm2, fm3 and tcfA2) were analyzed.
Results
Of the 32 B. pertussis strains, 25 (78%) were resistant to erythromycin, azithromycin, clarithromycin and clindamycin, with an MIC of >256 mg/L, and A2047G mutation was observed in the 23S rRNA gene. All strains had an MIC of ≤ 0.064 mg/L for SMZ. The MIC of ampicillin, amoxicillin, amoxicillin-clavulanic acid and ceftriaxone ranged from 0.032 to 1 mg/L. The strains resistant to macrolide antibiotics had an antigen genotype of ptxA1/ptxC1/ptxP1/prn1/fm2-1/fm3-1/tcfA2.
Conclusions
B. pertussis strains from neonates are often resistant to macrolides, and the in vitro test shows that off-label use of sulfonamides is a reliable regimen for the treatment of neonates with macrolide-resistant pertussis. The prevalence of drug-resistant strains further emphasizes the importance of immunoprophylaxis.
Keywords: Pertussis, Drug resistance, Antimicrobial drug, Neonate
百日咳主要由百日咳鲍特菌感染引起。自20世纪40年代起百日咳疫苗已开始推广使用,但至今百日咳仍是威胁全球公共健康的重要疾病[1-2]。20世纪90年代开始很多高疫苗接种率发达国家(如美国、澳大利亚等)报道百日咳再现。百日咳再现过程中,发现百日咳感染群体主要是未接种或未完成全程免疫的婴儿,以及年长儿和成人,后者还常常是婴幼儿的重要感染源。有研究指出百日咳鲍特菌对疫苗的适应性变化是百日咳再现的原因之一[3]。多个国家报道临床分离株出现与疫苗株不同的抗原基因型,如ptxA1、ptxP3、prn2等[4-6]。既往研究显示近几年国内临床分离的百日咳菌株抗原基因型主要为ptxA1/ptxC1/ptxP1/prn1/fim2-1/fim3-1/tcfA2,仅ptxA1与疫苗株(ptxA2)不同,且对大环内酯类抗菌药物耐药常见[1]。大环内酯类抗菌药物一直是预防及治疗百日咳的首选药物。二线药物——磺胺不推荐新生儿等小婴儿使用。新生儿可选用的其他抗菌药物种类也有限,且患百日咳有致命风险。因此,有必要及早探索有效治疗新生儿百日咳的抗菌药物备选方案。
1. 资料与方法
1.1. 菌株来源
本研究32株百日咳鲍特菌均分离自2013年5月至2018年7月北京儿童医院新生儿科疑诊的32例百日咳患儿。患儿年龄范围为7~30 d,年龄中位数为25 d;其中男20例,女12例。
1.2. 菌株的分离培养及鉴定
采集鼻咽拭子后,立即接种至百日咳鲍特菌选择培养基,置于37℃恒温箱孵育3~5 d,每日观察细菌生长情况。挑取圆形、光滑、隆起、带珠光、不透明的可疑菌落,使用百日咳鲍特菌、副百日咳鲍特菌特异抗血清(英国Remel Europe公司)观察玻片凝集反应,前者阳性、后者阴性鉴定为百日咳鲍特菌。分离纯化的菌株冻存在磁珠式菌种保存管(加拿大PRO-LAB Microbank公司)中,-60℃低温冰箱贮存。
1.3. 抗菌药物敏感性实验
采用E-test纸条法检测临床分离株对红霉素、阿奇霉素、克拉霉素、克林霉素、磺胺甲基异噁唑-甲氧苄啶(SMZ)、环丙沙星、左氧氟沙星、氨苄西林、阿莫西林、阿莫西林-克拉维酸、头孢曲松、亚胺培南、美罗培南、庆大霉素、妥布霉素、阿米卡星、四环素和利福平共18种抗菌药物的敏感性。细菌培养96 h后读取抗菌药物最低抑菌浓度(MIC)值。以金黄色葡萄球菌标准株ATCC29213作为质控菌株(美国模式培养物集存库)。由于美国临床和实验室标准协会(CLSI)和欧盟药敏试验委员会(EUCAST)没有百日咳鲍特菌的抗菌药物敏感性判定标准,药敏结果以MIC50、MIC90和MIC范围显示,同时借用流感嗜血杆菌和大肠埃希菌的CLSI和EUCAST标准分析百日咳鲍特菌对抗菌药物的敏感性。
1.4. 基因分型及23S rRNA基因检测
采用DNA提取试剂盒(北京赛百盛基因技术有限公司)提取百日咳鲍特菌DNA,实验步骤参照说明书革兰阴性菌提取方法。采用聚合酶链反应(PCR)扩增ptxA、ptxC、ptxP、prn、fim2、fim3和tcfA 7个毒力相关基因型,采用BLAST软件比对扩增产物序列与相应分型标准序列,判定致病株型别。同时PCR扩增红霉素耐药基因(23S rRNA),并与标准序列(Genbank序列号:X68323)进行比对,分析突变位点。PCR扩增测序引物参见文献[1]。
1.5. 统计学分析
采用SPSS 17.0和WHONET 5.3软件对数据进行统计学分析。计数资料以例数或率(%)表示。
2. 结果
2.1. 抗菌药物的敏感性
32株新生儿百日咳致病株对18种抗菌药物的MIC50、MIC90和MIC范围见表 1,红霉素、SMZ、左氧氟沙星、阿莫西林、庆大霉素和四环素的详细MIC值分布见图 1。大环内酯类抗菌药物(红霉素、阿奇霉素)对25株(25/32,78%)百日咳鲍特菌完全没有抑制作用,其余7株(21.9%)MIC值很低(≤0.064 mg/L),参考流感嗜血杆菌的标准可判定为敏感。
1.
32株百日咳鲍特菌的抗菌药物敏感性检测结果
| 抗菌药物 | MICs (mg/L) | 参考流感嗜血杆菌界值的敏感率(%) | 参考大肠埃希菌界值的敏感率(%) | ||||||
| MIC50 | MIC90 | MIC范围 | CLSI | EUCAST | CLSI | EUCAST | |||
| 注:[SMZ]磺胺甲基异噁唑-甲氧苄啶;[MIC]最低抑菌浓度;[CLSI]美国临床和实验室标准协会;[EUCAST]欧盟药敏试验委员会。 | |||||||||
| 红霉素 | > 256 | > 256 | 0.032~ > 256 | - | 21.9 | - | - | ||
| 阿奇霉素 | > 256 | > 256 | 0.016~ > 256 | 21.9 | 21.9 | 21.9 | 21.9 | ||
| 克拉霉素 | > 256 | > 256 | 0.25~ > 256 | 21.9 | 21.9 | - | - | ||
| 克林霉素 | > 256 | > 256 | 0.25~ > 256 | - | - | - | - | ||
| SMZ | 0.032 | 0.064 | 0.002~0.064 | 100 | 100 | 100 | 100 | ||
| 环丙沙星 | 1 | 2 | 1~2 | 75.0 | 0 | 75.0 | 0 | ||
| 左氧氟沙星 | 0.25 | 0.5 | 0.125~2 | 100 | 96.9 | 100 | 96.9 | ||
| 氨苄西林 | 0.125 | 0.25 | 0.032~0.5 | 100 | 100 | 100 | 100 | ||
| 阿莫西林 | 0.5 | 0.5 | 0.25~1 | - | 100 | - | 100 | ||
| 阿莫西林-克拉维酸 | 0.25 | 0.5 | 0.125~0.5 | 100 | 100 | 100 | 100 | ||
| 头孢曲松 | 0.125 | 0.25 | 0.064~0.5 | 100 | 78.1 | 100 | - | ||
| 亚胺培南 | 32 | 32 | 2~32 | 43.8 | 31.3 | 31.3 | 31.3 | ||
| 美罗培南 | 0.064 | 0.125 | 0.004~0.25 | 100 | 100 | 100 | 100 | ||
| 四环素 | 4 | 32 | 1~64 | 46.9 | 40.6 | 59.4 | - | ||
| 利福平 | 8 | 16 | 4~16 | 0 | - | - | - | ||
| 庆大霉素 | 0.5 | 1 | 0.25~1 | - | - | 100 | 100 | ||
| 妥布霉素 | 1 | 1 | 0.25~1 | - | - | 100 | 100 | ||
| 阿米卡星 | 4 | 8 | 2~8 | - | - | 100 | 100 | ||
1.
32株百日咳鲍特菌对6种抗菌药物的MIC值分布
[SMZ]磺胺甲基异噁唑-甲氧苄啶。
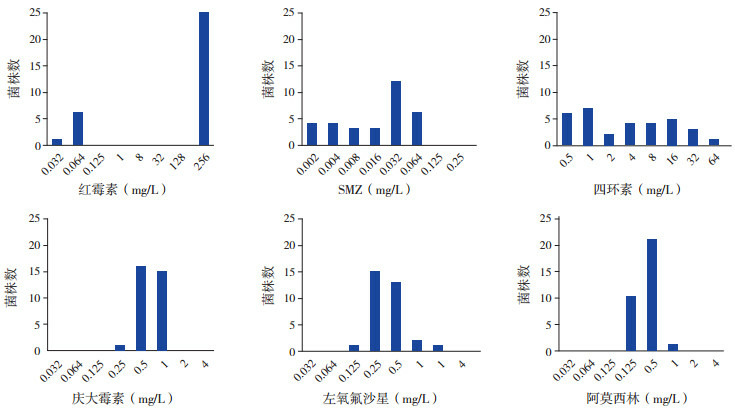
SMZ的最大MIC值为0.064 mg/L。氨苄西林、阿莫西林、阿莫西林‐克拉维酸和头孢曲松的MIC值相似,MIC90波动在0.25~0.5 mg/L,MIC最大值波动在0.5~1 mg/L。参考流感嗜血杆菌EUCAST界值,除头孢曲松外,32例新生儿百日咳临床分离株对其他β-内酰胺类抗菌药物(氨苄西林、阿莫西林及阿莫西林-克拉维酸)均敏感。环丙沙星和左氧氟沙星的MIC值差别明显,MIC90分别为2 mg/L和0.5 mg/L。四环素和利福平对百日咳鲍特菌没有明显抑菌作用。三种氨基糖甙类抗菌药物中,庆大霉素、妥布霉素的MIC值(0.25~1 mg/L)比阿米卡星(2~8 mg/L)要低。根据大肠埃希菌CLSI和EUCAST的判定标准,所有菌株对三种氨基糖甙类抗菌药物均敏感。
2.2. 23S rRNA基因分析
所有红霉素耐药分离株(> 256 mg/L)检测到23S rRNA A2047G突变,其余MIC≤0.064 mg/L的7株菌没有检测到该突变。
2.3. 基因型
32株百日咳鲍特菌的抗原基因型分布见表 2。全部分离株的ptxA、fim2、tcfA型别均一致,分别为ptxA1、fim2-1、tcfA2。根据其他4种抗原的等位基因可分为3种抗原基因型,其中主要基因型为ptxA1/ptxC1/ptxP1/prn1/fim2-1/fim3-1/tcfA2,占78%(25/32)。ptxP3型菌株共检出7株,所有ptxP3型菌株均同时携带ptxC2/prn2基因,1株ptxP3菌株携带fim3-3基因。7株ptxP3型菌株的红霉素MIC值均≤0.064 mg/L,所有ptxP1型菌株的红霉素MIC值均 > 256 mg/L,提示不同ptx P型菌株对大环内酯类抗菌药物的耐药情况不同。
2.
32株百日咳鲍特菌的抗原基因型与红霉素MIC值的分布
| 基因型 | 百日咳鲍特菌[例(%)] | 红霉素MIC (mg/L) |
| ptxA1/ptxC1/ptxP1/prn1/fim2-1/fim3-1/tcfA2 | 25(78) | > 256 |
| ptxA1/ptxC2/ptxP3/prn2/fim2-1/fim3-1/tcfA2 | 6(19) | ≤0.064 |
| ptxA1/ptxC2/ptxP3/prn2/fim2-1/fim3-3/tcfA2 | 1(3) | 0.064 |
3. 讨论
本研究从新生儿中共分离出32株百日咳鲍特菌,菌株数虽然有限,但其意义非常重要。这不但确证当前存在新生儿百日咳病例,而且,因新生儿生活方式特殊,间接证明了成人百日咳的客观存在。文献[7]显示,成年人至婴幼儿的传播模式是百日咳家庭聚集发病的主要传播模式。
美国2012~2016年间,每年死于百日咳者6~20例,绝大多数都是未接种百日咳疫苗的小婴儿[8]。我国近年也有新生儿百日咳死亡的病例报告[9]。本研究中确诊的32例百日咳患儿中,死亡1例,提示对新生儿百日咳应高度重视。研究显示,妊娠后期母亲接种百日咳疫苗可为新生儿提供一定免疫保护[10]。我国调查显示,孕妇及新生儿百日咳毒素抗体水平普遍很低,免疫策略有待改进[11]。
虽然CLSI和EUCAST没有百日咳鲍特菌对抗菌药物敏感性的判定标准,但不影响本研究中大环内酯类抗菌药物耐药的判断,所有耐药菌株MIC值均 > 256 mg/L,提示大环内酯类抗菌药物完全不能抑制这部分百日咳鲍特菌的生长。且所有大环内酯类耐药菌株均检测到23S rRNA基因发生A2047G耐药突变,和国内外既往研究结果相同[1]。
大环内酯类抗菌药物是治疗及预防百日咳的首选药物[12],耐药株的流行对此提出了挑战。本研究中,31%(10/32)的患儿在采集鼻咽拭子前已使用大环内酯类抗菌药物治疗,其中1例患儿大环内酯类治疗已超过7 d,但仍可分离出百日咳鲍特菌,提示大环内酯类可能不能有效清除患儿体内的耐药菌。
SMZ是治疗百日咳的二线药物[12],本研究中体外试验也显示其对百日咳鲍特菌仍具有较强抑菌作用,但SMZ不推荐用于新生儿及小于2月龄婴儿,因其易形成肾小管结晶,还可能会增加胆红素脑病的危险性。但根据本研究体外试验结果,对于大环内酯类耐药的百日咳鲍特菌感染,应考虑超说明书使用SMZ治疗的问题,根据已有推荐意见可以获得可靠的治疗效果。目前分离株大环内酯类耐药已经相当多见,应积极开展相关临床研究进行评估使用SMZ的可行性。
β-内酰胺类抗菌药物并不是治疗百日咳的推荐药物。既往认为β-内酰胺类抗菌药物用药后呼吸道局部药物浓度较低,可能不能有效清除细菌[12]。实际上20世纪80年代曾有部分权威专家提出氨苄西林可用于治疗百日咳[13]。Islur等[14]的研究显示36例使用氨苄西林治疗的患儿疗效不如131例红霉素治疗的患儿,但氨苄西林治疗8 d后只有8例仍可分离培养出百日咳鲍特菌。Trollfors [15]的研究显示口服阿莫西林(每日25~35 mg/kg)治疗14~17 d后,13例复查的患儿中仍有5例培养阳性。这些研究证实β-内酰胺类抗菌药物的治疗效果虽不如红霉素,但确有清除细菌的作用,Simon等[16]的研究显示氨苄西林(每日100 mg/kg)口服治疗7 d可达到满意效果。既往研究表明氨苄西林的唾液浓度可达0.2~0.7 mg/L[17],比本研究测得的MIC值要高,提示其用于临床百日咳的治疗应可取得一定的治疗效果。但是,β-内酰胺类抗菌药物用于治疗百日咳有几个问题亟待解决。第一,β-内酰胺类抗菌药物用于治疗百日咳的剂量。参考流感嗜血杆菌的CLSI和EUCAST标准,百日咳鲍特菌对阿莫西林、阿莫西林-克拉维酸、氨苄西林和头孢曲松均敏感。但百日咳鲍特菌的MIC值比既往报道的敏感流感嗜血杆菌的MIC值高,如头孢曲松抗流感嗜血杆菌的MIC50及MIC90分别为0.016 mg/L、0.047 mg/L,而本研究中头孢曲松抗百日咳鲍特菌的MIC50及MIC90分别为0.125 mg/L、0.25 mg/L,较高的MIC值可能意味着临床使用剂量需增大。第二,β-内酰胺类抗菌药物的疗程并不清楚,需要开展研究。Hoppe等[13]的研究表明常规剂量治疗7~14 d的效果较大环内酯类抗菌药物差,提示β-内酰胺类抗菌药物需要更长疗程。第三,不同β-内酰胺类抗菌药物的治疗效果可能存在差异。本研究中亚胺培南和美罗培南的MIC值分布及敏感率差异较大,提示临床治疗效果可能存在差异。
有关使用氨基糖甙类、四环素类抗菌药物及利福平治疗百日咳的研究很少。庆大霉素抗流感嗜血杆菌的敏感和耐药界值分别为≤0.2 mg/L和≥0.8 mg/L[18],而本研究中庆大霉素抗百日咳鲍特菌的MIC50和MIC90分别为0.5 mg/L、1 mg/L,数值较高,但根据大肠埃希菌(新生儿呼吸道感染的常见致病菌)的判定界值,菌株对氨基糖甙类抗菌药物均敏感。这些药物是否可用于百日咳治疗尚需进一步研究。成人百日咳患者可选择喹诺酮类抗菌药物治疗[12]。本研究结果显示根据流感嗜血杆菌的判定标准,所有菌株对左氧氟沙星敏感,可作为成人患者或密切接触者的可选药物,及时阻断病原传播。需要注意的是,本研究显示环丙沙星和左氧氟沙星的MIC值及敏感性分布明显不同。Ohtsuka等[19]在日本发现6株萘啶酸耐药的百日咳菌株,这几株菌对诺氟沙星、环丙沙星、司帕沙星、左氧氟沙星和加替沙星的敏感性下降,需持续关注。
除ptxA外,大多数临床菌株的抗原基因型与我国疫苗株相同,为ptxC1/ptxP1/prn1/fim2-1/fim3-1/tcfA2,疫苗株为ptxA1型,临床菌株为ptxA2型,与既往报告相符[1]。本研究共检出7株ptxP3型菌株(22%),所有的ptxP3型菌株对大环内酯类抗菌药物敏感,而ptxP1型菌株对大环内酯类抗菌药物耐药。这也解释了美国、欧洲和澳大利亚目前没有红霉素耐药株流行的原因,与其流行菌株为ptxP3型有关[20-21]。
本研究菌株数量较少,也只是一家单位的数据。但是本研究确证我国当前有新生儿百日咳,其感染来源分析可间接证明成人百日咳的客观存在,需要引起临床重视。新生儿百日咳致病株对大环内酯类抗菌药物耐药常见,抗菌药物选择面临挑战。本研究中将目前新生儿科可能用到的抗菌药物均进行了体外试验检测,为进一步深入研究打下了基础。本研究体外试验支持超说明书使用磺胺类抗菌药物是治疗大环内酯类耐药的新生儿百日咳的可靠方案。另一方面,应开展研究评估β-内酰胺类抗菌药物治疗新生儿百日咳的可行性。此外,耐药菌流行更加强调了免疫预防的重要性,应积极开展免疫策略研究,保护婴儿免于感染百日咳。
Biography
李丽君, 女, 硕士研究生
Funding Statement
国家自然科学基金(81701565);首都医科大学基础-临床科研合作项目(17JL55)
References
- 1.Yang Y, Yao K, Ma X, et al. Variation in Bordetella pertussis susceptibility to erythromycin and virulence-related genotype changes in China (1970-2014) PLoS One. 2015;10(9):e0138941. doi: 10.1371/journal.pone.0138941. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2.World Health Organization Pertussis vaccines:WHO position paper-August 2015. http://www.cabdirect.org/abstracts/20103328807.html;jsessionid=02BB5C49A4205196F80905AE58BC382A. Wkly Epidemiol Rec. 2015;90(35):433–460. [PubMed] [Google Scholar]
- 3.Warfel JM, Zimmerman LI, Merkel TJ. Acellular pertussis vaccines protect against disease but fail to prevent infection and transmission in a nonhuman primate model. Proc Natl Acad Sci USA. 2014;111(2):787–792. doi: 10.1073/pnas.1314688110. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.Kim SH, Lee J, Sung HY, et al. Recent trends of antigenic variation in Bordetella pertussis isolates in Korea. J Korean Med Sci. 2014;29(3):328–333. doi: 10.3346/jkms.2014.29.3.328. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Mosiej E, Zawadka M, Krysztopa-Grzybowska K, et al. Sequence variation in virulence-related genes of Bordetella pertussis isolates from Poland in the period 1959-2013. Eur J Clin Microbiol Infect Dis. 2015;34(1):147–152. doi: 10.1007/s10096-014-2216-6. [DOI] [PubMed] [Google Scholar]
- 6.Advani A, Gustafsson L, Ahrén C, et al. Appearance of Fim3 and ptxP3-Bordetella pertussis strains, in two regions of Sweden with different vaccination programs. Vaccine. 2011;29(18):3438–3442. doi: 10.1016/j.vaccine.2011.02.070. [DOI] [PubMed] [Google Scholar]
- 7.Wiley KE, Zuo Y, Macartney KK, et al. Sources of pertussis infection in young infants:a review of key evidence informing targeting of the cocoon strategy. http://www.sciencedirect.com/science/article/pii/S0264410X12016660. Vaccine. 2012;1(4):618–625. doi: 10.1016/j.vaccine.2012.11.052. [DOI] [PubMed] [Google Scholar]
- 8.Centers for Disease Control and Prevention. Pertussis surveillance reports[DB/OL]. (2014-01-21)[2018-12-27]. https://www.cdc.gov/pertussis/surv-reporting.html.
- 9.郭 丹, 李 耿. 新生儿百日咳. http://d.old.wanfangdata.com.cn/Periodical/lcekzz201609007 儿科学大查房. 2015;4(6):265–270. [Google Scholar]
- 10.Abu Raya B, Srugo I, Kessel A, et al. The effect of timing of maternal tetanus, diphtheria, and acellular pertussis (Tdap) immunization during pregnancy on newborn pertussis antibody levels-a prospective study. Vaccine. 2014;32(44):5787–5793. doi: 10.1016/j.vaccine.2014.08.038. [DOI] [PubMed] [Google Scholar]
- 11.Meng QH, Luo J, Yang F, et al. A general lack of IgG against pertussis toxin in Chinese pregnant women and newborns. http://europepmc.org/abstract/MED/29406469. Pediatr Infect Dis J. 2018;37(9):934–938. doi: 10.1097/INF.0000000000001933. [DOI] [PubMed] [Google Scholar]
- 12.Tiwari T, Murphy TV, Moran J, et al. Recommended antimicrobial agents for the treatment and postexposure prophylaxis of pertussis:2005 CDC Guidelines. http://www.ncbi.nlm.nih.gov/pubmed/16340941. MMWR Recomm Rep. 2005;54(RR-14):1–16. [PubMed] [Google Scholar]
- 13.Hoppe JE, Haug A. Treatment and prevention of pertussis by antimicrobial agents (Part Ⅱ) Infection. 1988;16(3):148–152. doi: 10.1007/BF01644089. [DOI] [PubMed] [Google Scholar]
- 14.Islur J, Anglin CS, Middleton PJ. The whooping cough syndrome:a continuing pediatric problem. Clin Pediatr (Phila) 1975;14(2):171–176. doi: 10.1177/000992287501400208. [DOI] [PubMed] [Google Scholar]
- 15.Trollfors B. Effect of erythromycin and amoxycillin on Bordetella pertussis in the nasopharynx. Infection. 1978;6(5):228–230. doi: 10.1007/BF01642314. [DOI] [PubMed] [Google Scholar]
- 16.Simon C, Bontemps M, Wiese K, et al. Ampicillin therapy of whooping cough. Dtsch Med Wochenschr. 1969;94(47):2435–2437. doi: 10.1055/s-0028-1110460. [DOI] [PubMed] [Google Scholar]
- 17.Smith BR, LeFrock JL. Bronchial tree penetration of antibiotics. Chest. 1983;83(6):904–908. doi: 10.1378/chest.83.6.904. [DOI] [PubMed] [Google Scholar]
- 18.Wang LM, Qiao XL, Ai L, et al. Isolation of antimicrobial resistant bacteria in upper respiratory tract infections of patients. 3 Biotech. 2016;6(2):166. doi: 10.1007/s13205-016-0473-z. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.Ohtsuka M, Kikuchi K, Shimizu K, et al. Emergence of quinolone-resistant Bordetella pertussis in Japan. Antimicrob Agents Chemother. 2009;53(7):3147–3149. doi: 10.1128/AAC.00023-09. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20.Clarke M, McIntyre PB, Blyth CC, et al. The relationship between Bordetella pertussis genotype and clinical severity in Australian children with pertussis. J Infect. 2016;72(2):171–178. doi: 10.1016/j.jinf.2015.11.004. [DOI] [PubMed] [Google Scholar]
- 21.van Gent M, Heuvelman CJ, van der Heide HG, et al. Analysis of Bordetella pertussis clinical isolates circulating in European countries during the period 1998-2012. Eur J Clin Microbiol Infect Dis. 2015;34(4):821–830. doi: 10.1007/s10096-014-2297-2. [DOI] [PMC free article] [PubMed] [Google Scholar]


