Abstract
目的
探讨肺表面活性物质(PS)联合布地奈德气管内滴入预防极低出生体重早产儿支气管肺发育不良(BPD)的临床疗效。
方法
选取胎龄 < 32周的患有宫内感染的呼吸窘迫综合征(NRDS)(Ⅲ或Ⅳ级)的极低出生体重儿30例,随机分成PS+布地奈德组(15例)和PS组(15例)。比较两组血气分析、氧合指数(OI)、呼吸机使用时间、吸氧时间、BPD发生率、纠正胎龄36周时病死率以及其他并发症的发生率。
结果
PS+布地奈德组患儿BPD发生率低于PS组,呼吸机使用时间和吸氧时间明显短于PS组(P < 0.05);给药后第2~6天,PS+布地奈德组pH、OI均高于PS组,PaCO2均低于PS组,且差异均有统计学意义(P < 0.05);两组间纠正胎龄36周时病死率以及其他并发症差异无统计学意义。
结论
PS联合布地奈德气管内滴入能有效降低重度NRDS极低出生体重早产儿BPD的发生率。
Keywords: 布地奈德, 肺表面活性物质, 支气管肺发育不良, 极低出生体重儿
Abstract
Objective
To explore the clinical efficacy of intratracheal instillation of pulmonary surfactant (PS) combined with budesonide for preventing bronchopulmonary dysplasia (BPD) in very low birth weight (VLBW) infants.
Methods
Thirty VLBW infants with gestational age < 32 weeks who developed neonatal respiratory distress syndrome (NRDS) (grade Ⅲ-IV) suffering from intrauterine infection were randomly assigned into a PS+budesonide group and a PS alone group. The changes were compared between the two groups in arterial blood gas indexes, oxygenation index (OI), duration of mechanical ventilation, duration of oxygen supplementation, incidence of BPD, mortality rate at 36 weeks corrected gestational age and incidences of other complications except BPD.
Results
Compared with the PS alone group, the PS+budesonide group had a lower incidence of BPD, shorter duration of mechanical ventilation and oxygen supplementation (P < 0.05). On the 2nd to 6th day after treatment, the PS+budesonide group had higher pH value of arterial blood gas and OI and lower carbon dioxide partial pressure compared with the PS alone group (P < 0.05). There were no significant differences in the mortality rate at 36 weeks corrected gestational age and the incidences of other complications except BPD between the two groups (P > 0.05).
Conclusions
Intratracheal instillation of PS combined with budesonide can effectively reduce the incidence of BPD in VLBW premature infants with severe NRDS.
Keywords: Budesonide, Pulmonary surfactant, Bronchopulmonary dysplasia, Very low birth weight infant
近年来产前预防性应用糖皮质激素(GC)以及出生后外源性表面活性物质的应用,使新生儿呼吸窘迫综合征(NRDS)抢救成功率大大提高[1],但其常见并发症支气管肺发育不良(BPD)的发生率仍居高不下,其中极低出生体重的早产儿所占比例高达50%[2]。如何降低极低出生体重早产儿BPD的发生率仍是目前国内外新生儿领域的热点课题。目前BPD的发病机制尚不完全清楚,除了与胎龄小、体重小、肺发育不成熟相关外,还与感染和炎性反应有关,而且炎症被认为在BPD发病机制中发挥重要作用[3-4]。GC具有高效抗炎作用,全身地塞米松可以改善BPD疾病进程,但由于其不良反应通常不推荐应用[5]。布地奈德局部抗炎作用较强而全身不良反应较小,但早产儿雾化吸入布地奈德难以到达肺泡内,抗炎疗效受限[6]。动物实验证实,肺表面活性物质(PS)联合布地奈德气管内滴注可以提高肺泡内布地奈德的药物浓度,提高抗炎疗效[7]。目前国内外有关PS联合布地奈德气管内滴注是否能降低BPD发生率的报道较少,Yeh等[8]报道气管内滴注PS联合布地奈德能够减少患NRDS的极低体重儿BPD的发生。但是对于小于32周、伴有宫内感染的NRDS极低出生体重儿,应用PS联合布地奈德是否能预防BPD的发生,目前国内外尚未见报道。因此本研究针对胎龄 < 32周、伴有宫内感染的的重度NRDS极低出生体重儿,予气管内滴注PS与布地奈德的混悬液,观察其是否能有效预防BPD,现报道如下。
1. 资料与方法
1.1. 研究对象
选取2015年6月至2016年3月在我院住院的早产儿30例。纳入标准如下:(1)出生体重 < 1 500 g,胎龄 < 32周,有宫内感染(符合以下其中1项:胎膜早破大于18 h、羊膜炎、孕母分娩前有发热、腹泻等)[9-11];(2)出生4 h内发生NRDS(Ⅲ或Ⅳ级),NRDS诊断标准均符合《实用新生儿学》第4版标准[12]。纳入患儿随机分为PS +布地奈德组(n=15)和PS组(n=15)。
排除标准:严重先天性畸形,除房间隔缺损、室间隔缺损或动脉导管未闭外的严重先天性心脏病,膈疝,呼吸系统畸形,染色体异常等。
本研究获得我院伦理委员会批准及患儿家属书面知情同意。
1.2. 给药方法
PS +布地奈德组使用PS(珂立苏:国产牛肺表面活性物质,北京双鹤现代医药技术有限责任公司生产,国药准字H20052128,规格为70 mg/2 mL)和布地奈德(AstraZeneca Pty Ltd,注册证号H20140475,规格1 mg/2 mL)混合剂(每70 mg PS中加入剂量0.25 mg布地奈德)。PS组仅使用PS,剂量70 mg/kg。在出生4 h内由气管内滴入,滴入时患儿上身抬高30°。分3个体位(平卧、右侧卧、左侧卧)使用。观察6~12 h,如果吸氧浓度(FiO2) > 0.4或平均动脉压(MAP) > 8 cm H2O,则重复给药1次。
1.3. 诊断标准
(1)BPD:任何氧依赖超过28 d的新生儿[13]。
(2)高血糖:血糖 > 7 mmol/L[14]。
(3)高血压:血压大于90/60 mm Hg[15]。
(4)气胸:床旁胸部X线表现为外凸弧形的细线条形阴影,线内为压缩的肺组织,线外见不到肺纹理,透亮度明显增加;大量气胸或张力性气胸显示纵隔和心脏移向健侧[16]。
(5)动脉导管未闭(PDA):床旁心脏彩超发现生后大于3 d动脉导管持续开放[17]。
(6)颅内出血(ICH):头颅超声表现为一侧或双侧室管膜下区域/侧脑室内/侧脑室前角旁、三角区及矢状旁区/脑实质内出现强回声光团,随着出血的吸收,强回声光团回声减低,逐渐液化形成小囊性病变;伴有或不伴有一侧或双脑室扩张;可引起脑中线偏移;在生后3 d、1周、1个月时各查1次。头颅磁共振(MRI)均在慢性期完成,T1、T2加权像和DWI均表现为低密度出血灶[18]。
(7)坏死性小肠结肠炎(NEC)[19]:临床主要表现为腹胀、呕吐、腹泻、便血;床旁腹部X线平片主要特征为肠壁囊样积气。
1.4. 观察指标
BPD的发生率;给药前和给药后6 d内生命体征、经皮测血氧饱和度、血气分析、氧合指数(OI);呼吸机使用时间及吸氧时间;纠正胎龄36周时死亡例数;常见并发症(高血糖、高血压、气胸、PDA、ICH、NEC等)的发生率。
1.5. 统计学分析
应用SPSS 17.0软件,计量资料用均数±标准差(x±s)表示,计数资料用率(%)表示,组间比较采用独立样本t检验或Fisher确切概率法,P < 0.05为差异有统计学意义。
2. 结果
2.1. 一般情况
两组患儿在出生体重、胎龄、性别、分娩方式、Apgar评分和产前用激素等一般资料比较中差异均无统计学意义(P > 0.05),见表 1。
1.
两组一般资料比较[(x±s)或n(%)]
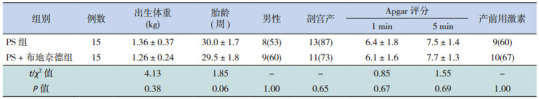
|
2.2. 两组观察指标的比较
两组给药前后呼吸、心率、血压、经皮血氧饱和度差异均无统计学意义。
PS +布地奈德组患儿中BPD发生率(1例,7%)明显低于PS组(6例,40%),差异有统计学意义(P < 0.05)。
给药前和给药后1 d两组患儿血气分析、FiO2和OI差异均无统计学意义;给药后第2~6天,PS +布地奈德组PH、OI均高于PS组,PaCO2均低于PS组,且差异均有统计学意义(P < 0.05),两组PaO2比较差异无统计学意义,见表 2。
2.
两组治疗前后血气分析及氧合指数的比较(x±s)

|
PS +布地奈德组患儿呼吸机使用时间和吸氧时间明显短于PS组,差异有统计学意义(P < 0.05),见表 3。
3.
呼吸机使用的时间及吸氧的时间(x±s)
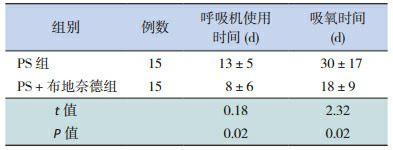
|
PS +布地奈德组纠正胎龄36周时无一例死亡,PS组死亡2例,两组病死率差异无统计学意义。两组患儿均无高血压、气胸、NEC的发生,同时两组高血糖、PDA、ICH的发生率差异均无统计学意义。
3. 讨论
NRDS是早产儿最常见的呼吸系统疾病之一,由肺泡Ⅱ型上皮细胞分泌PS下降所致。随着围产期医疗技术的提高,能够救治成活的小胎龄和极低出生体重的早产儿越来越多,其发育不成熟的肺受到气压伤、氧中毒以及炎性因子的破坏作用后致使BPD的发生率逐年上升,并造成撤机和停氧困难[20],因此预防BPD的发生显得尤为重要。
本研究采用PS联合布地奈德治疗患有宫内感染的重度NRDS的极低出生体重早产儿,结果显示PS联合布地奈德气管内滴入与单独PS气管内滴入相比,患儿BPD的发生率明显减少,通气功能和换气功能明显改善。其可能原因如下:
(1)气管内滴入PS常规用于治疗NRDS,由于肺表面梯度张力有助于GC弥散至呼吸道终末支气管和肺泡组织,PS还可以促进药物更均匀分布于肺泡并加速其溶解、吸收。(2)GC减少促炎细胞因子如白细胞介素1,白细胞介素6、肿瘤坏死因子-α等的生成进而发挥抗炎作用,从而抑制肺泡的炎症[21],其可能机制:GC通过膜联蛋白1合成介导,后者抑制磷脂酶A2的表达,从而阻止花生四烯酸(即前列腺素,血栓烷,前列环素和白三烯)生成和随后的白细胞粘附和迁移;GC也可以抑制环氧合酶Ⅰ和Ⅱ增强抗炎作用[22];GC还可以通过抑制核转录因子-κB(NF-κB)的激活进而抑制炎症。(3)GC与肺泡Ⅱ型细胞受体特异性结合后会产生多种激素相关蛋白,并作用于肺泡Ⅱ型细胞促进PS的合成和释放,也能够降低肺微血管的通透性和减少肺水肿最终改善肺功能[23]。
已知GC的治疗效果常常伴随着显著的临床不良反应,然而布地奈德局部抗炎作用较强而全身不良反应较小[24]。另外,布地奈德在肝脏或其他组织快速代谢,半衰期为约4 h,比大多数GC半衰期短,故其全身代谢物的影响较小[25]。本研究显示PS联合布地奈德与单纯PS治疗相比,近期并发症如高血糖、高血压、气胸、PDA、ICH、NEC的差异无统计学意义,远期并发症还有待长期随访结果。Kuo等[26]用布地奈德和PS混悬液气管内滴注治疗早产儿NRDS,并随访2~3年,未发现身体发育、神经运动和认知功能任何改变。
综上所述,PS联合布地奈德气管内滴注治疗患有宫内感染的重度NRDS的极低出生体重早产儿,在预防BPD方面取得较好的临床疗效。因此PS联合布地奈德气管内滴注可能是一种有前途的预防极低出生体重早产儿BPD的治疗方法。但本研究纳入样本量较少,而且缺乏远期疗效的评价,今后需更多的大样本、多中心的随机对照试验加以证实。
Biography
潘静, 女, 硕士研究生
Funding Statement
安徽省自然科学基金项目(No.1608085MH196);中华儿科杂志珂立苏儿科科研基金项目资助
References
- 1.Wang J, Liu X, Zhu T, et al. Analysis of neonatal respiratory distress syndrome among different gestational segments. https://www.researchgate.net/publication/284748038_Analysis_of_neonatal_respiratory_distress_syndrome_among_different_gestational_segments. Int J Clin Exp Med. 2015;8(9):16273–16279. [PMC free article] [PubMed] [Google Scholar]
- 2.Herting E. Bronchopulmonary dysplasia:pathogenesis, risk factors and early prevention strategies. http://www.docin.com/p-853476876.html. Chin Med J (Engl) 2010;123(20):2955–2957. [PubMed] [Google Scholar]
- 3.Westover AJ, Moss TJ. Effects of intrauterine infection or inflammation on fetal lung development. Clin Exp Pharmacol Physiol. 2012;39(9):824–830. doi: 10.1111/j.1440-1681.2012.05742.x. [DOI] [PubMed] [Google Scholar]
- 4.Speer C P. Chorioamnionitis, postnatal factors and proinflammatory response in the pathogenetic sequence of bronchopulmonary dysplasia. Neonatology. 2009;95(4):353–361. doi: 10.1159/000209301. [DOI] [PubMed] [Google Scholar]
- 5.Tropea K, Christou H. Current pharmacologic approaches for prevention and treatment of bronchopulmonary dysplasia. http://www.oalib.com/paper/3073020. Int J Pediatr. 2012;2012:598606. doi: 10.1155/2012/598606. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Cole CH, Colton T, Shah BL, et al. Early inhaled glucocorticoid therapy to prevent bronchopulmonary dysplasia. N Engl J Med. 1999;340(13):1005–1010. doi: 10.1056/NEJM199904013401304. [DOI] [PubMed] [Google Scholar]
- 7.Yang CF, Jeng MJ, Soong WJ, et al. Acute pathophysiological effects of intratracheal instillation of budesonide and exogenous surfactant in a neonatal surfactant-depleted piglet model. Pediatr Neonatal. 2010;51(4):219–226. doi: 10.1016/S1875-9572(10)60042-3. [DOI] [PubMed] [Google Scholar]
- 8.Yeh TF, Lin HC, Chang CH, et al. Early intratracheal instillation of budesonide using surfactant as a vehicle to prevent chronic lung disease in preterm infants:a pilot study. Pediatrics. 2008;121(5):e1310–e1318. doi: 10.1542/peds.2007-1973. [DOI] [PubMed] [Google Scholar]
- 9.Hartling L, Liang Y, Lacaze-Masmonteil T. Chorioamnionitis as a risk factor for bronchopulmonary dysplasia:a systematic review and meta-analysis. Arch Dis Child Fetal Neonatal Ed. 2012;97(1):F8–F8. doi: 10.1136/adc.2010.210187. [DOI] [PubMed] [Google Scholar]
- 10.Aksakal SE, Kandemir O, Altınbas S, et al. Fetal tyhmus size as a predictor of histological chorioamnionitis in preterm premature rupture of membranes. J Matern Fetal Neonatal Med. 2014;27(11):1118–1122. doi: 10.3109/14767058.2013.850666. [DOI] [PubMed] [Google Scholar]
- 11.李 文斌, 常 立文. 胎儿炎症反应综合征与新生儿疾病. http://www.cnki.com.cn/Article/CJFDTOTAL-LCAK201309001.htm 临床儿科杂志. 2013;13(9):801–804. [Google Scholar]
- 12.邵 肖梅, 叶 鸿瑁, 丘 小汕. 实用新生儿学. 北京: 人民卫生出版社; 2011. pp. 395–398. [Google Scholar]
- 13.Jobe AH, Bancalari E. Bronchopulmonary dysplasia. Am J Respir Crit Care Med. 2001;163(7):1723–1729. doi: 10.1164/ajrccm.163.7.2011060. [DOI] [PubMed] [Google Scholar]
- 14.Sinclair JC, Bottino M, Cowett RM. Interventions for prevention of neonatal hyperglycemia in very low birth weight infants. https://www.nichd.nih.gov/cochrane_data/bottinom_02/bottinom_02.html. Cochrane Database Syst Rev. 2011;5(10):7615–7617. doi: 10.1002/14651858.CD007615.pub3. [DOI] [PubMed] [Google Scholar]
- 15.Dionne JM, Abitbol CL, Flynn JT. Hypertension in infancy:diagnosis, management and outcome. Pediatr Nephrol. 2012;27(1):17–32. doi: 10.1007/s00467-010-1755-z. [DOI] [PubMed] [Google Scholar]
- 16.Trevisanuto D, Doglioni N, Ferrarese P, et al. Neonatal pneumothorax:comparison between neonatal transfers and inborn infants. http://www.academia.edu/13605340/Neonatal_pneumothorax_comparison_between_neonatal_transfers_and_inborn_infants. J Perinat Med. 2005;33(5):449–454. doi: 10.1515/JPM.2005.079. [DOI] [PubMed] [Google Scholar]
- 17.Skinner J. Diagnosis of patent ductus arteriosus. Semin Neonatol. 2001;6(1):49–61. doi: 10.1053/siny.2000.0037. [DOI] [PubMed] [Google Scholar]
- 18.Jodeiry B, Heidarzadeh M, Sahmani-Asl S, et al. Study of intraventricular hemorrhage in VLBW neonates admitted in Al-Zahra Hospital, Tabriz, Iran. https://www.researchgate.net/publication/234092175_Study_of_Intraventricular_Hemorrhage_in_VLBW_Neonates_Admitted_in_Al-Zahra_Hospital_Tabriz_IRAN. Niger J Med. 2012;21(1):92–97. [PubMed] [Google Scholar]
- 19.Müller MJ, Paul T, Seeliger S. Necrotizing enterocolitis in premature infants and newborns. J Neonatal Perinatal Med. 2016;9(3):233–242. doi: 10.3233/NPM-16915130. [DOI] [PubMed] [Google Scholar]
- 20.李 燕, 韦 秋芬, 潘 新年, et al. 早产儿支气管肺发育不良严重程度的影响因素. http://www.cnki.com.cn/Article/CJFDTOTAL-DDKZ201410011.htm. 中国新生儿科杂志. 2014;16(10):1014–1018. [PubMed] [Google Scholar]
- 21.Yang CF, Lin CH, Chiou SY, et al. Intratracheal budesonide supplementation in addition to surfactant improves pulmonary outcome in surfactant-depleted newborn piglets. Pediatr Pulmonol. 2013;48(2):151–159. doi: 10.1002/ppul.22564. [DOI] [PubMed] [Google Scholar]
- 22.Rhen T, Cidlowski JA. Antiinflammatory action of glucocorticoids-new mechanisms for old drugs. N Engl J Med. 2005;353(16):1711–1723. doi: 10.1056/NEJMra050541. [DOI] [PubMed] [Google Scholar]
- 23.Gupta S, Prasanth K, Chen CM, et al. Postnatal corticosteroids for prevention and treatment of chronic lung disease in the preterm newborn. http://www.docin.com/p-1527026516.html. Int J Pediatr. 2012;2012:315642. doi: 10.1155/2012/315642. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 24.Barrette AM, Roberts JK, Chapin C, et al. Antiinflammatory effects of budesonide in human fetal lung. Am J Respir Cell Mol Biol. 2016;55(5):623–632. doi: 10.1165/rcmb.2016-0068OC. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 25.Yeh TF, Chen CM, Wu SY, et al. Intratracheal administration of budesonide/surfactant to prevent bronchopulmonary dysplasia. Am J Respir Crit Care Med. 2016;193(1):86–95. doi: 10.1164/rccm.201505-0861OC. [DOI] [PubMed] [Google Scholar]
- 26.Kuo HT, Lin HC, Tsai CH, et al. A follow-up study of preterm infants given budesonide using surfactant as a vehicle to prevent chronic lung disease in preterm infants. J Pediatr. 2010;156(4):537–541. doi: 10.1016/j.jpeds.2009.10.049. [DOI] [PubMed] [Google Scholar]


