Abstract
目的
探讨淋巴细胞亚群绝对计数对儿童难治性肺炎支原体肺炎(RMPP)的早期预测作用。
方法
对244例肺炎支原体肺炎(MPP)患儿的临床资料进行回顾性分析。比较普通MPP(166例)和RMPP患儿(58例)的临床特点以及淋巴细胞亚群、乳酸脱氢酶、C反应蛋白、降钙素原、免疫球蛋白E(IgE)等实验室指标,应用ROC曲线评估预测RMMP患者的特异性指标。
结果
淋巴细胞亚群CD3+、CD4+、CD19+、CD56+绝对计数以及血清LDH、CRP、IgE水平两组比较差异均有统计学意义(P < 0.05)。ROC曲线分析显示,CD3+、CD4+、CD19+绝对计数鉴别诊断RMPP和普通MMP的曲线下面积分别为0.866、0.900、0.842,其敏感性分别为86%、90%、82%,特异性分别为75%、70%、80%。
结论
CD3+、CD4+、CD19+绝对计数可作为儿童RMPP的预测指标。
Keywords: 难治性肺炎支原体肺炎, 淋巴细胞计数, 儿童
Abstract
Objective
To study the value of absolute counts of lymphocyte subsets in the early prediction of refractory Mycoplasma pneumoniae pneumonia (RMPP) in children.
Methods
A retrospective analysis was performed for the clinical data of 244 children with Mycoplasma pneumoniae pneumonia (MPP). Among these children, 166 had MPP, and 58 had RMPP. The two groups were compared in terms of clinical features and laboratory markers such as lymphocyte subsets, lactate dehydrogenase, C-reactive protein, procalcitonin and immunoglobulin E (IgE). The receiver operating characteristic (ROC) curve was used to evaluate the specific indices for predicting RMMP.
Results
There were significant differences between the two groups in the absolute counts of CD3+, CD4+, CD19+, and CD56+ lymphocytes and the serum levels of lactate dehydrogenase, C-reactive protein, and IgE (P < 0.05). The ROC curve analysis showed that the absolute counts of CD3+, CD4+ and CD19+ lymphocytes had an area under the ROC curve (AUC) of 0.866, 0.900 and 0.842 respectively in the differential diagnosis of RMPP and MPP, with a sensitivity of 86%, 90% and 82% respectively and a specificity of 75%, 70% and 80% respectively.
Conclusions
The absolute counts of CD3+, CD4+ and CD19+ lymphocytes can be used to predict RMPP in children.
Keywords: Refractory Mycoplasma pneumoniae pneumonia, Lymphocyte count, Child
肺炎支原体肺炎(Mycoplasma pneumoniae pneumonia, MPP)是儿童常见的肺部感染性疾病之一,其中难治性肺炎支原体肺炎(refractory Mycoplasma pneumoniae pneumonia, RMPP)可遗留肺不张、支气管扩张、闭塞性支气管炎及闭塞性细支气管炎等。对RMPP及早识别和恰当治疗,可以避免或减轻后遗症及并发症的发生。与其他类型的感染一样,宿主免疫反应的特点和程度以及宿主的免疫能力可以极大地影响肺炎支原体(MP)感染等呼吸道疾病的临床结局和可能发生的肺外并发症[1]。MPP的严重程度与宿主对感染的免疫反应相关,其机制复杂,包括对MP的过敏反应、MP的毒力和宿主的防御能力等因素[2]。人类MPP最具特征性的病理特征是支气管周围血管有明显的富含浆细胞的淋巴细胞浸润。淋巴细胞的募集和活化在支原体呼吸道疾病的发病机制中起着重要的作用,T细胞是这些反应的重要组成部分。在许多情况下,T细胞很可能决定宿主对支原体产生的反应的性质,而这些反应随后决定感染的结局[3]。根据T细胞表面受体的表达及其效应功能的不同,将T细胞分为辅助性T细胞(CD4+ Th细胞)和细胞毒性T淋巴细胞(CTL),即CD8+ T淋巴细胞。有研究表明,CD4+ Th细胞参与了MPP的免疫病理过程,CD4+ Th细胞决定疾病的严重程度和对感染的抵抗力,而CD8+ T细胞则参与抑制这些炎症反应[4]。此外,也有研究表明细胞介导的免疫水平或主要反应可能与胸部图像中所见的不同肺炎类型有关[5];如果抗生素在感染早期开始使用,症状和体征的持续时间会更短[6]。因此,本研究就儿童RMPP的临床表现、相关危险因素、淋巴细胞亚群变化特点进行分析,拟探讨血清乳酸脱氢酶(LDH)、C反应蛋白(CRP)、降钙素原(PCT)、免疫球蛋白E(IgE)、淋巴细胞亚群相关免疫学指标在儿童RMPP早期预测中的指导作用。
1. 资料与方法
1.1. 研究对象
2018年1~12月于沈阳市儿童医院住院并确诊为普通MMP患儿166例和RMMP患儿58例为研究对象。166例普通MPP患儿中,男120例,女46例,年龄3.4±1.3岁(范围:1.1~10.8岁)。58例RMMP患儿中,男36例,女22例,年龄6.3±2.7岁(范围:1.2~15.3岁)。
1.2. 诊断标准
MPP的诊断参考《诸福棠实用儿科学》[7]和儿童社区获得性肺炎管理指南[8]。RMPP是指在确诊MPP基础上,有效应用大环内酯类药物1周以上无效,仍持续发热或肺部影像学无好转甚至进展[8]。
1.3. 方法
回顾性分析患儿入院后的血常规、PCT、生化全项、MP-IgG和MP-IgM、血IgE、淋巴细胞亚群、免疫系列、胸部正侧位DR、胸部超声等临床检查结果。
MP-IgM检测采用胶体金免疫层析技术法。MP-IgG采用颗粒凝集法检测。
淋巴细胞亚群检查方法:用已知总数的荧光微球Beads作标准内参,加入血中,再加入荧光抗体,应用流式细胞仪中的获取和分析软件,得出血中CD3、CD4、CD8、CD19、CD56细胞的百分比及绝对数。
1.4. 统计学分析
应用SPSS 17.0统计软件进行数据处理与分析。符合正态分布的计量资料用均数±标准差(x±s)表示,两组间比较采用独立样本t检验;不符合正态分布的计量资料用中位数和四分位数间距[M(P25,P75)]表示,两组间比较采用Mann-Whitney U检验。计数资料用率或百分比(%)表示,组间比较采用χ2检验。应用ROC曲线评估RMMP患者特异性检测指标,通过ROC曲线,根据Youden法确定预测RMMP患者的最佳临界点。P < 0.05为差异有统计学意义。
2. 结果
2.1. RMMP和普通MMP患儿临床资料的比较
普通MMP组患儿入院前病程和大环内酯类药物使用情况与RMMP组比较,差异无统计学意义;RMPP组患儿发病年龄较普通MMP组大,以学龄期儿童为主;RMPP组肺实变、胸腔积液发生率均高于普通MMP组,且RMMP组住院天数较普通MMP组明显延长。见表 1。
1.
两组患儿临床资料的比较
| 组别 | 例数 | 发病年龄 (x±s, 岁) |
入院前病程 (x±s, d) |
入院前应用大环内酯类药物 [例(%)] |
肺实变 [例(%)] |
胸腔积液 [例(%)] |
住院天数 (x±s, d) |
| 普通MMP | 166 | 3.4±1.3 | 5.9±1.7 | 137(82.5) | 3(1.8) | 2(1.2) | 8.4±2.8 |
| RMMP | 58 | 6.3±2.7 | 6.5±1.7 | 49(84.5) | 52(89.7) | 51(87.9) | 13.7±3.7 |
| t/χ2值 | 4.80 | 1.21 | 0.12 | 179.06 | 178.98 | -9.06 | |
| P值 | < 0.001 | 0.23 | 0.74 | < 0.01 | < 0.01 | < 0.001 |
所有入组患儿均给予了红霉素或阿奇霉素等基础治疗。RMMP组有11例行支气管肺泡灌洗液检查和治疗,有4例使用丙种球蛋白治疗,5例应用甲泼尼龙琥珀酸钠1~2 mg/kg治疗,而普通MMP组未予这些治疗。
2.2. 两组患儿外周血各淋巴细胞亚群百分比和绝对计数的比较
RMPP组和普通MMP组外周血各淋巴细胞亚群百分比比较,差异均无统计学意义,见表 2。RMPP组CD3+、CD4+、CD19+绝对计数明显低于普通MMP组,而CD56+绝对计数明显高于普通MMP组(P < 0.05),见表 3。
2.
两组外周血各淋巴细胞亚群百分比及CD4+/CD8+比值的比较
| (x±s) | |||||||
| 组别 | 例数 | CD3+ (%) | CD4+ (%) | CD8+ (%) | CD4+ /CD8+ | CD19+ (%) | CD56+ (%) |
| 普通MPP组 | 166 | 64±13 | 34±10 | 28±12 | 1.5±0.9 | 21±8 | 11±7 |
| RMMP组 | 58 | 67±10 | 35±8 | 25±9 | 1.6±0.8 | 23±12 | 11±7 |
| t值 | 1.189 | 0.918 | 1.492 | 1.785 | 1.106 | 0.080 | |
| P值 | 0.236 | 0.360 | 0.138 | 0.076 | 0.270 | 0.936 | |
3.
两组外周血各淋巴细胞亚群绝对计数的比较
| (x±s,个/μL) | ||||||
| 组别 | 例数 | CD3+ | CD4+ | CD8+ | CD19+ | CD56+ |
| 普通MMP组 | 166 | 3 159±216 | 1 504±83 | 1 388±165 | 854±50 | 483±34 |
| RMMP组 | 58 | 1 570±152 | 591±72 | 978±77 | 391±13 | 2 421±15 |
| t值 | 6.672 | 9.306 | 2.156 | 7.004 | 5.197 | |
| P值 | < 0.001 | < 0.001 | 0.054 | < 0.001 | < 0.001 | |
2.3. 两组外周IgE、IgA、IgG、IgM、CRP、PCT、LDH水平的比较
RMPP组外周血IgE、CRP、LDH水平明显高于普通MMP组,差异有统计学意义(P < 0.001);血IgA、IgG、IgM、PCT水平两组比较差异无统计学意义(表 4)。
4.
两组外周血IgE、IgA、IgG、IgM、CRP、PCT、LDH水平的比较
| [M(P25,P75)] | ||||||||
| 组别 | 例数 | IgE (IU/mL) |
IgA (g/L) |
IgG (g/L) |
IgM (g/L) |
CRP (mg/L) |
PCT (ng/mL) |
LDH (IU/L) |
| 普通MMP组 | 166 | 43.7(18.8, 112.9) | 1.5(1.1, 2.1) | 11.3(9.6, 13.8) | 1.6(1.2, 2.1) | 6.0 (6.0, 38.0) | 0.20(0.20, 0.23) | 285(256, 319) |
| RMMP组 | 58 | 135.6(26.4, 254.5) | 1.5(1.1, 1.9) | 10.5(8.7, 12.6) | 1.9(1.2, 2.3) | 13.1(34.3, 120.8) | 0.20(0.21, 0.24) | 396(351, 480) |
| Z值 | 3.538 | 1.080 | 0.753 | 1.843 | 3.212 | 1.685 | 9.640 | |
| P值 | < 0.001 | 0.363 | 0.452 | 0.065 | < 0.001 | 0.092 | < 0.001 | |
2.4. ROC曲线分析
为了探讨外周血CD3+、CD4+、CD19+、CD56+绝对计数及IgE、CRP、LDH等指标作为预测RMMP的价值,应用SPSS软件绘制了ROC曲线。根据Youden法确定了具有预测RMMP最大敏感性和特异性指标的临界值。对这些ROC曲线的分析表明,CD3+、CD4+、CD19+绝对计数曲线下面积均在0.8以上,其中CD4+绝对计数曲线下面积为0.900,预测价值最高。IgE、CRP、LDH的曲线下面积均小于0.5,无预测价值。CD3+、CD4+、CD19+绝对计数的临界值分别为1386.07、599.89、460.33个/μL,其区分普通MMP和RMMP的敏感性分别为86%、90%、82%,特异性分别为75%、70%、80%。见图 1和表 5。
1.
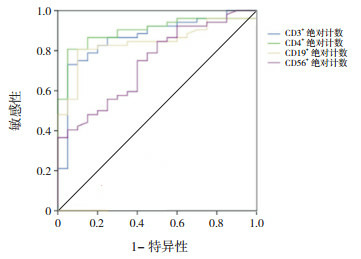
相关变量预测RMMP的ROC曲线
5.
相关变量预测RMMP分析相关变量预测RMMP分析
| 变量 | AUC | P值 | 临界值 | 敏感性 | 特异性 | AUC 95%CI |
| CD3+绝对计数(个/μL) | 0.866 | < 0.001 | 1 386.07 | 0.86 | 0.75 | 0.808~0.925 |
| CD4+绝对计数(个/μL) | 0.900 | < 0.001 | 599.89 | 0.90 | 0.70 | 0.852~0.948 |
| CD19+绝对计数(个/μL) | 0.842 | < 0.001 | 460.33 | 0.82 | 0.80 | 0.781~0.903 |
| CD56+绝对计数(个/μL) | 0.740 | < 0.001 | 256.12 | 0.71 | 0.60 | 0.665~0.816 |
| LDH (IU/L) | 0.147 | < 0.001 | 314.5 | 0.44 | 0.35 | 0.084~0.209 |
| CRP (mg/L) | 0.350 | 0.001 | 17.5 | 0.50 | 0.48 | 0.266~0.434 |
| IgE (IU/mL) | 0.366 | 0.004 | 48.63 | 0.42 | 0.35 | 0.272~0.461 |
3. 讨论
MP可引起上呼吸道和下呼吸道感染。动物研究表明,MP感染受性别、年龄、遗传背景和环境因素的影响,这些因素可能导致人类疾病出现广泛的临床表现[9]。与其他类型的感染一样,宿主免疫反应的特点和程度以及宿主的免疫能力可影响MP呼吸道疾病的临床结局和可能发生的肺外并发症。宿主免疫包括巨噬细胞、肥大细胞、中性粒细胞和自然杀伤(NK)细胞,以及T、B淋巴细胞和体液免疫应答。细胞因子刺激和细胞介导的反应越强,肺损伤越严重。宿主的潜在细胞免疫也在MP相关疾病的进展和发展中起重要作用。多项研究已确认IL-12、干扰素-γ和Th1型T细胞应答在MP感染过程中的重要性[10]。Th2细胞反应促进免疫病理,而Th1细胞则具有抗感染能力。也有研究表明,直接的微生物效应和随后引起的过度宿主免疫反应在一定程度上参与了RMPP的进展[11]。
人体宿主细胞对机体的免疫反应的差异与MP感染所致的各种致病模式的差异存在联系,包括相关性胸部图像和血清学反应[12-13]。本研究显示RMPP儿童胸部X线表现为肺实变、胸腔积液的发生率远高于普通MMP患儿。RMPP组患儿病程相对普通MMP患儿长、发病年龄也较普通MMP高,这些改变在一定程度上均提示RMMP患儿的宿主细胞存在过度免疫反应。
既往研究证实MP感染可导致淋巴细胞多克隆活化,促使T淋巴细胞亚群内环境被破坏,提示T细胞亚群变化与MP进展密切相关,尤其是CD4+ Th细胞与MPP的严重程度和对感染的抵抗力密切相关[14-15]。2017年制定的《儿童肺炎支原体肺炎中西医结合诊治专家共识》指出,免疫机制导致的炎性损伤被认为是临床表现,特别是肺外表现的主要原因,T细胞亚群会影响疾病的严重程度[16]。Bodhankar等[17]用支原体抗原对小鼠进行鼻肺免疫,让小鼠体内的CD4+ T细胞被清除,从而导致免疫介导对MP感染的抵抗力消除,而CD8+细胞的消耗对免疫介导没有影响。同时研究人员在这些免疫小鼠感染MP前就让Th细胞消失,3 d后发现MP未见减少,提示Th细胞直接参与了抗支原体感染的效应机制。该作者认为作为效应细胞,Th细胞反应可以明显增强对支原体感染的抵抗力,并促进与疾病相关的炎症病变的发展。Jones等[18]为探讨CD4+和CD8+细胞在疾病发病中的作用,在小鼠感染MP前3 d和感染后第5天分别给予特异性抗体使CD4+或CD8+ T细胞消耗98%,与CD4+减少或混合CD4+和CD8+减少组相比,仅CD8+ T细胞减少所致的疾病严重程度和临床症状增加,体重减轻也较明显,提示CD4+ Th细胞参与了MP肺疾病的免疫病理过程,而CD8+ T细胞则抑制了这些炎症反应。国内学者对6例MPP患儿和3例异物吸入患儿的支气管肺泡灌洗液细胞进行高通量测序,发现NK细胞介导的细胞毒性通路和T细胞受体信号通路已被显著激活,提示NK和CD8+ T细胞的活化在儿童MPP的发病中可能是不可缺少的。在这项研究中,儿童支气管肺泡灌洗液样本中的CD4水平没有发现明显的变化[19]。通过以上研究可以看出,免疫细胞在MP相关疾病进展过程中的作用研究虽然有很多,但研究免疫细胞类型之间错综复杂的相互作用仍具有挑战性。本研究对166例普通MMP患儿和58例RMMP患儿淋巴细胞亚群百分比和绝对计数进行对比分析,发现两组间淋巴细胞亚群百分比差异无统计学意义;而CD3+、CD4+、CD19+、CD56+绝对计数在两组间比较差异具有统计学意义,且ROC曲线分析显示CD3+、CD4+、CD19+绝对计数对预测RMMP的曲线下面积均在0.8以上,可作为儿童RMPP的良好预测指标。其中CD4+绝对计数曲线下面积为0.900,预测RMMP的价值最高。因此在淋巴细胞亚群绝对计数检测中,CD4+绝对计数对于鉴别普通MMP和RMMP患者有较高的价值,其临界值为599.89个/μL,敏感性和特异性分别为90%和70%。
MP肺炎的严重程度与宿主对感染的免疫反应有关,包括对MP的过敏反应、MP毒力、宿主防御以及向Th1或Th2优势的两极分化等。一些研究发现,哮喘患者中MP检出率较高,病毒性呼吸道感染引起的症状在过敏患者中比正常人中更严重[20-21]。有哮喘或特应性致敏史的儿童RMMP的患病率较高,这表明哮喘或特应性致敏史可能是发展需要类固醇治疗的RMMP的危险因素[22]。本研究也发现血清IgE在普通MMP组和RMMP组间比较差异有统计学意义,但ROC曲线分析其阳性预测值和阴性预测值均较低,不能作为预测RMMP的特异性指标。关于血清IgE是否能作为预测RMMP的检验指标相关报道很少,而本研究样本量不大,因此尚需大样本研究进一步论证。
近年来关于CRP和LDH在RMMP早期识别和激素应用时机中的指导作用的相关研究有很多,但关于CRP、LDH水平增高至何种程度可以提示RMPP的发生仍存在争议。国内学者朱影等[23]提出,CRP≥40 mg/L或LDH > 410 U/L对RMPP早期识别有临床意义;梅淑芬等[24]建议,CRP≥19.5 mg/L或LDH≥474.5 IU/L对鉴别RMPP与普通MPP具有重要价值;Inamura等[25]提出,LDH≥410 IU/L可作为激素治疗的适宜指标和评价MPP疗效的有用指标;Miyashita等[26]发现血清LDH水平在302~364 IU/L范围内可作为激素治疗的适宜指标。2015年中华医学会儿科学分会呼吸学组制定的《儿童肺炎支原体肺炎诊治专家共识》也指出,RMPP或重症MPP患儿LDH多明显升高,可作为给予全身糖皮质激素治疗的参考指标[27]。本研究也发现,血清CRP、LDH水平在普通MMP组和RMMP组间比较差异具有统计学意义,但ROC曲线下面积分别为0.350和0.147,诊断价值低,不能作为预测RMMP的特异性指标。因此当血清CRP、LDH升高时,提示患儿有可能进展为RMMP,但具体临界值还有待大样本研究进一步验证。
综上所述,本研究显示,患儿CD3+、CD4+、CD19+绝对计数可作为儿童RMPP的预测指标,其中CD4+绝对计数曲线下面积为0.900,预测RMMP的价值最高。但本研究是回顾性研究,因此在病例选择上可能存在一定偏倚,尚需要增加样本量进行前瞻性研究,以进一步确定淋巴细胞亚群绝对计数、LDH、CRP等作为预测RMPP的潜在效用和具体临界值。
Funding Statement
中华国际科学交流基金会课题(Z2018LLN001);辽宁省重点研发计划指导计划项目(2018020167-301)
References
- 1.Lu A, Wang C, Zhang X, et al. Lactate dehydrogenase as a biomarker for prediction of refractory Mycoplasma pneumoniae pneumonia in children. Respir Care. 2015;60(10):1469–1475. doi: 10.4187/respcare.03920. [DOI] [PubMed] [Google Scholar]
- 2.Biscardi S, Lorrot M, Marc E, et al. Mycoplasma pneumoniae and asthma in children. Clin Infect Dis. 2004;38(10):1341–1346. doi: 10.1086/392498. [DOI] [PubMed] [Google Scholar]
- 3.Dobbs NA, Odeh AN, Sun X, et al. The multifaceted role of T cell-mediated immunity in pathogenesis and resistance to Mycoplasma respiratory disease. https://www.ncbi.nlm.nih.gov/pubmed/21743780. Curr Trends Immunol. 2009;10:1–19. [PMC free article] [PubMed] [Google Scholar]
- 4.Chen K, Kolls JK. T cell-mediated host immune defenses in the lung. Annu Rev Immunol. 2013;31:605–633. doi: 10.1146/annurev-immunol-032712-100019. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Chiu CY, Chen CJ, Wong KS, et al. Impact of bacterial and viral coinfection on Mycoplasmal pneumonia in childhood community-acquired pneumonia. J Microbiol Immunol Infect. 2015;48(1):51–56. doi: 10.1016/j.jmii.2013.06.006. [DOI] [PubMed] [Google Scholar]
- 6.Parrott GL, Kinjo T, Fujita J. A compendium for Mycoplasma pneumoniae. http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=Doaj000004600093. Front Microbiol. 2016;7:513. doi: 10.3389/fmicb.2016.00513. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.江 载芳, 申 昆玲, 沈 颖. 诸福棠实用儿科学. 北京: 人民卫生出版社; 2015. pp. 1280–1282. [Google Scholar]
- 8.中华医学会儿科学分会呼吸学组, 《中华儿科杂志》编辑委员会 儿童社区获得性肺炎管理指南(2013修订)(上) 中华儿科杂志. 2013;51(10):745–752. doi: 10.3760/cma.j.issn.0578-1310.2013.10.006. [DOI] [Google Scholar]
- 9.Saraya T, Kurai D, Nakagaki K, et al. Novel aspects on the pathogenesis of Mycoplasma pneumoniae pneumonia and therapeutic implications. http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=Doaj000003672983. Front Microbiol. 2014;5:410. doi: 10.3389/fmicb.2014.00410. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.Kawabe T, Jankovic D, Kawabe S, et al. Memory-phenotype CD4+ T cells spontaneously generated under steady-state conditions exert innate TH1-like effector function. Sci Immunol. 2017;2(12):pii:eaam9304. doi: 10.1126/sciimmunol.aam9304. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.Odeh AN, Simecka JW. Regulatory CD4+CD25+ T cells dampen inflammatory disease in murine Mycoplasma pneumonia and promote IL-17 and IFN-γ responses. PLoS One. 2016;11(5):e0155648. doi: 10.1371/journal.pone.0155648. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.Atkinson TP, Duffy LB, Pendley D, et al. Deficient immune response to Mycoplasma pneumoniae in childhood asthma. Allergy Asthma Proc. 2009;30(2):158–165. doi: 10.2500/aap.2009.30.3207. [DOI] [PubMed] [Google Scholar]
- 13.Saraya T, Nakata K, Nakagaki K, et al. Identification of a mechanism for lung inflammation caused by mycoplasma pneumoniae using a novel mouse model. Results Immunol. 2011;1(1):76–87. doi: 10.1016/j.rinim.2011.11.001. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Techasaensiri C, Tagliabue C, Cagle M, et al. Variation in colonization, ADP-ribosylating and vacuolating cytotoxin, and pulmonary disease severity among Mycoplasma pneumoniae strains. Am J Respir Crit Care Med. 2010;182(6):797–804. doi: 10.1164/rccm.201001-0080OC. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.Wang M, Wang Y, Yan Y, et al. Clinical and laboratory profiles of refractory Mycoplasma pneumoniae pneumonia in children. Int J Infect Dis. 2014;29:18–23. doi: 10.1016/j.ijid.2014.07.020. [DOI] [PubMed] [Google Scholar]
- 16.中华中医药学会儿童肺炎联盟 儿童肺炎支原体肺炎中西医结合诊治专家共识(2017年制定) http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=zgsyekzz201712001 中国实用儿科杂志. 2017;32(12):881–885. [Google Scholar]
- 17.Bodhankar S, Woolard MD, Sun X, et al. NK cells interfere with the generation of resistance against mycoplasma respiratory infection following nasal-pulmonary immunization. J Immunol. 2009;183(4):2622–2631. doi: 10.4049/jimmunol.0802180. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18.Jones HP, Tabor L, Sun X, et al. Depletion of CD8+ T cells exacerbates CD4+ Th cell-associated inflammatory lesions during murine mycoplasma respiratory disease. J Immunol. 2002;168(7):3493–3501. doi: 10.4049/jimmunol.168.7.3493. [DOI] [PubMed] [Google Scholar]
- 19.Gao M, Wang K, Yang M, et al. Transcriptome analysis of bronchoalveolar lavage fluid from children with Mycoplasma pneumoniae pneumonia reveals natural killer and T cell-proliferation responses. Front Immunol. 2018;9:1403. doi: 10.3389/fimmu.2018.01403. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20.Wood PR, Hill VL, Burks ML, et al. Mycoplasma pneumoniae in children with acute and refractory asthma. Ann Allergy Asthma Immunol. 2013;110(5):328–334. doi: 10.1016/j.anai.2013.01.022. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 21.Smith-Norowitz TA, Silverberg J, Kusonruksa M, et al. Asthmatic children have increased specific anti-Mycoplasma pneumoniae IgM but not IgG or IgE-values independent of history of respiratory tract infection. Pediatr Infect Dis J. 2013;32(6):599–603. doi: 10.1097/INF.0b013e3182862ea8. [DOI] [PubMed] [Google Scholar]
- 22.Jung JA, Kita H, Yawn BP, et al. Increased risk of serious pneumococcal disease in patients with atopic conditions other than asthma. J Allergy Clin Immunol. 2010;125(1):217–221. doi: 10.1016/j.jaci.2009.10.045. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 23.朱 影, 王 婧. 儿童难治性肺炎支原体肺炎高危因素logistic回归分析. 河北医学. 2018;24(5):760–763. doi: 10.3969/j.issn.1006-6233.2018.05.015. [DOI] [Google Scholar]
- 24.梅 淑芬, 张 园园, 周 云连, et al. 学龄前期儿童难治性肺炎支原体肺炎临床特征及危险因素分析. 浙江医学. 2018;40(11):1202–1205. doi: 10.12056/j.issn.1006-2785.2017.40.11.2018-219. [DOI] [Google Scholar]
- 25.Inamura N, Miyashita N, Hasegawa S, et al. Management of refractory Mycoplasma pneumoniae pneumonia:utility of measuring serum lactate dehydrogenase level. J Infect Chemother. 2014;20(4):270–273. doi: 10.1016/j.jiac.2014.01.001. [DOI] [PubMed] [Google Scholar]
- 26.Miyashita N, Kawai Y, Inamura N, et al. Setting a standard for the initiation of steroid therapy in refractory or severe Mycoplasma pneumoniae pneumonia in adolescents and adults. J Infect Chemother. 2015;21(3):153–160. doi: 10.1016/j.jiac.2014.10.008. [DOI] [PubMed] [Google Scholar]
- 27.中华医学会儿科学分会呼吸学组, 《中华实用儿科临床杂志》编辑委员会 儿童肺炎支原体肺炎诊治专家共识(2015年版) 中华实用儿科临床杂志. 2015;30(17):1304–1308. doi: 10.3760/cma.j.issn.2095-428X.2015.17.006. [DOI] [Google Scholar]


