Abstract
目的
探讨肺功能与呼出气一氧化氮(FeNO)在儿童支气管哮喘规范化治疗过程中的变化及意义。
方法
选取254例初诊、急性发作期的支气管哮喘患儿作为研究对象,按照有无合并过敏性鼻炎分为合并鼻炎组与未合并鼻炎组,并以62例健康儿童作为对照组。哮喘患儿均给予规范化治疗,于治疗初始以及治疗3、6、9、12个月复查肺功能及FeNO水平;对照组测定一次肺功能和FeNO。
结果
规范治疗1年中第1秒用力呼气容积(FEV1)、最高呼气流速(PEF)、最大呼气中段流量(MMEF),以及最大呼气25%、50%及75%肺活量的瞬间流速(MEF25、MEF50、MEF75)均逐渐升高,FeNO水平逐渐降低(P < 0.05)。治疗6个月后PEF、FEV1等大气道功能指标基本恢复;9个月后MMEF、MEF25、MEF50、MEF75等小气道功能指标基本恢复;1年后大小气道功能指标与对照组的差异均无统计学意义(P > 0.05),而FeNO水平仍高于对照组(P < 0.05)。治疗初始及3个月时,合并鼻炎组的哮喘患儿FeNO均高于未合并鼻炎组(P < 0.05)。治疗初始FeNO水平与肺功能各项指标均存在负相关(P < 0.05)。
结论
哮喘儿童的规范化治疗过程中,肺功能参数逐渐升高,FeNO水平逐渐下降,大气道功能的恢复早于小气道功能,另外也要注意鼻炎对气道反应性的影响。
Keywords: 肺功能, 呼出气一氧化氮, 支气管哮喘, 儿童
Abstract
Objective
To investigate the changes of pulmonary function and fractional exhaled nitric oxide (FeNO) in the standardized treatment of bronchial asthma in children.
Methods
A total of 254 children who were newly diagnosed with acute exacerbation of bronchial asthma were selected as asthma group, and they were divided into two subgroups:asthma with concurrent rhinitis and asthma without concurrent rhinitis. All patients received the standardized management and treatment for one year. The pulmonary function parameters included forced expiratory volume in one second (FEV1), peak expiratory flow (PEF), maximal mid-expiratory flow (MMEF), and mid-expiratory flow at 25%, 50%, and 75% of vital capacity (MEF25, MEF50, and MEF75). The FeNO levels were measured before treatment and at 3, 6, 9, and 12 months after treatment. Another 62 healthy children were selected as the control group, and the pulmonary function and FeNO levels were measured only once.
Results
During one year of standardized treatment, FEV1, PEF, MMEF, MEF25, MEF50, and MEF75 gradually increased, and FeNO levels gradually decreased (P < 0.05). Indicators of large airway function, such as FEV1 and PEF, almost returned to normal after 6 months of treatment; indicators of small airway function, such as MMEF, MEF25, MEF50, and MEF75 almost returned to normal after 9 months of treatment; there were no significant differences in the above indices between the asthma group and the control group after one year of treatment (P > 0.05). However, the asthma group had a significantly higher FeNO levels than the control group after one year of treatment (P < 0.05). The asthmatic patients with concurrent rhinitis had significantly higher FeNO levels than those without concurrent rhinitis before treatment and 3 months after treatment (P < 0.05). Before treatment, there was a significant negative correlation between FeNO levels and pulmonary function parameters (P < 0.05).
Conclusions
With the standardized treatment of bronchial asthma in children, pulmonary function parameters gradually increase and FeNO levels gradually decrease. The recovery of large airway function occurs earlier than the recovery of small airway function. Furthermore, the effect of rhinitis on airway responsiveness should be noted.
Keywords: Pulmonary function, Fractional exhaled nitric oxide, Bronchial asthma, Child
支气管哮喘(简称哮喘)是儿童期最常见的慢性呼吸道疾病。2010年在全国范围内40万儿童的调查显示,儿童哮喘患病率达3.02%[1]。全球多中心研究认为哮喘患者经规范治疗1年,完全控制率可达50%,但我国儿童哮喘完全控制率不足10%[2]。众多研究表明,对哮喘患儿长期规范化管理与治疗是病情控制的关键。呼出气一氧化氮(fractional exhaled nitric oxide, FeNO)作为一种简便、无创的生物学指标,能有效地反映气道的炎症程度,可应用于哮喘儿童规范化管理。肺功能在评价气道阻塞情况,评估哮喘控制水平的长期治疗管理中起重要作用。哮喘儿童的肺功能及FeNO在规范化治疗过程中如何变化,以及两者是否存在相关性,尚无明确定论。本研究对254例6岁以上初诊哮喘儿童进行肺功能和FeNO动态监测,以探讨两者在儿童哮喘规范化治疗中的变化规律。
1. 资料与方法
1.1. 研究对象
选择2013年1月至2015年8月第四军医大学西京医院儿科哮喘门诊的急性发作期初诊哮喘患儿254例作为研究对象。入选标准:(1)≥6岁儿童;(2)诊断符合2016年儿童支气管哮喘诊断与治疗指南[3];(3)无闭塞性细支气管炎、胃食管反流、先天性呼吸道畸形、心脏疾病等影响肺功能的疾病。
254例中男155例、女99例,年龄6~11岁,平均年龄8.4±1.9岁。根据病情严重程度分级标准[3],轻度的118例,平均年龄8.4±1.9岁,平均身高134±10 cm,平均体重29±7 kg,其中34例合并过敏性鼻炎;中重度136例,平均年龄8.4±1.9岁,平均身高133±11 cm,平均体重29±6 kg,其中47例合并过敏性鼻炎。
正常健康儿童62例作为对照,入选标准:(1)≥6岁;(2)近2周无发热、无呼吸道感染和喘息发作,无哮喘病史;(3)无其他可能影响肺功能的疾病。其中男40例、女22例,年龄6~10.5岁、平均8.2±1.8岁,平均身高132±13 cm,平均体重29±7 kg。哮喘组与对照组及哮喘组轻度与中重度患儿,在性别分布、平均年龄、平均身高、平均体重等方面的差异均无统计学意义(P > 0.05)。
哮喘组依据患儿是否合并过敏性鼻炎,进一步分为未合并过敏性鼻炎的哮喘组(asthma without concurrent rhinitis, AS)、合并过敏性鼻炎的哮喘组(asthma with concurrent rhinitis, AR+AS)。AS组中男105例、女68例,平均年龄8.3±2.1岁,平均身高134±10 cm,平均体重29±7 kg;AR+AS组男50例、女31例,平均8.3±2.0岁,平均身高134±10 cm,平均体重29±7 kg;两组在性别分布、平均年龄、平均身高、平均体重方面的差异均无统计学意义(P > 0.05)。
1.2. 哮喘管理方法
入选患儿在首诊时由哮喘专科医师建立哮喘档案。举办哮喘学习班,向患儿及其家长进行哮喘知识宣教、同时强调定期复诊,并提供吸入器使用技能培训,提高依从性。
1.3. 哮喘治疗
根据病情按GINA方案[4]制定相应的阶梯式治疗措施,定期随访,适时升级或降级治疗,直至停药。哮喘组患儿于治疗初始以及治疗3、6、9、12个月复查肺功能及FeNO水平。
1.4. FeNO检测
FeNO检测前2 h禁食富含亚硝酸盐的食物,前1 h禁食、禁水并避免剧烈运动、被动吸烟。FeNO检测采用无锡尚沃生产的一氧化氮分析仪,参照美国胸科学会/欧洲呼吸学会2005年在线测定FeNO的推荐标准[5]。FeNO检测由固定的专业人员完成,在肺功能测定前进行,测试时室内温度、湿度恒定,无异味刺激。受试者取端坐位,平静呼吸,通过一次性滤器吸入不含一氧化氮的气体至接近肺总量,然后以50 mL/秒匀速呼气6~10秒。检测两次以上,取平均值作为检测结果,结果以ppb(parts per billion)为单位。并参照美国胸科学会2011年FeNO临床应用指南[6],将儿童FeNO低、中、高水平定义为 < 20 ppb,20~35 ppb和 > 35 ppb。
1.5. 肺功能测定
采用德国康讯肺功能仪,由肺功能专业技术人员完成,每个患儿均行3次肺功能检查,变异率不超过5%,取最佳值。主要检测指标包括:第1秒用力呼气容积(FEV1)、最高呼气流速(PEF)、最大呼气中段流量(MMEF)、最大呼气25%、50%及75%肺活量的瞬间流速(MEF25、MEF50、MEF75),以实测值占预计值的百分比表示。反映大气道功能的指标FEV1、PEF < 80%,反映小气道功能的指标MMEF、MEF25、MEF50、MEF75 < 65%判断为异常[7]。
1.6. 哮喘控制水平的判断
依据2016年儿童支气管哮喘诊断与治疗指南[3],将哮喘症状控制水平分为良好控制、部分控制和未控制。评估的指标包括日间症状 > 2次/周、夜间因哮喘憋醒、因哮喘而出现活动受限、应急缓解药物使用 > 2次/周。以上4项均无则为良好控制,存在1~2项者为部分控制,存在3~4项者为未控制。
1.7. 统计学分析
采用SPSS 19.0统计软件进行统计学处理。计量资料采用均数±标准差(x± s)表示,多组间比较采用单因素方差分析,组间两两比较采用独立样本t检验,组内比较采用配对样本t检验;计数资料以百分率(%)表示,两组比较采用χ2检验;相关性分析采用Pearson分析。P < 0.05为差异有统计学意义。
2. 结果
2.1. FeNO水平的变化
轻度及中重度哮喘组患儿从治疗初始至12个月,FeNO水平均逐渐下降(P < 0.05),但均高于对照组(P < 0.05);轻度与中重度哮喘在治疗初始及治疗3个月时FeNO水平差异均有统计学意义(P < 0.05),治疗6个月、9个月及12个月时两组的FeNO差异均无统计学意义(P > 0.05)。见表 1。
1.
哮喘患儿规范化治疗1年中肺功能及FeNO变化(x± s)
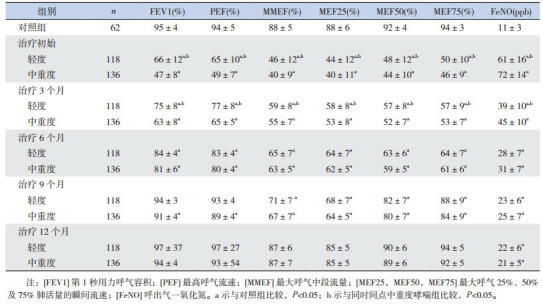
|
2.2. 肺功能指标的变化
轻度及中重度哮喘患儿规范化治疗一年中FEV1、PEF、MMEF、MEF25、MEF50及MEF75均逐渐升高(P < 0.05)。轻度及中重度患儿的大气道功能指标(FEV1、PEF)在治疗后6个月恢复正常,轻度哮喘患儿的小气道功能指标(MMEF、MEF25、MEF50及MEF75)至治疗后9个月达正常,中重度哮喘的MMEF、MEF50及MEF75在治疗后9个月恢复正常、MEF25在治疗后12个月恢复正常。轻度与中重度哮喘患儿两组间各项肺功能参数在治疗初始及治疗后3个月的差异均有统计学意义(P < 0.05),而治疗后6个月至1年两组间的差异均无统计学意义(P > 0.05)。治疗初始至6个月期间,轻度及中重度哮喘组各项肺功能参数均低于对照组,差异有统计学意义(P < 0.05)。治疗9个月时,轻度哮喘组各项大气道指标与对照组的差异均无统计学意义(P > 0.05),各项小气道指标均低于对照组(P < 0.05);中重度哮喘各项肺功能指标均低于对照组(P < 0.05)。治疗1年后,轻度及中重度哮喘组的各项肺功能参数与对照组差异均无统计学意义(P > 0.05)。见表 1。
2.3. 哮喘组肺功能各项指标及FeNO的异常率
在治疗6个月以内,大气道指标以PEF异常率较高,治疗9个月后所有大气道指标异常率均为0;治疗9个月内小气道指标中以MEF25及MEF50的异常率较高,治疗1年时所有小气道指标的异常率均为0。FeNO异常率从治疗初始(轻度哮喘组为90%、中重度组为97%)逐渐下降,治疗1年后分别为3%、11%,仍有部分哮喘患儿的FeNO水平高于20 ppb。
2.4. AS组及AS+AR组患儿治疗1年中FeNO及肺功能的变化
治疗1年中AS组及AS+AR组的大小气道指标均逐渐升高(P < 0.05)。治疗初始、3个月、6个月时,AS及AS+AR组各指标均低于对照组(P < 0.05)。治疗9个月时,两组的大气道指标与对照组差异无统计学意义(P > 0.05);小气道指标均低于对照组(P < 0.05)。治疗1年时大小气道指标与对照组之间的差异均无统计学意义(P > 0.05)。同时间点的AS组各项肺功能指标高于AS+AR组,但差异均无统计学意义(P > 0.05)。治疗6个月时AS组大小气道指标已基本恢复正常,AS+AR组大气道指标在6个月恢复正常、小气道指标在9个月时恢复正常。治疗1年中AS组及AS+AR组的FeNO水平均逐渐下降(P < 0.05),但均高于对照组(P < 0.05)。治疗初始及3个月时AS+AR组的FeNO均高于AS组(P < 0.05);而治疗6个月至1年期间,两组的FeNO差异均无统计学意义(P > 0.05)。见表 2。
2.
有无合并过敏性鼻炎的哮喘患儿治疗1年中FeNO及肺功能的变化(x± s)
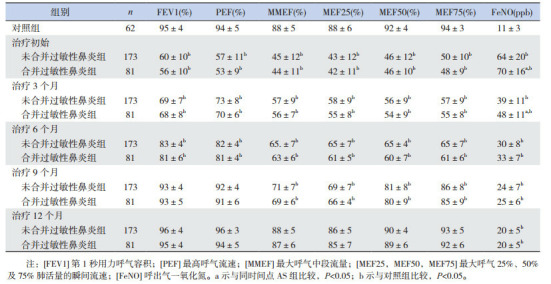
|
2.5. 哮喘组病情控制水平
所有哮喘患儿经6个月治疗后临床症状均消失,但仍有55例(21.7%)患儿的肺功能及74例(29.1%)患儿的FeNO水平并未恢复正常,至治疗1年时,所有患儿的肺功能均恢复正常,仍有24例(9.4%)患儿FeNO水平高于20 ppb。254例哮喘患儿经规范化管理治疗1年后,良好控制者为175例(68.9%),部分控制者为69例(27.2%),未控制者为10例(3.9%)。
2.6. 治疗1年后不同控制水平哮喘组FEV1、MMEF及FeNO的比较
治疗1年后,良好控制组的FEV1、MMEF明显高于部分控制组、未控制组,而部分控制组又高于未控制组,差异均有统计学意义(P < 0.05);FeNO在良好控制组明显低于部分控制组和未控制组,而部分控制组又低于未控制组(P < 0.05)。见表 3。
3.
治疗1年后不同控制水平哮喘组的FEV1、FeNO比较(x± s)
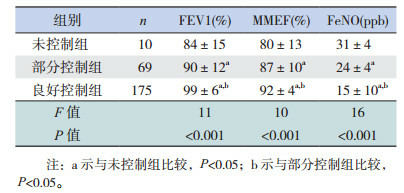
|
2.7. 治疗初始的FeNO水平与肺功能参数的相关性
治疗初始,哮喘患儿FeNO水平与肺功能各项参数(FEV1、PEF、MMEF、MEF25、MEF50及MEF75)均存在负相关(P < 0.05),见表 4。
4.
哮喘患儿治疗初始FeNO水平与肺功能的相关性
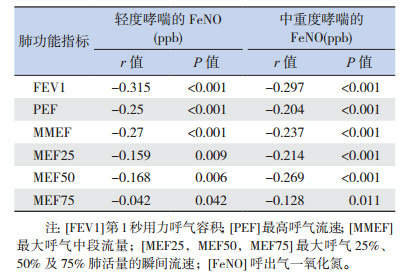
|
3. 讨论
全球哮喘防治创议(GINA)[4]以及现行我国儿童哮喘防治指南[3]指出哮喘规范化管理和治疗的长期目标是获得良好的症状控制、降低未来急性发作及气道受限持续存在的风险。肺功能是评估未来风险的重要组成部分,GINA方案已将其应用于哮喘的早期评估和定期评估中。气道炎症是气道受限持续存在的根本原因,FeNO作为气道炎症的监测方法,在哮喘规范化管理中起重要作用。本研究通过动态监测肺功能和FeNO,评估哮喘控制水平,以指导阶梯治疗调整,从而达到和维持哮喘控制的目标,为实施哮喘儿童规范化管理提供参考。
本研究254例哮喘患儿治疗1年后肺功能大气道及小气道指标均显著改善,证明哮喘患儿急性期大小气道均可出现通气功能障碍,也证实了哮喘气流受限的可逆性。本研究显示,规范治疗6个月后患儿症状消失,而部分患儿的肺功能和FeNO并未恢复正常,即症状控制与气道阻塞、气道炎症存在不一致性,提示临床症状缓解并不代表气道功能完全恢复[8],这与van den Toorn等[9]研究一致。Goldberg等[10]研究发现哮喘患儿以MEF50异常率最高。Ferguson等[11]发现临床症状稳定且无喘息的哮喘患儿中,PEF和FEV1在正常范围,而MEF50却明显降低。因此,小气道功能指标较大气道功能指标更能揭示哮喘的严重程度[12]。本研究发现无论轻度哮喘或中重度哮喘,小气道功能指标以MEF25和MEF50异常率最高,小气道功能指标恢复较大气道慢。因此在哮喘患儿规范化管理中需关注肺功能小气道参数的变化,对于缓解期小气道功能仍异常者,应继续抗炎治疗,以求彻底控制气道炎症、改善预后[13]。
FeNO是反映嗜酸性粒细胞气道炎症的无创性指标[14],可作为临床缓解期的哮喘儿童气道炎症控制水平的可靠指标[15]。Peirsman等[16]认为,将FeNO作为哮喘管理的一部分能使吸入激素量减少,急性发作次数减少,病情得到更好的控制。本研究发现,FeNO水平在良好控制组低于部分控制组和未控制组,而部分控制组又低于未控制组,FeNO水平在规范化治疗的1年期间逐渐下降,提示气道慢性炎症的严重程度与控制水平相关,哮喘的规范化治疗有助于降低气道炎症,且FeNO的连续监测可作为哮喘治疗方案调整的客观依据[17-18],与杨男[19]和沙莉等[20]研究结果一致。但经规范化治疗1年,部分哮喘患儿(9%)的FeNO仍高于20 ppb,这部分患儿气道炎症何时才能完全恢复正常,尚待进一步随访。
目前也有多项研究认为特应质与FeNO存在正相关。Malmberg等[21]报道FeNO升高与过敏性鼻炎显著相关。本研究结果显示哮喘合并鼻炎组的小气道指标恢复慢,其急性期及治疗3个月的FeNO明显高于未合并鼻炎哮喘组,但治疗6个月至1年期间两组的FeNO差异无统计学意义,说明鼻炎可能导致气道反应性升高,它在哮喘急性期对气道炎症影响较强,而临床缓解期对气道的影响较弱。因此对哮喘患儿进行病情评估时需考虑过敏性鼻炎的影响。
综上,随着哮喘儿童的规范化治疗,肺功能参数逐渐升高,FeNO水平逐渐下降,大气道功能的恢复早于小气道功能,还要注意鼻炎对气道反应性的影响。因此动态监测哮喘儿童治疗过程的肺功能及FeNO,有助于对哮喘患儿及时进行治疗的调整和更准确的病情评估。
Biography
张惠琴, 女, 硕士, 主治医师
References
- 1.全国儿科哮喘防治协助组 第三次中国城市儿童哮喘流行病学调查. 中华儿科杂志. 2013;51(10):729–735. doi: 10.3760/cma.j.issn.0578-1310.2013.10.003. [DOI] [Google Scholar]
- 2.朱 春梅, 陈 育智. 中国儿童支气管哮喘监测与治疗的调查. http://www.cnki.com.cn/Article/CJFDTOTAL-ZXCD200801006.htm 中华哮喘杂志 (电子版) 2008;2(1):18–20. [Google Scholar]
- 3.中华医学会儿科学分会呼吸学组 儿童支气管哮喘的诊断与防治指南. http://www.cnki.com.cn/Article/CJFDTOTAL-QKYX201331045.htm 中华儿科杂志. 2016;54(3):167–181. [Google Scholar]
- 4.Global Initiative for Asthma. Global strategy for asthma management and prevention[DB/OL].[2015-6-11]. http://www.ginasthma.org/documents/1/pocket-guide-for-asthmamanagement-and-prevention.
- 5.American Thoracic Society, European Respiratory Society ATS/ERS recommendations for standardized procedures for the online and offline measurement of exhaled lower respiratory nitric oxideand nasal nitric oxide. Am J Respir Crit Care Med. 2005;171(8):912–930. doi: 10.1164/rccm.200406-710ST. [DOI] [PubMed] [Google Scholar]
- 6.Dweik RA, Boggs PB, Erzurum SC, et al. An official ATS clinical practice guideline:interpretation of exhaled nitric oxide levels (FENO) for clinical applications. Am J Respir Crit Care Med. 2011;184(5):602–615. doi: 10.1164/rccm.9120-11ST. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Krouse JH, Brown RW, Fineman SM, et al. Asthma and the unified airway. http://journals.sagepub.com/doi/full/10.1016/j.otohns.2007.02.019. Otolaryngol Head Neck Surg. 2007;136(5 Suppl):S75–106. doi: 10.1016/j.otohns.2007.02.019. [DOI] [PubMed] [Google Scholar]
- 8.郭 建华, 满 立新, 张 莹莹, et al. 哮喘控制测试与肺功能检测在儿童哮喘管理中的临床应用. http://www.cnki.com.cn/Article/CJFDTOTAL-QKYX201004022.htm 中国全科医学. 2010;13(2):384–385. [Google Scholar]
- 9.van den Toorn LM, Overbeek SE, de Jongste JC, et al. Airway inflammation is present during clinical remission of atopic asthma. Am J Respir Crit Care Med. 2001;164(11):2107–2113. doi: 10.1164/ajrccm.164.11.2006165. [DOI] [PubMed] [Google Scholar]
- 10.Goldberg S, Springer C, Avital A, et al. Can peak expiratory flow measurements estimate small airway function in asthmatic children. Chest. 2001;120(2):482–488. doi: 10.1378/chest.120.2.482. [DOI] [PubMed] [Google Scholar]
- 11.Ferguson AC. Persisting airway obstruction in asymptomatic children with asthma with normal peak expiratory flow rates. J Allergy Clin Immunol. 1988;82(1):19–22. doi: 10.1016/0091-6749(88)90045-0. [DOI] [PubMed] [Google Scholar]
- 12.Rao DR, Gaffin JM, Baxi SN, et al. The utility of forced expiratory flow between 25% and 75% of vital capacity in predicting childhood asthma morbidity and severity. J Asthma. 2012;49(6):586–592. doi: 10.3109/02770903.2012.690481. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.Bjermr L. The role of small airway disease in asthma. Curr Opin Pulm Med. 2014;20(1):23–30. doi: 10.1097/MCP.0000000000000018. [DOI] [PubMed] [Google Scholar]
- 14.Pedrosa M, Cancelliere N, Barranco P, et al. Usefulness of exhaled nitric oxide for diagnosing asthma. J Asthma. 2010;47(7):817–821. doi: 10.3109/02770903.2010.491147. [DOI] [PubMed] [Google Scholar]
- 15.Hanson JR, De Lurgio SA, Williams DD, et al. Office-based exhaled nitric oxide measurement in children 4 years of age and older. Ann Allergy Asthma Immunol. 2013;111(5):358–363. doi: 10.1016/j.anai.2013.07.020. [DOI] [PubMed] [Google Scholar]
- 16.Peirsman EJ, Carvelli TJ, Hage PY, et al. Exhaled nitric oxide in childhood allergic asthma management:a randomised controlled trial. Pediatr Pulmonol. 2014;49(7):624–631. doi: 10.1002/ppul.22873. [DOI] [PubMed] [Google Scholar]
- 17.Hahn YS. Measurements of fractional exhaled nitric oxide in pediatric asthma. Korean J Pediatr. 2013;56(10):424–430. doi: 10.3345/kjp.2013.56.10.424. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18.Price D, Ryan D, Burden A, et al. Using fractional exhaled nitric oxide (FeNO) to diagnose steroidresponsive disease and guide asthma management in routine care. Clin Transl Allergy. 2013;3(1):37. doi: 10.1186/2045-7022-3-37. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.杨 男, 尚 云晓, 舒 林华, et al. 哮喘患儿呼出气一氧化氮水平与肺功能相关性研究. http://cdmd.cnki.com.cn/Article/CDMD-10159-2010117255.htm 中国小儿急救医学. 2010;17(1):34–36. [Google Scholar]
- 20.沙 莉, 曹 玲, 马 煜, et al. 呼出气一氧化氮监测评估儿童哮喘病情临床价值研究. http://www.cnki.com.cn/Article/CJFDTOTAL-ZSEK201104011.htm 中国实用儿科杂志. 2011;26(4):264–268. [Google Scholar]
- 21.Malmberg LP, Petays T, Haahtela T, et al. Exhaled nitric oxide in healthy nonatopic school-age children:determinants and height-adjusted reference values. Pediatric Pulmonol. 2006;41(7):635–642. doi: 10.1002/(ISSN)1099-0496. [DOI] [PubMed] [Google Scholar]


