Abstract
目的
基于小分子RNA-155(miR-155)/细胞因子信号抑制因子1(SOCS1)轴研究积雪草苷对高氧致新生大鼠支气管肺发育不良的保护作用。
方法
将新生大鼠随机分为对照组、模型组、积雪草苷低剂量(10 mg/kg)组、积雪草苷中剂量(25 mg/kg)组、积雪草苷高剂量(50 mg/kg)组、布地奈德(1.5 mg/kg)组,每组12只。除对照组外的其他各组在高浓度氧中暴露14 d建立新生大鼠支气管肺发育不良模型,同时以相应浓度积雪草苷对不同剂量积雪草苷组进行灌胃,布地奈德组行布地奈德雾化治疗。采用苏木精-伊红染色检测各组大鼠肺组织发育情况,测定放射状肺泡计数(RAC)、肺泡平均截距(MLI);采用超氧化物歧化酶(SOD)及丙二醛(MDA)检测试剂盒分别检测肺组织SOD、MDA水平;采用酶联免疫吸附法检测血清中肿瘤坏死因子α(TNF-α)、白介素6(IL-6)水平;采用实时荧光定量PCR法检测各组大鼠肺组织中miR-155、SOCS1的mRNA水平;采用蛋白免疫印迹法检测各组大鼠肺组织中SOCS1蛋白的相对表达。
结果
与对照组相比,模型组大鼠出现肺组织结构紊乱,肺泡融合增大,肺泡间隔不均,平均间隙增大,肺泡数量明显减少等肺发育不良症状,同时MLI、肺组织MDA水平、血清IL-6及TNF-α水平、肺组织miR-155水平均明显升高(P < 0.05),肺组织RAC、SOD水平、SOCS1 mRNA及蛋白水平均明显降低(P < 0.05)。与模型组相比,积雪草苷低、中、高剂量组、布地奈德组大鼠上述肺发育不良症状改善,MLI、肺组织MDA水平、血清IL-6及TNF-α水平、肺组织miR-155水平均降低(P < 0.05),肺组织RAC、SOD水平、SOCS1 mRNA及蛋白水平均升高(P < 0.05),且积雪草苷对肺发育不良症状及上述指标的改善程度有剂量依赖性(P < 0.05)。积雪草苷高剂量组与布地奈德组相比,上述指标差异均无统计学意义,且均达到对照组水平(P > 0.05)。
结论
积雪草苷可减轻高氧导致的新生大鼠肺部炎症损伤,改善支气管肺发育不良症状,且存在剂量依赖性。其作用机制可能与下调miR-155表达、上调SOCS1表达有关。
Keywords: 支气管肺发育不良, 积雪草苷, 小分子RNA-155, 细胞因子信号抑制因子1, 新生大鼠
Abstract
Objective
To study the protective effect of asiaticoside against hyperoxia-induced bronchopulmonary dysplasia in neonatal rats based on the microRNA-155 (miR-155)/suppressor of cytokine signaling-1 (SOCS1) axis.
Methods
Neonatal rats were randomly divided into a control group, a model group, a low-dose asiaticoside group (10 mg/kg), a middle-dose asiaticoside group (25 mg/kg), a high-dose asiaticoside group (50 mg/kg), and a budesonide group (1.5 mg/kg), with 12 rats in each group. All rats except those in the control group were exposed to a high concentration of oxygen for 14 days to establish a neonatal rat model of bronchopulmonary dysplasia. The low-, middle-, and high-dose asiaticoside groups were given asiaticoside at different doses by gavage, and those in the budesonide group were given budesonide aerosol treatment. Hematoxylin and eosin staining was used to observe lung tissue development and measure radial alveolar count (RAC) and mean linear intercept (MLI). Superoxide dismutase (SOD) and malondialdehyde (MDA) detection kits were used to measure the levels of SOD and MDA in lung tissue. ELISA was used to measure the serum levels of tumor necrosis factor-α (TNF-α) and interleukin-6 (IL-6). Quantitative real-time PCR was used to measure the mRNA expression of miR-155 and SOCS1 in lung tissue. Western blotting was used to measure the protein expression of SOCS1 in lung tissue.
Results
Compared with the control group, the model group had the symptoms of bronchopulmonary dysplasia such as a disordered structure of lung tissue, enlargement of alveolar fusion, uneven alveolar septa, enlargement of average alveolar space, and a reduction in alveolar number. The model group also had significant increases in MLI, MDA level in lung tissue, serum levels of IL-6 and TNF-α, and miR-155 level in lung tissue (P < 0.05) and significant reductions in RAC, SOD level, and mRNA and protein expression of SOCS1 in lung tissue (P < 0.05). Compared with the model group, the low-, middle-, and high-dose asiaticoside groups and the budesonide group had significant improvement in the above symptoms of bronchopulmonary dysplasia, significant reductions in MLI, MDA level in lung tissue, serum levels of IL-6 and TNF-α, and miR-155 level in lung tissue (P < 0.05), and significant increases in RAC, SOD level, and mRNA and protein expression of SOCS1 in lung tissue (P < 0.05). Asiaticoside improved the above symptoms and indices in a dose-dependent manner. There were no significant differences in the above indices between the high-dose asiaticoside and budesonide groups (P > 0.05).
Conclusions
Asiaticoside can alleviate inflammation injury induced by hyperoxia in neonatal rats and improve the symptoms of bronchopulmonary dysplasia in a dose-dependent manner, possibly by down-regulating the expression of miR-155 and up-regulating the expression of SOCS1.
Keywords: Bronchopulmonary dysplasia, Asiaticoside, microRNA-155, Suppressor of cytokine signaling-1, Neonatal rats
支气管肺发育不良(bronchopulmonary dysplasia, BPD)是早产儿常见的慢性肺部疾病,严重时可造成生长发育迟缓、肺功能不全等多种并发症,严重威胁患儿生长发育[1-2]。早产儿在进行机械通气和氧疗时,高氧会使患儿体内产生大量活性氧及自由基,导致促炎因子IL-6、TNF-α等大量合成分泌,引起严重的炎症及氧化应激反应,降低超氧化物歧化酶(SOD)水平,使脂质发生过氧化反应产生过量丙二醛(MDA),引起肺损伤,在BPD的发生发展中起到重要作用[3-5]。积雪草苷为中药积雪草的活性成分,具有抗氧化、抗肿瘤、抗炎、抗组织纤维化、保护肺脏的作用[6],可通过抑制平阳霉素引起的炎症而减弱肺间充质的纤维化[7],因而积雪草苷可能通过抑制炎症减轻高氧所致的新生大鼠BPD症状。小分子RNA-155(microRNA-155,miR-155)不编码蛋白,细胞因子信号抑制因子1(suppressor of cytokine signaling 1, SOCS1)是一种可减轻炎症的蛋白,miR-155可下调SOCS1蛋白水平,增强炎症反应[8]。miR-155上调可加重肺损伤,SOCS-1可通过抑制NALP3炎症小体的形成来抑制吸入烟雾所致的急性肺损伤,因此miR-155/SOCS1信号是治疗肺损伤的一个靶点[9-10],下调miR-155表达、上调SOCS1表达可能是积雪草苷改善高氧致新生大鼠BPD的作用机制。
1. 材料与方法
1.1. 实验动物
健康Sprague-Dawley(SD)大鼠75只,雌雄各半,体重为160~200 g,购自成都达硕实验动物有限公司,动物生产许可证号:SCXK(川)2017-0011,动物使用许可证号:SYXK(川)2017-0049,质量合格证号:NO.0016681。大鼠饲养于清洁、安静、通风良好的环境中,自由饮食、饮水,自然光照,温度25℃,湿度50%,定期更换垫料、清理消毒鼠笼。
1.2. 主要试剂及仪器
积雪草苷(广西昌洲天然产物开发有限公司,批号:20180124,质量分数:95%);吸入用布地奈德混悬液(阿斯利康制药有限公司,国药准字:H20090903,批号:20180307);miR-155、U6、SOCS1、GAPDH引物由上海生工生物工程股份有限公司合成;SOD检测试剂盒(上海钰博生物科技有限公司);MDA检测试剂盒(上海信裕生物科技有限公司);大鼠IL-6及TNF-α ELISA试剂盒、兔源GAPDH及SOCS1一抗、羊抗兔二抗(美国Abcam公司);RNAiso Plus、逆转录试剂盒、荧光定量PCR试剂盒(日本Takara公司);RIPA裂解液、BCA试剂盒、HE染色试剂盒(上海碧云天生物技术有限公司)。XElx800酶标仪(美国Perkin Elmer公司);CFX96 Touch Deep Well荧光定量PCR仪、1659001蛋白电泳仪、Trans-Blot SD半干转膜仪(美国Bio-Rad公司);3900型高通量DNA合成仪(美国应用生物系统公司);Centrifuge 5424R低温高速离心机(德国Eppendorf股份公司);CY100型数字测氧仪(杭州立华仪器有限公司);RM2035轮转切片机、EG1160包埋机、HI1220烤片机(德国Leica公司);Eclipse E200实验室教学生物显微镜(日本尼康公司)。
1.3. 新生大鼠BPD模型制备及分组给药
SD大鼠雌雄配对合笼后,将孕鼠分娩出的1日龄新生大鼠随机分为对照组、模型组、积雪草苷低剂量组、积雪草苷中剂量组、积雪草苷高剂量组、布地奈德组,每组12只。参考文献[11],将除对照组外的其他各组大鼠及其母鼠置于有机玻璃箱(100 cm×50 cm×30 cm)内,持续输入氧气,用测氧仪监测氧浓度,使其为60%,箱中放置钠石灰吸收CO2,使其浓度 < 0.5%,箱内温度、湿度与动物房内保持一致;对照组暴露在空气中,于动物房内常规饲养,定时更换垫料,添加水、饲料,并与对照组互换母鼠以避免其氧中毒,持续14 d造模,苏木精-伊红(HE)染色检测模型大鼠肺组织,呈现肺组织结构紊乱,肺泡融合增大,肺泡间隔不均,平均间隙增大,肺泡数量明显减少等肺发育不良症状,表示模型建立成功。共造模63只,成功60只,成功率为95%。
造模同时,参照文献[12],以生理盐水溶解积雪草苷,配制浓度为1.0、2.5、5.0 mg/mL的溶液,以10 mL/kg的剂量分别对不同剂量积雪草苷组大鼠进行灌胃;布地奈德组大鼠以1.5 mg/kg[13]剂量的布地奈德进行雾化吸入,并以等剂量的生理盐水灌胃;对照组与模型组大鼠以等剂量的生理盐水灌胃;1 d/次,共持续14 d。
1.4. 大鼠肺部病理检测及标本收集
末次给药24 h后,各组大鼠麻醉处死,经腹主动脉取血1 mL,离心提取血清,储存在-80℃备用。然后解剖分离肺组织,取1.5 g储存在-80℃备用,剩余肺组织以生理盐水漂洗、4%多聚甲醛固定、梯度酒精(由低到高)脱水、二甲苯透明、石蜡包埋后,以切片机做病理切片。参照说明书的步骤以HE试剂盒染色,经脱蜡、梯度酒精(由高到低)浸泡后置于蒸馏水中,再次经脱水、透明后封片,在光学显微镜下观察肺组织病理改变情况。每个标本随机取3张切片,每张切片随机选取5个视野,以Image-Pro Plus 6.0软件测定每个视野放射状肺泡计数(radical alveolar counts, RAC)、肺泡平均截距(mean linear intercept, MLI),取平均值。
1.5. 大鼠肺组织SOD及MDA水平、血清IL-6及TNF-α水平检测
取肺组织约1 g加入蛋白裂解液,制备匀浆液,取其上清,以SOD、MDA试剂盒检测肺组织SOD及MAD水平,具体操作参照说明书,剩余上清收集后储存在-80℃备用。
取血清置于4℃解冻后,采用IL-6、TNF-α ELISA试剂盒检测血清IL-6、TNF-α水平,具体操作参照说明书。
1.6. 大鼠肺组织miR-155 mRNA及SOCS1 mRNA水平检测
取剩余肺组织加入RNAiso Plus提取总RNA,然后以逆转录试剂盒逆转录为cDNA,具体操作步骤参照说明书进行。再以荧光定量PCR试剂盒进行荧光定量PCR反应,反应体系:SYBR Premix 12.5 µL,上下游引物(10 µmol/L)各1 µL,cDNA 0.5 µL,dH2O 10 µL。反应条件:95℃预变性3 min;95℃变性30 s,58℃退火30 s,72℃延伸30 s,35个循环。使用U6作为miR-155的内参基因,以GAPDH作为SOCS1的内参基因,以2-ΔΔCt法对所得数据进行分析,各基因引物序列见表 1。
1.
各基因引物序列
| 引物名称 | 序列(5'→3') |
| miR-155 | F: GCGCGTTAATGCTAATTGTGAT |
| R: GTGCAGGGTCCGAGGT | |
| SOCS1 | F: ACCAGGTGGCAGCCGACAAT |
| R: ATGCGCCGGTAATCGGAGTG | |
| U6 | F: GCGCGTCGTGAAGCGTTC |
| R: GTGCAGGGTCCGAGGT | |
| GAPDH | F: CATCTTCTTTTGCGTCGCCA |
| R: TAAAAGCAGCCCTGGTGACC |
1.7. 大鼠肺组织SOCS1蛋白表达检测
将1.5中剩余的匀浆上清液置于4℃解冻后,采用BCA试剂盒测得各组总蛋白浓度,具体操作参照说明书。各组分别取含相同质量总蛋白的样品液进行电泳,转移蛋白至PVDF膜上,以5%脱脂奶粉室温封闭2 h,根据分子量截取目的蛋白条带,加入兔源SOCS1及GAPDH一抗(1 : 1 000),4℃孵育过夜,以TBST漂洗,加入羊抗兔二抗(1 : 2 000),室温孵育2 h,以TBST漂洗,采用增强化学发光法显色,凝胶成像系统拍照,以Quantity One软件分析条带灰度值,结果以SOCS1蛋白灰度值/GAPDH灰度值表示。
1.8. 统计学分析
采用SPSS 24.0统计软件对所有数据进行统计学分析,计量资料以均数±标准差(x±s)表示,多组间比较采用单因素方差分析,组间两两比较采用SNK-q检验,P < 0.05为差异有统计学意义。
2. 结果
2.1. 各组大鼠肺组织损伤情况
对照组肺组织肺泡结构清晰完整,无损伤症状;模型组大鼠肺组织出现结构紊乱,肺泡融合增大,肺泡间隔不均、平均间隙增大,肺泡数量明显减少等肺发育不良症状;积雪草苷低、中、高剂量组大鼠上述肺发育不良症状有所改善,且随剂量升高其改善程度增强;积雪草苷高剂量组与布地奈德组大鼠上述肺发育不良症状改善程度相似。与对照组相比,模型组大鼠MLI明显升高,RAC明显降低(P < 0.05);与模型组相比,积雪草苷低、中、高剂量组及布地奈德组大鼠MLI明显降低,RAC明显升高,且积雪草苷各剂量组具有剂量依赖性(P < 0.05);积雪草苷高剂量组与布地奈德组相比,MLI及RAC值差异均无统计学意义,且均达到对照组水平(P > 0.05)。见图 1,表 2。
1.
各组大鼠肺组织病理结果(苏木精-伊红染色,×200)
A:对照组新生大鼠肺泡结构清晰完整,无损伤症状;B:模型组新生大鼠出现肺泡融合增大,肺泡间隔不均、平均间隙增大,肺泡数量明显减少等肺发育不良症状;C:积雪草苷低剂量组新生大鼠肺发育不良症状较模型组有所改善;D:积雪草苷中剂量组新生大鼠肺发育不良症状较积雪草苷低剂量组进一步改善;E:积雪草苷高剂量组新生大鼠肺发育不良症状改善程度相比积雪草苷中剂量组更高,肺组织基本恢复正常;F:布地奈德组新生大鼠肺发育不良症状改善程度与积雪草苷高剂量组相似,肺组织基本恢复正常。

2.
各组大鼠肺组织MLI及RAC比较 (x±s,n=12)
| 组别 | MLI (μm) | RAC (个) |
| 注:[MLI]肺泡平均截距;[RAC]放射状肺泡计数。a示与对照组相比,P < 0.05;b示与模型组相比,P < 0.05;c示与积雪草苷低剂量组相比,P < 0.05;d示与积雪草苷中剂量组相比,P < 0.05。 | ||
| 对照组 | 38.8±1.7 | 10.92±0.81 |
| 模型组 | 53.3±2.2a | 4.72±0.19a |
| 积雪草苷低剂量组 | 48.8±2.0a, b | 6.22±0.28a, b |
| 积雪草苷中剂量组 | 44.1±1.8a, b, c | 8.13±0.23a, b, c |
| 积雪草苷高剂量组 | 39.8±1.0b, c, d | 10.21±0.63b, c, d |
| 布地奈德组 | 40.0±1.9b, c, d | 10.33±0.72b, c, d |
| F值 | 321.357 | 686.500 |
| P值 | < 0.001 | < 0.001 |
2.2. 各组大鼠肺组织SOD及MDA水平
与对照组相比,模型组大鼠肺组织MDA水平明显升高,SOD水平明显降低(P < 0.05)。与模型组相比,积雪草苷低、中、高剂量组及布地奈德组大鼠肺组织MDA水平降低,SOD水平升高,且积雪草苷各剂量组之间有剂量依赖性(P < 0.05)。积雪草苷高剂量组与布地奈德组相比,肺组织MDA、SOD水平差异均无统计学意义,且均达到对照组水平(P > 0.05)。见表 3。
3.
各组大鼠肺组织SOD及MDA水平比较 (x±s,n=12)
| 组别 | SOD (U/mg) | MDA (nmol/mg) |
| 注:[SOD]超氧化物歧化酶;[MDA]丙二醛。a示与对照组相比,P < 0.05;b示与模型组相比,P < 0.05;c示与积雪草苷低剂量组相比,P < 0.05;d示与积雪草苷中剂量组相比,P < 0.05。 | ||
| 对照组 | 118±10 | 5.6±0.4 |
| 模型组 | 79±7a | 8.6±0.9a |
| 积雪草苷低剂量组 | 93±8a, b | 7.7±0.8a, b |
| 积雪草苷中剂量组 | 103±8a, b, c | 6.7±0.5a, b, c |
| 积雪草苷高剂量组 | 115±8b, c, d | 5.6±0.4b, c, d |
| 布地奈德组 | 116±8b, c, d | 5.6±0.4b, c, d |
| F值 | 111.506 | 138.055 |
| P值 | < 0.001 | < 0.001 |
2.3. 各组大鼠血清中IL-6及TNF-α水平变化
与对照组相比,模型组大鼠血清中IL-6、TNF-α水平明显升高(P < 0.05)。与模型组相比,积雪草苷低、中、高剂量组及布地奈德组大鼠血清中IL-6、TNF-α水平均降低,且积雪草苷各剂量组之间有剂量依赖性(P < 0.05)。积雪草苷高剂量组与布地奈德组相比,血清中IL-6、TNF-α水平差异均无统计学意义,且均达到对照组水平(P > 0.05)。见表 4。
4.
各组大鼠血清中IL-6及TNF-α水平比较 (x±s,ng/mg,n=12)
| 组别 | IL-6 | TNF-α |
| 注:a示与对照组相比,P < 0.05;b示与模型组相比,P < 0.05;c示与积雪草苷低剂量组相比,P < 0.05;d示与积雪草苷中剂量组相比,P < 0.05。 | ||
| 对照组 | 0.431±0.032 | 0.984±0.055 |
| 模型组 | 1.162±0.084a | 1.624±0.072a |
| 积雪草苷低剂量组 | 0.915±0.065a, b | 1.411±0.037a, b |
| 积雪草苷中剂量组 | 0.766±0.058a, b, c | 1.222±0.023a, b, c |
| 积雪草苷高剂量组 | 0.502±0.034b, c, d | 1.024±0.027b, c, d |
| 布地奈德组 | 0.494±0.021b, c, d | 1.018±0.019b, c, d |
| F值 | 1064.785 | 1379.455 |
| P值 | < 0.001 | < 0.001 |
2.4. 各组大鼠肺组织中miR-155 mRNA及SOCS1 mRNA表达变化
与对照组相比,模型组大鼠肺组织中miR-155 mRNA水平升高,SOCS1 mRNA水平降低(P < 0.05)。与模型组相比,积雪草苷低、中、高剂量组及布地奈德组大鼠肺组织中miR-155 mRNA水平降低,SOCS1 mRNA水平升高,且积雪草苷各剂量组之间有剂量依赖性(P < 0.05)。积雪草苷高剂量组与布地奈德组相比,肺组织中miR-155 mRNA及SOCS1 mRNA水平差异均无统计学意义,且均达到对照组水平(P > 0.05)。见表 5。
5.
各组大鼠肺组织中miR-155 mRNA、SOCS1 mRNA及其蛋白相对表达水平比较 (x±s,n=12)
| 组别 | miR-155 mRNA | SOCS1 mRNA | SOCS1 |
| 注:[miR-155]小分子RNA-155;[SOCS1]细胞因子信号抑制因子1。a示与对照组相比,P < 0.05;b示与模型组相比,P < 0.05;c示与积雪草苷低剂量组相比,P < 0.05;d示与积雪草苷中剂量组相比,P < 0.05。 | |||
| 对照组 | 0.991±0.073 | 1.012±0.085 | 1.014±0.055 |
| 模型组 | 2.265±0.133a | 0.384±0.026a | 0.154±0.026a |
| 积雪草苷低剂量组 | 1.856±0.085a, b | 0.578±0.037a, b | 0.424±0.033a, b |
| 积雪草苷中剂量组 | 1.438±0.045a, b, c | 0.762±0.045a, b, c | 0.685±0.042a, b, c |
| 积雪草苷高剂量组 | 1.046±0.039b, c, d | 0.970±0.056b, c, d | 0.974±0.045b, c, d |
| 布地奈德组 | 1.037±0.025b, c, d | 0.982±0.041b, c, d | 0.981±0.052b, c, d |
| F值 | 1 659.066 | 936.649 | 2 490.669 |
| P值 | < 0.001 | < 0.001 | < 0.001 |
2.5. 各组大鼠肺组织中SOCS1蛋白表达
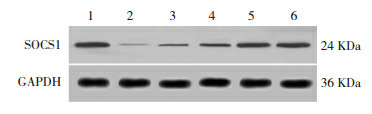
与对照组相比,模型组大鼠肺组织中SOCS1蛋白表达水平明显降低(P < 0.05)。与模型组相比,积雪草苷低、中、高剂量组及布地奈德组大鼠肺组织中SOCS1蛋白表达水平升高,且积雪草苷各剂量组之间有剂量依赖性(P < 0.05)。积雪草苷高剂量组与布地奈德组相比,SOCS1蛋白表达水平差异无统计学意义,且均达到对照组水平(P > 0.05)。见表 5、图 2。
2.
Western blot法检测各组大鼠肺组织中SOCS1蛋白水平电泳图
1:对照组;2:模型组;3:积雪草苷低剂量组;4:积雪草苷中剂量组;5:积雪草苷高剂量组;6:布地奈德组。
3. 讨论
如今BPD的发病率逐年增加,预后差、病死率高[14-15],发病机制复杂,公认高氧导致的氧化应激及炎症损伤是主要致病原因[16],因而本文将新生大鼠暴露在高氧中建立新生大鼠BPD模型。结果显示,模型组大鼠肺组织结构紊乱,肺泡融合增大,肺泡间隔不均,肺泡数量明显减少,MLI明显升高、RAC明显降低,表明模型组新生大鼠肺泡减少,出现发育不良症状。且模型组大鼠肺组织MDA水平、血清IL-6及TNF-α水平明显升高,肺组织SOD水平明显降低,表明高氧引起大鼠肺组织氧化应激及炎症反应,损伤肺组织,最终导致肺发育不良,BPD模型建立成功。
积雪草苷可抑制炎症因子分泌,减轻炎症损伤,促进肺上皮细胞存活,并可缓解肺纤维化,因而可能阻止高氧导致的BPD[17]。布地奈德是雾化吸入给药的糖皮质激素,具有高效的局部抗炎作用,可减轻支气管肺水肿,预防、治疗BPD[18],故可做为阳性对照药。miR-155可靶向下调SOCS1,促进炎症进展,引起肺损伤,下调其表达,可促进SOCS1表达,抑制炎症反应,因此miR-155/SOCS1是调控肺部氧化应激及炎症反应的作用靶点[19],并可能是积雪草苷减轻高氧所致BPD的药理机制。模型大鼠经积雪草苷治疗后,可下调其肺组织miR-155表达,上调SOCS1表达,改善肺发育不良症状,降低肺组织MLI、MDA、IL-6及TNF-α水平,升高肺组织RAC、SOD水平,且有剂量依赖性,表明积雪草苷可调控miR-155/SOCS1信号,抑制高氧导致的炎症及氧化应激反应,改善BPD症状,且随剂量增加而疗效增强,表明积雪草苷可能通过下调miR-155,上调SOCS1减轻高氧导致的氧化应激及炎症损伤,缓解新生大鼠BPD。
综上所述,积雪草苷可减轻高氧导致的新生大鼠肺部氧化应激及炎症损伤,恢复肺泡结构功能,改善新生大鼠肺发育不良症状,并逆转高氧导致的miR-155表达上调及SOCS1表达下调,这可能是其药理机制,但本研究只进行了初步研究,未使用通路抑制剂、激动剂进行对照验证,还存在不足,有待于进一步深入研究。
Biography
麦朗君, 男, 本科, 主治医师。Email:mailangjun2008@126.com
MAI Lang-Jun, Email: mailangjun986@163.com
Funding Statement
海南省卫生计生行业科研项目(17A200125)
References
- 1.Davis NL. Commentary on "Oxygen desaturations in the early neonatal period predict development of bronchopulmonary dysplasia" by Fairchild et al. http://cn.bing.com/academic/profile?id=898595f207055fabd435e23deb654dc6&encoded=0&v=paper_preview&mkt=zh-cn. Pediatr Res. 2019;85(7):927–928. doi: 10.1038/s41390-019-0358-z. [DOI] [PubMed] [Google Scholar]
- 2.Shahzad T, Radajewski S, Chao CM, et al. Pathogenesis of bronchopulmonary dysplasia:when inflammation meets organ development. http://cn.bing.com/academic/profile?id=8d54e9ba66f3efefe4fbc7dd50c3c91d&encoded=0&v=paper_preview&mkt=zh-cn. Mol Cell Pediatr. 2016;3(1):23. doi: 10.1186/s40348-016-0051-9. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.Bhunwal S, Mukhopadhyay K, Bhattacharya S, et al. Bronchopulmonary dysplasia in preterm neonates in a level Ⅲ neonatal unit in India. http://cn.bing.com/academic/profile?id=56f7b3b5f2e359d29cc809b1ded2c09d&encoded=0&v=paper_preview&mkt=zh-cn. Indian Pediatr. 2018;55(3):211–215. [PubMed] [Google Scholar]
- 4.Ito M, Nagano N, Arai Y, et al. Genetic ablation of Bach1 gene enhances recovery from hyperoxic lung injury in newborn mice via transient upregulation of inflammatory genes. http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=a9186cbf8ec273fe82c6d77e6a0ebb23. Pediatr Res. 2017;81(6):926–931. doi: 10.1038/pr.2017.17. [DOI] [PubMed] [Google Scholar]
- 5.Jobe AH, Bancalari EH. Controversies about the definition of bronchopulmonary dysplasia at 50 years. http://cn.bing.com/academic/profile?id=8caf9b75b5dcf37d1c0720074befd0bc&encoded=0&v=paper_preview&mkt=zh-cn. Acta Paediatr. 2017;106(5):692–693. doi: 10.1111/apa.13775. [DOI] [PubMed] [Google Scholar]
- 6.郭 宇杰, 徐 钧. 积雪草苷药理作用的研究进展. http://d.old.wanfangdata.com.cn/Periodical/sxyyzz201715020 山西医药杂志. 2017;46(15):1829–1832. [Google Scholar]
- 7.叶 文静, 朱 小春, 王 晓冰, et al. 积雪草苷通过抑制炎症和纤维化减弱平阳霉素诱导的肺间充质纤维化. http://www.cqvip.com/QK/93652X/201601/667779969.html 中国药理学与毒理学杂志. 2016;30(1):29–37. [Google Scholar]
- 8.Zheng X, Huang H, Liu J, et al. Propofol attenuates inflammatory response in LPS-activated microglia by regulating the miR-155/SOCS1 pathway. http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=e072411194a9cd311e5867edd6911e8d. Inflammation. 2018;41(1):11–19. doi: 10.1007/s10753-017-0658-6. [DOI] [PubMed] [Google Scholar]
- 9.Yuan Z, Syed M, Panchal D, et al. TREM-1-accentuated lung injury via miR-155 is inhibited by LP17 nanomedicine. http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=9006df65e641ee55fbf79103d4446e3e. Am J Physiol Lung Cell Mol Physiol. 2016;310(5):L426–L438. doi: 10.1152/ajplung.00195.2015. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.Zhang L, Xu C, Chen X, et al. SOCS-1 suppresses inflammation through inhibition of NALP3 inflammasome formation in smoke inhalation-induced acute lung injury. http://cn.bing.com/academic/profile?id=a8f0766525f741ecbc5c4c200a1a3491&encoded=0&v=paper_preview&mkt=zh-cn. Inflammation. 2018;41(4):1557–1567. doi: 10.1007/s10753-018-0802-y. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.尹 玲玲, 叶 贞志, 唐 丽君, et al. 大黄对高氧致新生大鼠支气管肺发育不良的影响. http://www.zgddek.com/CN/abstract/abstract14520.shtml. 中国当代儿科杂志. 2018;20(5):410–415. doi: 10.7499/j.issn.1008-8830.2018.05.014. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.Ye WJ, Zhu XC, Wang XB, et al. Asiaticoside attenuates bleomycin-induced interstitial pulmonary fibrosis. http://d.old.wanfangdata.com.cn/Periodical/zgylxydl201601005 Chin J Pharmacol Toxicol. 2016;30(1):29–37. [Google Scholar]
- 13.寇 晨, 韩 冬, 李 兆娜, et al. 肺表面活性物质联合布地奈德气管内给药对早产儿支气管肺发育不良的防治效果. http://d.old.wanfangdata.com.cn/Periodical/zhongguoyy201901014 中国医药. 2019;14(1):53–57. [Google Scholar]
- 14.Méndez-Abad P, Zafra-Rodríguez P, Lubián-López S, et al. NTproBNP is a useful early biomarker of bronchopulmonary dysplasia in very low birth weight infants. http://cn.bing.com/academic/profile?id=8334ac5b89a619636f2989cf809a35c0&encoded=0&v=paper_preview&mkt=zh-cn. Eur J Pediatr. 2019;178(5):755–761. doi: 10.1007/s00431-019-03347-2. [DOI] [PubMed] [Google Scholar]
- 15.McCrary AW, Barker PCA, Torok RD, et al. Agreement of an echocardiogram-based diagnosis of pulmonary hypertension in infants at risk for bronchopulmonary dysplasia among masked reviewers. http://cn.bing.com/academic/profile?id=4aedd3674966f51977d79c1be3f2845c&encoded=0&v=paper_preview&mkt=zh-cn. J Perinatol. 2019;39(2):248–255. doi: 10.1038/s41372-018-0277-6. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.Chen XQ, Wu SH, Luo YY, et al. Lipoxin A4 attenuates bronchopulmonary dysplasia via upregulation of Let-7c and downregulation of TGF-β1 signaling pathway. http://link.springer.com/10.1007/s10753-017-0649-7. Inflammation. 2017;40(6):2094–2108. doi: 10.1007/s10753-017-0649-7. [DOI] [PubMed] [Google Scholar]
- 17.刘 涛, 魏 海龙, 李 伟, et al. 积雪草苷对TGF-β1诱导的肺泡上皮细胞增殖和Vimentin蛋白表达影响. http://d.old.wanfangdata.com.cn/Periodical/zgmyxzz201901006 中国免疫学杂志. 2019;35(1):25–29. [Google Scholar]
- 18.Bassler D, Plavka R, Shinwell ES, et al. Early inhaled budesonide for the prevention of bronchopulmonary dysplasia. http://cn.bing.com/academic/profile?id=f2614e548a31439d8201be6b34ca46f4&encoded=0&v=paper_preview&mkt=zh-cn. N Engl J Med. 2015;373(16):1497–1506. doi: 10.1056/NEJMoa1501917. [DOI] [PubMed] [Google Scholar]
- 19.Rao R, Rieder SA, Nagarkatti P, et al. Staphylococcal enterotoxin B-induced microRNA-155 targets SOCS1 to promote acute inflammatory lung injury. http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=b10b2b967521ad89257c94c1331d939a. Infect Immun. 2014;82(7):2971–2979. doi: 10.1128/IAI.01666-14. [DOI] [PMC free article] [PubMed] [Google Scholar]


