Abstract
目的
初步探讨手足口病患儿外周血血管活性肠肽的表达水平和意义。
方法
根据病情将86例手足口病患儿分为1期组(19例)和2期组(67例)。采用ELISA法检测外周血血浆中血管活性肠肽、γ-干扰素(IFN-γ)和白细胞介素-4(IL-4)浓度。流式细胞术检测CD3+T、CD4+T、CD8+T淋巴细胞亚群。RTPCR法定性检测大便肠道病毒71型(EV71)-RNA。
结果
2期组EV71-RNA阳性率明显高于1期组(P < 0.05);2期组血清IgG、IgA、IgM、补体C3水平高于1期组(P < 0.05);2期组外周血CD3+T、CD4+T、CD8+T淋巴细胞亚群比例低于1期组(P < 0.05);2期组外周血B细胞比例高于1期组(P < 0.05);2期组CD4+/CD8+比值低于1期组(P < 0.05);2期组外周血血管活性肠肽浓度低于1期组(P < 0.05)。86例手足口病患儿外周血血管活性肠肽浓度与CD4+T淋巴细胞亚群比例以及CD4+/CD8+比值呈正相关(分别r=0.533、0.532,P < 0.05)。
结论
血管活性肠肽可能是反映手足口病严重程度的重要标记物。
Keywords: 血管活性肠肽, 手足口病, T淋巴细胞亚群, 儿童
Abstract
Objective
To investigate the expression of vasoactive intestinal peptide (VIP) in peripheral blood of children with hand, foot and mouth disease and its significance.
Methods
According to the condition of the disease, 86 children with hand, foot and mouth disease were classified into phase 1 group (19 children) and phase 2 group (67 children). ELISA was used to measure the concentrations of plasma VIP, interferon-γ (IFN-γ), and interleukin-4 (IL-4) in peripheral blood. Flow cytometry was used to measure CD3+, CD4+, and CD8+ T lymphocyte subsets. RT-PCR was used for qualitative detection of enterovirus 71 (EV71) RNA in stool.
Results
Compared with the phase 1 group, the phase 2 group had a significantly higher positive rate of EV71-RNA (P < 0.05) and significantly higher serum levels of IgG, IgA, IgM, and C3 (P < 0.05). The phase 2 group had significantly lower proportions of peripheral CD3+, CD4+, and CD8+ T lymphocyte subsets than the phase 1 group (P < 0.05), as well as significantly lower proportion of peripheral B cells and CD4+/CD8+ ratio than the phase 1 group (P < 0.05). The phase 2 group also had a significantly lower concentration of VIP in peripheral blood than the phase 1 group (P < 0.05). In the 86 children with hand, foot and mouth disease, the concentration of VIP in peripheral blood was positively correlated with the proportion of CD4+ T lymphocyte subset and CD4+/CD8+ ratio (r=0.533 and 0.532 respectively; P < 0.05).
Conclusions
VIP may be an important marker of the severity of hand, foot and mouth disease.
Keywords: Vasoactive intestinal peptide; Hand, foot and mouth disease; T lymphocyte subset; Child
血管活性肠肽(vasoactive intestinal polypeptide, VIP)由28个氨基酸残基组成,是一种非肾上腺素能非胆碱能神经递质,在中枢神经系统和周围神经系统均可表达。VIP因其强烈的舒血管活性而得名,能够通过扩张血管、改善心肺脑等器官循环而发挥保护脏器的作用[1]。近年来,VIP在炎症反应中的作用越来越受到重视。研究证实,在感染性疾病、炎症性疾病等疾病发病过程中,内源性VIP往往表达不足,使得炎症反应加重、疾病恶化,加入外源性VIP可以有效减轻炎症反应和组织损伤[2-4]。免疫炎症反应被认为在手足口病发病中发挥着重要作用,但VIP在手足口病中的作用尚未见报道。本研究通过对手足口病患儿外周血浆VIP表达水平的研究,探讨VIP在手足口病中的可能作用。
1. 资料与方法
1.1. 研究对象及分组
入选标准:(1)2015年4~9月确诊为手足口病在徐州市儿童医院住院治疗且既往无基础疾病的患儿;(2)入院时在病程3 d以内;(3)诊断标准符合《手足口病诊疗指南(2010年版)》(简称指南)和《肠道病毒71型(EV71)感染重症病例临床救治专家共识》(简称共识)[5-6];(4)为排除年龄因素对机体免疫的影响,入选患儿年龄均在1~3岁之间。同时排除合并其他疾病或近期有免疫调节剂使用史的患儿。
共纳入86例患儿,其中男52例,女34例,年龄范围1~3岁,平均年龄2.1±0.7岁。根据临床分期分为1期组和2期组。1期组(19例,其中男13例,女6例):为《指南》所指的普通病例,同时参照《共识》定义的第1期即手足口出疹期诊断标准。入组患儿均表现有不同程度的发热,手、足、口、臀等部位有斑丘疹、丘疹或小疱疹。2期组(67例,其中男39例,女28例):为《指南》所指的重症重型病例,同时参照《共识》定义的第2期即神经系统受累期诊断标准。患儿脑脊液检查均示WBC > 20×106/L,脑脊液中葡萄糖、蛋白质、氯化物均在正常范围。临床上除有1期表现外,还有不同程度的精神差、嗜睡、易惊、头痛、呕吐、烦躁、肢体抖动、急性肢体无力、颈项强直等脑膜炎、脑炎、脊髓灰质炎样综合征、脑脊髓炎症状体征。1期组与2期组之间年龄比较差别无统计学意义(1.8±0.6岁vs 2.2±0.7岁,P > 0.05),组间性别差异无统计学意义(P > 0.05)。两组患儿治疗方案均遵照《指南》《共识》的相关规定,1期患儿均在1周内治愈出院,2期患儿均在2周内治愈出院,所有患儿均无后遗症发生。
1.2. 血浆VIP等指标的检测
所有研究对象在入院的第1~2天采集1 mL外周静脉血,肝素钠抗凝。使用酶联免疫吸附试验法检测VIP、γ-干扰素(IFN-γ)和白细胞介素-4(IL-4)水平(美国Cloud-Clone公司),检测方法严格按照说明书进行。采用7080型全自动生化分析仪(日本东芝)进行血IgG、IgA、IgM、补体C3、C4浓度检测;采用FACSCanto II流式细胞仪(美国BD公司)进行CD3+ T、CD4+ T、CD8+ T、NK、B淋巴细胞亚群百分比检测;采用RT-PCR法进行大便EV71-RNA定性检测。
本研究中进行腰椎穿刺的患儿临床均怀疑有神经系统感染,操作之前签署家属知情同意书。本研究已取得徐州市儿童医院伦理委员会批准。
1.3. 统计学分析
采用SPSS 16.0软件包进行统计学分析。正态分布的的定量数据以均数±标准差(x±s)表示,非正态分布数据经对数转换(log10)后以x±s表示。计数资料采用卡方检验。组间样本均数比较采用独立样本t检验。相关性分析采用Pearson相关分析方法。P < 0.05为差异有统计学意义。
2. 结果
2.1. 1期和2期患儿一般资料以及临床指标的比较
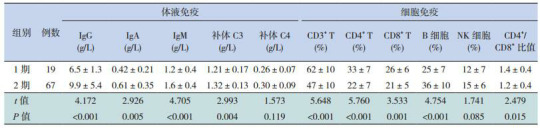
1期组和2期组分别有18例和61例患儿进行了EV71-RNA的检测,结果显示2期患儿EV71-RNA阳性率明显高于1期[22%(4/18)vs 80%(49/61),χ2=21.252,P < 0.001]。2期组患儿血清IgG、IgA、IgM、补体C3水平高于1期组(P < 0.05);两组间补体C4水平差异无统计学意义(P > 0.05)。2期组外周血CD3+ T、CD4+ T、CD8+ T淋巴细胞亚群比例低于1期组(P < 0.05);2期组外周血B细胞比例高于1期组(P < 0.05);2期组CD4+/CD8+比值低于1期组(P < 0.05);两组NK细胞比例差异无统计学意义(P > 0.05)。见表 1。
1.
1期组和2期组免疫指标的比较(x±s)
|
2.2. 1期和2期患儿血浆VIP、IFN-γ和IL-4水平的比较
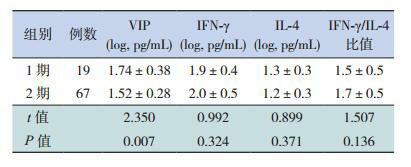
2期组外周血血浆VIP浓度低于1期组,差异有统计学意义(P < 0.05);两组间Th1细胞因子IFN-γ、Th2细胞因子IL-4以及IFN-γ/IL-4比值比较差异无统计学意义(P > 0.05),见表 2。
2.
1期组和2期组血浆VIP、IFN-γ、IL-4水平的比较(x±s)
|
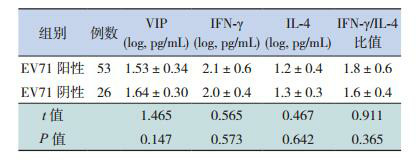
EV71-RNA阳性组与EV71-RNA阴性组之间血浆VIP、IFN-γ、IL-4浓度和IFN-γ/IL-4比值比较差异均无统计学意义(P > 0.05),见表 3。
3.
EV71-RNA阳性和阴性组血浆VIP、IFN-γ、IL-4水平的比较(x±s)
|
2.3. VIP与细胞免疫的相关性分析
86例手足口病患儿外周血VIP浓度与CD4+ T淋巴细胞亚群比例呈正相关(r=0.533,P < 0.05),见图 1;与CD4+/CD8+比值亦呈正相关(r=0.532,P < 0.05),见图 2;与CD3+ T细胞和CD8+ T细胞比例、IFN-γ、IL-4水平及IFN-γ/IL-4比值均无显著相关性(分别r=0.131,P=0.229;r=-0.063,P=0.562;r=0.124,P=0.256;r=0.052,P=0.637;r=0.023,P=0.833)。
1.
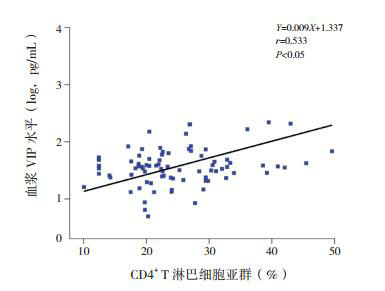
CD4+ T淋巴细胞亚群与血浆VIP水平的相关性
2.
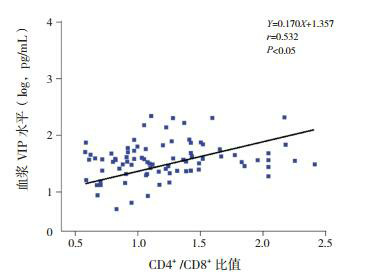
CD4+/CD8+比值与血浆VIP水平的相关性
3. 讨论
手足口病是一种急性肠道传染病,3岁以下小儿多见。手足口病主要病原包括EV71型和柯萨奇病毒A组16型。其中EV71具有强嗜神经性,是重症手足口病的最常见病原,本研究也证实重症手足口病患儿EV71-RNA阳性率明显高于普通手足口病。EV71致手足口病的第1期(手足口出疹期)和第2期(中枢神经系统受累期)临床最为多见,积极治疗后一般预后较好。第3期(心肺衰竭前期)和第4期(心肺衰竭期)病情较为凶险,致死、致残率高。早期识别第2期病例并阻断其向第3、4期进展有重要的临床意义,因此找到能反映手足口病严重程度的指标十分必要。
研究表明,EV71侵犯脑干后形成的“儿茶酚胺风暴”所导致的神经源性肺水肿、肺出血以及呼吸循环衰竭是手足口病的主要死亡原因[7]。但是,越来越多的研究表明手足口病发病过程中免疫炎症反应也发挥了重要作用[8-9]。Chen等[10]研究发现EV71可直接感染T淋巴细胞并激活FasL的表达,诱导其凋亡;而付丹等[11]研究发现EV71感染可致CD14+单核细胞HLA-DR表达下降,造成T淋巴细胞失能。本研究发现2期手足口病患儿外周血B淋巴细胞亚群以及补体C3、IgG、IgA、IgM等体液免疫指标较1期增高,而2期组CD3+ T、CD4+ T、CD8+ T淋巴细胞亚群比例和CD4+/CD8+比值等细胞免疫指标均低于1期组,与既往研究报道一致[12-13]。这些结果提示重症手足口病发病与免疫失衡有关,监测这些指标有助于判断手足口病病情。但这些指标较多且需要综合分析,淋巴细胞亚群分析还需要贵重仪器且不同实验条件下差异性较大,因此实用性较差。
VIP是一种神经肽,同时也是一种免疫因子,参与多种炎症反应,被认为是反映炎症性疾病严重程度和预后的重要标记[14]。本研究证实2期手足口病患儿外周血浆VIP浓度低于1期,提示VIP与手足口病有关。本研究未发现EV71-RNA阳性组和阴性组VIP表达的差异,提示VIP表达的变化与EV71感染无直接相关性。因此,以上结果提示血浆VIP水平主要反映手足口病严重程度。外周血VIP主要来源于神经系统,2期患儿血浆VIP浓度的下降提示神经系统受损,因此,VIP水平的监测还有助于判断临床分期。
CD4+ T、CD8+ T细胞以及CD4+/CD8+比值是反映机体免疫状态的重要指标,CD4+ T、CD8+ T细胞和CD4+/CD8+比值的下降更能提示机体清除病毒能力下降,手足口病有进一步加重趋势[15]。本研究发现手足口病患儿血浆VIP浓度与CD4+ T细胞比例、CD4+/CD8+比值呈正相关,进一步提示VIP在手足口病严重程度中的指示作用。这种相关性可能与CD4+ T和CD8+ T细胞表达的VIP受体差异性有关。VIP受体包括VPAC1、VPAC2和PAC1,其中VPAC2抗增殖作用最为明显。VPAC2水平在活化的T细胞表达较高,且CD4+ T细胞表达高于CD8+ T细胞,抗原特异性CD8+ T细胞甚至不表达VPAC2。国外研究表明,活化的T细胞在加入VIP后CD4+ T、CD8+ T细胞均减少,其中CD4+ T细胞减少更为明显,使得CD4+/CD8+比值下降[16-17]。动物实验表明,通过阻断VIP/VPAC信号通路,抗原特异性CD8+ T细胞可降低表达PD-1等抑制分子,而对CD4+ T上PD-1表达无明显影响[18-19]。因此虽然重症手足口病患儿外周血VIP降低,但是在相同的低VIP的微环境下,表达更多抗增殖受体VPAC2的活化CD4+ T细胞受到抑制作用更为明显,而低表达甚至不表达VPAC2的CD8+ T细胞的增殖能力影响不大[20]。以上结果提示VIP不仅是反映手足口病病情的重要指标,还参与手足口病炎症反应过程。
与Li等[21]的研究结果相似,本研究未发现血清IFN-γ、IL-4水平在1期和2期的组间差异,也未发现这些指标与VIP之间相关性,提示Th1/Th2平衡理论可能不适用于解释重症手足口病的发病机制。
总之,本研究显示,VIP是反映手足口病严重程度的重要标志,并可能通过影响CD4+/CD8+ T淋巴细胞亚群而不是Th1/Th2平衡机制参与手足口病的发病。
Biography
任劲松, 男, 硕士, 主治医师。Email: wamhm@163.com
Funding Statement
江苏省卫生厅预防医学课题(Y2013013);徐州市科技指导性计划项目(XZZD1367)
References
- 1.Delgado M, Ganea D. Vasoactive intestinal peptide:a neuropeptide with pleiotropic immune functions. Amino Acids. 2013;45(1):25–39. doi: 10.1007/s00726-011-1184-8. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2.Fraccaroli L, Grasso E, Hauk V, et al. Defects in the vasoactive intestinal peptide (VIP)/VPAC system during early stages of the placental-maternal leucocyte interaction impair the maternal tolerogenic response. Clin Exp Immunol. 2012;170(3):310–320. doi: 10.1111/cei.2012.170.issue-3. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.Padua D, Vu JP, Germano PM, et al. The role of neuropeptides in mouse models of colitis. J Mol Neurosci. 2016;59(2):203–210. doi: 10.1007/s12031-015-0688-1. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.徐 梁, 张 育才, 王 斐, et al. 血管活性肠肽和甲泼尼龙对内毒素性休克大鼠肠道Toll样受体mRNA表达的影响. 中国小儿急救医学. 2013;20(2):149–152. [Google Scholar]
- 5.中华人民共和国卫生部 手足口病诊疗指南(2010年版) http://www.cnki.com.cn/Article/CJFDTOTAL-YXLZ201202023.htm 国际呼吸杂志. 2010;30(24):1473–1475. [Google Scholar]
- 6.卫生部手足口病临床专家组 肠道病毒71型(EV71)感染重症病例临床救治专家共识. http://group.medlive.cn/topic/18256 中华儿科杂志. 2011;49(9):675–678. [Google Scholar]
- 7.刘 映霞. 重视EV71重症手足口病发病机制及防治对策的研究. http://med.wanfangdata.com.cn/Paper/Detail/PeriodicalPaper_zhsyhlcbdx201306001 中华实验和临床病毒学杂志. 2013;27(6):401–402. [Google Scholar]
- 8.Li H, Li S, Zheng J, et al. Cerebrospinal fluid Th1/Th2 cytokine profiles in children with enterovirus 71-associated meningoencephalitis. Microbiol Immunol. 2015;59(3):152–159. doi: 10.1111/mim.v59.3. [DOI] [PubMed] [Google Scholar]
- 9.Han J, Wang Y, Gan X, et al. Serum cytokine profiles of children with human enterovirus 71-associated hand, foot, and mouth disease. J Med Virol. 2014;86(8):1377–1385. doi: 10.1002/jmv.v86.8. [DOI] [PubMed] [Google Scholar]
- 10.Chen LC, Shyu HW, Chen SH, et al. Enterovirus 71 infection induces Fas ligand expression and apoptosis of Jurkat cells. J Med Virol. 2006;78(6):780–786. doi: 10.1002/(ISSN)1096-9071. [DOI] [PubMed] [Google Scholar]
- 11.付 丹, 李 成荣, 何 颜霞, et al. 肠道病毒71型感染患儿免疫功能探讨. http://www.cqvip.com/qk/90104x/200911/32162985.html. 中华儿科杂志. 2009;47(11):829–834. [PubMed] [Google Scholar]
- 12.姜 涛, 李 双杰, 欧阳 文献, et al. 手足口病患儿Th17、CD4+CD25+调节性T细胞的变化及意义. http://www.cjcp.org/EN/Y2013/V15/I12/1113. 中国当代儿科杂志. 2013;15(12):1113–1115. [PubMed] [Google Scholar]
- 13.陆 国平, 朱 启镕. 肠道病毒71型感染所致危重症手足口病诊治中的一些思考. http://med.wanfangdata.com.cn/paper/detail/periodicalpaper_zhek201204002. 中华儿科杂志. 2012;50(4):244–248. [PubMed] [Google Scholar]
- 14.Martínez C, Ortiz AM, Juarranz Y, et al. Serum levels of vasoactive intestinal peptide as a prognostic marker in early arthritis. PLoS One. 2014;9(1):e85248. doi: 10.1371/journal.pone.0085248. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.袁 圣福, 李 洁, 祝 伟宏. 肠道病毒71感染手足口病患儿外周血T淋巴细胞亚群及免疫球蛋白检测研究. http://www.cnki.com.cn/Article/CJFDTOTAL-ZHYY201412099.htm 中华医院感染学杂志. 2014;24(12):3112–3114. [Google Scholar]
- 16.Delgado M, Abad C, Martinez C, et al. Vasoactive intestinal peptide prevents experimental arthritis by downregulating both autoimmune and inflammatory components of the disease. Nat Med. 2001;7(5):563–568. doi: 10.1038/87887. [DOI] [PubMed] [Google Scholar]
- 17.Vomhof-DeKrey EE, Haring JS, Dorsam GP. Vasoactive intestinal peptide receptor 1 is downregulated during expansion of antigen-specific CD8 T cells following primary and secondary Listeria monocytogenes infections. J Neuroimmunol. 2011;234(1-2):40–48. doi: 10.1016/j.jneuroim.2011.02.002. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18.Li JM, Darlak KA, Southerland L, et al. VIPhyb, an antagonist of vasoactive intestinal peptide receptor, enhances cellular antiviral immunity in murine cytomegalovirus infected mice. PLoS One. 2013;8(5):e63381. doi: 10.1371/journal.pone.0063381. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.Li JM, Hossain MS, Southerland L, et al. Pharmacological inhibition of VIP signaling enhances antiviral immunity and improves survival in murine cytomegalovirus-infected allogeneic bone marrow transplant recipients. Blood. 2013;121(12):2347–2351. doi: 10.1182/blood-2012-06-437640. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20.Ipp H, Nkambule BB, Reid TD, et al. CD4+T cells in HIV infection show increased levels of expression of a receptor for vasoactive intestinal peptide, VPAC2. Immunol Res. 2014;60(1):11–15. doi: 10.1007/s12026-014-8487-2. [DOI] [PubMed] [Google Scholar]
- 21.Li S, Cai C, Feng J, et al. Peripheral T lymphocyte subset imbalances in children with enterovirus 71-induced hand, foot and mouth disease. Virus Res. 2014;180:84–91. doi: 10.1016/j.virusres.2013.11.021. [DOI] [PubMed] [Google Scholar]


