Abstract
现已认识到百日咳是一个影响全年龄段人群的疾病,现行不分年龄段的“一刀切”式的诊断标准存在明显局限性,不利于及时地开始个体治疗和阻断传播的工作。全球百日咳计划(Global Pertussis Initiative, GPI)专家组于是拟定了新的百日咳诊断标准建议。该讲座结合相关研究,综合分析了现行标准的不足,并详细介绍了GPI提出的百日咳诊断建议。
Keywords: 百日咳, 诊断, 临床表现, 实验室检测
Abstract
It has been recognized that pertussis is a disease that affects all age groups. There are obvious limitations in the currently used diagnostic criteria with "one-size-fits-all" definition, which is not advantageous to start individual treatment and perform strategies for preventing the transmission. Therefore, the expert group of Global Pertussis Initiative gives a suggestion for the diagnosis of pertussis. Based on the related published studies, the present article analyzes the limitations of the current criteria, and introduces the GPI's suggestion in detail.
Keywords: Pertussis, Diagnosis, Clinical manifestation, Laboratory detection
百日咳是一种具有强传染性的感染性疾病。在疫苗前时代,通常认为百日咳是一种儿童疾病,百日咳患病康复后可获得终身免疫。现行百日咳监测和临床实践过程中,诊断时常采用不分年龄段的“一刀切(one-size-fits-all)”式的诊断标准[1]。现已认识到百日咳患病后、接种疫苗都不能获得终身免疫,百日咳是一个影响全年龄段人群的疾病,也越来越意识到既往使用的百日咳诊断标准存在明显局限。2001年,在赛诺菲巴斯德提供的基金支持下,来自17个国家的37位专家组成了全球百日咳计划(Global Pertussis Initiative, GPI)专家组,呼吁国际社会关注百日咳,提高对百日咳的认识和报告率,促进实施有效的免疫策略[2]。本文结合相关研究,综合分析现行标准的不足,并详细介绍GPI提出的百日咳诊断建议[1],以期临床医生能重视这一问题,更新认识,并积极开展相关研究,推动修订我国百日咳诊断标准的工作。
1. 当前国内外常用的百日咳诊断标准
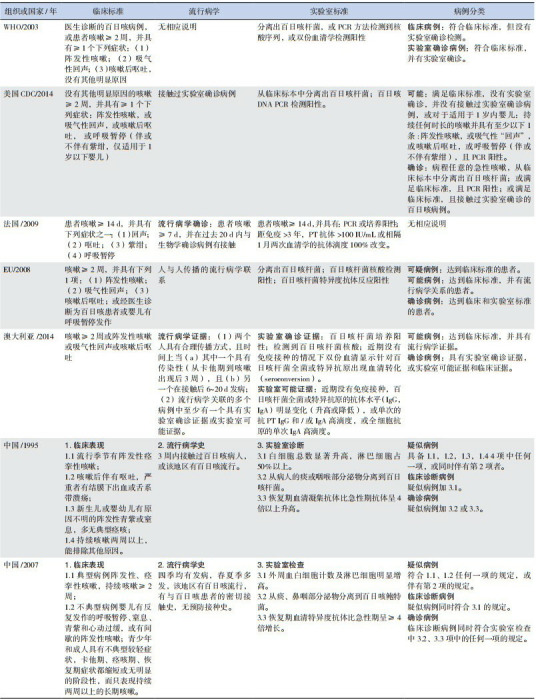
在已发表文献或公开的百日咳监测方案中,不同国家和地区采用的诊断标准常有差异。为了说明诊断标准的差异,表 1中列出了世界卫生组织(WHO)[3]、欧盟(EU)[1]、美国疾病预防控制中心(CDC)[4]、法国[1]、澳大利亚[5]的诊断标准,以及我国在不同阶段公布的两个诊断标准[6-7]。
1.
不同组织或国家当前使用的百日咳诊断标准
|
从表 1可看出多数诊断标准都要求咳嗽持续时间≥2周,少数国家的标准没有咳嗽≥2周的要求:法国标准中要求咳嗽达到7 d以上,而澳大利亚标准没有咳嗽持续时长的要求,只要咳嗽伴有阵发性、回音或呕吐的特点。
值得注意的是,在WHO、EU的临床诊断中,都明确有一条“临床医生诊断的百日咳”,说明表中所列的临床表现不应该是临床医生诊断百日咳的全部线索。但遗憾的是,在两个方案中并没有介绍另一个供临床医生使用的诊断标准。而国内临床实践中,已将相应标准作为临床诊断标准。尽管2007年标准[7]将不典型临床表现列入其中,但指导性和实用性并不令人满意。
2. 诊断标准的局限性
尽管不同国家和地区的诊断标准并不完全一致,但都没有考虑到年龄、流行和非流行季节或地区、免疫接种背景等对临床表现的影响。另外,咳嗽超过2周才考虑诊断百日咳,对个体来说,错过抗生素治疗有效时段的概率增加(阵发性咳嗽3周后开始治疗几乎不会改善患者咳嗽状况[8]);从阻止传播来说,也延误了时机(卡他期即有传染性,咳嗽出现后3周内传染效率高[8])。
2.1. 百日咳再现促进了对不典型百日咳的认识,暴露了现行标准的不足
过去的二十年,疫苗接种率很高的国家和地区报告了百日咳发病率升高[9],而且明显伴有青少年和成人百日咳发病率升高的流行病学特征[10]。美国疫苗使用前,主要发病年龄段为1~9岁,占87.1%;1978~1981年 < 1岁者占到53.5%,1~4岁26.5%;而2010年百日咳病例的年龄组成为 < 1岁15%,1~6岁22%,7~9岁18%,10~19岁20%,≥20岁25%[8]。在疫苗前时代,普遍认为百日咳是儿童期疾病,具有阵发性咳嗽、咳嗽后呕吐、吸气性回声,且病程可持续长达3个月的疾病。而这种典型病例因为疫苗计划免疫现已少见。实际上,百日咳感染后,临床表现可以很轻,在疫苗接种率很高的国家,青少年和成人百日咳主要表现为无回声、病程缩短的咳嗽。甚至一些具有较强免疫力的儿童和成人可呈无症状的携带[7]。按照现行标准,这些病例常常被忽视。
不论是发达国家,还是不发达国家,临床医生对不典型百日咳认识水平都很低[5, 7]。近期流行病学评估显示亚洲地区对成人百日咳的认识明显不足[11]。因为疫苗使用后,长期处于低水平发病,典型病例减少,缺少实验室诊断条件等原因,国内临床很少诊断百日咳,对青少年和成人百日咳的认识更少,不典型患者很难获得及时诊断。最近血清学调查显示,国内年长儿和成人中百日咳并不少见[12-13]。而这些年龄组不是免疫接种对象,患者也得不到针对性治疗,导致病原在社区持续传播,成为小婴儿的重要传染源。
2.2. 现行标准导致患者失去实验室诊断时机
标本种类、标本质量、转运培养基的类型和转运时间(最好在48 h内)都是影响百日咳实验室检测的因素,但影响百日咳实验室诊断最为重要的是从发病到采样的时间间隔[4, 14-15]。一般来说,咳嗽出现3周内是进行细菌分离培养和特异核酸检测的最佳时间。如果没有使用抗生素,典型儿童病例在咳嗽出现2周内采样进行细菌培养,阳性率可达80%[8]。但是,由于百日咳在发病初期病情较轻,易被忽视,尤其青少年和成人患者就诊时间明显很晚,往往失去检测时机。一项研究显示,7~12岁患儿平均在咳嗽后7.8 d就诊,13~18岁青少年在咳嗽后12.5 d才就诊,成人咳嗽出现17.3 d后才就诊[1]。因此,大多数成人患者就诊时,培养和RT-PCR检查的时间窗已经过了,而此时抗体水平常已升高,应该考虑血清学诊断方法[1, 4]。但诊断标准中血清学方法地位不一,尤其对于单次血清学检测诊断百日咳的问题,分歧很大,对检测指标、方法和阈值等多有不同意见。EU参考实验室近期已推荐百日咳的血清学诊断,主要是PT定量IgG抗体检测,使用国际单位/mL定量表示[16-17]。
2.3. 依据典型临床表现诊断百日咳的敏感度和特异度
表 1显示除了咳嗽持续时间≥2周,大多数临床诊断标准中还需要至少另外一个特征性表现,如阵发性咳嗽、吸气性回声,或咳嗽后呕吐。依据典型表现诊断百日咳的敏感度和特异度,不同研究之间的结果差异较大。Ghanaie等[18]分析了328例6~14岁咳嗽≥2周的儿童,经鼻咽拭子培养和PCR扩增百日咳杆菌特异的IS481或副百日咳杆菌特异的IS1001确诊百日咳,WHO临床标准的咳嗽≥2周加≥1个典型表现的敏感度为95.2%,特异度为15.0%;典型表现的数目增加,敏感度下降,特异度升高;咳嗽后呕吐增加特异度的效应最大。另一项前瞻性百日咳监测1995~1996年在密尼苏达开展,纳入人群为10~49岁具有急性阵发性咳嗽,或持续7~34 d咳嗽的患者。百日咳杆菌感染是通过培养、PCR或血清学滴度升高或单次PT抗体滴度高诊断。结果显示依据阵发性咳嗽诊断百日咳的敏感度为100%,特异度为12%;咳嗽后呕吐的敏感度为56%,特异度68%;回声的敏感度为28%,特异度为85%[19]。Miyashita等[20]的研究中纳入青少年和成人的咳嗽患者,包括183例经血清学和PCR确诊的百日咳和1 132例无确诊依据的病例,发现诊断百日咳时,阵发性咳嗽的敏感度为90%,但特异度低,仅25%;咳嗽后呕吐和回声的敏感度仅为25%和19%,但特异度高,分别为80%和86%;咳嗽后干呕(posttussive gagging)的敏感度和特异度分别为49%和77%;百日咳患者FeNO值平均为18.2 ppb,明显低于哮喘患者的56.9 ppb;综合分析,最有意义的依据为咳嗽后呕吐和/或干呕,加上正常FeNO值,其诊断百日咳敏感度为72%,特异度为70%。Nieves等[21]比较了32例 < 3月龄百日咳患儿与91例呼吸道合胞病毒或流感病毒感染患儿,发现百日咳患儿更多见无发热、入院前多次就诊、咳嗽病程、阵发性咳嗽、紫绀和急性危及生命事件。Shojaei等[22]分析了118例满足WHO百日咳临床标准的婴儿病例,其中19例经PCR确诊百日咳,比较实验室确诊和临床诊断的两组病例,发现两组患儿阵发性咳嗽和面色改变(facial discoloration)的发生状况没有不同,但确诊患儿明显更多见回声、呼吸暂停、白细胞升高(≥16 000/mm3)和淋巴细胞增多(≥11 000/mm3)。主张无热、阵发性咳嗽≥7 d,且有回声和/或呼吸暂停,尤其伴有白细胞/淋巴细胞增多的婴儿应该考虑百日咳。
从上述研究可发现,基于临床表现诊断百日咳明显会受当地其他类似疾病的流行病学状况的影响。另外,是否属于疫情暴发期,或是否为流行地区都可能影响评估结果。上世纪80年代,Patriarca等[23]在一个社区百日咳暴发期间评估了15个临床表现的诊断价值,发现≥14 d咳嗽对于诊断培养阳性的病例具有较高敏感度(77%~91%)和特异度(54%~71%)。但是,在无暴发的情况下,这些表现的诊断敏感度都很低[24]。
3. GPI建议的百日咳诊断标准
2011年GPI圆桌会议拟定了一份新的百日咳诊断建议,希望拟定标准比现有标准在诊断百日咳时更加特异和/或敏感,能适用于发达和不发达的国家或地区,能够促进实验室确诊方法的推广,从而增加百日咳上报的敏感度和特异度。
GPI按3个不同年龄段(0~3月龄、4月龄至9岁、≥10岁)给出了百日咳临床诊断标准和实验室检测方法的建议[1],见图 1。
1.
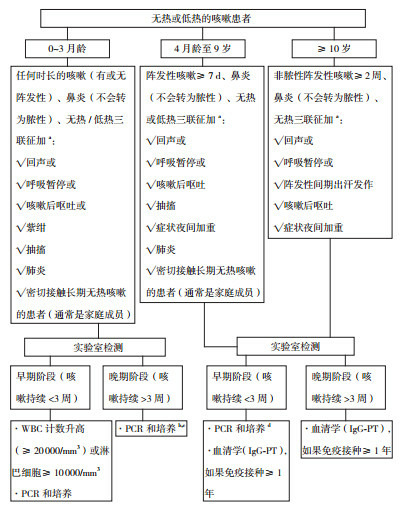
GPI建议的百日咳临床诊断标准和实验室检测方案注:此图基于建议[1]中的原图 2的内容,整合了图 1中有关实验室检测的内容。a示根据建议中的文字叙述有所修改;b示可能假阴性;c示在这个年龄段血清学检查没有意义;d示原文中仅有PCR。
建议中强调几个重要的临床表现因年龄而有所不同。0~3月龄的小婴儿病初常有无热、鼻炎和咳嗽表现,初次就诊时临床医生常首先考虑病毒性呼吸道感染。但其后1~2 d,父母常能观察到咳嗽加重,而医生通常看不到该加重过程。该年龄段疑诊百日咳的关键是无热、伴频率和严重度都在加重的咳嗽、鼻炎一直呈水性,上述三联征可能具有高的敏感度和特异度。在三联征的基础上,出现呼吸暂停、抽搐、紫绀、呕吐或肺炎表现将进一步增加诊断百日咳的特异度。这些小婴儿病例如果血常规白细胞计数升高(≥20 000/mm3),伴淋巴细胞血症事实上已可诊断。对小婴儿来说,临床上尤其要注意阵发性的呼吸暂停和抽搐。
4月龄至9岁儿童出现≥7 d持续加重的阵发性非脓性咳嗽(a worsening paroxysmal, nonproductive cough)、无热、伴不变为脓性的鼻炎也可能具有诊断百日咳的高敏感度和特异度。在此基础上出现回声、呼吸暂停或咳嗽后呕吐都会增加诊断的特异度。对于≥10岁的人群,上述4月龄至9岁的三联征也可能具有高的敏感度和特异度。此外,阵发性咳嗽间期的出汗发作(sweating episodes,出现于咳嗽发作的间期,与咳嗽没有直接关系)会明显增加特异度。成人患者常述说咳嗽有痰,但仔细询问就可确定并非脓性痰液。
对实验室诊断,GPI总的建议包括:病初3周,PCR和培养最有意义;接种无细胞或全细胞疫苗后1年内不要采用血清学诊断;ELISA检测抗PT IgG优于抗PT IgA检测;尤其不鼓励使用直接荧光抗体(direct fluorescent antibody)检测百日咳杆菌,也不鼓励在ELISA检测过程中使用全细胞百日咳杆菌作为抗原。
GPI建议的诊断标准主要基于专家经验,还缺乏针对性的临床研究。GPI专家组也认为应该先做些回顾性研究,如果该建议可接受,则应进一步针对3个不同年龄段开展前瞻性研究,来确定该标准是否能为临床所用,是否增加了百日咳诊断的敏感度和/或特异度[1]。实际上,GPI建议中还有些值得商榷的地方,比如年龄分段是否合适?年龄分段时是否要考虑不同国家和地区间疫苗接种程序的差异?是否要考虑患者的疫苗接种情况?加重过程如何客观评估和描述?新近描述的咳嗽后干呕[20]等有无诊断价值?同时,GPI建议中对实验室诊断的观点也比较宏观,还没有涉及到血清学诊断具体方法、界值等问题。国内临床医生应充分利用资源,不应满足于对典型百日咳临床表现的认识,受制于现行诊断标准,积极探索,对百日咳临床表现和变化过程需要进行更为细致的观察总结,发现更为敏感和特异的百日咳诊断线索,早日制定出更加切实可行的百日咳诊断标准,有效防控百日咳。
志谢
本文写作过程中,多次就有关内容求教于GPI建议(参考文献1)的通讯作者Cherry JD,他耐心地回复了有关问题,在此表示衷心感谢。
Biography
姚开虎, 男, 研究员, 副教授。Email: yaokaihu@bch.com.cn
Funding Statement
北京市科委行业定额经费自主项目(2016-bjsekyjs-3)
References
- 1.Cherry JD, Tan T, Wirsing von König CH, et al. Clinical definitions of pertussis:Summary of a Global Pertussis Initiative roundtable meeting, February 2011. Clin Infect Dis. 2012;54(12):1756–1764. doi: 10.1093/cid/cis302. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2.Forsyth KD, Wirsing von Konig CH, Tan T, et al. Prevention of pertussis:recommendations derived from the second Global Pertussis Initiative roundtable meeting. Vaccine. 2007;25(14):2634–2642. doi: 10.1016/j.vaccine.2006.12.017. [DOI] [PubMed] [Google Scholar]
- 3.World Health Organization; Dept. of Vaccines and Biologicals. WHO-recommended standards for surveillance of selected vaccine-preventable diseases[EB/OL]. (February 2003). http://apps.who.int/iris/bitstream/10665/68334/1/WHO_V-B_03.01_eng.pdf
- 4.Centers for Disease Control and Prevention (CDC). Manual for the Surveillance of Vaccine-Preventable Diseases: Chapter 10: Pertussis[EB/OL]. (January 1, 2014). http://www.cdc.gov/vaccines/pubs/surv-manual/chpt10-pertussis.html#laboratory.
- 5.Department of Health, Australian Government. Pertussis case definition[EB/OL]. (January 16, 2014). http://www.health.gov.au/internet/main/publishing.nsf/Content/cda-surveil-nndsscasedefs-cd_pertus.htm.
- 6.中华人民共和国卫生部.百日咳诊断标准及处理原则[EB/OL]. (1995-12-15). http://www.moh.gov.cn/zwgkzt/s9491/201212/34026.shtml.
- 7.中华人民共和国卫生部. WS 274-2007百日咳诊断标准[EB/OL]. (2007-04-17). http://www.moh.gov.cn/zwgkzt/s9491/201410/52040bc16d3b4eecae56ec28b3358666.shtml
- 8.Nieves DJ, Heininger U. Bordetella pertussis. Microbiol Spectr. 2016;4(3) doi: 10.1128/microbiolspec.EI10-0008-2015. [DOI] [PubMed] [Google Scholar]
- 9.Cherry JD. Epidemic pertussis in 2012-the resurgence of a vaccine-preventable disease. N Engl J Med. 2012;367(9):785–787. doi: 10.1056/NEJMp1209051. [DOI] [PubMed] [Google Scholar]
- 10.Cherry JD, Grimprel E, Guiso N, et al. Defining pertussis epidemiology:clinical, microbiologic and serologic perspectives. http://cn.bing.com/academic/profile?id=2086971286&encoded=0&v=paper_preview&mkt=zh-cn. Pediatr Infect Dis J. 2005;24(5 Suppl):S25–S34. doi: 10.1097/01.inf.0000160926.89577.3b. [DOI] [PubMed] [Google Scholar]
- 11.Koh MT, Liu CS, Chiu CH, et al. Under-recognized pertussis in adults from Asian countries:a cross-sectional seroprevalence study in Malaysia, Taiwan and Thailand. Epidemiol Infect. 2016;144(6):1192–1200. doi: 10.1017/S0950268815002393. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.He H, Yao P, Zhou Y, et al. Is pertussis infection neglected in China? Evidence from a seroepidemiology survey in Zhejiang, an eastern province of China. PLoS One. 2016;11(5):e0155965. doi: 10.1371/journal.pone.0155965. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.Chen Z, Zhang J, Cao L, et al. Seroprevalence of pertussis among adults in China where whole cell vaccines have been used for 50 years. J Infect. 2016;73(1):38–44. doi: 10.1016/j.jinf.2016.04.004. [DOI] [PubMed] [Google Scholar]
- 14.Mattoo S, Cherry JD. Molecular pathogenesis, epidemiology, and clinical manifestations of respiratory infections due to Bordetella pertussis and other Bordetella subspecies. Clin Microbiol Rev. 2005;18(2):326–382. doi: 10.1128/CMR.18.2.326-382.2005. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.Schmitt-Grohé S, Cherry JD, Heininger U, et al. Pertussis in German adults. Clin Infect Dis. 1995;21(4):860–866. doi: 10.1093/clinids/21.4.860. [DOI] [PubMed] [Google Scholar]
- 16.Huygen K, Rodeghiero C, Govaerts D, et al. Bordetella pertussis seroprevalence in Belgian adults aged 20-39 years, 2012. Epidemiol Infect. 2014;142(4):724–728. doi: 10.1017/S0950268813002458. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.Guiso N, Berbers G, Fry NK, et al. What to do and what not to do in serological diagnosis of pertussis:recommendations from EU reference laboratories. Eur J Clin Microbiol Infect Dis. 2011;30(3):307–312. doi: 10.1007/s10096-010-1104-y. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18.Ghanaie RM, Karimi A, Sadeghi H, et al. Sensitivity and specificity of the World Health Organization pertussis clinical case definition. Int J Infect Dis. 2010;14(12):e1072–e1075. doi: 10.1016/j.ijid.2010.07.005. [DOI] [PubMed] [Google Scholar]
- 19.Strebel P, Nordin J, Edwards K, et al. Population-based incidence of pertussis among adolescents and adults, Minnesota, 1995-1996. J Infect Dis. 2001;183(9):1353–1359. doi: 10.1086/jid.2001.183.issue-9. [DOI] [PubMed] [Google Scholar]
- 20.Miyashita N, Akaike H, Teranishi H, et al. Diagnostic value of symptoms and laboratory data for pertussis in adolescent and adult patients. BMC Infect Dis. 2013;13:129. doi: 10.1186/1471-2334-13-129. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 21.Nieves DJ, Singh J, Ashouri N, et al. Clinical and laboratory features of pertussis in infants at the onset of a California epidemic. J Pediatr. 2011;159(6):1044–1046. doi: 10.1016/j.jpeds.2011.08.010. [DOI] [PubMed] [Google Scholar]
- 22.Shojaei J, Saffar M, Hashemi A, et al. Clinical and laboratory features of pertussis in hospitalized infants with confirmed versus probable pertussis cases. Ann Med Health Sci Res. 2014;4(6):910–914. doi: 10.4103/2141-9248.144911. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 23.Patriarca PA, Biellik RJ, Sanden G, et al. Sensitivity and specificity of clinical case definitions for pertussis. Am J Public Health. 1988;78(7):833–836. doi: 10.2105/AJPH.78.7.833. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 24.Stehr K, Cherry JD, Heininger U, et al. A comparative efficacy trial in Germany in infants who received either the Lederle/Takeda acellular pertussis component DTP (DTaP) vaccine, the Lederle whole-cell component DTP vaccine, or DT vaccine. http://cn.bing.com/academic/profile?id=2052180986&encoded=0&v=paper_preview&mkt=zh-cn. Pediatrics. 1998;101(1 Pt 1):1–11. doi: 10.1542/peds.101.1.1. [DOI] [PubMed] [Google Scholar]


