Abstract
目的
探讨需肌醇酶1(IRE1)介导的内质网应激通路与高氧暴露肺泡Ⅱ型上皮细胞(AEC Ⅱ)凋亡的关系。
方法
原代培养早产大鼠AEC Ⅱ,随机分为空气组和高氧组,建立高氧细胞损伤模型。在24、48及72 h收集细胞,倒置相差显微镜观察细胞形态变化;Annexin V/PI双染流式细胞术检测细胞凋亡;RT-PCR及Western blot分别检测葡萄糖调节蛋白78(GRP78)、IRE1、X盒结合蛋白1(XBP1)及C/EBP同源蛋白(CHOP)mRNA及蛋白表达;免疫荧光检测CHOP表达。
结果
随着给氧时间延长,高氧组AEC Ⅱ伸展呈不规则形,出现空泡样改变;高氧组AEC Ⅱ凋亡率与同时间点空气组比较明显增加(P < 0.05);随着氧暴露时间延长,高氧组GRP78、IRE1、XBP1及CHOP mRNA及蛋白表达升高,且较同时间点空气组明显上升(P < 0.05);高氧组CHOP荧光强度高于同时间点空气组。高氧组CHOP蛋白表达与AEC Ⅱ凋亡率、IRE1及XBP1蛋白表达呈显著正相关(r=0.97、0.85、0.88,均P < 0.05)。
结论
高氧所致AEC Ⅱ凋亡可能是通过激活IRE1-XBP1-CHOP通路来实现。
Keywords: 内质网应激, 凋亡, 需肌醇酶1, C/EBP同源蛋白, 肺泡Ⅱ型上皮细胞, 大鼠
Abstract
Objective
To study the association between endoplasmic reticulum stress (ERS) pathway mediated by inositol-requiring kinase 1 (IRE1) and the apoptosis of type Ⅱ alveolar epithelial cells (AECⅡs) exposed to hyperoxia.
Methods
The primarily cultured AECⅡs from preterm rats were devided into an air group and a hyperoxia group. The model of hyperoxia-induced cell injury was established. The cells were harvested at 24, 48, and 72 hours after hyperoxia exposure. An inverted phase-contrast microscope was used to observe morphological changes of the cells. Annexin V/PI double staining flow cytometry was performed to measure cell apoptosis. RT-PCR and Western blot were used to measure the mRNA and protein expression of glucose-regulated protein 78 (GRP78), IRE1, X-box binding protein-1 (XBP-1), and C/EBP homologous protein (CHOP). An immunofluorescence assay was performed to measure the expression of CHOP.
Results
Over the time of hyperoxia exposure, the hyperoxia group showed irregular spreading and vacuolization of AECⅡs. Compared with the air group, the hyperoxia group showed a significantly increased apoptosis rate of AECⅡs and significantly increased mRNA and protein expression of GRP78, IRE1, XBP1, and CHOP compared at all time points (P < 0.05). The hyperoxia group had significantly greater fluorescence intensity of CHOP than the air group at all time points. In the hyperoxia group, the protein expression of CHOP was positively correlated with the apoptosis rate of AECⅡs and the protein expression of IRE1 and XBP1 (r=0.97, 0.85, and 0.88 respectively; P < 0.05).
Conclusions
Hyperoxia induces apoptosis of AECⅡs possibly through activating the IRE1-XBP1-CHOP pathway.
Keywords: Endoplasmic reticulum stress, Apoptosis, Inositol-requiring kinase 1, C/EBP homologous protein, Type Ⅱ alveolar epithelial cell, Rats
支气管肺发育不良(bronchopulmonary dysplasia, BPD)是威胁早产儿,特别是小早产儿生存及生活质量的常见呼吸系统疾病。高浓度氧治疗是早产儿BPD主要原因之一[1],但具体发病机制尚不十分清楚。肺泡Ⅱ型上皮细胞(type Ⅱ alveolar epithelial cell, AECⅡ)是肺内主要干细胞,研究发现[2],AECⅡ高氧损伤及凋亡在BPD形成中起重要作用。AECⅡ内质网丰富,具有发生内质网应激(endoplasmic reticulum stress, ERS)的结构基础。内质网应激相关凋亡是近年研究热点,与多种肺部疾病有关[3-4]。我们前期利用早产大鼠BPD模型研究已发现[5],高氧暴露后早产大鼠肺组织C/EBP同源蛋白(CHOP)表达明显增高,CHOP途径参与BPD中肺细胞凋亡。需肌醇酶1(inositol-requiring kinase 1, IRE1)是ERS感受信号之一,ERS状态下IRE1剪切X盒结合蛋白1(X-box binding protein-1, XBP1)前体mRNA生成编码XBP1s的mRNA,XBP1s可诱导下游ERS特异CHOP凋亡蛋白表达。已有研究指出[6],IRE1-XBP1-CHOP途径与非小细胞肺癌细胞凋亡密切相关。而IRE1-XBP1-CHOP途径与AECⅡ凋亡的关系目前研究甚少。本实验拟建立原代培养早产大鼠AECⅡ细胞高氧损伤模型,进一步从细胞层面探讨IRE1-XBP1-CHOP通路是否与AECⅡ凋亡相关。
1. 材料与方法
1.1. 材料
IV胶原酶(Sigma公司,美国);D/F12培养基(Hyclone公司,美国);胰蛋白酶(Invitrogen公司,美国);胎牛血清(Serpro公司,德国);双抗(Invitrogen公司,美国);SDS-PAGE配胶试剂盒(长沙艾佳生物技术有限公司);TRIzol(Invitrogen公司,美国);Prime-Script RT reagent Kit试剂盒、SYBR Premix Ex TaqTM试剂盒(TaKaRa公司,日本);兔抗大鼠β-actin、葡萄糖调节蛋白78(GRP78)、IRE1、XBP1s及CHOP单克隆抗体(CST公司,美国);辣根过氧化物酶标记山羊抗兔IgG(CST公司,美国);山羊抗兔IgG、FITC(北京康为世纪生物技术有限公司);FITC AnnexinV/PI流式试剂盒(BD公司,美国);ECL(Millipore公司,美国);引物由上海生工生物工程公司设计及合成(表 1);CYS-1数字式测氧仪(上海嘉定学联仪表厂)。
1.
引物序列

|
1.2. AECⅡ高氧损伤模型建立及分组
雌性清洁级Sprague-Dawley(SD)大鼠,体重200~220 g,雄性清洁级SD大鼠,体重220~250 g,由江苏大学实验动物中心提供。SD雌雄鼠按3:1合笼交配,次日晨取雌鼠阴道分泌物涂片,镜检见精子,当日记为妊娠第1天。孕19~20 d SD大鼠,无菌条件下剖腹取出胎鼠,并取胎鼠肺组织进行AECⅡ原代培养,按前期已报道方法进行[7]。AECⅡ接种15 h贴壁后,更换培养液并随机分为空气组和高氧组。高氧组按3 L/min通入95% O2+5% CO2 10 min,置于37℃、5% CO2培养箱中培养,空气组直接置于37℃、5% CO2培养箱中培养。每隔24 h更换培养液,高氧组重复以上操作。分别于给氧后24、48及72 h收获各组细胞,CYS-1数字式测氧仪检测培养瓶中O2浓度,低于900 mL/L O2浓度标本舍弃。
1.3. 倒置相差显微镜观察AECⅡ形态变化
在各时间点吸弃各组培养基,以PBS液洗涤细胞2遍,倒置相差显微镜观察细胞形态变化。
1.4. Annexin V/PI双染流式细胞术检测细胞凋亡
每组分别在24、48及72 h,各取8瓶细胞,吸弃培养基,以PBS液洗涤细胞2遍,用不含EDTA胰酶消化,每瓶细胞平均分3份收集于EP管中。严格按照FITC Annexin V/PI流式试剂盒说明处理细胞。处理后1 h内用Accuri C6流式机(BD公司,美国)检测各样本细胞凋亡率。
1.5. RT-PCR检测相关因子mRNA表达
每组分别在24、48及72 h,各取8瓶细胞,TRIzol试剂提取AECⅡ总RNA,紫外分光光度计(Thermo公司,美国)测定RNA纯度和含量,严格按照试剂盒说明书反转录合成cDNA,将每个样本平均分成3份在PCR扩增仪(Roche公司,美国)上进行扩增。PCR反应体系:12.5 μL SYBR Premix Ex TaqTM;PCR上下游引物(10 μM)各0.5 μL;0.5 μL ROX Reference Dye Ⅱ(×50);2.0 μL DNA模板;9.0 μL ddH2O;合计25 μL。PCR反应条件:95℃ 30 s;95℃ 5 s,60℃ 30 s,40个循环。以β-actin为内参照,采用2-△CT相对定量法进行分析。
1.6. Western blot检测相关因子蛋白表达
每组分别在24、48及72 h,各收集8瓶细胞,Ripa裂解液(含PMSF)提取各组细胞总蛋白。按每泳道取20 μg总蛋白进行SDS-PAGE凝胶电泳,湿式电转移至PVDF膜上,5%脱脂奶粉37℃封闭1 h后,以兔抗大鼠β-actin、GRP78、IRE1、XBP1s及CHOP IgG(1:1 000)4℃孵育过夜。第2天洗膜后,以辣根过氧化物酶标记的山羊抗兔单克隆IgG(1:5 000)孵育1 h,ECL化学发光显色。每次跑胶重复上样3次,GDS-8000型凝胶成像分析系统扫描并分析。以目的蛋白与β-actin条带积分吸光度的比值表示目的基因的相对表达水平。
1.7. CHOP免疫荧光检测
各时间点各组样本以PBS液洗涤3遍,4%多聚甲醛固定20 min,0.5% Triton通透化30 min,37℃封闭1 h,以兔抗大鼠CHOP IgG(1:200)4℃孵育过夜。第2天以FITC标记山羊抗兔IgG(1:300)37℃避光孵育1 h。DAPI染核2 min后荧光显微镜(Olympus公司,日本)观察拍照。
1.8. 统计学分析
采用SPSS 18.0统计软件对数据进行统计学分析,计量资料以均数±标准差(x±s)表示,两组样本间比较采用t检验;组内各时间点比较采用单因素方差分析,两两时间点比较采用SNK-q检验;两样本间相关性采用Pearson相关分析。P < 0.05为差异有统计学意义。
2. 结果
2.1. AECⅡ形态变化
空气组AECⅡ在24、48及72 h略呈梭形,细胞贴壁呈岛状生长,细胞饱满。高氧暴露24 h,AECⅡ颜色变暗,细胞内出现细小点状颗粒,部分细胞变小变圆;48 h后,细胞伸展呈不规则形,胞内点状颗粒增多,部分细胞漂浮于培养基中;72 h后,细胞形态更不规则,细胞颜色变暗,部分细胞呈空泡化改变,漂浮于培养基中的死细胞更多。
2.2. AECⅡ凋亡变化
Annexin V/PI双染流式细胞术检测各时间点各组AECⅡ凋亡情况,结果表明,各时间点空气组AECⅡ早期凋亡率均较低,而高氧组AECⅡ早期凋亡率明显增加,与同时间点空气组相比差异均有统计学意义(P < 0.05)。见表 2及图 1。
2.
空气组和高氧组AECII凋亡率比较(x±s,%)

|
1.

Annexin V/PI双染流式细胞术检测AECⅡ凋亡左上象限代表机械损伤细胞,左下象限代表正常细胞,右下象限代表早期凋亡细胞,右上象限代表晚期凋亡细胞。24、48及72 h,空气组早期凋亡率均较低,同时间点高氧组早期凋亡率均明显增加。
2.3. ERS相关因子mRNA表达变化
实时荧光定量PCR结果表明,各时间点空气组GRP78、IRE1、XBP1及CHOP mRNA表达量均较低;GRP78、IRE1、XBP1及CHOP mRNA表达随高氧暴露时间延长,表达量呈逐渐增高趋势(P < 0.05),且与同时间点空气组比较均增高,差异有统计学意义(P < 0.05)。见表 3。
3.
两组各时间点ERS相关因子mRNA表达比较(×10-3,x±s,n=8)

|
2.4. ERS相关因子蛋白表达变化
Western blot结果表明,随着高氧暴露时间延长,高氧组GRP78、IRE1、XBP1s、CHOP蛋白表达呈逐渐上升趋势(P < 0.05);与同时间点空气组相比升高明显,差异具有统计学意义(P < 0.05)。见图 2及表 4。
2.

Western blot检测ERS相关因子蛋白表达1:空气组24 h;2:高氧组24 h;3:空气组48 h;4:高氧组48 h;5:空气组72 h;6:高氧组72 h。[GRP78]葡萄糖调节蛋白78;[IRE1]需肌醇酶1;[XBP1]X盒结合蛋白1;[CHOP]C/EBP同源蛋白。
4.
两组各时间点ERS相关因子蛋白表达比较(x±s,n=8)

|
2.5. CHOP免疫荧光变化
免疫荧光显示CHOP定位于AECⅡ细胞核内。在24、48及72 h,空气组荧光强度较弱,CHOP表达量较少;而在各时间点高氧组,荧光强度增强,CHOP表达量增多。见图 3。
3.
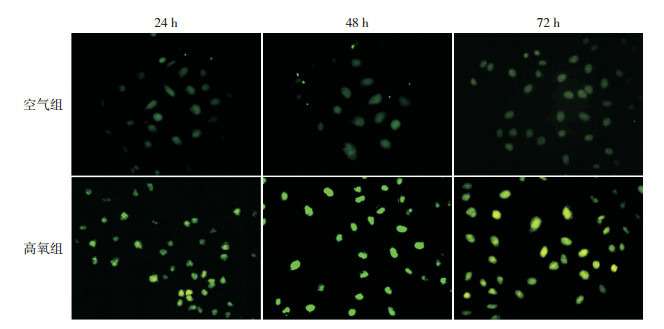
免疫荧光检测CHOP表达(免疫荧光,×400)CHOP呈绿色荧光。24、48及72 h,空气组荧光强度较弱,CHOP表达较少;同时间点高氧组,荧光强度增强,CHOP表达增多。
2.6. 相关性分析
高氧组AECⅡ CHOP蛋白表达与AECⅡ凋亡率、IRE1及XBP1s蛋白表达均呈显著正相关(r=0.97、0.85、0.88,均P < 0.05),见图 4~6。
4.

CHOP蛋白表达与AECII凋亡率相关分析图
6.

CHOP蛋白表达与XBP1蛋白表达相关分析图
5.

CHOP蛋白表达与IRE1蛋白表达相关分析图
3. 讨论
AECⅡ是肺内主要干细胞。Hou等[8]利用新生大鼠BPD模型及原代培养AECⅡ研究发现,高氧暴露后,BPD组大鼠肺泡间隔中断增多,高氧组AECⅡ凋亡及转分化较对照组明显增加。本实验研究结果显示,高氧暴露后,AECⅡ出现了颜色变暗、细胞伸展,细胞中出现细小颗粒并有空泡化改变,漂浮细胞增多等改变。Annexin V/PI双染流式细胞术结果表明,空气组AECⅡ凋亡率较低,而高氧组AECⅡ凋亡率较同时间点空气组明显增加,说明高氧使AECⅡ发生了形态改变并诱导AECⅡ凋亡增加。
ERS相关凋亡是新近研究发现的非经典凋亡途径,AECⅡ含有大量板层小体和粗面内质网,具有发生ERS的基础。正常情况下,GRP78与跨膜蛋白结合以维持内质网稳态,但任何应激破坏内质网稳态,即发生ERS时,GRP78便与跨膜蛋白解离,因此GRP78被认为是ERS标志性蛋白之一[9]。本研究结果显示,高氧组GRP78 mRNA及蛋白表达水平随着给氧时间延长逐渐增高,且显著高于同时间点空气组,说明高氧确实启动了AECⅡ过程。
CHOP是ERS特异的早期凋亡相关转录因子,可阻滞细胞分裂诱导细胞凋亡。CHOP凋亡途径已被证实与多种疾病有关,包括糖尿病,神经退行性疾病,癌症等[10]。有研究表明[11],沉默CHOP基因可改善小鼠肾纤维化,减轻肾细胞凋亡及氧化应激损伤。利用高氧暴露小鼠BPD模型及小鼠肺上皮细胞损伤模型研究发现[12],沉默CHOP基因可使不成熟肺组织损伤后发生重构,出现肺泡化,肺细胞死亡减少。但CHOP凋亡途径与AECⅡ凋亡的关系目前还不十分清楚。在本研究中,CHOP表达于核内,空气组CHOP荧光强度较弱,高氧组CHOP荧光强度较空气组明显增强。空气组CHOP mRNA及蛋白表达均较低,而随着给氧时间延长,CHOP mRNA及蛋白表达均呈逐渐上升趋势,与同时间点空气组比较,增加明显,且CHOP表达与细胞凋亡率呈显著正相关。以上结果进一步从细胞层面说明,高氧可激活CHOP途径并参与AECⅡ凋亡,但是沉默CHOP基因是否能抑制AECⅡ凋亡仍需进一步研究。
ERS有三条跨膜感受器,均可诱导CHOP表达。IRE1是内质网跨膜蛋白之一,与GRP78解离后发生自身寡聚化和磷酸化,同时激活自身核糖核酸内切酶活性,剪切XBP1前体mRNA生成能编码XBP1s的mRNA,XBP1s具有转录活性,可激活CHOP凋亡途径。IRE1通路对于细胞的生存和凋亡,发挥重要调控作用,并已被证实与多种疾病相关,包括糖尿病、癌症等[13]。van Schadewijk等[14]利用毒胡萝卜素诱导肺上皮细胞ERS,研究发现,XBP1在发生ERS的肺上皮细胞中表达明显增高,且和GRP78、CHOP表达呈显著正相关。本实验研究发现,空气组IRE1及XBP1表达均较低,随着给氧时间延长,高氧组IRE1及XBP1 mRNA及蛋白表达逐渐上升,且与同时间点空气组比较差异有统计学意义。IRE1、XBP1s蛋白表达均与CHOP蛋白表达呈显著正相关,说明高氧启动了AECⅡ中IRE1-XBP1-CHOP通路,且很可能与AECⅡ凋亡密切相关。Ghosh等[15]利用大量细胞和动物ERS模型研究发现,抑制IRE1通路可缓解ERS,拮抗细胞凋亡,保护细胞生理功能。因此推测,在高氧所致AECⅡ凋亡过程中抑制IRE1通路可能对AECⅡ具有保护作用。
综上所述,高氧激活了ERS相关的IRE1-XBP1-CHOP途径,并参与AECⅡ凋亡。应用基因敲除技术或拮抗剂抑制CHOP功能,或调控IRE1-XBP1-CHOP途径,对于高氧所致AECⅡ损伤是否具有保护作用仍有待进一步研究。
Biography
鞠慧敏, 女, 硕士研究生
Funding Statement
国家自然科学基金面上项目(81370746);镇江市社会发展项目(SH2015071)
References
- 1.Balany J, Bhandari V. Understanding the impact of infection, inflammation, and their persistence in the pathogenesis of bronchopulmonary dysplasia. http://cn.bing.com/academic/profile?id=2267251307&encoded=0&v=paper_preview&mkt=zh-cn. Front Med (Lausanne) 2015;2:90. doi: 10.3389/fmed.2015.00090. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2.Jin L, Yang H, Fu J, et al. Association between oxidative DNA damage and the expression of 8-oxoguanine DNA glycosylase 1 in lung epithelial cells of neonatal rats exposed to hyperoxia. http://cn.bing.com/academic/profile?id=2096216481&encoded=0&v=paper_preview&mkt=zh-cn. Mol Med Rep. 2015;11(6):4079–4086. doi: 10.3892/mmr.2015.3339. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.Kim SR, Lee YC. Endoplasmic reticulum stress and the related signaling networks in severe asthma. Allergy Asthma Immunol Res. 2015;7(2):106–117. doi: 10.4168/aair.2015.7.2.106. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.Koyama M, Furuhashi M, Ishimura S, et al. Reduction of endoplasmic reticulum stress by 4-phenylbutyric acid prevents the development of hypoxia-induced pulmonary arterial hypertension. Am J Physiol Heart Circ Physiol. 2014;306(9):H1314–H1323. doi: 10.1152/ajpheart.00869.2013. [DOI] [PubMed] [Google Scholar]
- 5.Lu HY, Zhang J, Wang QX, et al. Activation of the endoplasmic reticulum stress pathway involving CHOP in the lungs of rats with hyperoxia-induced bronchopulmonary dysplasia. http://cn.bing.com/academic/profile?id=2119706136&encoded=0&v=paper_preview&mkt=zh-cn. Mol Med Rep. 2015;12(3):4494–4500. doi: 10.3892/mmr.2015.3979. [DOI] [PubMed] [Google Scholar]
- 6.Wang LL, Hu RC, Dai AG, et al. Bevacizumab induces A549 cell apoptosis through the mechanism of endoplasmic reticulum stress in vitro. http://cn.bing.com/academic/profile?id=1012659431&encoded=0&v=paper_preview&mkt=zh-cn. Int J Clin Exp Pathol. 2015;8(5):5291–5299. [PMC free article] [PubMed] [Google Scholar]
- 7.卢 红艳, 常 立文, 汪 鸿, et al. 高氧对早产大鼠Ⅱ型肺泡上皮细胞转分化的影响. http://www.cnki.com.cn/Article/CJFDTOTAL-XBFM200606004.htm. 细胞与分子免疫学杂志. 2006;22(6):706–709. [PubMed] [Google Scholar]
- 8.Hou A, Fu J, Yang H, et al. Hyperoxia stimulates the transdifferentiation of type Ⅱ alveolar epithelial cells in newborn rats. Am J Physiol Lung Cell Mol Physiol. 2015;308(9):L861–L872. doi: 10.1152/ajplung.00099.2014. [DOI] [PubMed] [Google Scholar]
- 9.Feng J, Chen X, Sun X, et al. Expression of endoplasmic reticulum stress markers GRP78 and CHOP induced by oxidative stress in blue light-mediated damage of A2Econtaining retinal pigment epithelium cells. Ophthalmic Res. 2014;52(4):224–233. doi: 10.1159/000363387. [DOI] [PubMed] [Google Scholar]
- 10.Oyadomari S, Mori M. Roles of CHOP/GADD153 in endoplasmic reticulum stress. Cell Death Differ. 2004;11(4):381–389. doi: 10.1038/sj.cdd.4401373. [DOI] [PubMed] [Google Scholar]
- 11.Liu SH, Wu CT, Huang KH, et al. C/EBP homologous protein (CHOP) deficiency ameliorates renal fibrosis in unilateral ureteral obstructive kidney disease. http://cn.bing.com/academic/profile?id=2308491720&encoded=0&v=paper_preview&mkt=zh-cn. Oncotarget. 2016;7(16):21900–21912. doi: 10.18632/oncotarget.7870. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.Choo-Wing R, Syed MA, Harijith A, et al. Hyperoxia and interferon-γ-induced injury in developing lungs occur via cyclooxygenase-2 and the endoplasmic reticulum stressdependent pathway. Am J Respir Cell Mol Biol. 2013;48(6):749–757. doi: 10.1165/rcmb.2012-0381OC. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.Hetz C, Martinon F, Rodriguez D, et al. The unfolded protein response:integrating stress signals through the stress sensor IRE1α. Physiol Rev. 2011;91(4):1219–1243. doi: 10.1152/physrev.00001.2011. [DOI] [PubMed] [Google Scholar]
- 14.van Schadewijk A, van't Wout EF, Stolk J, et al. A quantitative method for detection of spliced X-box binding protein-1(XBP1) mRNA as a measure of endoplasmic reticulum (ER) stress. Cell Stress Chaperones. 2012;17(2):275–279. doi: 10.1007/s12192-011-0306-2. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.Ghosh R, Wang L, Wang ES, et al. Allosteric inhibition of the IRE1α RNase preserves cell viability and function during endoplasmic reticulum stress. Cell. 2014;158(3):534–548. doi: 10.1016/j.cell.2014.07.002. [DOI] [PMC free article] [PubMed] [Google Scholar]


