Abstract
目的
研究KyoT2对哮喘小鼠气道平滑肌细胞(ASMC)增殖和迁移的影响。
方法
卵白蛋白(OVA)诱导BALB/c小鼠建立哮喘气道重塑模型后,行ASMC分离和培养,并以原代培养的正常小鼠ASMC作为对照组。检测对照组和哮喘组小鼠ASMC中KyoT2的表达。哮喘小鼠ASMC转染pCMV-Myc(空载体组)和过表达KyoT2质粒pCMV-Myc-KyoT2(KyoT2过表达组)48 h后,采用RT-PCR和Western blot方法检测各组KyoT2 mRNA和蛋白表达;采用MTT法和BrdU法检测ASMC增殖;采用Transwell法检测ASMC的迁移。Western blot用于检测过表达KyoT2对RBP-Jκ、PTEN和AKT蛋白表达水平的影响。
结果
与对照组比较,哮喘组ASMC中KyoT2表达下调,KyoT2过表达组ASMC中KyoT2表达显著上调(P < 0.05)。与空载体组比较,KyoT2过表达抑制细胞增殖和细胞迁移(P < 0.05);且KyoT2过表达能下调RBP-Jκ和AKT的表达,上调PTEN的表达(P < 0.05)。
结论
KyoT2抑制哮喘ASMC增殖和迁移,其机制可能是通过负调控RBP-Jκ/PTEN/AKT信号通路来实现。
Keywords: KyoT2, 气道平滑肌细胞, 增殖, 迁移, RBP-Jκ/PTEN/AKT信号通路, 小鼠
Abstract
Objective
To investigate the effect of KyoT2 on the proliferation and migration of airway smooth muscle cells (ASMCs) in mice with asthma.
Methods
Ovalbumin (OVA) was used to establish the asthmatic model of airway remodeling in BALB/c mice. ASMCs were isolated and cultured, and primarily cultured ASMCs were used as the control group. The expression of KyoT2 in ASMCs was measured in the control and asthma groups. After the ASMCs from asthmatic mice were transfected with pCMV-Myc (empty vector group) or pCMV-Myc-KyoT2 plasmid with overexpressed KyoT2 (KyoT2 expression group) for 48 hours, RT-PCR and Western blot were used to measure the mRNA and protein expression of KyoT2, the MTT assay and BrdU assay were used to measure the proliferation of ASMCs, and Transwell assay was used to measure the migration of ASMCs. Western blot was used to determine the effect of KyoT2 overexpression on the protein expression of RBP-Jκ, PTEN, and AKT.
Results
Compared with the control group, the asthma group had significantly downregulated expression of KyoT2 in ASMCs, and the KyoT2 expression group had significantly upregulated expression of KyoT2 in ASMCs (P < 0.05). Compared with the empty vector group, overexpressed KyoT2 significantly inhibited cell proliferation and migration, downregulated the expression of RBP-Jκ and AKT, and upregulated the expression of PTEN.
Conclusions
Overexpressed KyoT2 can inhibit the proliferation and migration of ASMCs through the negative regulation of RBP-Jκ/PTEN/AKT signaling pathway.
Keywords: KyoT2, Airway smooth muscle cell, Proliferation, Migration, RBP-Jκ/PTEN/AKT signaling pathway, Mice
哮喘是常见的慢性呼吸道疾病之一,其发病率近年明显增加,目前仍是全球性的主要公共卫生问题[1]。据估计全球有约3亿哮喘患者,且儿童哮喘患病率高于成人,严重威胁青少年身体健康[2]。积极防治小儿支气管哮喘可防止气道不可逆性狭窄和气道重塑。
KyoT是一种LIM结构域蛋白,有两种类型:KyoT1和KyoT2蛋白,其中KyoT2可与RBP-Jκ相互作用[3]。有研究表明,在哮喘型小鼠中,过表达KyoT2抑制气道重塑[4]。气道平滑肌细胞(airway smooth muscle cells, ASMC)增殖和迁移参与哮喘的发生发展,是哮喘过程中重要的病理学变化[5]。KyoT2对ASMC的增殖和迁移作用尚未见报道。本研究拟通过卵白蛋白(ovalbumin, OVA)建立小鼠哮喘模型,观察KyoT2在哮喘小鼠ASMC中的表达;分离正常和哮喘小鼠的ASMC,探讨KyoT2对哮喘小鼠ASMC增殖和迁移的作用及可能的机制,为KyoT2防治哮喘气道重塑提供实验依据并奠定理论基础。
1. 材料与方法
1.1. 材料
OVA(Sigma公司,美国),胎牛血清(Hyclone,美国),0.25%胰蛋白酶和D-Hanks液(JRH公司,美国),MTT试剂盒(上海碧云天公司),BrdU试剂盒(Roche公司,瑞士),AKT、p-AKT、Myc和PTEN抗体(Cell Signaling公司,美国),KyoT2抗体(Abcam公司,美国),RBP-Jκ(Santa Cruz公司,美国),HRP标记的二抗(北京中杉金桥公司),Transwell小室(Corning公司,美国)。
1.2. 哮喘动物模型建立
3周龄SPF级雌性BALB/c小鼠16只,体重18~22 g,由西安交通大学医学院实验动物中心提供,随机分成对照组和哮喘组,每组8只。小鼠哮喘动物模型的建立参照文献[6]后略加改动,哮喘组小鼠于第0天和第14天腹腔注射致敏液0.1 mL/只,致敏液中含20 μg OVA和0.1 mL氢氧化铝凝胶;第21~27天以0.5%的OVA溶液雾化激发,每次20 min。对照组给予相同体积的生理盐水致敏、雾化。两组小鼠于最后1次雾化吸入后24 h颈椎脱臼处死,取气管作ASMC分离培养实验。
1.3. 小鼠ASMC分离及培养
运用组织贴块分离培养ASMC。小鼠经断颈处死,迅速分离气管部分,置入含有青霉素的D-Hanks溶液中,剥离外膜并刮除内膜,将气管小心剪成约1 mm3组织块,贴于培养皿底部,加入含20%胎牛血清的完全培养基。显微镜下观察组织块外缘细胞融合度达80%时,进行首次传代,按照1:2传代。
1.4. 细胞转染
过表达KyoT2的质粒pCMV-Myc-KyoT2和对照质粒pCMV-Myc由上海生工生物公司提供。将哮喘组ASMC接种于培养皿中,随机分为空载体组(转染pCMV-Myc的哮喘组ASMC)和KyoT2过表达组(转染pCMV-Myc-KyoT2的哮喘组ASMC)。无血清培养24 h,采用lipo2000试剂将pCMV-Myc和pCMV-Myc-KyoT2转入ASMC中,5 h后换上完全培养基继续培养48 h,收样后检测KyoT2转染效率。
1.5. MTT法检测ASMC增殖
ASMC经0.25%胰蛋白酶消化后,以1× 107/L的密度接种于96孔培养板中。细胞分为对照组(对照组ASMC)、哮喘组(哮喘组ASMC)、空载体组(转染pCMV-Myc的哮喘组ASMC)和KyoT2过表达组(转染pCMV-Myc-KyoT2的哮喘组ASMC),每组设置3个复孔。每孔加入5 g/L的MTT 20 μg,培养3.5 h后弃培养液,加入150 μL培养液,震荡10 min,选择570 nm波长,采用酶标仪检测各孔490 nm处的吸光度值(OD)。实验独立重复6次。
1.6. BrdU法检测ASMC增殖
细胞处理及分组情况同1.5小节,每组设置3个复孔。收样前8~10 h,每孔加入BrdU 10 μL。收样时弃上清,加入200 μL/孔Fix Denat室温反应30 min,弃上清,加入100 μL/孔anti-BrdU-POD工作液,室温反应90 min,弃上清,清洗4次,加入100 μL底物溶液,室温反应15 min。2 mol/L硫酸终止反应。实验独立重复6次。
1.7. Transwell检测细胞迁移
Transwell板上室和下室之间的聚碳酸酯膜采用I型胶原溶液于4℃过夜反应。ASMC经转染pCMV-Myc和pCMV-Myc-KyoT2 48 h后,消化细胞并计数,用含10%胎牛血清的培养基调整细胞密度为1×105/L,Transwell上室中加入各组细胞悬液100 μL,下室中加入600 μL含10%胎牛血清的培养基。将Transwell小室于37℃孵育6 h,擦去微孔膜上未穿膜的细胞,膜下面的ASMC采用甲醇固定,结晶紫染色10 min,封片,在倒置显微镜下,每组观察4张切片,每张切片随机选取5个视野进行计数,取平均值计算。实验独立重复6次。
1.8. Real-Time PCR
ASMC接种于6孔板中,分为对照组、空载体组和KyoT2过表达组。每组设3个平行样本,采用TRIzol提取各组细胞的总RNA。以总RNA为模板,采用逆转录试剂盒合成cDNA,引物由上海生工生物工程公司合成。KyoT2上游引物:5'-GACCAGAACGTGGAGTACAA-3',下游引物:5'-AGTCAGGGCAATACACCTGC-3';β-actin上游引物:5'-TGCTGTCCCTGTATGCCTCT-3',下游引物:5'-TTGATGTCACGCACGATTTC-3'。各组取5 μg cDNA为模板,选择25 μL的反应体系,94℃预变性2 min;94℃变性15 s,60℃退火30 s,72℃延伸30 s,共40个循环。每个基因用内参基因β-actin校准。目的基因的相对表达水平依据2-ΔΔCt法计算。实验独立重复6次。
1.9. Western blot法检测RBP-Jκ、PTEN和AKT蛋白表达
ASMC接种于6孔板中,分为哮喘组、空载体组和KyoT2过表达组。每组设3个平行样本,提取各组总蛋白。采用BCA试剂盒测定蛋白浓度,每组50 μg蛋白经SDS-PAGE电泳、转膜后,5%脱脂牛奶室温封闭1 h,加入一抗4℃反应过夜。加入HRP标记的二抗,室温反应1 h,采用化学发光液进行显色。采用Image J软件分析各个条带的OD值。实验重复6次。
1.10. 统计学分析
采用SPSS 11.0统计学软件对数据进行统计学分析,计量资料采用均数±标准差(x±s)表示,两组间比较采用t检验;多组间比较采用单因素方差分析,组间两两比较采用SNK-q检验。P < 0.05为差异有统计学意义。
2. 结果
2.1. KyoT2在哮喘ASMC中的表达
RT-PCR和Western blot用于检测KyoT2的表达。哮喘组ASMC中KyoT2 mRNA表达较对照组显著下降(P < 0.05)(图 1A)。将Myc-KyoT2转染至哮喘组ASMC中48 h,结果表明哮喘组ASMC中KyoT2蛋白表达较对照组下调(P < 0.05)(图 1B)。
1.
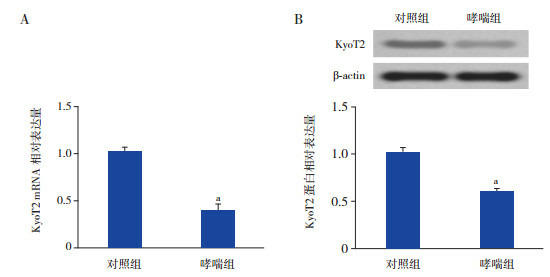
KyoT2在OVA诱导的哮喘小鼠ASMC中的表达A:RT-PCR检测KyoT2 mRNA表达水平(n=3);B:Western blot检测KyoT2蛋白表达水平(n=3)。a示与对照组相比,P < 0.05。
2.2. KyoT2转染效率
采用RT-PCR法检测KyoT2 mRNA表达水平。结果显示,与空载体组比较,过表达KyoT2显著上调其mRNA(图 2A,P < 0.05)和蛋白表达水平(图 2B,P < 0.05)。
2.
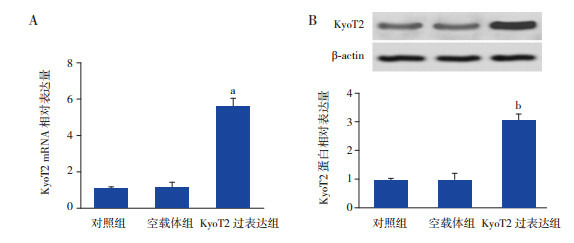
KyoT2的转染效率A:RT-PCR检测KyoT2 mRNA表达水平(n=3);B:Western blot检测KyoT2蛋白表达水平(n=3)。a示与空载体组相比,P < 0.01;b示与空载体组相比,P < 0.05。
2.3. 过表达KyoT2抑制ASMC增殖
分别采用MTT法和BrdU法检测ASMC增殖。结果显示,KyoT2过表达组细胞增殖速度较空载体组下降(图 3A,P < 0.05)。采用BrdU法进一步验证,KyoT2过表达组细胞BrdU掺入量较空载体组显著减少(图 3B,P < 0.05)。
3.
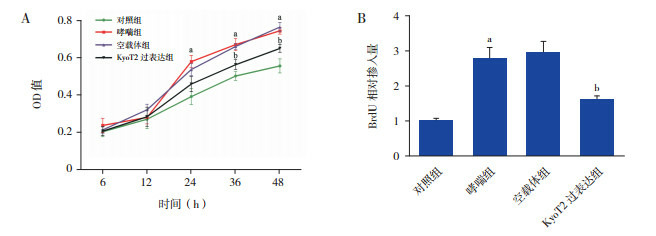
过表达KyoT2抑制ASMC增殖A:MTT法检测ASMC增殖(n=3);B:BrdU法检测ASMC增殖(n=3)。a示与对照组相比,P < 0.05;b示与空载体组相比,P < 0.05。
2.4. 过表达KyoT2抑制ASMC迁移
Transwell法用于检测过表达KyoT2对哮喘组ASMC迁移的作用,结果如图 4所示,哮喘组细胞迁移能力较对照组显著增强,而过表达KyoT2明显抑制OVA诱导的细胞迁移(P < 0.05)。
4.
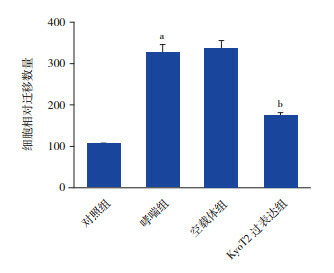
过表达KyoT2抑制ASMC迁移(n=4)a示与对照组相比,P < 0.05;b示与空载体组相比,P < 0.05。
2.5. 过表达KyoT2负调控RBP-J/PTEN/AKT通路
KyoT2能负调控RBP-Jκ的活性及表达[7],同时RBP-Jκ能与PTEN的启动子结合进一步调控PTEN的表达及下游信号通路[8]。本研究结果显示,在ASMC中过表达KyoT2能显著抑制RBP-Jκ(图 5A和B)和p-AKT(图 5A和D)的表达而上调PTEN的表达(图 5A和C)(P < 0.05)。
5.
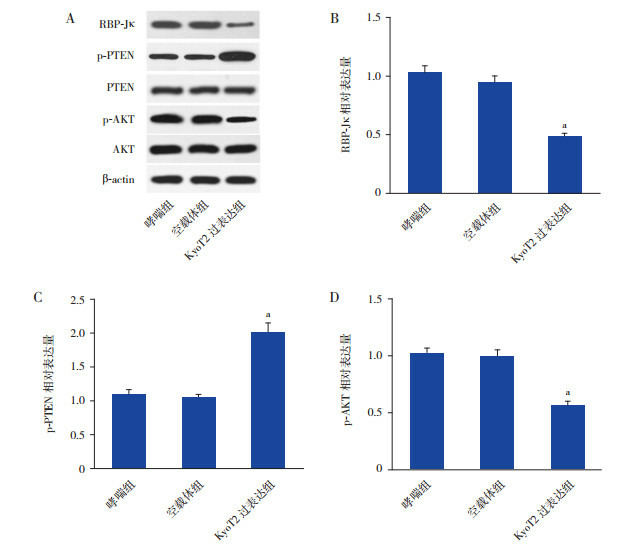
过表达KyoT2负调控RBP-Jκ/PTEN/AKT信号通路A:Western blot检测RBP-Jκ、PTEN和AKT蛋白表达水平(n=3);B:RBP-Jκ蛋白相对表达水平统计图(n=3);C:p-PTEN蛋白相对表达水平统计图(n=3);D:p-AKT蛋白相对表达水平统计图(n=3)。a示与空载体组相比,P < 0.05
3. 讨论
近年来,由于环境污染及社会因素,哮喘发病率显著升高,尤其儿童哮喘的发病率逐年上升[9]。OVA是常用哮喘致敏原,一般分为单纯和复合两种方式致敏和诱导哮喘。氢氧化铝作为佐剂乳化OVA,多次经腹腔或者皮下致敏后,再滴鼻或者雾化吸入诱导哮喘模型。哮喘作为一种反复性发作的疾病,长期反复发作会使气道发生不可逆的缩窄和重塑[10]。同时,哮喘发生伴随着ASMC增殖并向气管腔内迁移,进一步促进气道壁增厚[11]。ASMC的增殖和迁移导致哮喘的加重。KyoT2是Notch 1信号的负性调控因子[12],能下调小鼠肺组织Hes1的表达,减轻OVA诱导的哮喘模型小鼠气道上皮下胶原沉积,减轻基底膜的厚度[4]。本研究证实,过表达KyoT2能抑制哮喘ASMC增殖和迁移,其具体机制可能是通过负调控RBP-Jκ/PTEN/AKT通路实现。
KyoT2是Notch信号通路的负性调控因子,能与其下游分子RBP-Jκ结合抑制Notch信号通路[13]。本研究发现过表达KyoT2下调RBP-Jκ的表达。同时,PTEN是一个具有双特异性磷酸酶活性的抑癌基因,对细胞的生长、增殖、分化、迁移和血管生长等均有明显的调控作用。研究表明过表达PTEN可通过下调p-Akt的表达,抑制HASMC的增殖和迁移,参与调控气道重塑[14]。RBP-Jκ能够与PTEN启动子结合调控PTEN基因的表达,进一步调控其下游分子的表达[8]。本研究结果显示过表达KyoT2显著上调PTEN的表达并抑制p-AKT表达。因此,过表达KyoT2抑制ASMC增殖和迁移可能是通过负调控RBP-Jκ/PTEN/AKT通路实现。
综上所述,过表达KyoT2抑制ASMC增殖和迁移,其可能的机制是通过负调控RBP-Jκ/PTEN/AKT信号通路实现。提示KyoT2可能作为防治哮喘的靶分子,为KyoT2预防哮喘气道重塑提供实验依据和新的思路。
Biography
赵龙, 男, 本科, 主治医师。Email: hbo_liu@126.com
References
- 1.To T, Stanojevic S, Moores G, et al. Global asthma prevalence in adults:findings from the cross-sectional world health survey. BMC Public Health. 2012;12:204. doi: 10.1186/1471-2458-12-204. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2.Gasana J, Dillikar D, Mendy A, et al. Motor vehicle air pollution and asthma in children:a meta-analysis. Environ Res. 2012;117:36–45. doi: 10.1016/j.envres.2012.05.001. [DOI] [PubMed] [Google Scholar]
- 3.李 荣, 程 轶梦, 陈 蕾, et al. LIM蛋白KyoT在小鼠胚胎发育中的表达. http://www.cnki.com.cn/Article/CJFDTOTAL-SHSW200301017.htm 生物化学与生物物理进展. 2003;30(1):95–98. [Google Scholar]
- 4.Hu M, Ou-Yang HF, Han XP, et al. KyoT2 downregulates airway remodeling in asthma. http://cn.bing.com/academic/profile?id=2442028204&encoded=0&v=paper_preview&mkt=zh-cn. Int J Clin Exp Pathol. 2015;8(11):14171–14179. [PMC free article] [PubMed] [Google Scholar]
- 5.Li LH, Lu B, Wu HK, et al. Apigenin inhibits TGF-β1-induced proliferation and migration of airway smooth muscle cells. http://cn.bing.com/academic/profile?id=2418065255&encoded=0&v=paper_preview&mkt=zh-cn. Int J Clin Exp Pathol. 2015;8(10):12557–12563. [PMC free article] [PubMed] [Google Scholar]
- 6.Hamelmann E, Schwarze J, Takeda K, et al. Noninvasive measurement of airway responsiveness in allergic mice using barometric plethysmography. http://cn.bing.com/academic/profile?id=2153231621&encoded=0&v=paper_preview&mkt=zh-cn. Am J Respir Crit Care Med. 1997;156(3 Pt 1):766–775. doi: 10.1164/ajrccm.156.3.9606031. [DOI] [PubMed] [Google Scholar]
- 7.Qin H, Wang J, Liang Y, et al. RING1 inhibits transactivation of RBP-J by Notch through interaction with LIM protein KyoT2. Nucleic Acids Res. 2004;32(4):1492–1501. doi: 10.1093/nar/gkh295. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.Whelan JT, Forbes SL, Bertrand FE. CBF-1(RBP-J kappa) binds to the PTEN promoter and regulates PTEN gene expression. Cell Cycle. 2007;6(1):80–84. doi: 10.4161/cc.6.1.3648. [DOI] [PubMed] [Google Scholar]
- 9.Von Mutius E. The microbial environment and its influence on asthma prevention in early life. J Allergy Clin Immunol. 2016;137(3):680–689. doi: 10.1016/j.jaci.2015.12.1301. [DOI] [PubMed] [Google Scholar]
- 10.Ozdogan S, Tabakci B, Demirel AS, et al. The evaluation of risk factors for recurrent hospitalizations resulting from wheezing attacks in preschool children. Ital J Pediatr. 2015;41:91. doi: 10.1186/s13052-015-0201-z. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.Prakash YS. Airway smooth muscle in airway reactivity and remodeling:what have we learned. Am J Physiol Lung Cell Mol Physiol. 2013;305(12):L912–L933. doi: 10.1152/ajplung.00259.2013. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.秦 鸿雁, 韩 骅. KyoT2结合蛋白KBP1对RBP-J介导的转录活性的影响. http://mall.cnki.net/magazine/article/xbfm200405008.htm. 细胞与分子免疫学杂志. 2004;20(5):544–547. [PubMed] [Google Scholar]
- 13.Borggrefe T, Oswald F. Keeping notch target genes off:a CSL corepressor caught in the act. Structure. 2014;22(1):3–5. doi: 10.1016/j.str.2013.12.007. [DOI] [PubMed] [Google Scholar]
- 14.蓝 海兵, 罗 雅玲, 赖 文岩, et al. 肿瘤抑制基因PTEN对人气道平滑肌细胞迁移和增殖的影响. http://www.cnki.com.cn/Article/CJFDTOTAL-JXYB201503005.htm 南昌大学学报(医学版) 2015;55(3):14–18. [Google Scholar]


