Abstract
目的
探索槐杞黄在哮喘大鼠模型中的作用及相关机制。
方法
将40只Sprague-Dawley大鼠随机分为对照组、哮喘模型组、布地奈德组和槐杞黄组(n=10)。通过卵白蛋白致敏并激发建立哮喘大鼠模型,布地奈德组在每次激发前以布地奈德2 mg雾化,槐杞黄组在每次激发前以槐杞黄4 g/kg溶于水中灌胃。苏木精-伊红染色观察各组大鼠肺组织病理变化;计数肺泡灌洗液(BALF)中嗜酸性粒细胞比例;ELISA法检测各组BALF中细胞因子IL-3、IL-4、IL-5、IL-10、INF-γ及IgE浓度;流式细胞术检测外周血及脾脏中Th1/Th2细胞比例;RT-PCR法检测肺组织中T-bet、GATA-3 mRNA表达;应用Western bolt检测肺组织中T-bet、GATA-3蛋白表达。
结果
与对照组相比,哮喘组大鼠气道炎症程度明显增加;BALF中嗜酸性粒细胞比例显著升高;IL-3、IL-4、IL-5、IgE浓度显著升高,而IL-10、INF-γ浓度明显下降;外周血及脾脏Th1细胞比例明显降低,Th2细胞比例明显升高;肺组织T-bet mRNA及其蛋白表达水平明显降低,GATA-3 mRNA及其蛋白表达水平明显升高(P < 0.05)。槐杞黄及布地奈德均能明显改善哮喘大鼠气道炎症及上述指标水平(P < 0.05),且效果相当;但与对照组比较,差异仍有统计学意义(P < 0.05)。
结论
槐杞黄能改善哮喘大鼠气道炎症,缓解哮喘症状,其机制可能与调节相关细胞因子水平及Th1/Th2比例有关,这一作用可能经T-bet和GATA-3通路进行调控。
Keywords: 哮喘, 槐杞黄, Th细胞, T-bet, GATA-3, 大鼠
Abstract
Objective
To study the role and mechanism of action of Huai Qi Huang (HQH) in the rat model of asthma.
Methods
Forty Sprague-Dawley rats were randomly divided into a control group, an asthma model group, a budesonide group, and an HQH group, with 10 rats in each group. A rat model of asthma was established by ovalbumin sensitization and challenge. The budesonide group was given budesonide aerosol 2 mg before each challenge. The HQH group was given HQH 4 g/kg dissolved in water by gavage before each challenge. Hematoxylin and eosin staining was used to observe the pathological changes of lung tissues. The percentage of eosinophils in bronchoalveolar lavage fluid (BALF) was measured. Enzyme-linked immunosorbent assay was used to determine the levels of interleukin-3 (IL-3), interleukin-4 (IL-4), interleukin-5 (IL-5), interleukin-10 (IL-10), interferon gamma (INF-γ), and immunoglobulin E (IgE) in BALF. Flow cytometry was used to determine T-helper type 1 (Th1)/T-helper type 2 (Th2) ratio in peripheral blood and the spleen. RT-PCR and Western blot were used to measure the mRNA and protein expression of T-bet and GATA-3 in lung tissue.
Results
Compared with the control group, the asthma model group showed significant increases in the degree of airway inflammation, the percentage of eosinophils in BALF, and the levels of IL-3, IL-4, IL-5 and IgE in BALF (P < 0.05), however, the asthma model group showed significant reductions in the levels of IL-10 and INF-γ in BALF (P < 0.05). The asthma model group had significantly lower percentage of Th1 cells but significantly higher percentage of Th2 cells in peripheral blood and the spleen compared with the control group (P < 0.05). The mRNA and protein expression of T-bet in lung tissue was significantly lower, but the mRNA and protein expression of GATA-3 in lung tissue was significantly higher in the asthma group than those in the control group (P < 0.05). Both HQH and budesonide significantly improved airway inflammation and the above markers in asthmatic rats (P < 0.05), with comparable effects between them. However, there were still significant differences in these indices between the control group and the HQH or budesonide group (P < 0.05).
Conclusions
HQH can reduce the airway inflammation of asthmatic rats and alleviate the symptoms of asthma, possibly by regulating the levels of related cytokines and Th1/Th2 ratio through the T-bet/GATA-3 pathway.
Keywords: Asthma, Huai Qi Huang, Th lymphocyte, T-bet, GATA-3, Rats
支气管哮喘是儿童时期最常见的呼吸道慢性炎症性疾病[1]。近年来,儿童哮喘发病率呈上升趋势,严重影响了儿童的身心健康[1-2]。槐杞黄作为一种免疫调节剂,可激发机体免疫系统,提高患儿抵抗非特异性感染的能力[3-4],在临床中用于哮喘的辅助治疗和预防,但其对哮喘的作用及机制尚未明确。有研究表明,Th1/Th2功能失衡,Th2细胞优势分化是哮喘的发病机制之一[5],而转录因子T-bet和GATA3是决定Th1、Th2细胞亚群分化方向的重要因素[6]。本研究通过对哮喘大鼠模型应用槐杞黄后,观察其肺组织炎症改变,嗜酸性粒细胞水平及细胞因子变化,Th1、Th2细胞比例变化,以及T-bet和GATA3表达变化,以进一步探究槐杞黄对哮喘的作用及其机制。
1. 材料与方法
1.1. 实验动物及试剂
SPF级6~8周龄雄性Sprague-Dawley大鼠40只,购于北京华阜康生物科技股份有限公司,饲养于华中科技大学同济医学院动物实验中心SPF动物房内,饲养环境为22~25℃,12 h/12 h昼夜交替,自由饮水及摄食。槐杞黄颗粒(国药准字B20020074,10 g/袋,启东盖天力药业有限公司),吸入用布地奈德混悬液(药品批号324102,阿斯利康有限公司),卵白蛋白(OVA,美国Sigma公司),IL-3、IL-4、IL-5、IgE、IFN-γ ELISA试剂盒购于武汉伊莱瑞特生物科技有限公司。
1.2. 溶液配制
致敏液:将OVA溶于新鲜配制的10% Al(OH)3溶液中,充分搅拌混匀,使OVA的终浓度为0.2%。注意混悬液制备后,为保证致敏效果,应于1 h内使用。雾化液配制:将OVA与0.9% NaCl溶液搅拌使其混合均匀,使OVA的终浓度为1%。
1.3. 实验分组及哮喘模型的建立
将大鼠随机分为4组,分别为对照组、哮喘模型组、布地奈德组、槐杞黄组,每组10只。通过OVA致敏并激发建立哮喘大鼠模型[7]。哮喘模型组致敏:第1天采用传统的10点致敏法,包括两前后足趾4点,两侧腹股沟2点,颈部1点,背部左、中、右3点,每点皮下注射0.05 mL OVA致敏液,另腹腔注射0.5 mL OVA致敏液,OVA致敏总体积为每只大鼠1 mL。激发:第14~21天,将小鼠置于密闭容器中并以1%OVA溶液雾化30 min/d。布地奈德组:致敏和激发同哮喘组,从第14天开始,激发前30 min以布地奈德2 mg雾化,每天1次;槐杞黄组:致敏和激发同哮喘组,从第14天开始,激发前1~2 h,以槐杞黄4 g/kg剂量溶于2~3 mL水中,每天灌胃1次。对照组皮下及腹腔注射、雾化、灌胃,哮喘模型组、槐杞黄组激发前雾化,以及哮喘模型组、布地奈德组灌胃均用等量生理盐水替代。
1.4. 标本的采集
造模成功后24 h,以10%水合氯醛麻醉大鼠,取外周血。开胸游离出气管和肺,结扎右侧支气管,用0.5 mL生理盐水灌洗大鼠左侧支气管肺泡3次,取支气管肺泡灌洗液(BALF)备用。取左肺及脾脏,-80℃冰箱保存。取小鼠近肺门处的左肺组织,在4%多聚甲醛中固定约4~6 h,进行常规的石蜡包埋及切片,随机选取每个样本3张切片,以行染色检测。
1.5. 苏木精-伊红染色
将制备好的切片常规固定、脱水,以进行苏木精-伊红(HE)染色,用来观察气道的病理学改变。
1.6. BALF中嗜酸性粒细胞检测
取各组大鼠BALF,4℃、1 200 r/min离心5 min后,用1 mL Hank′s液重悬细胞,取0.2 mL涂片,瑞吉液染色,至少计数200个细胞作细胞分类计数,依据形态学特点计算嗜酸性粒细胞比例。
1.7. ELISA法检测细胞因子
使用IL-3、IL-4、IL-5、IgE、IFN-γ ELISA试剂盒(武汉伊莱瑞特生物科技有限公司)来测定每组大鼠BALF中细胞因子的浓度。实验步骤按照试剂盒说明书进行操作。根据标准曲线计算各组细胞因子的浓度。
1.8. 流式细胞仪检测Th1及Th2细胞比例
分离外周血及脾脏淋巴细胞,加1 mL RPMI1640完全培养基悬浮,每管加入终浓度为20 ng/mL的佛波醇,终浓度为1 μg/mL的钙离子霉素,终浓度为2 μmol/L的莫能菌素,37℃、5%CO2培养箱孵育4 h;然后加PBS 1 mL,2 000 r/min离心5 min,洗涤2次,PBS 100 μL重悬;加入CD4抗体,4℃避光孵育30 min;2 000 r/min离心3 min,PBS清洗2遍;加入2%多聚甲醛0.5 mL,室温固定20 min;离心,弃上清,加含0.1%皂素的PBS 1 mL,室温孵育10 min;离心,弃上清,加入300 μL PBS重悬,平均分成3管;每管分别加入IFN-γ、IL-4,4℃避光孵育30 min;离心,弃上清,2 000 r/min离心3 min,PBS清洗2遍;每管加入1%多聚甲醛0.1 mL,固定10 min;上机检测。
1.9. RT-PCR检测T-bet mRNA及GATA-3 mRNA水平
取-80℃冰箱中保存的各组大鼠新鲜冰冻肺组织100 mg,匀浆后采用TRIzol试剂裂解10 min,提取总RNA,用紫外分光光度计测定RNA的纯度和浓度。提取出的总RNA经逆转录反应体系逆转录成cDNA。10倍稀释cDNA,采用实时荧光定量PCR检测,引物由武汉巴菲尔生物技术服务有限公司设计并合成,序列见表 1。反应体系:cDNA(10×)4 μL,上下游引物(10 μmol/L)各0.4 μL,SYBR Green/Flourescein qPCR Master Mix(2×)10 μL,dH2O 5.2 μL。反应条件:50℃ 2 min,95℃10 min;95℃ 30 s,60℃ 30 s,40个循环。绘制溶解曲线,最终数据以2-△△Ct法进行分析。
1.
引物序列
| 基因 | 引物序列 | 片段长度 |
| GAPDH | Forward: 5′-ACAGCAACAGGGTGGTGGAC-3′ | 253 bp |
| Reverse: 5′-TTTGAGGGTGCAGCGAACTT-3′ | ||
| GATA-3 | Forward: 5′-ACTCCAGTCCGCATCTCTTC-3′ | 240 bp |
| Reverse: 5′-AGGGCGGATAGGTGGTAATG-3′ | ||
| T-bet | Forward: 5′-TCCGGGAGAACTTTGAGTCC-3′ | 237 bp |
| Reverse: 5′-TCACTGCTCGGAACTCTGTT-3′ |
1.10. Western blot检测T-bet及GATA-3蛋白水平
取不同组大鼠肺组织匀浆,细胞裂解液裂解,4℃下12 000 r/min离心5 min,取上清,BSA法测定蛋白浓度。每组取40 μg蛋白上样,聚丙烯酰胺凝胶电泳进行分离、转膜,以5%脱脂牛奶室温封闭1 h,电泳。加一抗过夜,漂洗后加脱脂牛奶稀释的辣根过氧化物酶标记的二抗,室温反应1 h,化学发光底物显色,胶片曝光,扫描。采用的一抗包括兔多克隆抗体T-bet(55 KD)(美国Invitrogen公司,PA5-40573)、兔多克隆抗体GATA-3(50 KD)(武汉三鹰生物技术有限公司,10417-1-AP)、兔多克隆抗体GAPDH(内参)(杭州贤至生物有限公司,AB-P-R 001),所有一抗稀释比例为1 : 1 000;采用的二抗是辣根过氧化物酶标记的羊抗兔二抗(武汉博士德生物工程有限公司,BA1054),稀释比例为1 : 50 000。所得图像在图像分析系统上分析,结果分别以T-bet、GATA-3与GAPDH的比值进行半定量分析。
1.11. 统计学分析
采用SPSS 17.0统计软件对数据进行统计学分析。符合正态分布计量资料采用均数±标准差(x±s)表示,多组间比较采用单因素方差分析,组间两两比较采用SNK-q检验。不符合正态分布计量资料采用中位数(四分位间距)[M(P25,P75)]表示,多组间比较采用Kruskal-Wallis H非参数检验,组间两两比较采用Nemenyi法。P < 0.05为差异有统计学意义。
2. 结果
2.1. 各组大鼠肺组织切片病理学表现
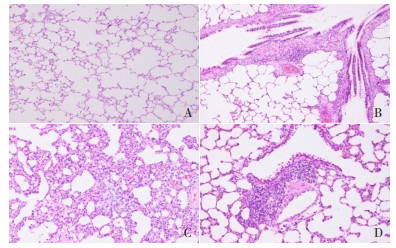
对照组大鼠肺泡结构正常;哮喘组大鼠肺泡壁结构受损,肺泡壁增厚,支气管腔狭窄,大量黏膜上皮细胞脱落,支气管与血管周围重度炎性细胞浸润;槐杞黄组大鼠肺泡腔较模型组变大,支气管壁水肿程度减轻,炎性细胞浸润程度明显降低,其病理变化程度与布地奈德组相近。见图 1。
1.
各组大鼠肺组织病理变化(苏木精-伊红染色,×400)
A为对照组,肺泡结构正常,肺泡腔内无渗出液,间隔无增宽,肺泡上皮细胞排列有序,肺泡壁厚度正常,无炎性细胞浸润;B为哮喘组,肺泡壁结构受损,肺泡壁增厚,支气管腔狭窄,大量黏膜上皮细胞脱落,支气管与血管周边疏松水肿及纤维化形成,支气管上皮杯状细胞化生,支气管与血管周围重度炎性细胞浸润,可见增生的淋巴滤泡;C为布地奈德组,肺泡腔较哮喘组变大,支气管腔有少量脱落的上皮细胞,支气管壁水肿程度减轻,炎性细胞浸润程度明显降低,可见部分增生的淋巴滤泡;D为槐杞黄组,病理变化程度与布地奈德组相近。
2.2. 各组大鼠BALF中嗜酸性粒细胞比例变化
各组大鼠BALF中嗜酸性粒细胞比例比较差异有统计学意义(n=10,F=28.537,P < 0.001)。哮喘组嗜酸性粒细胞比例(0.140±0.023)较对照组(0.016±0.005)显著增高(P < 0.01),槐杞黄组嗜酸性粒细胞比例(0.099±0.022)较哮喘组显著下降(P < 0.01),槐杞黄组与布地奈德组(0.080±0.030)相比差异无统计学意义(P > 0.05)。
2.3. 各组大鼠BALF中细胞因子水平变化
哮喘组BALF中IL-3、IL-4、IL-5、IgE浓度较对照组显著增加,IL-10、INF-γ浓度较对照组显著下降(P < 0.01);槐杞黄组IL-3、IL-4、IL-5、IgE浓度较哮喘组显著降低,IL-10、INF-γ浓度较哮喘组显著升高(P < 0.01),但与对照组相比,差异仍有统计学意义(P < 0.05);槐杞黄组与布地奈德组相比差异无统计学意义(P > 0.05)。见表 2。
2.
各组大鼠BALF中细胞因子水平比较 (x±s)
| 组别 | n | IL-3 (pg/mL) | IL-4 (pg/mL) | IL-5 (pg/mL) | IgE (ng/mL) | IL-10 (pg/mL) | INF-γ (pg/mL) |
| 注:a示与对照组比较,P < 0.05;b示与哮喘组比较,P < 0.05。 | |||||||
| 对照组 | 10 | 35±6 | 48±7 | 19.5±2.4 | 60±6 | 183±15 a | 249±13 |
| 哮喘组 | 10 | 86±8 a | 148±13 a | 51.5±6.1 a | 148±15 a | 74±13 a | 106±13 a |
| 布地奈德组 | 10 | 59±8 a, b | 90±9 a, b | 36.6±3.8 a, b | 96±12 a, b | 135±11 a, b | 182±20 a, b |
| 槐杞黄组 | 10 | 63±6 a, b | 105±11 a, b | 39.6±5.0 a, b | 106±9 a, b | 115±18 a, b | 166±11 a, b |
| F值 | 44.158 | 79.273 | 42.204 | 57.226 | 49.567 | 82.542 | |
| P值 | < 0.001 | < 0.001 | < 0.001 | < 0.001 | < 0.001 | < 0.001 | |
2.4. 各组外周血及脾脏Th1、Th2细胞比例变化
哮喘组外周血及脾脏Th1细胞比例较对照组显著降低(P < 0.05),Th2细胞比例较对照组显著增高(P < 0.05);槐杞黄组外周血及脾脏Th1细胞比例较哮喘组显著增加(P < 0.05),Th2细胞比例较哮喘组显著下降(P < 0.05);槐杞黄组外周血及脾脏Th1细胞比例与布地奈德组相比差异均无统计学意义(P > 0.05),槐杞黄组外周血Th2细胞比例与布地奈德组比较差异无统计学意义(P > 0.05),但脾脏Th2细胞比例高于布地奈德组(P < 0.05)。见表 3。
3.
各组外周血及脾脏Th1、Th2细胞比例比较
| 组别 | n | 外周血(x±s, %) | 脾脏[ M(P25, P75), %] | |||
| Th1 | Th2 | Th1 | Th2 | |||
| 注:a示与对照组比较,P < 0.05;b示与哮喘组比较,P < 0.05;c示与布地奈德组比较,P < 0.05。 | ||||||
| 对照组 | 10 | 13.6±1.1 | 4.3±0.6 | 14.51(14.09, 15.04) | 0.42(0.30, 2.68) | |
| 哮喘组 | 10 | 3.8±0.6 a | 13.4±1.0 a | 0.16(0.14, 1.28) a | 14.93(14.68, 15.42) a | |
| 布地奈德组 | 10 | 9.0±0.6 a, b | 9.7±1.0 a, b | 8.07(7.63, 8.12) a, b | 8.08(7.94, 8.27) a, b | |
| 槐杞黄组 | 10 | 9.8±1.0 a, b | 10.2±1.2 a, b | 8.90(8.59, 9.67) a, b | 10.27(9.43, 10.49) a, b, c | |
| F/H值 | 107.519 | 72.825 | 17.871 | 17.857 | ||
| P值 | < 0.001 | < 0.001 | < 0.001 | < 0.001 | ||
2.5. 各组T-bet、GATA-3 mRNA及其蛋白表达变化
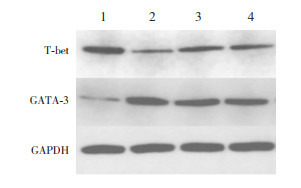
哮喘组T-bet mRNA及其蛋白表达较对照组显著降低(P < 0.05),GATA-3 mRNA及其蛋白表达较对照组显著增加(P < 0.05);槐杞黄组及布地奈德组T-bet mRNA及其蛋白表达较哮喘组显著增加(P < 0.05),GATA-3 mRNA及其蛋白表达较哮喘组显著下降(P < 0.05),但与对照组比较差异仍有统计学意义(P < 0.05);槐杞黄组与布地奈德组比较上述指标差异均无统计学意义(P > 0.05)。见图 2,表 4。
2.
Western blot检测各组T-bet及GATA-3蛋白表达电泳图
1.对照组;2.哮喘组;3.布地奈德组;4.槐杞黄组。
4.
各组T-bet、GATA-3 mRNA及其蛋白相对表达量 [x±s或M(P25, P75)]
| 组别 | n | mRNA | 蛋白表达 | |||
| T-bet | GATA-3 | T-bet | GATA-3 | |||
| 注:a示与对照组比较,P < 0.05;b示与哮喘组比较,P < 0.05。 | ||||||
| 对照组 | 10 | 1.04±0.12 | 1.02±0.14 | 0.82±0.05 | 0.28(0.23, 0.29) | |
| 哮喘组 | 10 | 0.48±0.10 a | 3.04±0.33 a | 0.28±0.03 a | 0.87(0.83, 0.99) a | |
| 布地奈德组 | 10 | 0.67±0.09 a, b | 2.05±0.33 a, b | 0.52±0.05 a, b | 0.63(0.58, 0.72) a, b | |
| 槐杞黄组 | 10 | 0.63±0.10 a, b | 2.03±0.27 a, b | 0.59±0.04 a, b | 0.57(0.56, 0.65) a, b | |
| F/H值 | 26.412 | 43.501 | 121.356 | 16.300 | ||
| P值 | < 0.001 | < 0.001 | < 0.001 | < 0.001 | ||
3. 讨论
经典免疫学说认为,Th1/Th2免疫失衡及Th2细胞优势分化是导致哮喘发病的重要机制[5]。Th1/Th2细胞失衡的同时,Th2细胞相关的细胞因子如IL-3、IL-4、IL-5、IgE等分泌增加,而Th1细胞相关的细胞因子IL-10、INF-γ等分泌减少,启动气道炎症及过敏反应,导致哮喘发作[8]。槐杞黄是一种真菌类药物,由槐耳菌、枸杞子、黄精等组成,槐耳的主要活性成分是槐耳多糖蛋白,其中由6个单糖结合18种氨基酸组成的结合蛋白,具有免疫调节作用[9]。临床研究表明,槐杞黄有助于儿童哮喘的治疗[10-11],但作用机制未明。
本研究结果显示,哮喘模型大鼠肺组织肺泡壁结构受损,肺泡壁增厚,支气管腔狭窄,黏膜上皮细胞脱落,支气管与血管周围重度炎性细胞浸润;槐杞黄干预后,支气管壁水肿程度减轻,管腔狭窄缓解,炎性细胞浸润程度明显降低,与布地奈德干预后效果相当,表明槐杞黄可显著降低哮喘所致肺泡壁损伤及气道炎症反应。哮喘模型组大鼠BALF中嗜酸性粒细胞比例较对照组显著升高,槐杞黄干预后BALF中嗜酸性粒细胞比例较哮喘组明显下降,与布地奈德组比较差异无统计学意义,表明槐杞黄能显著降低气道中嗜酸性粒细胞比例。
细胞因子IL-3、IL-4、IL-5均为Th2细胞产生。IL-4能诱导IgE的产生,抑制Th1细胞活化并分泌细胞因子,与IL-3协同刺激肥大细胞增殖,促进炎症及过敏反应性疾病;IL-5主要功能是刺激嗜酸性粒细胞增殖、分化及活化,同时还促进嗜碱性粒细胞释放组胺和白三烯等炎症介质;IL-10和INF-γ均为Th1细胞因子,可起到下调炎症反应的作用[5]。本研究结果显示,哮喘组大鼠BALF中IL-3、IL-4、IL-5、IgE浓度显著升高,IL-10、INF-γ浓度明显降低;槐杞黄干预后,IL-3、IL-4、IL-5、IgE浓度下降显著,IL-10、INF-γ浓度明显增高,与布地奈德干预的效果相当,表明槐杞黄能减轻哮喘发作时的炎症反应,减轻哮喘症状。张琴珍等[12]对槐杞黄在哮喘大鼠中的作用进行研究发现,槐杞黄可以抑制哮喘大鼠血清IgE和IL-5合成,促进INF-γ合成,调节Th1/Th2平衡,发挥其抗嗜酸性粒细胞性气道炎症的作用。
流式细胞仪检测结果更为直观的显示Th1和Th2细胞比例,哮喘组大鼠外周血及脾脏Th1细胞比例下降,Th2细胞比例增加,槐杞黄干预后Th1细胞比例增加,Th2细胞比例下降,与布地奈德干预的效果相当。这一结果与Liang等[13]进行的小鼠哮喘模型的研究结果相似,表明槐杞黄能纠正哮喘发作时的Th1/Th2免疫失衡,阻断哮喘病理进程。
特异性转录因子T-bet和GATA3是决定Th1、Th2细胞亚群分化方向的关键因素[6]。T-bet是人类免疫细胞中首次发现的T-box转录因子家族成员,是Th1淋巴细胞特异性转录因子。GATA3是GATA转录因子家族成员,是Th2细胞功能亚群分化的关键调控因子,通过诱导Th2细胞因子的产生,上调Th2细胞分化,还能通过抑制T-bet的表达,抑制Th1细胞信号通路[13]。本研究结果显示,哮喘组大鼠T-bet表达显著降低,GATA3表达显著上升,使Th1/Th2淋巴细胞比例失衡;而槐杞黄干预后,T-bet表达明显升高,GATA-3表达明显降低,逆转了Th1/Th2失衡,这一作用与布地奈德干预的效果相当,表明槐杞黄通过调节转录因子T-bet和GATA-3的表达,起到纠正哮喘发作时Th1/Th2细胞比例失衡的作用,从而缓解哮喘发作。
综上所述,槐杞黄能明显减轻哮喘大鼠肺泡壁损伤和气道炎症反应,降低嗜酸性粒细胞比例,同时使IL-3、IL-4、IL-5、IgE浓度显著下降,IL-10、INF-γ浓度显著增高,从而纠正Th1/Th2失衡,达到缓解哮喘发作的目的,这一作用是可能通过调节转录因子T-bet、GATA-3来实现的。槐杞黄口服可缓解哮喘病情,效果与吸入糖皮质激素相当,可作为儿童哮喘治疗的推荐方案。
Biographies
鲁娜, 女, 博士, 主治医师
Bai-Y, Email: yanbaixh@hust.edu.cn
Funding Statement
湖北省自然科学基金(2018CFB745)
References
- 1.中华医学会儿科学分会呼吸学组, 《中华儿科杂志》编辑委员会 儿童支气管哮喘诊断与防治指南(2016年版) 中华儿科杂志. 2016;54(3):167–181. doi: 10.3760/cma.j.issn.0578-1310.2016.03.003. [DOI] [Google Scholar]
- 2.李 昌崇, 朱 丽丽. 儿童支气管哮喘急性发作期治疗进展-各国支气管哮喘防治指南比较. 中华实用儿科临床杂志. 2017;32(16):1209–1214. doi: 10.3760/cma.j.issn.2095-428X.2017.16.003. [DOI] [Google Scholar]
- 3.张 红艳, 赵 淑景, 田 菲. 槐杞黄颗粒佐治小儿咳嗽变异性哮喘对免疫球蛋白、T淋巴细胞亚群及细胞因子的影响. http://d.old.wanfangdata.com.cn/Periodical/hainanyxyxb201703034 海南医学院学报. 2017;23(3):404–407. [Google Scholar]
- 4.刘 金, 闫 虹, 陈 小庚, et al. 槐杞黄颗粒对重型肺炎支原体肺炎患儿免疫功能的影响. http://www.zgddek.com/CN/abstract/abstract14306.shtml. 中国当代儿科杂志. 2017;19(7):759–762. doi: 10.7499/j.issn.1008-8830.2017.07.006. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Strickland DH, Holt PG. T regulatory cells in childhood asthma. Trends Immunol. 2011;32(9):420–427. doi: 10.1016/j.it.2011.06.010. [DOI] [PubMed] [Google Scholar]
- 6.Kardan M, Rafiei A, Ghaffari J, et al. Effect of ginger extract on expression of GATA3, T-bet and ROR-γt in peripheral blood mononuclear cells of patients with allergic asthma. Allergol Immunopathol (Madr) 2019;47(4):378–385. doi: 10.1016/j.aller.2018.12.003. [DOI] [PubMed] [Google Scholar]
- 7.王 雅娟, 赵 一婷, 戴 斌, et al. 两种大鼠哮喘模型的比较. 中国药理学通报. 2014;30(8):1175–1178. doi: 10.3969/j.issn.1001-1978.2014.08.028. [DOI] [Google Scholar]
- 8.Hu C, Li Z, Feng J, et al. Glucocorticoids modulate Th1 and Th2 responses in asthmatic mouse models by inhibition of Notch1 signaling. Int Arch Allergy Immunol. 2018;175(1-2):44–52. doi: 10.1159/000485890. [DOI] [PubMed] [Google Scholar]
- 9.张 书琳, 崔 岚巍. 槐耳及其复方制剂槐杞黄颗粒的研究进展. 医学综述. 2015;21(1):114–116. doi: 10.3969/j.issn.1006-2084.2015.01.045. [DOI] [Google Scholar]
- 10.金 世杰, 饶 花平, 丁 妞, et al. 槐杞黄颗粒辅助GINA方案治疗支气管哮喘患儿疗效观察. 中医儿科杂志. 2012;8(3):20–22. doi: 10.3969/j.issn.1673-4297.2012.03.010. [DOI] [Google Scholar]
- 11.景 晓平, 陈 文霞. 槐杞黄颗粒预防支气管哮喘儿童呼吸道反复感染的临床观察. http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=shzyydxxb201403014 上海中医药大学学报. 2014;28(3):39–42. [Google Scholar]
- 12.张 琴珍, 尚 云晓. 槐杞黄对哮喘大鼠BALF中IL-5及INF-γ的影响. 实用药物与临床. 2011;14(1):4–6. doi: 10.3969/j.issn.1673-0070.2011.01.002. [DOI] [Google Scholar]
- 13.Liang P, Peng S, Zhang M, et al. Huai Qi Huang corrects the balance of Th1/Th2 and Treg/Th17 in an ovalbumin-induced asthma mouse model. Biosci Rep. 2017;37(6):BSR20171071. doi: 10.1042/BSR20171071. [DOI] [PMC free article] [PubMed] [Google Scholar]


