Abstract
目的
利用改良的自然发育法构建早产大鼠动脉导管开放模型。
方法
基于自然发育法在构建早产大鼠动脉导管开放模型上的缺陷, 本研究对实验技术进行了改进, 避免固定方式、脱水处理及切片方式对血管管径的影响。将1只孕19 d的Wistar大鼠行剖宫产, 取出8只新生大鼠, 脱臼处死后整体包埋、避免脱水、微距切片、水平切片, 苏木精-伊红染色后镜下测量动脉导管、主肺动脉、降主动脉内径。
结果
孕19 d大鼠剖宫产术后8只新生大鼠动脉导管均开放。各血管内径测量结果显示:降主动脉长径:354±106 μm, 短径:182±140 μm; 动脉导管短径:155±122 μm, 面积:36 847±42 582 μm2; 主肺动脉长轴:589±150 μm, 短轴:174±170 μm。
结论
改良的早产大鼠动脉导管开放模型成功构建。
Keywords: 动脉导管开放, 动物模型, 早产, 大鼠
Abstract
Objective
To establish the patent ductus arteriosus model in preterm rats using the improved natural development method.
Methods
In the light of the flaws of the natural development method in establishing the patent ductus arteriosus model, the experimental technology was modified to avoid the influence of fixation, dehydration, and section method on blood vessel diameter. Cesarean section was performed for a Wistar rat pregnant for 19 days, and 8 neonatal rats were obtained. After they were sacrificed by dislocation, they were embedded as a whole to avoid dehydration, and the microsection and horizontal section were made. After hematoxylin and eosin staining, a microscope was used to measure the inner diameters of the ductus arteriosus, the main pulmonary artery, and the descending aorta.
Results
After the cesarean section for the rat pregnant for 19 days, patent ductus arteriosus occurred in all the 8 neonatal rats. The measurements of the inner diameters of blood vessels were as follows: the long diameter and short diameter of the descending aorta were 354±106 and 182±140 μm, respectively; the short diameter of the ductus arteriosus was 155±122 μm, and its area was 36 847±42 582 μm2; the long axis and short axis of the main pulmonary artery were 589±150 and 174±170 μm, respectively.
Conclusions
The improved natural development method can help to successfully establish the patent ductus arteriosus model in preterm rats.
Keywords: Patent ductus arteriosus, Animal model, Preterm, Rats
动脉导管开放(patent ductus arteriosus, PDA)是指胎儿时期连接肺动脉和主动脉之间的动脉导管在出生后未能正常关闭。大多数足月儿在生后48 h内动脉导管关闭[1]。早产儿因发育不成熟,出生后动脉导管多不能及时关闭。胎龄越小,出生体重越低,PDA发生率越高,对早产儿危害也越大[2-3]。
理想的PDA模型应该能够在血液动力学、组织学、分子生物学、病理生理机制、疾病进展的过程等方面模拟人类的PDA。而由于该类模型制作较难,目前国内外尚无统一公认的方法。以往国内外研究采用了模拟动脉导管未闭法[4],维持动脉导管开放法[5],先天畸形法[6]以及基因改造法[7],由于其制作过程复杂,不能完全模拟早产儿PDA,因而利用以上方法建立的PDA模型较为局限。近年来国内外研究者多采用自然发育法,该方法造模周期短、操作简便、模型成熟、可重复性好,可以较为贴近地模拟不同胎龄的早产儿PDA[8-10]。但这种建模方法也有以下几点局限性:(1)只切取新生大鼠的胸腔部分,使胸腔大血管横断,血管内血液流出,影响血管内径测量;(2)制作方法多采用传统的石蜡切片,制作过程中需要进行组织固定,蔗糖脱水,使得血管收缩;(3)切片通常间隔较远距离(50~300 μm)[11]观测一次,不能观测到管径的细微变化,容易遗漏重要信息;(4)切片方向大多为冠状面或矢状面,而动脉导管走行多为水平面,因而不能观察到动脉导管全长,无法精确测量动脉导管内径。针对以上缺点,本研究对自然发育法进行了自创性改良:即(1)整体包埋;(2)避免脱水;(3)微距切片;(4)水平切片,使得测量结果更加准确真实。
1. 材料与方法
1.1. 实验动物
90日龄雌、雄Wistar大鼠各1只(吉林大学基础医学院动物室提供),从第一天17点开始成对饲养,第二天早上8点,若雌性大鼠阴道口可见阴道栓,或阴道涂片观察有精子时记为怀孕0 d,标记后用营养型饲料和水单独喂养。
孕鼠于怀孕19 d时,在当天早上8点,乙醚麻醉,快速放入37℃ 75%酒精中浸泡2 s,置于解剖盘上,剪开腹部皮肤,暴露并取出子宫,浸入37℃ 75%酒精中浸泡2 s,用37℃生理盐水冲洗子宫,用灭菌纱布擦干后,再用另一剪刀剪开子宫,逐只取出新生大鼠。用无菌纱布擦拭口鼻,人工按压,直至新生大鼠自主呼吸恢复,全身鲜红。
1.2. 冰冻切片制作与动脉导管测量
取8只新生大鼠脱臼处死,将其直立于锡箔纸槽中,加冰冻切片包埋剂没过组织,包埋20 min。将包埋块置于液氮中迅速冷冻,于-80℃冰箱冻存。切片之前将切片机设置在-18℃,取出包埋组织块,去锡箔纸,用包埋剂将组织块连接于标本盘上,安装固定,修块,切掉胸腔上下部分,余下组织以水平面进行切片,厚度为8 μm,当肉眼可见主动脉弓时开始,连续留取切片150张,苏木精-伊红染色后置于光学显微镜下观察,选取其中第1张降主动脉轮廓完全的切片,测量降主动脉的长径与短径;选取其中动脉导管最宽的切片,测量动脉导管与降主动脉交汇处动脉导管的最大内径,并测量此内径与降主动脉包围形成的面积;选取其中主肺动脉分为左右肺动脉处的切片,测量分叉处与另一端的最长距离定义为长轴,并测量长轴的中垂线与主肺动脉相交所得的线段长度。
1.3. 统计学分析
使用SPSS 11.0统计软件对数据进行统计分析,结果以均数±95%置信区间(x±s±2.262×σ)表示。
2. 结果
剖宫产娩出的8只孕19 d新生大鼠均成活,动脉导管均开放,此模型可以清晰观测到降主动脉、动脉导管及主肺动脉,造模成功。各血管内径测量结果显示:降主动脉长径:354±106 μm,短径:182±140 μm;动脉导管短径:155±122 μm,面积:36 847±42 582 μm2;主肺动脉长轴:589±150 μm,短轴:174±170 μm。见表 1及图 1。
1.
早产大鼠降主动脉、动脉导管及主肺动脉内径测量
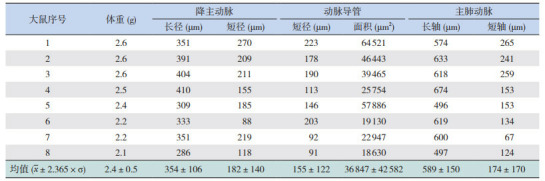
|
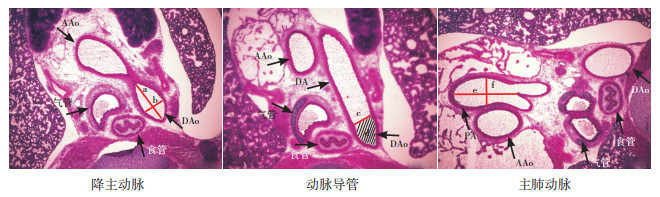
1.
早产大鼠降主动脉、动脉导管及主肺动脉内径水平面测量(苏木精-伊红染色,×40)
降主动脉(DAo)测量:a为DAo长径,b为DAo短径;动脉导管(DA)测量:取DA与DAo交汇处最大内径为短径c,并且测得此短径与DAo包围形成的面积d;主肺动脉(PA)测量:取PA分为左右肺动脉处,测得分叉处与另一端最长距离为长轴e,并且取长轴的中垂线与该图形相交所得线段为短轴f。[AAo]升主动脉。
3. 讨论
大鼠动脉导管在早期胚胎发育、解剖结构、功能代谢、发生发展机制、超微结构等方面都与人类动脉导管具有相似性,因此利用大鼠建立PDA模型能够更接近于人类的PDA,以便于在机制、诊断、治疗等方面对PDA的研究[12]。
目前国内外对大鼠早产的时间限制尚无统一标准,一般认为19 d的胚胎未成熟,动脉导管无法自发闭合,模拟PDA早产儿;21 d的胚胎是成熟的,动脉导管可以自发闭合,模拟足月新生儿[8-10],根据文献报道[13]:小鼠孕龄16 d为孕82%,孕龄17 d为孕87%,孕龄19.5 d为孕100%。但未见对大鼠胎龄百分率的报道,根据对小鼠胎龄的报道,我们推断大鼠胎龄19 d相当于孕88.3%,由于胎龄越小对PDA的影响越大,故考虑到新生鼠的成活率以及对疾病的模拟,本研究采用孕19 d而非20 d或18 d大鼠进行剖宫产。
本实验以胎龄为19 d的早产Wistar大鼠为研究对象,利用冰冻切片、苏木精-伊红染色,建立早产大鼠动脉导管、降主动脉、主肺动脉直径的正常标准值,构建早产大鼠PDA动物模型。
本研究测得的降主动脉、动脉导管及主肺动脉内径与Toyono等[11]学者利用自然发育法测量的结果存在差异,其文献报道的结果为:降主动脉内径590±10 μm;动脉导管内径490±10 μm;主肺动脉内径490±10 μm,除包埋方法及切片间隔厚度不同外,上述数据的测得是采用冠状面、矢状面进行测量,在主肺动脉与左右肺动脉分支处测量主肺动脉内径,在动脉导管连接降主动脉处测量动脉导管内径,在升主动脉、降主动脉纵向中点测量它们的内径。本研究与之不同如下:(1)整体包埋新生大鼠,避免胸腔大血管横断、血管内血液流出,使得血管内径测量更为精准;(2)制作方法采用冰冻切片,瞬时冷冻,使血管内径瞬时固定保持不变;制作过程中不进行福尔马林固定与蔗糖脱水,避免福尔马林、蔗糖溶液引起的血管收缩;(3)切片厚度为8 μm,每张冰冻切片都进行镜下观测,可以观测到管径的细微变化,提高测量的精确度,避免遗漏重要信息;(4)切片方向选择水平位,与动脉导管走行基本一致,因而可以观察到动脉导管全长,一览动脉导管全貌,便于选择动脉导管的测量点;(5)在主动脉弓下第一张降主动脉轮廓完全的切片上,测得降主动脉长径与短径;取动脉导管与降主动脉交汇处最大内径处测动脉导管内径,并且测得此短径与降主动脉包围形成的面积;取主肺动脉分为左右肺动脉分叉处与另一端最长距离为主肺动脉长轴,并且取长轴的中垂线与该图形相交所得线段为短轴。以上五点使得测量结果更加准确真实。
为提高模型制作质量,在大鼠受孕监测方法、剖宫产技术方面应注意以下两点。(1)通过阴道栓法与阴道涂片法相结合,根据阴道涂片判断大鼠性周期来安排交配,能够提高大鼠受孕时间的准确性;(2)剖宫产时程、术后环境温度、正确计算妊娠日期会影响胎鼠出生生存率,而剖宫产时间延长会导致新生大鼠窒息,进而影响动脉导管的内径。
本模型的不足:由于本模型的建立需要进行大鼠的繁育,因而耗时较长,而且要求一定的手术及操作技术,在以后的模型应用中常常还需要代乳母鼠,以保证早产/足月大鼠存活。
Biography
朱梦茹, 女, 硕士研究生
Funding Statement
吉林省科技厅自然科学基金(20160101071JC)
References
- 1.Reese J. Patent ductus arteriosus: mechanisms and management. Semin Perinatol. 2012;36(2):89–91. doi: 10.1053/j.semperi.2011.09.017. [DOI] [PubMed] [Google Scholar]
- 2.Evans N. Preterm patent ductus arteriosus: a continuing conundrum for the neonatologist? Semin Fetal Neonatal Med. 2015;20(4):272–277. doi: 10.1016/j.siny.2015.03.004. [DOI] [PubMed] [Google Scholar]
- 3.Ohlsson A, Walia R, Shah SS. Ibuprofen for the treatment of patent ductus arteriosus in preterm or low birth weight (or both) infants. http://cn.bing.com/academic/profile?id=0cce127fd2852fc5c9db453432ac14aa&encoded=0&v=paper_preview&mkt=zh-cn. Cochrane Database Syst Rev. 2015;2:CD003481. doi: 10.1002/14651858.CD003481.pub6. [DOI] [PubMed] [Google Scholar]
- 4.Huang YY, Wong YS, Chan JN, et al. A fully biodegradable patent ductus arteriosus occlude. J Mater Sci Mater Med. 2015;26(2):93. doi: 10.1007/s10856-015-5422-6. [DOI] [PubMed] [Google Scholar]
- 5.Tanke RB, van Heijst AF, Klaessens JH, et al. Measurement of the ductal L-R shunt during extracorporeal membrane oxygenation in the lamb. J Pediatr Surg. 2004;39(1):43–47. doi: 10.1016/j.jpedsurg.2003.09.017. [DOI] [PubMed] [Google Scholar]
- 6.Hsieh YT, Liu NM, Ohmori E, et al. Transcription profiles of the ductus arteriosus in Brown-Norway rats with irregular elastic fiber formation. Circ J. 2014;78(5):1224–1233. doi: 10.1253/circj.CJ-13-1029. [DOI] [PubMed] [Google Scholar]
- 7.Baeten JT, Jackson AR, McHugh KM, et al. Loss of Notch 2 and Notch 3 in vascular smooth muscle causes patent ductus arteriosus. Genesis. 2015;53(12):738–748. doi: 10.1002/dvg.22904. [DOI] [PubMed] [Google Scholar]
- 8.Bökenkamp R, van Brempt R, van Munsteren JC, et al. Dlx 1 and Rgs 5 in the ductus arteriosus: vessel-specific genes identified by transcriptional profiling of laser-capture microdissected endothelial and smooth muscle cells. PLoS One. 2014;9(1):e86892. doi: 10.1371/journal.pone.0086892. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.Yokota T, Aida T, Ichikawa Y, et al. Low-dose thromboxane A2 receptor stimulation promotes closure of the rat ductus arteriosus with minimal adverse effects. Pediatr Res. 2012;72(2):129–136. doi: 10.1038/pr.2012.68. [DOI] [PubMed] [Google Scholar]
- 10.Yokota T, Shiraishi R, Aida T, et al. Thromboxane A(2) receptor stimulation promotes closure of the rat ductus arteriosus through enhancing neointima formation. PLoS One. 2014;9(4):e94895. doi: 10.1371/journal.pone.0094895. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.Toyono M, Ito T, Harada K, et al. Morphological adaptation of the cardiovascular system in fetal rats during late gestation. Tohoku J Exp Med. 1999;188(4):299–309. doi: 10.1620/tjem.188.299. [DOI] [PubMed] [Google Scholar]
- 12.Coceani F, Baragatti B. Mechanisms for ductus arteriosus closure. Semin Perinatol. 2012;36(2):92–97. doi: 10.1053/j.semperi.2011.09.018. [DOI] [PubMed] [Google Scholar]
- 13.Trivedi D B, Sugimoto Y, Loftin C D. Attenuated cyclooxygenase-2 expression contributes to patent ductus arteriosus in preterm mice. Pediatr Res. 2006;60(6):669–674. doi: 10.1203/01.pdr.0000246480.13170.c0. [DOI] [PubMed] [Google Scholar]


