Abstract
目的
探讨早期早产儿动脉导管未闭(PDA)发生的危险因素, 为进一步减少早产儿PDA的发生提供临床依据。
方法
将2013年1月至2014年12月住院治疗的136例诊断为有血流动力学意义的PDA(hs-PDA)的早期早产儿(胎龄≤ 32周)设为病例组, 按1:1的比例从同期住院的早期早产儿中按匹配病例对照原则抽取136例无hs-PDA的早产儿作为对照组, 两组匹配因素包括性别及胎龄。收集可能与PDA发生有关的新生儿基本情况、母亲孕期及围产期情况等资料, 应用多因素条件logistic回归分析筛选PDA发生的危险因素。
结果
单因素分析结果显示:新生儿感染性疾病、新生儿呼吸窘迫综合征(RDS)、生后24 h内血小板计数减低及低出生体重与hs-PDA的发生相关(P < 0.05)。多因素条件logistic回归分析显示新生儿感染性疾病(OR=2.368)及生后24 h内血小板计数减低(OR=0.996)是hs-PDA发生的独立危险因素。
结论
新生儿感染性疾病及生后24 h内血小板计数减低会增加早期早产儿hs-PDA的发生风险。
Keywords: 动脉导管未闭, 危险因素, 病例对照研究, 早产儿
Abstract
Objective
To investigate the risk factors for the occurrence of patent ductus arteriosus (PDA) and to provide a clinical basis for reducing the occurrence of PDA in early preterm infants.
Methods
A total of 136 early preterm infants (gestational age ≤32 weeks) who were hospitalized between January 2013 and December 2014 and diagnosed with hemodynamicalhy significant PDA (hs-PDA) were enrolled as the case group. Based on the matched case-control principle, 136 early preterm infants without hs-PDA were selected among those who were hospitalized within the same period at a ratio of 1:1 and enrolled as the control group. The two groups were matched for sex and gestational age. The basic information of neonates and maternal conditions during the pregnancy and perinatal periods were collected. Logistic regression analysis was performed to identify the risk factors for the development of PDA.
Results
Univariate analysis showed that neonatal infectious diseases, neonatal respiratory distress syndrome, decreased platelet count within 24 hours after birth, and low birth weight were associated with the development of hs-PDA (P < 0.05). Multivariate conditional logistic regression analysis revealed that neonatal infectious diseases (OR=2.368) and decreased platelet count within 24 hours after birth (OR=0.996) were independent risk factors for hs-PDA.
Conclusions
Neonatal infectious diseases and decreased platelet count within 24 hours after birth increase the risk of hs-PDA in early preterm infants.
Keywords: Patent ductus arteriosus, Risk factor, Case-control study, Preterm infant
动脉导管未闭(patent ductus arteriosus, PDA)在早产儿的发生率波动于18%~77%,出生体重 < 1 000 g的新生儿其发生率高达67%,胎龄 < 32周的早期早产儿其发生率为20%[1-3]。有血流动力学意义的PDA(hemodynamic significant PDA,hs-PDA)可导致肺水肿、机械通气时间延长、支气管肺发育不良、早产儿坏死性小肠结肠炎、肾功能减低、颅内出血,甚至死亡等严重并发症[4-6],是影响早产儿存活率的重要原因之一。根据目前国内外文献报道,与PDA发生相关的因素有胎龄小、低出生体重、宫内感染、宫内窘迫、宫内发育迟缓、孕母产前应用硫酸镁、孕母产前应用糖皮质激素、妊娠期高血压疾病、生后缺氧、呼吸窘迫综合征(RDS)、血小板减少、液体入量过多以及遗传因素等[7-16],但部分研究指出,孕母产前应用硫酸镁及血小板减少与PDA发生无相关性[17-19],甚至有报道指出妊娠期高血压疾病及保护性遗传因素可减少PDA的发生[13, 20]。本研究旨在进一步明确hs-PDA的危险因素,为早产儿hs-PDA的防治提供临床依据。
1. 资料与方法
1.1. 研究对象
选取2013年1月至2014年12月于吉林大学第一医院住院治疗、胎龄≤32周、生后24 h内入院,并于生后3 d内经彩色多普勒超声检查诊断为hs-PDA(hs-PDA的诊断标准见纳入标准)的136例早期早产儿作为病例组,并按1 : 1的比例从同期住院的早期早产儿中随机抽取136例无hs-PDA的早产儿作为对照组,两组的匹配因素包括性别及胎龄(±2 d)。
纳入标准:(1)胎龄≤32周;(2)生后24 h内入院;(3)病例组患儿生后3 d内经彩色多普勒超声检查诊断为hs-PDA,其诊断为出现以下至少1条标准:动脉导管(ductus arteriosus, DA)内径直径≥1.5 mm,左房径与主动脉根部直径比值> 1.6,导管内非限制性血流,舒张期降主动脉反向血流[21];(4)住院资料完整。
排除标准:先天性心脏病、心肌炎、心肌病、充血性心力衰竭、染色体疾病及出生后不足3 d死亡或放弃治疗者。
1.2. 研究方法
根据文献报道选择可能与PDA发生有关的因素设计统一的病例调查表,按调查表查阅病历,病例中记载不全的以电话询问的方式予以调查。调查内容包括以下几方面:(1)新生儿基本情况:性别、胎龄、是否为多胎、出生体重、生后缺氧(1 min Apgar评分≤7分)、生后24 h内血小板计数、有无新生儿RDS(RDS诊断标准参照文献[22]);(2)母亲孕期情况:是否患有妊娠期高血压疾病(诊断标准参照文献[23])、有无胎膜早破(诊断标准参照文献[24]);(3)感染性疾病(纳入标准为宫内感染及生后7 d内的细菌性感染)。宫内感染诊断标准参照文献[25]。生后7 d内细菌性感染诊断标准为:①临床表现或体征:发热或低温;少吃、少哭、少动、面色欠佳、体重不增加或增加缓慢;黄疸加重或退而复现;四肢冰凉、花斑,毛细血管充盈时间延长;拒乳、呕吐、腹胀、肠鸣音减弱;出现频繁呼吸暂停;心动过速或过慢;四肢肌力肌张力低下、易激惹或抽搐。②辅助检查:血常规检查示WBC < 5.0×109/L或 > 20×109/L,血小板 < 100×109/L,C反应蛋白 > 3 mg/L。③血培养、脑脊液培养或其他无菌体液培养阳性。符合①中两项及②中两项,伴有或不伴有条件③或体查有明确的皮肤、口腔、眼、脐等部位的感染即可诊断为细菌性感染。
1.3. 统计学分析
使用SPSS 21.0统计软件进行统计学处理与分析。对两组患儿的各研究变量进行单因素分析,计算比值比(OR值)及95%可信区间(95%CI),正态分布的计量资料以均数±标准差(x±s)表示,组间比较采用配对资料t检验;非正态分布计量资料以中位数及四分位数间距[P50(P25,P75)]表示,两组间比较用配对资料秩和检验;计数资料采用例数和百分率(%)表示,两组间的比较采用配对资料χ2检验。将单因素分析中P < 0.05的因素纳入多因素条件logistic回归逐步分析。另外,对于不能形成配对资料的计数资料采用例数和百分率(%)表示,两组间比较采用χ2检验。P < 0.05示差异有统计学意义。
2. 结果
2.1. 两组基本资料的比较
本研究共收集符合纳入标准及排除标准的136对早期早产儿,其中男性79对,女性57对,病例组早产儿胎龄为30.6(29.6,31.4)周,对照组早产儿胎龄为30.7(29.6,31.4)周,两组在性别及胎龄方面差异无统计学意义(P > 0.05)。
2.2. PDA影响因素的单因素分析
对可进行配对的可能影响PDA发生的因素进行配对χ2检验,结果如表 1,显示病例组患儿感染性疾病及RDS发生率高于对照组,差异有统计学意义(P < 0.05),而两组患儿中多胎、胎膜早破、孕母产前应用地塞米松、孕母患妊娠期高血压疾病及生后缺氧的比例差异无统计学意义(P > 0.05)。对不可进行配对的危险因素孕母产前应用硫酸镁情况进行成组χ2检验,显示两组患儿孕母产前应用硫酸镁的比例差异无统计学意义[67%(45/67)vs 78%(51/65);χ2=2.12,P > 0.05]。
1.
PDA影响因素的配对χ2检验 (n)
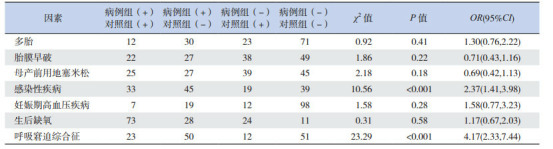
|
病例组患儿在生后24 h内血小板计数及出生体重均低于对照组,差异有统计学意义(表 2)。
2.
两组患儿生后24h内血小板计数及出生体重的比较
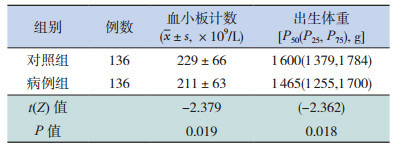
|
2.3. PDA影响因素的多因素条件logistic回归分析
应用条件logistic回归模型进行多因素综合分析,将单因素分析中差异有统计学意义的因素作为自变量(包括感染性疾病、RDS、生后24 h内血小板计数及出生体重)纳入多因素条件logistic回归逐步分析,其分析结果如表 3所示,感染性疾病和出生后24 h内血小板计数2个自变量有统计学意义,感染性疾病使PDA发生的风险增加(OR=2.355),出生后24 h内血小板计数增加降低PDA发生的风险(OR=0.996)。
3.
PDA影响因素的logistic回归分析
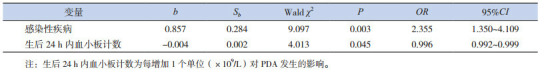
|
3. 讨论
本研究多因素logistic回归分析显示新生儿感染性疾病(宫内感染及生后7 d内患感染性疾病)是hs-PDA发生的独立危险因素。感染性疾病影响PDA的发生机制可能为病原微生物被相应受体识别并激活天然免疫系统,产生大量炎性细胞因子(包括IL-1、TNF-α、IL-8等),使前列腺素合成酶的合成及活性增强,同时间接通过激活下丘脑-垂体-肾上腺轴,刺激胎盘滋养细胞促肾上腺皮质激素释放激素(CRH)的合成和分泌,促进前列腺素的合成,维持DA的开放[25]。同时感染性疾病通过各种途径产生的前列腺素还可通过作用于血小板环素受体,抑制血小板激活[8],从而影响DA的闭合。相关研究指出血小板在后期DA解剖学关闭阶段起重要作用[26],本研究多因素logistic回归分析也提示生后24 h内血小板计数增加可降低早产儿hs-PDA的发生风险(OR=0.996)。本研究中,PDA组患儿生后24 h内血小板计数降低(< 100×109/L)4例,对照组中仅1例,故本研究针对两组匹配病例中生后24 h内血小板计数进行比较,得出PDA组生后24 h内血小板计数低于对照组。以上结果提示医务工作者积极预防及治疗早产儿感染性疾病和血小板减少可降低hs-PDA的发生及促进DA的关闭。
本研究单因素分析显示RDS及低出生体重是hs-PDA发生的危险因素。RDS导致PDA发生的机制考虑主要与低氧血症有关[27-28]。低氧血症可抑制平滑肌细胞膜去极化所致的细胞外钙离子内流[27];低氧血症也不利于Rho(ras homologue)及Rho激酶信号通路活化,使DA保持持续舒张状态[29]。我国吴忠仕等[30]对新生乳猪的动物实验研究指出,生后缺氧显著改变了肺血管出生后正常重构,导致肺血管阻力增高及严重肺动脉高压形成,因而不利于DA的闭合。低出生体重易发生PDA的机制可能为出生体重越低,DA管壁平滑肌发育越不成熟,动脉导管内膜弹力纤维薄弱、仅由极薄的内皮细胞组成,同时常伴有低氧血症及PGE2对DA的松弛作用敏感性升高等因素,维持DA的持续开放。Lee等[31]指出在平均胎龄为30周的早产儿中,适于胎龄儿PDA的发病率为28.6%,小于胎龄儿发病率为40.9%,提示同胎龄早产儿低出生体重者PDA发病率升高。因此,针对早产儿,尤其是低出生体重早产儿,保持良好的呼吸功能,可减少hs-PDA发病率。
有研究指出妊娠期高血压疾病导致早产及宫内发育迟缓是PDA发生的原因[9],但Kim等[11]和Itabashi等[32]指出,患有妊娠期高血压疾病的孕妇所分娩的新生儿减少了前列腺素暴露及增加皮质醇水平,可促进DA闭合。因此,妊娠期高血压疾病与PDA发生的关系尚不明确,需要更大样本和(或)多中心临床研究进行进一步明确。有研究报道,孕母产前应用硫酸镁是PDA发生的高危因素[33],其机制可能与细胞外镁离子抑制钙离子进入平滑肌细胞,抑制DA平滑肌收缩有关,还可能与此因素刺激前列腺素的合成有关[8],从而使DA保持舒张状态。也有报道表明,孕母应用糖皮质激素,不仅可以减少新生儿RDS的发生,还可以增加未成熟DA对氧的敏感性,也可以影响前列腺素的合成,同时糖皮质激素本身具有微弱的收缩DA作用,是PDA的保护性因素[9, 27]。在本研究中妊娠期高血压疾病、产前应用硫酸镁以及孕母应用糖皮质激素与hs-PDA的发生无相关性,分析原因如下:(1)我院产前应用地塞米松促进胎肺成熟联合硫酸镁保胎治疗,以上因素相互混杂,对DA关闭是否具有协同或拮抗作用需进一步明确,容易形成混杂偏倚;(2)用药病史信息不全,导致信息偏倚。
综上所述,新生儿感染性疾病、RDS、生后24 h内血小板计数减低及低出生体重与hs-PDA的发生有关,其中新生儿感染性疾病和生后24 h内血小板计数减低会增加hs-PDA发生的风险。因此,预防hs-PDA的发生应该从孕期做起,定期产前检查,及时纠正营养不良、慢性疾病,避免产程延长及胎膜早破,及时治疗妊娠合并感染性疾病,如阴道炎等,加强对高危妊娠的管理,积极治疗妊娠合并症,从而减少宫内感染及早产、低出生体重儿的发生。患儿生后积极治疗RDS,早期应用肺泡表面活性物质,改善低氧血症,预防感染,从而减少hs-PDA的发生,改善早产儿的预后,提高生存质量。
Biography
杜金凤, 女, 硕士研究生
References
- 1.Koch J, Hensley G, Roy L, et al. Prevalence of spontaneous closure of the ductus arteriosus in neonates at a birth weight of 1000 grams or less. Pediatrics. 2006;117(4):1113–1121. doi: 10.1542/peds.2005-1528. [DOI] [PubMed] [Google Scholar]
- 2.Rolland A, Shankar-Aguilera S, Diomandé D, et al. Natural evolution of patent ductus arteriosus in the extremely preterm infant. Arch Dis Child Fetal Neonatal Ed. 2015;100(1):F55–F58. doi: 10.1136/archdischild-2014-306339. [DOI] [PubMed] [Google Scholar]
- 3.AlFaleh K, Alluwaimi E, AlOsaimi A, et al. A prospective study of maternal preference for indomethacin prophylaxis versus symptomatic treatment of a patent ductus arteriosus in preterm infants[J]. 2015, 15: 47.https://www.researchgate.net/publication/275279292_A_prospective_study_of_maternal_preference_for_indomethacin_prophylaxis_versus_symptomatic_treatment_of_a_patent_ductus_arteriosus_in_preterm_infants
- 4.Hamrick SE, Hansmann G. Patent ductus arteriosus of the preterm infant. Pediatrics. 2010;125(5):1020–1030. doi: 10.1542/peds.2009-3506. [DOI] [PubMed] [Google Scholar]
- 5.Chock VY, Punn R, Oza A, et al. Predictors of bronchopulmonary dysplasia or death in premature infants with a patent ductus arteriosus. Pediatr Res. 2014;75(4):570–575. doi: 10.1038/pr.2013.253. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Sellmer A, Bjerre JV, Schmidt MR, et al. Morbidity and mortality in preterm neonates with patent ductus arteriosus on day 3. Arch Dis Child Fetal Neonatal Ed. 2013;98(6):F505–F510. doi: 10.1136/archdischild-2013-303816. [DOI] [PubMed] [Google Scholar]
- 7.Chen YY, Wang HP, Chang JT, et al. Perinatal factors in patent ductus arteriosus in very low-birth-weight infants. Pediatr Int. 2014;56(1):72–76. doi: 10.1111/ped.12199. [DOI] [PubMed] [Google Scholar]
- 8.Echtler K, Stark K, Lorenz M, et al. Platelets contribute to postnatal occlusion of the ductus arteriosus. Nat Med. 2010;16(1):75–82. doi: 10.1038/nm.2060. [DOI] [PubMed] [Google Scholar]
- 9.陈 佳, 封 志纯. 早产儿动脉导管未闭的发病机制、高危因素及并发症. http://d.old.wanfangdata.com.cn/Periodical/xsekzz201301021 中国新生儿科杂志. 2013;28(1):62–65. [Google Scholar]
- 10.Gonzalez A, Sosenko IR, Chandar J, et al. Influence of infection on patent ductus arteriosus and chronic lung disease in premature infants weighing 1000 grams or less. J Pediatr. 1996;128(4):470–478. doi: 10.1016/S0022-3476(96)70356-6. [DOI] [PubMed] [Google Scholar]
- 11.Kim ES, Kim EK, Choi CW, et al. Intrauterine inflammation as a risk factor for persistent ductus arteriosus patency after cyclooxygenase inhibition in extremely low birth weight infants. J Pediatr. 2010;157(5):745–750. doi: 10.1016/j.jpeds.2010.05.020. [DOI] [PubMed] [Google Scholar]
- 12.Rakza T, Magnenant E, Klosowski S, et al. Early hemodynamic conseque nces of patent ductus arteriosus in preterm infants with intrauterine growth restriction. J Pediatr. 2007;151(6):624–628. doi: 10.1016/j.jpeds.2007.04.058. [DOI] [PubMed] [Google Scholar]
- 13.杨 晓彤. 新生儿呼吸窘迫综合征常频机械通气常见并发症及预防策略. 中国妇幼保健. 2007;22(12):1631–1632. doi: 10.3969/j.issn.1001-4411.2007.12.034. [DOI] [Google Scholar]
- 14.Vucovich MM, Cotton RB, Shelton EL, et al. Aminoglycosidemediated relaxation of the ductus arteriosus in sepsis-associated PDA. Am J Physiol Heart Circ Physiol. 2014;307(5):H732–H740. doi: 10.1152/ajpheart.00838.2013. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.Kesiak M, Nowiczewski M, Gulczyńska E, et al. Can we expect decreasing the incidence of patent ductus arteriosus (PDA) in the population of premature neonates who had received antenatal steroid therapy? http://cn.bing.com/academic/profile?id=54b8fe30eddf7bd2930c2b09b83a0697&encoded=0&v=paper_preview&mkt=zh-cn. Ginekol Pol. 2005;76(10):812–818. [PubMed] [Google Scholar]
- 16.Bhandari V, Zhou G, Bizzarro MJ, et al. Genetic contribution to patent ductus arteriosus in the premature newborn. Pediatrics. 2009;123(2):669–673. doi: 10.1542/peds.2008-1117. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.Elimian A, Verma R, Ogburn P, et al. Magnesium sulfate and neonatal outcomes of preterm neonates. http://d.old.wanfangdata.com.cn/OAPaper/oai_doaj-articles_2ccad87056afede80b56c3c57fb4cb89. J Matern Fetal Neonatal Med. 2002;2(2):118–122. doi: 10.1080/jmf.12.2.118.122. [DOI] [PubMed] [Google Scholar]
- 18.Fujioka K, Morioka I, Miwa A, et al. Does thrombocytopenia contribute to patent ductus arteriosus? Nat Med. 2011;17(1):29–30. doi: 10.1038/nm0111-29. [DOI] [PubMed] [Google Scholar]
- 19.Bas-Suárez MP, González-Luis GE, Saavedra P, et al. Platelet counts in the first seven days of life and patent ductus arteriosus in preterm very low-birth-weight infants. Neonatology. 2014;106(3):188–194. doi: 10.1159/000362432. [DOI] [PubMed] [Google Scholar]
- 20.Bokodi G, Derzbach L, Bányász I, et al. Association of interferon gamma T+874A and interleukin 12 p40 promoter CTCTAA/GC polymorphism with the need for respiratory support and perinatal complications in low birthweight neonates. Arch Dis Child Fetal Neonatal Ed. 2007;92(1):F25–F29. doi: 10.1136/adc.2005.086421. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 21.McNamara PJ, Sehgal A. Towards rational management of the patent ductus arteriosus: the need for disease staging. Arch Dis Child Fetal Neonatal Ed. 2007;92(6):F424–F427. doi: 10.1136/adc.2007.118117. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 22.邵 肖梅, 叶 鸿瑁, 丘 小汕. 实用新生儿学. 北京: 人民卫生出版社; 2012. pp. 396–397. [Google Scholar]
- 23.乐 杰. 妇产科学. 第5版.北京: 人民卫生出版社; 2000. pp. 117–118. [Google Scholar]
- 24.乐 杰. 妇产科学. 第5版.北京: 人民卫生出版社; 2000. p. 164. [Google Scholar]
- 25.常 立文, 李 文斌. 宫内感染与早产儿疾病. 中华实用儿科临床杂志. 2013;28(14):1041–1043. doi: 10.3760/cma.j.issn.2095-428X.2013.14.001. [DOI] [Google Scholar]
- 26.Coceani F, Baragatti B. Mechanisms for ductus arteriosus closure. Semin Perinatol. 2012;36(2):92–97. doi: 10.1053/j.semperi.2011.09.018. [DOI] [PubMed] [Google Scholar]
- 27.赵 金章, 李 明霞. 早产儿动脉导管未闭发病机制研究进展. 中华实用儿科临床杂志. 2014;29(1):60–63. doi: 10.3760/cma.j.issn.2095-428X.2014.01.017. [DOI] [Google Scholar]
- 28.杨 长仪, 陈 涵强, 杨 文庆, et al. 口服布洛芬和吲哚美辛治疗早产儿动脉导管未闭的效果及其影响因素. 中华围产医学杂志. 2012;15(8):483–489. doi: 10.3760/cma.j.issn.1007-9408.2012.08.011. [DOI] [Google Scholar]
- 29.Kajimoto H, Hashimoto K, Bonnet SN, et al. Oxygen activates the Rho/ Rho-kinase pathway and induces RhoB and ROCK-1 expression in human and rabbit ductus arteriosus by increasing mitochondria-derived reactive oxygen species: a newly recognized mechanism for sustaining ductal constriction. Circulation. 2007;115(13):1777–1788. doi: 10.1161/CIRCULATIONAHA.106.649566. [DOI] [PubMed] [Google Scholar]
- 30.吴 忠仕, Hall SM, Haworth SG, et al. 新生乳猪缺氧性肺动脉高压的肺血管重构. http://d.old.wanfangdata.com.cn/Periodical/hnykdx200202007 湖南医科大学学报. 2002;27(2):115–117. [Google Scholar]
- 31.Lee MJ, Conner EL, Charafeddine L, et al. A critical birth weight and other determinants of survival for infants with severe intrauterine growth restriction. Ann N Y Acad Sci. 2001;943:326–339. doi: 10.1111/j.1749-6632.2001.tb03813.x. [DOI] [PubMed] [Google Scholar]
- 32.Itabashi K, Ohno T, Nishida H. Indomethacin responsiveness of patent ductus arteriosus and renal abnormalities in preterm infants treated with indomethacin. J Pediatr. 2003;143(2):203–207. doi: 10.1067/S0022-3476(03)00303-2. [DOI] [PubMed] [Google Scholar]
- 33.del Moral T, Gonzalez-Quintero VH, Claure N, et al. Antenatal exposure to magnesium sulfate and the incidence of patent ductus arteriosus in extremely low birth weight infants. J Perinatol. 2007;27(3):154–157. doi: 10.1038/sj.jp.7211663. [DOI] [PubMed] [Google Scholar]


