Abstract
目的
通过研究细胞因子信号转导抑制因子(SOCS)低甲基化与过敏性紫癜(HSP)患儿Th17/Treg细胞失衡的关系,探讨HSP的免疫发病机制。
方法
选取2014年5月至2015年1月32例急性期HSP住院患儿为研究对象,另选取行健康体检的28例儿童作为健康对照组。采用ELISA法检测血浆IL-6水平;流式细胞术检测外周血CD4+IL-17A+T细胞(Th17细胞)比例、CD4+CD25+调节性T细胞(Treg)比例和CD4+T细胞磷酸化STAT3(pSTAT3)蛋白平均荧光强度(MFI);实时荧光定量PCR(RT-qPCR)技术检测CD4+T细胞SOCS1、SOCS3基因mRNA表达;高分辨率熔解曲线(HRM)分析法检测外周血单个核细胞SOCS1基因外显子2、SOCS3基因5'端非翻译区(5'-UTR)可能的STAT3结合位点CpG岛甲基化水平。
结果
与健康对照组比较,HSP组血浆IL-6浓度、CD4+T细胞pSTAT3的MFI显著增加;HSP组Th17细胞比例显著上调,Treg细胞比例显著下调(P < 0.05)。HSP组患儿急性期外周血单个核细胞SOCS1 mRNA和SOCS3 mRNA水平均显著高于健康对照组(P < 0.05);HSP组SOCS1 mRNA及SOCS3 mRNA表达均与Th17/Treg比值呈负相关(P < 0.05)。HSP组患儿急性期SOCS1基因外显子2、SOCS3基因5'-UTR区可能的STAT结合位点CpG岛呈低甲基化,而健康对照组呈完全去甲基化状态。
结论
SOCS1、SOCS3基因低甲基化所致其相对表达不足可能是HSP患儿Th17/Treg失衡的因素之一。
Keywords: 过敏性紫癜, Th17细胞, 调节性T细胞, 细胞因子信号转导抑制因子, 甲基化, 儿童
Abstract
Objective
To investigate the association between suppressor of cytokine signaling (SOCS) hypomethylation and T helper 17 (Th17) cell/regulatory T (Treg) cell imbalance in children with Henoch-Schönlein purpura (HSP) and the immune pathogenesis of HSP.
Methods
A total of 32 children in the acute stage of HSP who were hospitalized from May 2014 to January 2015 were enrolled as subjects, and 28 children who underwent physical examination were enrolled as normal control group. ELISA was used to measure the plasma level of interleukin-6 (IL-6). Flow cytometry was used to measure the percentages of CD4+ IL-17A+ T cells (Th17 cells) and CD4+CD25+ Treg cells (Treg cells) in peripheral blood and mean fluorescence intensity (MFI) for phosphorylated-STAT3 (pSTAT3) protein in CD4+ T cells. Quantitative real-time PCR was used to measure the mRNA expression of suppressor of cytokine signaling-1 (SOCS1) and suppressor of cytokine signaling-3 (SOCS3) in CD4+ T cells. High-resolution melting (HRM) was used to evaluate the methylation level of the CpG islands in SOCS1 exon 2 and the CpG islands of the potential bind sites for STAT3 in the 5'-untranslated region (5'-UTR) of SOCS3 in peripheral blood mononucleated cells.
Results
Compared with the normal control group, the HSP group had significant increases in plasma IL-6 concentration and MFI for pSTAT3 in CD4+ T cells, as well as a significant increase in the percentage of Th17 cells and a significant reduction in the percentage of Treg cells (P < 0.05). The HSP group had significantly higher mRNA expression of SOCS1 and SOCS3 in peripheral blood mononucleated cells than the normal control group (P < 0.05). In the HSP group, the mRNA expression of SOCS1 and SOCS3 was negatively correlated with Th17/Treg ratio (P < 0.05). The HSP group had hypomethylation of the CpG islands in SOCS1 exon 2 and the potential binding site for STAT3 in SOCS3 5'-UTR, while the normal control group had complete demethylation.
Conclusions
Low relative expression of SOCS1 and SOCS3 caused by hypomethylation may be a factor for Th17/Treg imbalance in children with HSP.
Keywords: Henoch-Schönlein purpura, T helper 17 cell, Regulatory T cell, Suppressor of cytokine signaling, Methylation, Child
过敏性紫癜(Henoeh-Schönlein purpura, HSP)是以全身小血管炎症为主要病变的系统性血管炎,其病因及发病机制尚未完全明确。本课题组前期研究证实,HSP患儿急性期存在Th17细胞过度活化、调节性T细胞(regulatory T cell, Treg)减少并由此引起免疫抑制效应不足,但导致免疫功能异常的调控因素仍不清楚[1]。Th17/Treg是一对具有促炎/抑炎作用的T淋巴细胞亚群,参与维持体内免疫功能动态平衡。在炎症反应、自身免疫性疾病及移植排斥反应时,IL-6等促炎细胞因子过度表达,并通过影响初始CD4+T细胞的分化格局,促进Th17细胞分化,破坏Th17/Treg平衡,导致一系列炎症反应损伤机体[2]。细胞因子信号转导抑制因子(suppressor of cytokine signaling, SOCS)可通过抑制IL-6/信号转导和转录激活蛋白3(STAT3)信号通路参与调控T淋巴细胞分化成熟,在维持体内Th17/Treg稳态中发挥重要作用。HSP患儿是否存在IL-6/STAT3信号途径过度活化而导致Th17/Treg失衡?其负性调节因子SOCS表达是否存在相对不足?SOCS表达相对不足的原因是否存在SOCS基因低甲基化?目前相关研究国内外文献少见报道。故本研究观察IL-6/STAT3信号及其负性调节因子SOCS1、SOCS3对急性HSP患儿Th17/Treg失衡的影响,并通过高分辨率熔解曲线(high-resolution melting, HRM)分析法检测SOCS1和SOCS3表观遗传学修饰,旨在进一步明确HSP的免疫发病机制。
1. 资料与方法
1.1. 研究对象及分组
选取2014年5月至2015年1月在青岛大学附属医院心肾免疫儿科住院的HSP患儿32例为研究对象,其中男18例,女14例,年龄3~12岁,平均年龄6.5岁,所有患儿近4周内均无糖皮质激素及免疫增强剂或免疫抑制剂等特殊药物使用情况,且均为首次发病。所有患儿诊断标准参照参考文献[3]。另选取我院儿童保健科健康体检儿童28例作为健康对照组,其中男14例,女14例,年龄3~13岁,平均年龄7.0岁。两组儿童年龄及性别比较差异无统计学意义,具有可比性。本研究获得所有受试者家属知情同意后实施,并报医院医学伦理委员会讨论通过。
1.2. 流式细胞术检测外周血CD4+IL-17A+T细胞(Th17细胞)百分率及CD4+CD25+Treg百分率
测试管和同型对照管中同时加入10 μL抗人CD4-FITC,随后分别加入80 μL的外周肝素抗凝静脉血,避光室温下静置20 min。每管加入100 μL破膜剂1,用力摇匀后避光室温下静置20 min,加入PBS,2 000 r/min离心5 min。弃上清液,每管加入破膜剂2,摇匀后避光室温下静置5 min,测试管中加入抗人IL-17A-PE(美国eBioscience公司)5 μL、抗人CD25-PE 10 μL,对照管中加入鼠源IgG1-PE 10 μL,用力摇匀后避光室温下静置30 min。用PBS反复洗涤两遍,2 000 r/min离心5 min。末次丢弃上清液,将PBS 1 mL分别加测试管和同型对照管。将测试管和同型对照管同时放入流式细胞仪(Cytomics FC500型流式细胞仪,英国Biogend公司)检测,CD4+T细胞设门,分析门中IL-17A、CD25阳性细胞百分率。抗人CD4-FITC、抗人CD25-PE及鼠源IgG1-PE试剂均购自美国Beckman Coulter公司。
1.3. 流式细胞术检测外周血CD4+T细胞磷酸化STAT3蛋白平均荧光强度
取HSP组患儿急性期(新发皮疹1周内)及健康对照组儿童肝素抗凝血80 μL,加入5 μL 1 μg/mL佛波醇乙酯、4 μL 50 μg/mL离子霉素工作液及3 μL 1.4 μg/mL莫能菌素,于37℃下刺激15 min。测试管和对照管中同时加入10 μL抗人CD4-FITC,随后测试管中加入80 μL已经刺激的外周静脉血,对照管中加入未刺激的外周血80 μL,避光室温下静置20 min。两管分别加入100 μL破膜剂1,用力摇匀后避光室温下静置20 min,加入PBS,2 000 r/min离心5 min。弃上清液,每管加入破膜剂2,摇匀后避光室温下静置5 min,测试管中加入鼠源Anti-STAT3-PE(pY705,美国BD公司)10 μL,对照管中加入鼠源IgG2a-PE(美国Beckman Coulter公司)10 μL,用力摇匀后避光室温下静置30 min。用PBS反复洗涤两遍,2 000 r/min离心5 min。末次丢弃上清液,将PBS 1 mL分别加入测试管和同型对照管。将测试管和同型对照管同时放入流式细胞仪检测,CD4+T细胞设门,测定10 000个外周血淋巴细胞双染色双阳性细胞百分率。选择CXP Analysis软件获取细胞并分析。
1.4. 分离外周血单个核细胞
无菌采集肝素抗凝静脉血3 mL,淋巴细胞分离液(北京索莱宝科技有限公司)密度梯度离心法分离外周血单个核细胞(PBMC),加入1 mL RNA提取液,放置-80℃冰箱保存备用。
1.5. 实时荧光定量聚合酶链反应法检测SOCS mRNA表达
取已加入RNAiso的PBMC,按试剂盒说明书(上海杰美基因医药科技有限公司)步骤提取总RNA;紫外分光光度计测量其浓度及纯度。按试剂盒(FP207,北京天根生化有限公司)说明书,经反转录合成cDNA。参照GenBank中目的基因mRNA序列设计相关引物(由上海生工生物工程有限公司合成),有关参数见表 1。实时荧光定量聚合酶链反应(qRT-PCR)反应体系(20 μL):2×FastFire qPCR PreMix 10 μL、上下游引物(10 μmol/L)各0.6 μL、DNA模板2.0 μL、dH2O 6.8 μL。RT-qPCR反应条件:95℃预变性60 s;95℃变性5 s,60℃延伸15 s,共40个循环。RT-qPCR产物鉴定:取SOCS1及SOCS3扩增产物10 μL在2%琼脂糖凝胶中,90 V电泳30 min,回收纯化,并送交上海生工生物工程有限公司测序。测序结果与GenBank中目的基因mRNA序列比较确定完全一致。以目的基因的Ct值减去内参GAPDH的Ct值为△Ct,目的基因的相对表达量以2-△△Ct表示。具体计算方法参考文献[4]。
1.
RT-qPCR及甲基化特异性定量PCR引物
| 基因 | 引物 | 序列 | 产物大小(bp) | 复性温度 |
| SOCS1 | Forward primer | 5'-CTTCTGTAGGATGGTAGCACAC-3' | 98 | 62℃ |
| Reverse primer | 5'-AGGAAGAGGAGGAAGGTTCT-3' | |||
| SOCS3 | Forward primer | 5'-ACTCTGTGCCTCCTGACTAT-3' | 99 | 62℃ |
| Reverse primer | 5'-AGGCTGAGTATGTGGCTTTC-3' | |||
| SOCS1-M | Forward primer | 5'-CGAGTTCGTGGGTATTTTTTTGGT-3' | 146 | 63℃ |
| Reverse primer | 5'-AACTCTCGCGACTACCATCCAAATA-3 | |||
| SOCS3-M | Forward primer | 5'-GATGGAAGTCGGAGATTTTAGGTTT-3' | 138 | 61℃ |
| Reverse primer | 5'-TAAACGCCGCTCAATCCAATAA-3' |
1.6. 高分辨率熔解曲线法检测SOCS1、SOCS3相应位点甲基化水平
参照HRM分析试剂盒(FP210,北京天根生化有限公司)说明书,提取淋巴细胞基因组DNA,基因组DNA甲基化修饰,修饰后DNA纯化回收,标准品配制,建立HRM PCR反应体系,用HRM法获曲线图进行分析。从Pubmed GenBank中寻找人SOCS1、SOCS3的基因序列,由相关技术人员设计甲基化特异性引物(表 1),检测SOCS1基因外显子2、SOCS3基因5'端非翻译区(5'-untrashted region, 5'-UTR)可能的STAT3结合位点CpG岛甲基化状态,引物由上海生物工程有限公司合成。
1.7. 血浆IL-6水平的测定
采用双抗体夹心法酶联免疫吸附试验检测血浆IL-6水平,实验步骤按IL-6酶联免疫吸附试验试剂盒(上海元龙生物技术有限公司)说明书进行操作。
1.8. 统计学分析
采用SPSS 19.0统计软件对数据进行统计学分析。符合正态分布计量资料以均数±标准差(x±s)表示,两组间比较采用t检验或t'检验;不符合正态分布计量资料以中位数(四分位间距)[M(P25,P75)]表示,两组间比较采用Wilcoxon秩和检验;相关分析采用Spearman秩相关。P<0.05为差异有统计学意义。
2. 结果
2.1. 两组儿童外周血CD4+IL-17A+T细胞、CD4+CD25+Treg百分率及Th17/Treg比值情况
HSP组CD4+IL-17A+T细胞百分率明显高于健康对照组,CD4+CD25+Treg细胞百分率显著低于健康对照组,Th17/Treg比值较对照组明显升高(P<0.05)。见表 2及图 1。
2.
两组儿童外周血CD4+IL-17A+T细胞、CD4+CD25+Treg百分率及Th17/Treg比值比较
| 组别 | n | CD4+IL-17A+T细胞(x±s, %) | CD4+CD25+Treg (x±s, %) | Th17/Treg比值[M(P25, P75)] |
| 健康对照组 | 28 | 0.49±0.28 | 4.0±1.5 | 0.10(0.02, 1.45) |
| HSP组 | 32 | 1.58±0.76 | 2.5±1.0 | 0.23(0.11, 1.77) |
| t(t')[Z]值 | (7.585) | 4.582 | [-4.038] | |
| P值 | <0.05 | <0.01 | <0.01 |
1.
两组儿童外周血CD4+IL-17A+T细胞及CD4+CD25+Treg百分率
第二象限(C2)示CD4+IL-17A+T细胞或CD4+CD25+Treg百分率。
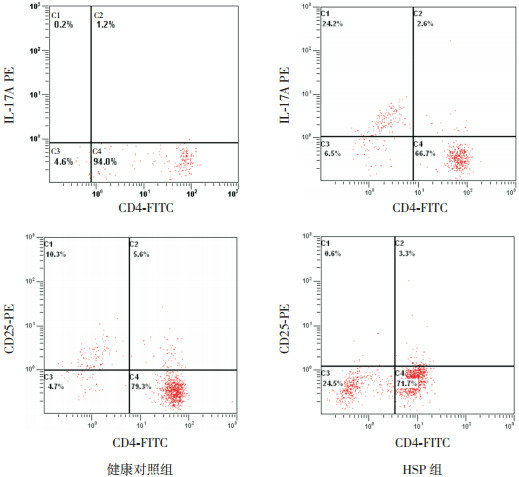
2.2. 两组儿童外周血CD4+T细胞磷酸化STAT3蛋白及血浆IL-6表达情况
急性期HSP组磷酸化STAT3(pSTAT3)蛋白平均荧光强度(34±8)明显高于健康对照组(17±5),差异有统计学意义(t=9.338,P<0.01);急性期HSP患儿IL-6表达水平(115± 24 ng/mL)显著高于健康对照组(38±11 ng/mL),差异有统计学意义(t=16.488,P<0.01)。
2.3. 两组儿童外周血PBMC SOCS1及SOCS3 mRNA表达情况
HSP组SOCS1及SOCS3 mRNA表达水平均显著高于健康对照组(P<0.01),见表 3。
3.
两组儿童外周血PBMC SOCS1及SOCS3 mRNA水平比较 (x±s,×10-3)
| 组别 | n | SOCS1 mRNA | SOCS3 mRNA |
| 健康对照组 | 28 | 1.6±0.9 | 5.1±1.9 |
| HSP组 | 32 | 3.6±1.0 | 12.5±4.4 |
| t值 | 8.436 | 8.153 | |
| P值 | <0.01 | <0.01 |
2.4. 相关性分析
HSP组患儿外周血PBMC SOCS1 mRNA、SOCS3 mRNA水平分别与Th17/Treg比值均呈负相关(分别r=-0.623、-0.644,P<0.01);CD4+ T细胞pSTAT3蛋白平均荧光强度与Th17/Treg比值呈正相关(r=0.407,P<0.05)。见图 2。
2.
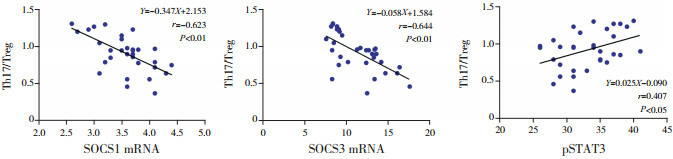
SOCS1 mRNA、SOCS3 mRNA、pSTAT3蛋白平均荧光强度与Th17/Treg比值相关性分析
2.5. 外周血SOCS1和SOCS3基因甲基化检测结果
HRM能确定特定样品中甲基化的比例。将不同比例的甲基化和未甲基化DNA混合,制作出标准曲线,同时以甲基化修饰后的待测样品的DNA为模板进行检测,根据待测标本在标准曲线上的位置判定其甲基化程度及比例。每份标本重复检测3次,最后结果为其平均甲基化程度及比例。
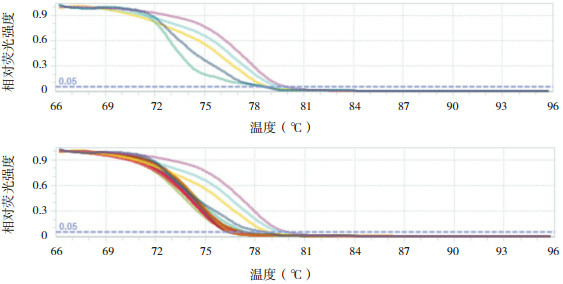
SOCS1基因外显子2甲基化检测结果显示,27份健康对照组及2份HSP组标本甲基化水-平基本重叠在0%标准曲线上;30份HSP组及1份健康对照组标本甲基化水平在0%~25%区域内,其他区域无标本出现。见图 3。
3.
HRM绘制SOCS1甲基化程度的标准曲线图及HSP组SOCS1甲基化程度的曲线图
上图:HRM绘制SOCS1甲基化程度的标准曲线图(曲线从左至右依次代表 0%、25%、50%、75%、100%甲基化程度);下图:HRM绘制HSP组SOCS1甲基化程度的曲线图(深红色曲线代表HSP组标本甲基化水平在0%~25%区域内)。
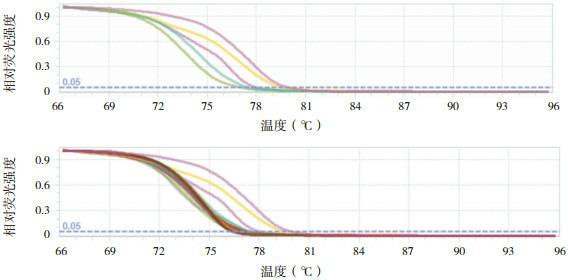
SOCS3基因5'-UTR可能的STAT3结合位点GpG岛甲基化检测结果显示,28份健康对照组及1份HSP组标本甲基化水平基本重叠在0%标准曲线上;31份HSP组标本甲基化水平在0%~25%区域内,其他区域无标本出现。见图 4。
4.
HRM绘制SOCS3甲基化程度的标准曲线图及HSP组SOCS3甲基化程度的曲线图
上图:HRM绘制SOCS3甲基化程度的标准曲线图(曲线从左至右依次代表 0%、25%、50%、75%、100%甲基化程度);下图:HRM绘制HSP组SOCS3甲基化程度的曲线图(深红色曲线代表HSP组标本甲基化水平在0%~25%区域内)。
通过测定曲线位置可判定HSP患儿SOCS1和SOCS3基因基本处于低甲基化状态,而健康对照组基本处于完全去甲基化状态。
3. 讨论
HSP是儿童期最常见的系统性血管炎,迄今其发病机制仍未完全阐明,可能涉及体液免疫紊乱、T细胞亚群功能失调、细胞因子分泌异常、凝血与纤溶机制紊乱等多方面参与发病[5]。
Th17细胞是一种特征性分泌IL-17的CD4+辅助T细胞亚群,在机体炎症反应或自身免疫反应中发挥作用。Treg是一组具有免疫抑制功能的T细胞亚群,对移植排斥、自身免疫性疾病等具有主要的调节功能,CD4+CD25+Treg为其家族中最主要的一群。Th17与Treg细胞都来源于初始CD4+T细胞,是一对具有促炎/抑炎作用的T淋巴细胞亚群,参与维持体内免疫功能动态平衡。在炎症反应、自身免疫性疾病及移植排斥反应时,IL-6等促炎症细胞因子的过度表达通过影响初始CD4+T细胞的分化格局, 增加Th17细胞分化, 破坏Th17/Treg平衡,导致一系列炎症反应损伤机体[6]。本研究结果显示,HSP患儿存在T细胞功能紊乱,Th17过度活化,Treg生成减少,并由此引起免疫抑制效应不足,与既往研究结果相同[1],再次证实HSP患儿体内存在Th17/Treg细胞失衡,但具体调节机制目前仍不清楚。
IL-6与细胞表面受体结合通过JAK/STAT3信号转导途径传递生物信息,IL-6与细胞表面受体结合使受体蛋白胞内段分子构象发生改变,触发JAK/STAT3信号。活化的JAK激酶磷酸化STAT3,pSTAT3可启动下游相关基因诱导RORγt、IL-17A/F表达,从而促使初始CD4+T细胞向Th17分化[7]。IL-6还通过STAT3促使Foxp3基因(Treg细胞发育的重要转录因子)上游增强子CpG岛发生甲基化从而抑制Treg细胞分化,推动机体炎症反应的发展[8]。本研究观察到HSP患儿急性期血浆IL-6浓度及CD4+T细胞pSTAT3蛋白表达均较健康对照组明显升高,且与Th17/Treg比值呈正相关,提示IL-6/STAT3信号异常活化可能为HSP患儿Th17/Treg失衡的重要原因之一。
SOCS是由细胞因子诱导产生的信号通路中非常重要的负性调节蛋白,通过抑制细胞因子信号转导调节机体对细胞因子的过度刺激。在T淋巴细胞功能亚群的分化调节过程中,SOCS家族起着重要的作用,其中SOCS1和SOCS3对调节T淋巴细胞发育、分化的作用最重要[9-10]。研究发现,SOCS在类风湿性关节炎、川崎病、免疫性血小板减少性紫癜、炎症性肠病及肿瘤性疾病等多种疾病的发病中起着重要的作用[11-13]。
Zhang等[14]通过体内外试验发现黄芪苷通过上调SOCS3表达抑制STAT3活性从而使Th17细胞分化减少,减轻实验性自身免疫性脑脊髓炎。王国兵等[15]在研究免疫性血小板减少性紫癜中发现,急性期患儿体内存在Th17/Treg失衡,导致失衡的原因与SOCS1和SOCS3表达不足有关。本研究结果显示HSP患儿外周血PBMC SOCS1 mRNA、SOCS3 mRNA表达均高于健康对照组,且与Th17/Treg比值均呈负相关。即Th17/Treg的比值越高,SOCS1、SOCS3 mRNA表达越低,我们推测,HSP患儿虽然SOCS1、SOCS3表达上调,但尚不足以完全抑制IL-6/STAT3信号的过度活化,进而导致HSP患儿Th17/Treg细胞失衡。提示HSP急性期患儿可能存在SOCS1和SOCS3表达的相对不足。
为探讨急性期HSP SOCS1和SOCS3相对表达不足的可能影响因素,我们观察了SOCS1和SOCS3基因的表观遗传学改变,结果显示,HSP组患儿SOCS1基因外显子2和SOCS3基因5'-UTR区可能的STAT结合位点CpG岛基本处于低甲基化状态,而健康对照组儿童SOCS1和SOCS3基因处于去甲基化状态,我们推测,HSP患儿SOCS1和SOCS3基因低甲基化可能导致其相对表达不足,从而干扰IL-6/STAT3负反馈调节通路,反过来抑制Foxp3表达,降低Treg细胞分化,进而导致Th17/Treg细胞失衡。DNA甲基化是一种涉及多种甲基转移酶的酶促动力学过程,导致HSP患儿急性期SOCS1和SOCS3基因甲基化修饰异常的分子调节机制尚待进一步研究。由于IL-6/STAT3信号通路作用机制复杂,本研究未做相关干预实验,故本实验结果仅为理论假设。
Biography
常红, 女, 博士, 主任医师。Email:18661802671@yeah.net
CHANG Hong, Email:18661802671@yeah.net
Funding Statement
山东省科技发展计划项目(2014GSF118049)
References
- 1.刘 萍, 张 秋业. 儿童过敏性紫癜急性期Th17细胞功能和CD4+CD25+调节性T细胞水平变化. http://d.old.wanfangdata.com.cn/Periodical/qlyxzz201201011 齐鲁医学杂志. 2012;27(1):31–33. [Google Scholar]
- 2.Kimura A, Kishimoto T. IL-6:regulator of Treg/Th17 balance. Eur J Immunol. 2010;40(7):1830–1835. doi: 10.1002/eji.201040391. [DOI] [PubMed] [Google Scholar]
- 3.Ozen S, Ruperto N, Dillon MJ, et al. EULAR/PReS endorsed consensus criteria for the classification of childhood vasculitides. http://med.wanfangdata.com.cn/Paper/Detail/PeriodicalPaper_PM16322081. Ann Rheum Dis. 2006;65(7):936–941. doi: 10.1136/ard.2005.046300. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.Livak KJ, Schmittgen TD. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta CT) method. Methods. 2001;25(4):402–408. doi: 10.1006/meth.2001.1262. [DOI] [PubMed] [Google Scholar]
- 5.Trnka P. Henoch-Schönlein purpura in children. J Paediatr Child Health. 2013;49(12):995–1003. doi: 10.1111/jpc.2013.49.issue-12. [DOI] [PubMed] [Google Scholar]
- 6.Egwuagu CE. STAT3 in CD4+T helper cell differentiation and inflammatory diseases. Cytokine. 2009;47(3):149–156. doi: 10.1016/j.cyto.2009.07.003. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Nishihara M, Ogura H, Ueda N, et al. IL-6-gp130-STAT3 in T cells directs the development of IL-17+ Th with a minimum effect on that of Treg in the steady state. Int Immunol. 2007;19(6):695–702. doi: 10.1093/intimm/dxm045. [DOI] [PubMed] [Google Scholar]
- 8.Lal G, Zhang N, Touw WVD, et al. Epigenetic regulation of Foxp3 expression in regulatory T cells by DNA methylation. Immunol. 2009;182(1):259–273. doi: 10.4049/jimmunol.182.1.259. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.Tamiya T, Kashiwagi I, Takahashi R, et al. Suppressors of cytokine signaling (SOCS) proteins and JAK/STAT pathways:regulation of T-cell inflammation by SOCS1 and SOCS3. Arterioscler Thromb Vasc Biol. 2011;31(5):980–985. doi: 10.1161/ATVBAHA.110.207464. [DOI] [PubMed] [Google Scholar]
- 10.Takahashi R, Nishimoto S, Muto G, et al. SOCS1 is essential for regulatory T cell functions by preventing loss of Foxp3 expression as well as IFN-γ and IL-17A production. J Exp Med. 2011;208(10):2055–2067. doi: 10.1084/jem.20110428. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.Yoshimura A, Suzuki M, Sakaguchi R, et al. SOCS, inflammation, and autoimmunity. http://d.old.wanfangdata.com.cn/NSTLQK/NSTL_QKJJ02686767/ Front Immunol. 2012;3:20. doi: 10.3389/fimmu.2012.00020. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.Malemud CJ. Negative regulators of JAK/STAT signaling in rheumatoid arthritis and osteoarthritis. Int J Mol Sci. 2017;18(3):E484. doi: 10.3390/ijms18030484. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.Chikuma S, Kanamori M, Mise-Omata S, et al. Suppressors of cytokine signaling:potential immune checkpoint molecules for cancer immunotherapy. Cancer Sci. 2017;108(4):574–580. doi: 10.1111/cas.13194. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Zhang Y, Li X, Ciric B, et al. Therapeutic effect of baicalin on experimental autoimmune encephalomyelitis is mediated by SOCS3 regulatory pathway. Sci Rep. 2015;5:17407. doi: 10.1038/srep17407. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.王 国兵, 李 成荣, 杨 军, et al. IL-6/STAT3信号活化在川崎病Th17/Tr细胞失衡中的作用. 中华微生物学和免疫学杂志. 2011;31(6):517–522. doi: 10.3760/cma.j.issn.0254-5101.2011.06.011. [DOI] [Google Scholar]


