Abstract
目的
探讨低浓度紫杉醇(PTX)对转化生长因子β1(TGF-β1)促进大鼠肺动脉平滑肌细胞(PASMCs)外胶原沉积的作用及其机制。
方法
原代培养大鼠PASMCs并分为空白对照组、模型组和干预组(n=3)。空白对照组不做任何处理,模型组施加终浓度为10 ng/mL的TGF-β1,干预组在模型组基础上施加终浓度为100 nmol/L的PTX。MTT比色法检测细胞增殖能力;实时荧光定量PCR法检测Ⅰ型胶原(COL Ⅰ)、Ⅲ型胶原(COL Ⅲ)mRNA相对表达量;ELISA法检测COL Ⅰ、COL Ⅲ蛋白的OD值;Western blot法检测COL Ⅰ、COL Ⅲ蛋白,以及TGF-β1/Smad3信号通路关键蛋白Smad3、p-Smad3的相对表达水平。
结果
与空白对照组比较,模型组细胞增殖能力、COL Ⅰ、COL Ⅲ mRNA及其蛋白、p-Smad3蛋白相对表达水平均明显增高(P < 0.05);干预组上述指标较模型组均有所下降,但仍高于空白对照组(P < 0.05);各组Smad3蛋白相对表达水平比较差异均无统计学意义(P > 0.05)。
结论
低浓度PTX对TGF-β1促进PASMCs外胶原合成具有明显抑制作用,该作用可能是通过调控Smad3蛋白的磷酸化来实现。
Keywords: 胶原沉积, 肺动脉平滑肌细胞, 紫杉醇, 转化生长因子β1, 大鼠
Abstract
Objective
To study the effect of low-concentration paclitaxel (PTX) on transforming growth factor-β1 (TGF-β1)-induced collagen deposition outside rat pulmonary artery smooth muscle cells (PASMCs) and related mechanism.
Methods
Primary rat PASMCs were divided into a blank control group (n=3), a model group (n=3), and a drug intervention group (n=3). No treatment was given for the blank control group. The model group was treated with TGF-β1 with a final concentration of 10 ng/mL. The drug intervention group was treated with PTX with a final concentration of 100 nmol/L in addition to the treatment in the model group. MTT colorimetry was used to measure cell proliferation. Quantitative real-time PCR was used to measure the relative mRNA expression of collagen type Ⅰ (COL-Ⅰ) and collagen type Ⅲ (COL-Ⅲ). ELISA was used to measure the OD value of COL-Ⅰ and COL-Ⅲ proteins. Western blot was used to measure the relative protein expression of COL-Ⅰ, COL-Ⅲ, and the key proteins of the TGF-β1/Smad3 signaling pathway (Smad3 and p-Smad3).
Results
Compared with the blank control group, the model group had significant increases in proliferation ability, relative mRNA and protein expression of COL-Ⅰ and COL-Ⅲ, and relative protein expression of p-Smad3 (P < 0.05). Compared with the model group, the drug intervention group had significant reductions in the above indicators, but which were still higher than those in the blank control group (P < 0.05). There was no significant difference in the relative protein expression of Smad3 among the three groups (P > 0.05).
Conclusions
Low-concentration PTX exerts a marked inhibitory effect on TGF-β1-induced collagen deposition outside PASMCs, possibly by regulating the phosphorylation of Smad3 protein.
Keywords: Collagen deposition, Pulmonary artery smooth muscle cell, Paclitaxel, Transforming growth factor-β1, Rats
近年来,大量研究显示,肺血管重构是肺动脉高压(pulmonary artery hypertension, PAH)不可逆发展的基本病理特征,其中位于肺血管中膜层的平滑肌细胞外胶原的过度沉积起着重要作用[1]。因此,如何逆转肺动脉平滑肌细胞(pulmonary artery smooth muscle cells, PASMCs)外胶原沉积成为治疗PAH的关键靶点之一。转化生长因子β1(transforming growth factor-β1, TGF-β1)是目前发现的促纤维化作用最强的生长因子,其可刺激PASMCs发生表型转换并过度分泌细胞外基质,主要成分为Ⅰ、Ⅲ型胶原蛋白(COL Ⅰ、COL Ⅲ),引起肺动脉中膜层增厚,从而导致了肺血管重构[2]。Smad3蛋白是TGF-β1下游重要的信号分子之一,当TGF-β1与其配体结合后可介导Smad3蛋白磷酸化,调控相关基因的转录和翻译,促进胶原蛋白合成[3]。紫杉醇(paclitaxel, PTX)是一种传统化疗药物,由红豆杉树皮提取而成,能够通过促进微管聚集并抑制其解聚从而达到抗肿瘤细胞增殖作用,目前广泛用于乳腺癌、淋巴癌、肠癌等多种恶性肿瘤的化学治疗[4]。低浓度PTX即非细胞毒性剂量的PTX [5-6]。近年来有学者将低浓度PTX用于胶原沉积性疾病(如肝纤维化、肾间质纤维化、肺纤维化等)的研究中,结果表明低浓度PTX能够通过抑制胶原合成来逆转纤维化进程[7-8]。本实验拟研究低浓度PTX对TGF-β1诱导的体外大鼠PASMCs胶原沉积模型的作用及具体机制。
1. 材料与方法
1.1. 试剂与仪器
胰酶、青/链霉素、DMEM高糖培养基、胎牛血清(FBS,美国Hyclone公司);TGF-β1(美国Pepro Tech公司);PTX(深圳信立泰药业股份有限公司);大鼠COL Ⅰ及COL Ⅲ α1链ELISA试剂盒(武汉华美生物工程有限公司);COL Ⅰ、COL Ⅲ及β-actin引物合成(上海生工生物工程股份有限公司);iQTM SYBR® Green Supermix试剂盒(美国Bio-Rad公司);兔抗大鼠β-actin、COL Ⅲ单克隆抗体,小鼠抗大鼠COL Ⅰ单克隆抗体(美国Abcam公司);兔抗大鼠Smad3、p-Smad3单克隆抗体(美国CST公司);山羊抗兔IgG、山羊抗小鼠IgG辣根过氧化物酶(美国KPL公司)。荧光定量PCR仪(美国Bio-Rad公司);CO2细胞培养箱、全自动酶标仪(美国Thermo公司)。
1.2. 原代大鼠PASMCs的培养、鉴定及分组
健康雄性Sprague-Dawley(SD)大鼠,体重150~180 g,由成都达硕实验动物有限公司提供。大鼠PASMCs原代培养与鉴定方法参照文献[9],颈椎脱臼方式处死健康大鼠,无菌环境中剥离出大鼠肺动脉中膜层,在预冷PBS中漂洗后,剪碎为1 mm2左右的组织块,展平铺种于培养瓶中,倒放晾干2 h后加入含20%FBS的培养基,置于37℃、5%CO2、饱和湿度培养箱中,传代后换用含10%FBS的培养基。参照文献[9-10]采用免疫组化法,通过检测平滑肌特异性标志物α平滑肌肌动蛋白(α-SMA)对第二代细胞进行鉴定。鉴定合格后取3~6代细胞进行实验。实验分为空白对照组(不做处理)、模型组(加入TGF-β1,终浓度为10 ng/mL)、干预组(加入TGF-β1和PTX,TGF-β1终浓度为10 ng/mL,PTX终浓度为100 nmol/L)。造模方法及TGF-β1剂量参考文献[11],PTX剂量参考前期预实验结果及文献[5]。细胞孵育24 h后用于以下实验检测,时间截点的选择参考前期预实验结果及文献[5]。
1.3. MTT法检测PASMCs增殖水平
调整PASMCs密度为3×104/mL接种于96孔板,每孔100 μL,置于37℃、5%CO2、饱和湿度培养箱中培养,每组设置5个复孔。待细胞密度长到70%时则进行分组处理。24 h后参考MTT法操作说明,在酶标仪上检测490 nm处各样本孔的吸光度(OD)值。实验独立重复5次。
1.4. ELISA法检测COL Ⅰ及COL Ⅲ的含量
如上法接种、培养、分组处理PASMCs 24 h后,收集各组细胞培养液,于4℃、4 000 r/min离心15 min,取其上清液进行实验。参照大鼠COL Ⅰ及COL Ⅲ ELISA试剂盒使用操作说明,并将酶标仪调至450 nm处检测各个样本孔的OD值,所测得的OD值可间接代表培养液中胶原蛋白含量。实验独立重复3次。
1.5. 采用实时荧光定量PCR法检测PASMCs中COL Ⅰ、COL Ⅲ mRNA相对表达量
运用NCBI基因数据库设计大鼠COL Ⅰ、COL Ⅲ、β-actin引物(表 1)。调整PASMCs密度,接种细胞于6孔板,培养、分组处理24 h后,收集各组细胞,采用TRIzol法提取细胞总RNA后使用逆转录试剂盒合成cDNA。取cDNA进行实时荧光定量PCR(qRT-PCR)反应,反应体系(20 µL):荧光MIX体系(2×,荧光MIX含有Taq酶、dNTP、Mg2+的buffer缓冲液)10 µL,上、下游引物(10 µmol/L)各0.8 µL,ddH2O 6.4 µL,cDNA(稀释3倍)2 µL。反应条件:95℃ 3 min;95℃ 10 s,58℃ 30 s,72℃ 30 s,循环40次。以管家基因β-actin作为参照,COL Ⅰ、COL Ⅲ mRNA的相对表达量依照2-ΔΔCt法进行分析。实验独立重复3次。
1.
引物序列
| 基因 | 引物(5'→3') | 片段长度(bp) |
| COL Ⅰ | 上游:GGATCGACCCTAACCAAGGC | 210 |
| 下游:GATCGGAACCTTCGCTTCCA | ||
| COL Ⅲ | 上游:CGGAGGAATGGGTGGCTATC | 268 |
| 下游:ACCAGCTGGGCCTTTGATAC | ||
| β-actin | 上游:GTAGCCATCCAGGCTGTGTT | 236 |
| 下游:ATGTCACGCACGATTTCCCT |
1.6. Western blot法检测PASMCs中COL Ⅰ、COL Ⅲ、Smad3、p-Smad3蛋白相对表达
调整PASMCs密度,接种细胞于6孔板,培养、分组处理24 h后,提取细胞总蛋白。利用BCA蛋白浓度测定试剂盒检测各组蛋白浓度。根据各组蛋白浓度确定上样量,将样品加入上样孔进行电泳。电泳结束后转膜、封闭,加入相应蛋白一抗(β-actin 1 : 1 000稀释,COL Ⅰ 1 : 500稀释,COL Ⅲ 1 : 500稀释,Smad3 1 : 1 000稀释,p-Smad3 1 : 500稀释),并在4℃冰箱中孵育过夜,洗膜后在摇床上孵育二抗(均1 : 10 000稀释)2 h,洗膜,用吸水纸吸干后曝光扫瞄。应用Quantity One软件对结果条带进行分析,结果以各目的蛋白与β-actin的灰度值比值表示。实验独立重复3次。
1.7. 统计学分析
采用SPSS 17.0统计软件对数据进行统计学分析。计量资料用均数±标准差(x±s)表示,多组间比较采用单因素方差分析,组间两两比较使用SNK-q法,P < 0.05为差异有统计学意义。
2. 结果
2.1. 原代PASMCs形态学观察及鉴定
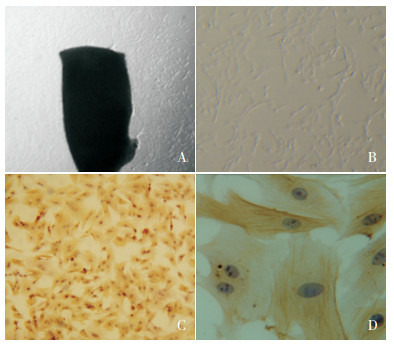
原代培养第4天,倒置相差显微镜下可见贴壁的组织块边缘有细胞爬出,逐渐由卵圆形伸展为长梭形,在第6天呈现典型的“峰-谷状”生长。取第二代细胞采用免疫组化法检测α-SMA的表达,显微镜下可见细胞胞质呈现棕黄色(即α-SMA阳性表达),且有大量与细胞长轴相平行排列的丝状物(细胞骨架),计数阳性表达细胞,若阳性率在95%以上,则提示其为PASMCs。见图 1。
1.
大鼠PASMCs原代培养
A:原代培养第4天大鼠肺动脉组织块(×40),贴壁的组织块周围有细胞萌出;B:传代培养的细胞(×100),呈长梭形生长;C:α-SMA免疫组化染色鉴定(×200),显微镜下可见PASMCs胞质有大量α-SMA阳性表达(阳性表达呈棕黄色);D:α-SMA免疫组化染色鉴定(×400),显微镜下可见大量与PASMCs长轴相平行排列的丝状物(细胞骨架)。
2.2. MTT法检测各组PASMCs增殖情况
空白对照组、模型组和干预组OD值比较差异有统计学意义(F=65.340,P < 0.001)。与空白对照组OD值(0.444±0.033)相比,模型组OD值(0.642±0.031)和干预组OD值(0.516±0.017)均明显增高(P < 0.05);与模型组相比,干预组OD值明显降低(P < 0.05)。提示TGF-β1能显著促进PASMCs增殖,而PTX能抑制TGF-β1的促增殖作用。
2.3. ELISA法检测各组PASMCs中COL Ⅰ、COL Ⅲ的蛋白含量
与空白对照组比较,模型组和干预组COL Ⅰ、COL Ⅲ蛋白含量明显增多(P < 0.05);与模型组比较,干预组COL Ⅰ、COL Ⅲ含量有所下降(P < 0.05)。见表 2。
2.
各组COL Ⅰ、CoL Ⅲ蛋白含量比较
| (x±s,ng/mL,n=3) | ||
| 组别 | COL Ⅰ | COL Ⅲ |
| 注:a示与空白对照组相比,P < 0.05;b示与模型组相比,P < 0.05。 | ||
| 空白对照组 | 1.59±0.11 | 1.46±0.06 |
| 模型组 | 3.60±0.10a | 3.27±0.12a |
| 干预组 | 2.56±0.13a, b | 2.44±0.14a, b |
| F值 | 216.751 | 206.328 |
| P值 | < 0.001 | < 0.001 |
2.4. qRT-PCR法检测各组PASMCs中COL Ⅰ、COL Ⅲ mRNA相对表达
与空白对照组比较,模型组和干预组PASMCs中COL Ⅰ、COL Ⅲ mRNA表达水平明显增高(P < 0.05);与模型组相比,干预组PASMCs中COL Ⅰ、COL Ⅲ mRNA表达水平明显降低(P < 0.05)。见表 3。
3.
各组COL Ⅰ、COL Ⅲ mRNA相对表达水平比较
| (x±s,n=3) | ||
| 组别 | COL Ⅰ mRNA | COL Ⅲ mRNA |
| 注:a示与空白对照组相比,P < 0.05;b示与模型组相比,P < 0.05。 | ||
| 空白对照组 | 0.93±0.06 | 1.000±0.024 |
| 模型组 | 1.98±0.08a | 1.801±0.082a |
| 干预组 | 1.14±0.04a, b | 1.217±0.052a, b |
| F值 | 255.740 | 154.154 |
| P值 | < 0.001 | < 0.001 |
2.5. Western blot法检测各组PASMCs中COL Ⅰ、COL Ⅲ、Smad3、p-Smad3蛋白相对表达水平
与空白对照组比较,模型组和干预组PASMCs中COL Ⅰ、COL Ⅲ、p-Smad3蛋白相对表达水平均明显增高(P < 0.05);与模型组比较,干预组PASMCs中COL Ⅰ、COL Ⅲ、p-Smad3蛋白相对表达水平均显著降低(P < 0.05)。各组间Smad3蛋白表达水平比较差异无统计学意义(P > 0.05)。见表 4,图 2。
4.
各组COL Ⅰ、COL Ⅲ、Smad3、p-Smad3蛋白相对表达水平比较 (x±s,n=3)
| 组别 | COL Ⅰ | COL Ⅲ | Smad3 | p-Smad3 |
| 注:a示与空白对照组相比,P < 0.05;b示与模型组相比,P < 0.05。 | ||||
| 空白对照组 | 0.125±0.070 | 0.11±0.03 | 0.43±0.03 | 0.051±0.015 |
| 模型组 | 0.598±0.010a | 0.56±0.06a | 0.44±0.04 | 0.336±0.054a |
| 干预组 | 0.356±0.052a, b | 0.27±0.06a, b | 0.43±0.03 | 0.185±0.021a, b |
| F值 | 65.677 | 55.149 | 0.057 | 51.981 |
| P值 | < 0.001 | < 0.001 | 0.945 | < 0.001 |
2.
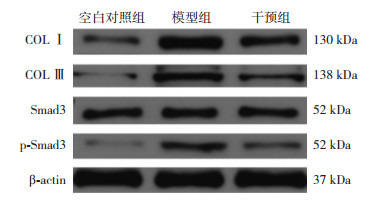
Western blot法检测各组COL Ⅰ、COL Ⅲ、Smad3、p-Smad3蛋白相对表达条带图
3. 讨论
肺血管重构的重要病理改变是肺小动脉管壁中膜层厚度异常增加,血管壁伸展性受限,血流动力学阻力增加,肺动脉压力持续性升高。其中血管中膜层厚度增加是由平滑肌细胞异常增殖、细胞外基质过度沉积共同导致[12]。细胞外基质作为PASMCs的支持物及细胞间的连接物,对PASMCs的生物学特性有重要作用,但细胞外基质过度合成则会刺激PASMCs增殖失控,进一步加重血管结构重建[9]。因此细胞外基质异常沉积在PAH的发生、发展过程中扮演着极其重要的角色,抑制细胞外基质沉积已经成为缓解甚至逆转PAH持续性进展的重要靶点。众所周知,细胞外基质的主要成分是COL Ⅰ、COL Ⅲ,其中COL Ⅰ参与维持肺动脉管壁的韧性及抗张力,COL Ⅲ参与维持肺动脉管壁的弹性,它们在血管管壁完整性的构成及正常生理功能维持方面起着主要作用,但是COL Ⅰ、COL Ⅲ合成失控时胶原大量堆积而造成血管壁纤维化,导致血管硬化、管壁增厚、管腔狭窄、顺应性下降[13],引起血流动力学改变,形成PAH。因此,减少COL Ⅰ、COL Ⅲ的产生成为抑制细胞外基质过度沉积、防治PAH的关键所在。
TGF-β1是促进细胞增殖并合成胶原蛋白等细胞外基质的细胞因子,具有很强的促纤维化作用[14]。当TGF-β1与其相应受体结合,位于下游的Smads蛋白则发生磷酸化后将信息传入核内,转录并翻译产生过多胶原,引发众多胶原沉积性疾病[15]。研究表明PAH的形成亦与血管壁胶原沉积密切相关[16]。郑常龙等[17]用野百合碱诱导的大鼠PAH模型,结果提示大鼠模型组较空白对照组TGF-β1、p-Smads蛋白表达量上调,提示TGFβ1/Smads信号通路可能参与了胶原等细胞外基质的沉积。其中Smad2、3蛋白在TGF-β1/Smads通路中尤为关键,是TGF-β1信号传递到Smads通路的第一步。与Smad2相比,对胶原等细胞外基质的调控主要依赖Smad3。本研究采用10 ng/mL TGF-β1处理大鼠PASMCs 24 h发现,PASMCs增殖及COL Ⅰ、COL Ⅲ在mRNA和蛋白表达水平均明显增高,p-Smad3蛋白表达上调,该结果不仅表明本实验已成功构建大鼠PASMCs外胶原沉积模型,而且也从细胞水平证实TGF-1β/Smad3信号通路在胶原沉积中的重要作用。通过以上研究结果可以推测,TGF-β1/Smad3通路可能在肺血管重塑过程中起了主导作用,因此通过干预TGF-β1/Smad3信号通路减少胶原沉积,对于治疗PAH具有潜在的临床应用价值。
PTX能与靶细胞内微管特异性结合,促进微管蛋白聚合并阻碍其解聚,干扰细胞有丝分裂,从而抑制细胞增殖[18],目前广泛应用于抗肿瘤治疗[4]和一些非肿瘤性疾病的研究[19]。近年来越来越多文献报道,低浓度PTX能够阻断TGF-β1/Smads信号通路,降低胶原mRNA和蛋白的表达,从而对多种胶原沉积性疾病起到很好的疗效[20]。众所周知,细胞骨架微丝和微管有助于各类信号通路传导和调控,其中微管结构在TGF-β1信号通路的下传中也起着重要作用,Smads蛋白则是介导TGF-β1信号传导至微管的细胞内部中间蛋白。小剂量PTX干预TGF-β1/Smads信号通路的具体机制可能是:PTX促进微管蛋白的聚集并稳定微管,更多的Smads蛋白绑定到微管上,则使Smads蛋白与TGF-β1受体隔离,阻断了TGF-β1信号通路的传导[21-22]。王红岗等[23]用PTX干预博莱霉素诱导的大鼠肺纤维化模型,结果显示大鼠肺组织COL Ⅰ、COL Ⅲ表达量减少,表明PTX能通过减少胶原沉积而阻止肺纤维化形成。虽然PTX改善胶原沉积、抗纤维化作用已在胶原性关节炎[24]、输尿管梗阻[20]、青光眼滤过术后瘢痕形成[25]、肾间质纤维化[26]、肝纤维化[27]等疾病模型中得到证实,但其在PAH时血管管壁胶原过度沉积的作用未见报道。本研究用小剂量PTX(100 nmol/L)干预TGF-β1诱导的大鼠PASMCs外胶原沉积模型,结果显示,模型组中PASMCs增殖水平,COL Ⅰ、COL Ⅲ mRNA及其蛋白相对表达水平,p-Smad3蛋白表达量均较空白对照组明显上调,而Smad3蛋白表达量无明显改变。由此推测TGF-β1激活了TGF-β1/Smad3信号通路,上调了Smad3蛋白磷酸化水平,传入胞核信号相对增多,促进细胞增殖及COL Ⅰ、COL Ⅲ mRNA及其蛋白表达。PTX干预组中PASMCs增殖水平,COL Ⅰ、COL Ⅲ mRNA及其蛋白表达水平,p-Smad3蛋白表达量均较模型组显著下调,而Smad3蛋白表达量亦无明显改变。由此推测低浓度PTX可以抑制TGF-β1/Smad3信号通路,下调Smad3蛋白磷酸化水平,传入胞核信号相对减少,抑制细胞增殖及COL Ⅰ、COL Ⅲ mRNA及其蛋白表达。
综上,本研究结果提示低浓度PTX可对TGF-β1促进PASMCs外胶原过度沉积具有显著的抑制作用,该作用可能是通过调控Smad3蛋白的磷酸化来实现。
Biography
罗燕, 女, 硕士研究生
References
- 1.庞 璐璐, 齐 建光, 高 扬, et al. 中介素抑制高肺血流性肺动脉高压大鼠肺组织胶原生成. 中国病理生理杂志. 2014;30(12):2185–2189. doi: 10.3969/j.issn.1000-4718.2014.12.012. [DOI] [Google Scholar]
- 2.王 丹姝, 方 莲花, 杜 冠华. 转化生长因子β1在肺动脉高压中作用的研究进展. 中国药理学通报. 2017;33(6):741–744. doi: 10.3969/j.issn.1001-1978.2017.06.001. [DOI] [Google Scholar]
- 3.郝 淑玲, 王 卫平, 于 忠和, et al. 肾上腺髓质素通过Smad2/3信号途径抑制TGF-β1刺激的肺成纤维细胞前胶原蛋白的合成. http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=xbyfzmyxzz201411002. 细胞与分子免疫学杂志. 2014;30(11):1125–1128. [PubMed] [Google Scholar]
- 4.Bernabeu E, Cagel M, Lagomarsino E, et al. Paclitaxel:what has been done and the challenges remain ahead. Int J Pharm. 2017;526(1-2):474–495. doi: 10.1016/j.ijpharm.2017.05.016. [DOI] [PubMed] [Google Scholar]
- 5.吴珊珊.低浓度紫杉醇对大鼠肺动脉平滑肌细胞生物学行为的影响及机制研究[D].泸州: 西南医科大学, 2018.https://www.ixueshu.com/document/009f3309b4cb192e05d245eaa5878b66.html
- 6.Zhang D, Yang R, Wang S, et al. Paclitaxel:new uses for an old drug. http://d.old.wanfangdata.com.cn/Periodical/zgyxkxyxb201403014. Drug Des Devel Ther. 2014;8:279–284. doi: 10.2147/DDDT.S56801. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Zhou J, Zhong DW, Wang QW, et al. Paclitaxel ameliorates fibrosis in hepatic stellate cells via inhibition of TGF-beta/Smad activity. World J Gastroenterol. 2010;16(26):3330–3334. doi: 10.3748/wjg.v16.i26.3330. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.Zhang D, Sun L, Xian W, et al. Low-dose paclitaxel ameliorates renal fibrosis in rat UUO model by inhibition of TGF-beta/Smad activity. Lab Invest. 2010;90(3):436–447. doi: 10.1038/labinvest.2009.149. [DOI] [PubMed] [Google Scholar]
- 9.胡 煜, 李 刚, 贾 鹏, et al. ERK1/2和PI3K/PKB信号通路在调节大鼠肺动脉平滑肌细胞外基质基因表达中的作用. 临床儿科杂志. 2013;31(12):1154–1158. doi: 10.3969/j.issn.1000-3606.2013.12.014. [DOI] [Google Scholar]
- 10.王 静, 戴 爱国. 原代大鼠肺动脉平滑肌细胞的提取和鉴定以及缺氧对其增殖的影响. 中国呼吸与危重监护杂志. 2012;11(2):147–152. doi: 10.3969/j.issn.1671-6205.2012.02.010. [DOI] [Google Scholar]
- 11.Jung ES, Lee J, Heo NJ, et al. Low-dose paclitaxel ameliorates renal fibrosis by suppressing transforming growth factor-β1-induced plasminogen activator inhibitor-1 signaling. Nephrology (Carlton) 2016;21(7):574–582. doi: 10.1111/nep.12747. [DOI] [PubMed] [Google Scholar]
- 12.桑 葵, 周 英, 李 明霞. 缺氧性肺动脉高压新生大鼠肺血管重塑的研究. http://www.zgddek.com/CN/abstract/abstract12783.shtml. 中国当代儿科杂志. 2012;14(3):210–214. [PubMed] [Google Scholar]
- 13.González JM, Briones AM, Starcher B, et al. Influence of elastin on rat small artery mechanical properties. Exp Physiol. 2005;90(4):463–468. doi: 10.1113/expphysiol.2005.030056. [DOI] [PubMed] [Google Scholar]
- 14.Dong J, Ma Q. Myofibroblasts and lung fibrosis induced by carbon nanotube exposure. Part Fibre Toxicol. 2016;13(1):60. doi: 10.1186/s12989-016-0172-2. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.Ni J, Shi Y, Li L, et al. Cardioprotection against heart failure by Shenfu injection via TGF-β/Smads signaling pathway. Evid Based Complement Alternal Med. 2017;2017:7083016. doi: 10.1155/2017/7083016. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.梁 晨, 金 红芳, 杜 淑旭, et al. 野百合碱诱导肺动脉高压大鼠肺动脉Ⅰ型胶原的变化. http://d.old.wanfangdata.com.cn/Periodical/syeklczz201001007 中华实用儿科临床杂志. 2010;25(1):18–20. [Google Scholar]
- 17.郑 常龙, 刘 旭辉, 冯 亚群, et al. 野百合碱诱导的肺动脉高压大鼠TGF-β1/Smad2信号通路表达的研究. 心肺血管病杂志. 2014;33(3):442–444. doi: 10.3969/j.issn.1007-5062.2014.03.034. [DOI] [Google Scholar]
- 18.Turner E, Erwin M, Atigh M, et al. In vitro and in vivo assessment of keratose as a novel excipient of paclitaxel coated balloons. Front Pharmacol. 2018;9:808. doi: 10.3389/fphar.2018.00808. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.吴 珊珊, 刘 平先, 刘 斌. 紫杉醇在非肿瘤性疾病中应用的研究进展. http://d.old.wanfangdata.com.cn/Periodical/gwyy-zwyfc201709044 现代药物与临床. 2017;32(9):1796–1800. [Google Scholar]
- 20.Zhang D, Sun L, Xian W, et al. Low-dose paclitaxel ameliorates renal fibrosis in rat UUO model by inhibition of TGF-beta/Smad activity. Lab Invest. 2010;90(3):436–447. doi: 10.1038/labinvest.2009.149. [DOI] [PubMed] [Google Scholar]
- 21.Gong K, Xing D, Li P, et al. cGMP inhibits TGF-beta signaling by sequestering Smad3 with cytosolic beta2-tubulin in pulmonary artery smooth muscle cells. Mol Endocrinol. 2011;25(10):1794–1803. doi: 10.1210/me.2011-1009. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 22.Dong C, Li Z, Alvarez R Jr, et al. Microtubule binding to Smads may regulate TGF beta activity. Mol Cell. 2000;5(1):27–34. doi: 10.1016/S1097-2765(00)80400-1. [DOI] [PubMed] [Google Scholar]
- 23.王 红岗, 鲁 明霞. 红豆杉提取物紫杉醇对博莱霉素致大鼠肺纤维化的影响. 浙江中医杂志. 2014;49(4):275–276. doi: 10.3969/j.issn.0411-8421.2014.04.033. [DOI] [Google Scholar]
- 24.徐娟.紫杉醇对胶原诱导性关节炎小鼠血管新生抑制作用的研究[D].广州: 南方医科大学, 2017.http://cdmd.cnki.com.cn/Article/CDMD-12121-1017234947.htm
- 25.李 俊英. 紫杉醇在青光眼滤过术后的抗增殖作用. http://d.old.wanfangdata.com.cn/Periodical/ykxjz201511023t 眼科新进展. 2015;35(11):1080–1082. [Google Scholar]
- 26.Lei Z, Xuan X, Yang R, et al. Paclitaxel attenuates renal interstitial fibroblast activation and interstitial fibrosis by inhibiting STAT3 signaling. http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=Doaj000003840057. Drug Des Devel Ther. 2015;9:2139–2148. doi: 10.2147/DDDT.S81390. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 27.Zhou J, Zhong DW, Wang QW, et al. Paclitaxel ameliorates fibrosis in hepatic stellate cells via inhibition of TGF-beta/Smad activity. World J Gastroenterol. 2010;16(26):3330–3334. doi: 10.3748/wjg.v16.i26.3330. [DOI] [PMC free article] [PubMed] [Google Scholar]


