Abstract
目的
探讨血浆中性粒细胞胞外网状陷阱(NETs)及相关标志物在儿童社区获得性肺炎(CAP)诊断中的价值。
方法
选择收治的160例CAP患儿为CAP组,另选50例健康体检儿童为对照组。CAP组根据病情严重程度分为轻度CAP亚组(n=137)和重度CAP亚组(n=23);根据病原体不同分为细菌性肺炎亚组(n=78)、支原体肺炎亚组(n=35)和病毒性肺炎亚组(n=47)。检测各组血浆NETs及相关标志物抗菌肽-37(LL-37)、胞外游离DNA(cfDNA)、DNA酶Ⅰ(DNaseⅠ)水平,采用受试者工作特征曲线(ROC)分析各指标对CAP及其病情严重程度的诊断价值。
结果
与对照组相比,CAP组NETs、LL-37、cfDNA水平显著增加,DNaseⅠ活性显著降低(P < 0.05)。与轻度CAP亚组相比,重度CAP亚组NETs、LL-37、cfDNA水平显著增加,DNaseⅠ活性显著降低(P < 0.05)。细菌性肺炎亚组、支原体肺炎亚组、病毒性肺炎亚组间NETs、LL-37、cfDNA水平及DNaseⅠ活性差异无统计学意义(P > 0.05)。CAP组NETs与WBC、中性粒细胞百分比、C-反应蛋白(CRP)、降钙素原、肿瘤坏死因子-α呈正相关(分别r=0.166、0.168、0.275、0.181、0.173,P < 0.05);LL-37、cfDNA与WBC(分别r=0.186、0.338)、CRP(分别r=0.309、0.274)呈正相关(P < 0.05),DNaseⅠ活性与CRP呈负相关(r=-0.482,P < 0.05)。ROC曲线分析显示,NETs、LL-37、cfDNA、DNaseⅠ诊断CAP的曲线下面积(AUC)分别为0.844、0.648、0.727、0.913;最佳截断值分别为182.89、46.26 ng/mL、233.13 ng/mL、0.39 U/mL;灵敏度分别为88.12%、35.63%、54.37%、91.25%;特异度分别为74.00%、92.00%、86.00%、76.00%。鉴别CAP病情严重程度的AUC分别为0.873、0.924、0.820、0.778;最佳截断值分别为257.7、49.11 ng/mL、252.54 ng/mL、0.29 U/mL;灵敏度分别为83.21%、86.96%、78.26%、95.65%;特异度分别为78.26%、83.94%、76.64%、56.93%。
结论
CAP患儿血浆NETs及相关标志物水平对CAP诊断及病情严重程度具有一定预测价值。
Keywords: 社区获得性肺炎, 中性粒细胞胞外网状陷阱, 诊断, 病情, 儿童
Abstract
Objective
To study the significance of plasma neutrophil extracellular trap (NET) and its markers in the diagnosis of community-acquired pneumonia (CAP) in children.
Methods
A total of 160 children with CAP were enrolled as the CAP group, and 50 healthy children were enrolled the control group. According to disease severity, the CAP group was further divided into a mild CAP subgroup with 137 children and a severe CAP subgroup with 23 children. According to the pathogen, the CAP group was further divided into a bacterial pneumonia subgroup with 78 children, a Mycoplasma pneumonia subgroup with 35 children, and a viral pneumonia subgroup with 47 children. The levels of plasma NET and its markers[antibacterial peptide (LL-37), extracellular free DNA (cfDNA), and deoxyribonuclease I (DNase I)] were measured. Receiver operating characteristic (ROC) curve was used to analyze the value of each index in diagnosing CAP and assessing its severity.
Results
Compared with the control group, the CAP group had significant increases in the levels of NET, LL-37, and cfDNA and a significant reduction in the activity of DNase I (P < 0.05). Compared with the mild CAP subgroup, the severe CAP subgroup had significantly higher levels of NET, LL-37 and cfDNA and a significantly lower activity of DNase I (P < 0.05). There were no significant differences in the levels of NET, LL-37, and cfDNA and the activity of DNase I among the bacterial pneumonia, Mycoplasma pneumonia, and viral pneumonia subgroups (P > 0.05). In the CAP group, plasma NET levels were positively correlated with white blood cell count (WBC), percentage of neutrophils, and serum levels of C-reactive protein (CRP), procalcitonin and tumor necrosis factor-α (r=0.166, 0.168, 0.275, 0.181 and 0.173 respectively, P < 0.05); LL-37 and cfDNA levels were positively correlated with WBC (r=0.186 and 0.338 respectively, P < 0.05) and CRP levels (r=0.309 and 0.274 respectively, P < 0.05); the activity of DNase I was negatively correlated with CRP levels (r=-0.482, P < 0.05). The ROC curve analysis showed that NET, LL-37, cfDNA, and DNase I had an area under the ROC curve (AUC) of 0.844, 0.648, 0.727, and 0.913 respectively in the diagnosis of CAP, with optimal cut-off values of 182.89, 46.26 ng/mL, 233.13 ng/mL, and 0.39 U/mL respectively, sensitivities of 88.12%, 35.63%, 54.37%, and 91.25% respectively, and specificities of 74.00%, 92.00%, 86.00%, and 76.00% respectively. In the assessment of the severity of CAP, NET, LL-37, cfDNA, and DNase I had an AUC of 0.873, 0.924, 0.820, and 0.778 respectively, with optimal cut-off values of 257.7, 49.11 ng/mL, 252.54 ng/mL, and 0.29 U/mL respectively, sensitivities of 83.21%, 86.96%, 78.26%, and 95.65% respectively, and specificities of 78.26%, 83.94%, 76.64%, and 56.93% respectively.
Conclusions
Plasma NET and its related markers have a certain value in diagnosing CAP and assessing its severity in children.
Keywords: Community-acquired pneumonia, Neutrophil extracellular trap, Diagnosis, Severity, Child
社区获得性肺炎(community-acquired pneumonia, CAP)作为儿童下呼吸道感染的常见病之一,具有发展快、预后不一的特点,严重时可累及循环、消化、神经等系统,甚至危及患儿生命[1]。及早诊断并明确CAP的病情严重程度、识别高危患儿对于改善CAP的预后具有重要意义[2]。近来研究发现,中性粒细胞胞外网状陷阱(neutrophil extracellular traps, NETs)作为中性粒细胞杀菌的第二种机制,在多种感染性疾病以及自身免疫性疾病(如类风湿性关节炎、系统性红斑狼疮)中发挥重要作用[3-5]。抗菌肽-37(antibacterial peptide-37, LL-37)和胞外游离DNA(circulating cell-free DNA, cfDNA)是反映NETs水平的两个间接血清标志物,能够间接反映体内NETs的形成情况[6-7]。DNA酶Ⅰ(deoxyribonuclease I, DNaseⅠ)作为降解胞外形成的NETs的重要酶,能够直观反映NETs在体内的降解情况[8]。目前有国外学者提出NETs与感染性疾病有关,外周血中NETs水平与CAP患者病情严重程度有关[9]。然而,目前国内尚未见关于NETs与儿童呼吸道及肺部感染等相关疾病关系的研究报道。因此,本研究拟通过对CAP患儿血浆中NETs进行检测,探讨NETs及相关标志物与儿童CAP病情严重程度的关系,以期为疾病的临床监测提供一定参考依据。
1. 资料与方法
1.1. 一般资料
选择2016年2月至2018年2月于郑州大学附属儿童医院就诊的160例CAP患儿为研究对象,其中男87例,女73例,发病年龄3.7±1.2岁。纳入标准:(1)符合2013年儿童社区获得性肺炎管理指南[10]的诊断标准;(2)存在肺炎症状及体征(发热和呼吸系统症状);(3)入院时患儿年龄大于28 d,小于5岁;(4)父母或监护人知情同意。排除标准:(1)入院前抗菌药物治疗 > 48 h;(2)伴潜在慢性呼吸系统疾病;(3)哮喘、反复呼吸道感染病史;(4)贫血、佝偻病、免疫功能低下者;(5)有遗传代谢性疾病者。参照2013年儿童社区获得性肺炎管理指南[10]中重症肺炎的诊断标准[存在以下任意一项:拒食或脱水征;意识障碍;婴儿呼吸频率(RR) > 70次/min、年长儿RR > 50次/min;紫绀;呼吸困难;多肺叶或≥2/3的肺受累;脉搏血氧饱和度≤92%;肺外并发症等],将CAP组分为轻度CAP亚组137例,重度CAP亚组23例。根据病原体不同分为3个亚组:细菌性肺炎亚组78例,支原体肺炎亚组35例和病毒性肺炎亚组47例。
另选择同期于本院体检的健康儿童50例作为对照组,其中男26例,女24例,年龄4.0±0.9岁。
1.2. 研究方法
采集所有研究对象的一般资料及实验室检查,包括入院时体重、心率、RR,入院时血常规、C-反应蛋白(C-reactive protein, CRP)、降钙素原(procalcitonin, PCT)、肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)及病原学等。
1.3. 血浆NETs及相关标志物水平测定
EDTA抗凝管抽取所有研究对象入院时空腹静脉全血10 mL。根据参考文献[11],采用免疫荧光法定量检测外周血NETs水平。利用中性粒细胞分离液(AXIS-SHIELD)分离中性粒细胞,重悬于含5%胎牛血清的1640培养液中,并在预包了多聚赖氨酸的载玻片上培养2 h。经磷酸缓冲盐溶液(phosphate buffer saline, PBS)洗涤后固定于4%多聚甲醛溶液20 min。PBS洗涤后,加入1% Triton X-100冰浴1 min。PBS洗涤后,加入血清封闭液孵育20 min,之后加入髓过氧化物酶(MPO)特异性抗体孵育2 h,再加入FITC标记的山羊抗兔IgG孵育1 h。滴加含有4' , 6-二脒基-2-苯基吲哚(DAPI)荧光淬灭封片液,盖上盖玻片,封片。于荧光酶标仪读取荧光值(激发波长485 nm,发射波长525 nm),以相对荧光强度表示NETs的形成量。采用PicoGreen试剂盒(Thermo Fisher, P7589)测定血浆cfDNA含量。采用LL-37 ELISA试剂盒(武汉华美生物工程有限公司,CSB-E14948h)测定血浆中LL-37的浓度;采用辐射状酶扩散法测定血浆DNaseⅠ活性。
1.4. 统计学分析
采用SPSS 17.0进行数据处理。呈正态分布的计量资料以均数±标准差(x±s)表示,两组间比较采用独立样本t检验。计数资料以例和百分比(%)表示,组间比较采用χ2检验或Fisher精确概率法。采用Pearson法分析变量间的相关性。采用受试者工作特征曲线(ROC)分析NETs及相关标志物对CAP诊断及病情严重程度的预测价值。P < 0.05为差异有统计学意义。
2. 结果
2.1. 一般资料
CAP组和对照组年龄与性别差异无统计学意义(P > 0.05),但CAP组WBC、中性粒细胞百分比(N%)、RBC、CRP、PCT、TNF-α水平均高于对照组,差异有统计学意义(P < 0.05)。轻度CAP亚组和重度CAP亚组间年龄、性别、RBC、PCT、TNF-α差异无统计学意义(P > 0.05),但重度CAP亚组WBC、N%、CRP水平均高于轻度CAP亚组,差异有统计学意义(P < 0.05)。细菌性肺炎亚组、支原体肺炎亚组和病毒性肺炎亚组间年龄、性别、WBC、N%、RBC、CRP、PCT、TNF-α差异无统计学意义(P < 0.05)。见表 1~3。
1.
CAP组和对照组一般资料及实验室指标比较
| 项目 | 对照组(n=50) | CAP组(n=160) | χ2/t值 | P值 |
| 注:[N]中性粒细胞;[CRP] C-反应蛋白;[PCT]降钙素原;[TNF-α]肿瘤坏死因子-α。 | ||||
| 年龄(x±s, 岁) | 4.0±0.9 | 3.7±1.2 | 1.702 | 0.090 |
| 性别(男/女, 例) | 26/24 | 87/73 | 0.067 | 0.796 |
| 病原体感染[(例)%] | ||||
| 细菌性 | - | 78(48.8) | - | - |
| 支原体 | - | 35(21.9) | - | - |
| 病毒性 | - | 47(29.4) | - | - |
| WBC (x±s, ×109/L) | 6.0±1.3 | 9.7±2.1 | 12.001 | < 0.001 |
| N (x±s, %) | 46±9 | 52±11 | 3.300 | 0.001 |
| RBC (x±s, ×109/L) | 3.2±0.7 | 5.8±1.1 | 15.438 | < 0.001 |
| CRP (x±s, ng/mL) | 6.0±1.3 | 7.5±1.9 | 5.170 | < 0.001 |
| PCT (x±s, mg/L) | 0.069±0.012 | 0.079±0.011 | 5.489 | < 0.001 |
| TNF-α (x±s, μg/L) | 6.1±1.2 | 14.0±1.5 | 33.655 | < 0.001 |
3.
细菌性肺炎亚组、支原体肺炎亚组和病毒性肺炎亚组的一般资料和实验室指标比较
| 项目 | 细菌性肺炎亚组 (n=78) |
支原体肺炎亚组 (n=35) |
病毒性肺炎亚组 (n=47) |
χ2/F值 | P值 |
| 注:[N]中性粒细胞;[CRP]C-反应蛋白;[PCT]降钙素原;[TNF-α]肿瘤坏死因子-α。 | |||||
| 年龄(x±s, 岁) | 3.7±1.2 | 3.8±1.2 | 3.6±1.2 | 0.336 | 0.751 |
| 性别(男/女, 例) | 38/40 | 20/15 | 29/18 | 2.131 | 0.344 |
| WBC (x±s, ×109/L) | 9.7±2.2 | 9.5±2.1 | 9.5±2.2 | 0.213 | 0.808 |
| N (x±s, %) | 54±11 | 51±12 | 49±11 | 2.735 | 0.068 |
| RBC (x±s, ×109/L) | 5.9±1.2 | 5.7±1.2 | 5.7±1.2 | 0.790 | 0.456 |
| CRP (x±s, ng/mL) | 7.6±2.0 | 7.1±1.8 | 7.2±1.8 | 1.004 | 0.369 |
| PCT (x±s, mg/L) | 0.080±0.011 | 0.079±0.009 | 0.079±0.013 | 0.135 | 0.874 |
| TNF-α (x±s, μg/L) | 13.8±1.5 | 13.8±2.1 | 14.0±2.0 | 0.201 | 0.818 |
2.
轻度CAP亚组与重度CAP亚组一般资料和实验室指标比较
| 项目 | 轻度CAP亚组(n=137) | 重度CAP亚组(n=23) | χ2/t值 | P值 |
| 注:[N]中性粒细胞;[CRP] C-反应蛋白;[PCT]降钙素原;[TNF-α]肿瘤坏死因子-α。 | ||||
| 年龄(x±s, 岁) | 3.7±1.2 | 3.3±1.0 | 1.575 | 1.117 |
| 性别(男/女, 例) | 74/63 | 13/10 | 0.050 | 0.823 |
| WBC (x±s, ×109/L) | 9.6±2.1 | 10.5±1.8 | 2.052 | 0.042 |
| N (x±s, %) | 51±10 | 57±13 | 2.485 | 0.014 |
| RBC (x±s, ×109/L) | 5.8±1.1 | 6.1±1.4 | 1.365 | 0.174 |
| CRP (x±s, ng/mL) | 7.1±1.6 | 9.9±2.0 | 7.546 | < 0.001 |
| PCT (x±s, mg/L) | 0.080±0.011 | 0.077±0.011 | 1.210 | 0.228 |
| TNF-α (x±s, μg/L) | 13.9±1.4 | 14.2±1.9 | 0.877 | 0.382 |
2.2. 外周血NETs及相关标志物比较及相关性分析
与对照组相比,CAP组NETs、LL-37、cfDNA水平显著增加,DNaseⅠ活性显著降低(P < 0.05);重度CAP亚组NETs、LL-37、cfDNA水平显著高于轻度CAP亚组,DNaseⅠ活性显著低于轻度CAP亚组(P < 0.05)。见表 4~5,图 1。
4.
对照组与CAP组NETs及相关标志物水平比较
| (x±s) | |||||
| 组别 | 例数 | NETs荧光强度 | LL-37 (ng/mL) |
cfDNA (ng/mL) |
DNaseⅠ (U/mL) |
| 注:[NETs]中性粒细胞胞外网状陷阱;[LL-37]抗菌肽-37;[cfDNA]胞外游离DNA;[DNaseⅠ] DNA酶Ⅰ。 | |||||
| 对照组 | 50 | 168±42 | 35±10 | 202±31 | 0.45±0.11 |
| CAP组 | 160 | 230±48 | 42±13 | 236±46 | 0.29±0.09 |
| t值 | 8.146 | 3.372 | 4.878 | 10.385 | |
| P值 | < 0.001 | 0.001 | < 0.001 | < 0.001 | |
5.
轻度CAP亚组与重度CAP亚组NETs及相关标志物水平比较 (x±s)
| 组别 | 例数 | NETs荧光强度 | LL-37 (ng/mL) |
cfDNA (ng/mL) |
DNaseⅠ (U/mL) |
| 注:[NETs]中性粒细胞胞外网状陷阱;[LL-37]抗菌肽-37;[cfDNA]胞外游离DNA;[DNaseⅠ] DNA酶Ⅰ。 | |||||
| 轻度CAP亚组 | 137 | 219±38 | 39±11 | 228±40 | 0.30±0.09 |
| 重度CAP亚组 | 23 | 295±51 | 61±10 | 286±52 | 0.22±0.05 |
| t值 | 8.393 | 8.959 | 6.218 | 4.149 | |
| P值 | < 0.001 | < 0.001 | < 0.001 | < 0.001 | |
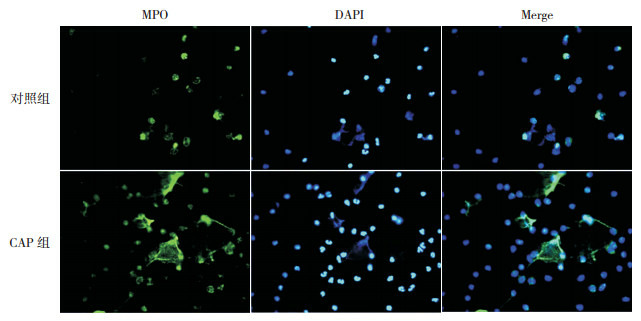
1.
免疫荧光法定量检测外周血中NETs水平(200×)
使用4', 6-二脒基-2-苯基吲哚(DAPI,蓝色)进行DNA染色,以髓过氧化物酶(MPO,绿色)进行NETs染色。DAPI和MPO共染后,通过免疫荧光显微镜评估NETs的相对荧光强度。
细菌性肺炎亚组、支原体肺炎亚组、病毒性肺炎亚组间NETs、LL-37、cfDNA水平及DNaseⅠ活性的差异无统计学意义(P > 0.05),见表 6。
6.
不同病原体亚组NETs及相关标志物水平比较
| (x±s) | |||||
| 组别 | 例数 | NETs荧光强度 | LL-37 (ng/mL) |
cfDNA (ng/mL) |
DNaseⅠ (U/mL) |
| 注:[NETs]中性粒细胞胞外网状陷阱;[LL-37]抗菌肽-37;[cfDNA]胞外游离DNA;[DNaseⅠ] DNA酶Ⅰ。 | |||||
| 细菌性肺炎亚组 | 78 | 230±50 | 43±14 | 238±492 | 0.28±0.06 |
| 支原体肺炎亚组 | 35 | 231±41 | 43±14 | 243±45 | 0.29±0.06 |
| 病毒性肺炎亚组 | 47 | 229±39 | 39±11 | 227±42 | 0.28±0.05 |
| F值 | 0.020 | 1.492 | 1.307 | 0.417 | |
| P值 | 0.980 | 0.228 | 0.274 | 0.660 | |
NETs与LL-37、cfDNA呈正相关(分别r=0.502、0.497,P < 0.05),而与DNaseⅠ活性呈负相关(r=-0.458,P < 0.05),见图 2~4。
2.
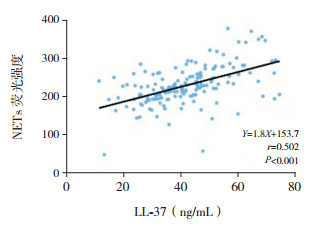
CAP组外周血NETs与LL-37水平相关分析图
4.
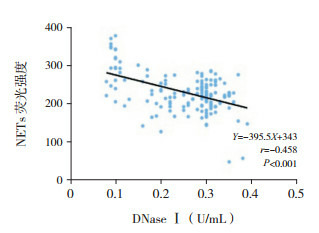
CAP组外周血NETs与DNaseⅠ活性相关分析图
3.
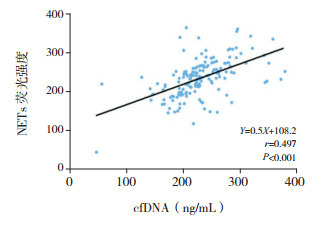
CAP组外周血NETs与cfDNA水平相关分析图
2.3. NETs及相关标志物与CAP临床指标相关性分析
CAP组NETs与WBC、N%、CRP、PCT、TNF-α呈正相关(P < 0.05);LL-37、cfDNA与WBC、CRP呈正相关(P < 0.05);DNaseⅠ活性与CRP呈负相关(P < 0.05)。见表 7。
7.
NETs及相关标志物与CAP组临床指标相关性分析
| 指标 | NETs | LL-37 | cfDNA | DNaseⅠ | |||||||
| r值 | P值 | r值 | P值 | r值 | P值 | r值 | P值 | ||||
| 注:[N%]中性粒细胞百分比;[CRP] C-反应蛋白;[PCT]降钙素原;[TNF-α]肿瘤坏死因子-α;[NETs]中性粒细胞胞外网状陷阱;[LL-37]抗菌肽-37;[cfDNA]胞外游离DNA;[DNaseⅠ] DNA酶Ⅰ。 | |||||||||||
| 年龄 | 0.118 | 0.138 | 0.009 | 0.905 | 0.017 | 0.816 | -0.095 | 0.112 | |||
| WBC | 0.166 | 0.036 | 0.186 | 0.018 | 0.338 | < 0.001 | -0.875 | 0.383 | |||
| N% | 0.168 | 0.034 | 0.026 | 0.747 | 0.034 | 0.647 | -0.116 | 0.245 | |||
| RBC | 0.152 | 0.976 | 0.070 | 0.381 | 0.078 | 0.279 | -0.118 | 0.237 | |||
| CRP | 0.275 | < 0.001 | 0.309 | < 0.001 | 0.274 | < 0.001 | -0.482 | < 0.001 | |||
| PCT | 0.181 | 0.022 | 0.083 | 0.277 | 0.037 | 0.609 | 0.035 | 0.727 | |||
| TNF-α | 0.173 | 0.002 | 0.099 | 0.237 | 0.112 | 0.166 | 0.186 | 0.065 | |||
2.4. NETs及相关标志物在CAP诊断及病情严重程度中的预测价值
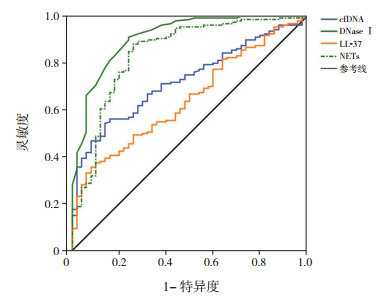
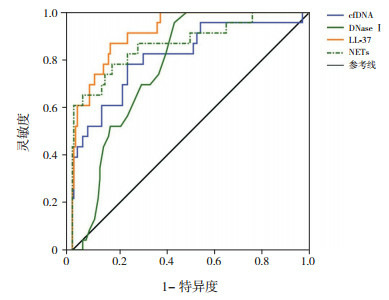
NETs、LL-37、cfDNA、DNaseⅠ诊断CAP的曲线下面积(AUC)分别为0.844、0.648、0.727、0.913(图 5、表 8);最佳截断值分别为182.89、46.26 ng/mL、233.13 ng/mL、0.39 U/mL;灵敏度分别为88.12%、35.63%、54.37%、91.25%;特异度分别为74.00%、92.00%、86.00%、76.00%。鉴别重度CAP的AUC分别为0.873、0.924、0.820、0.778(图 6、表 8);最佳截断值分别为257.7、49.11 ng/mL、252.54 ng/mL、0.29 U/mL;灵敏度分别为83.21%、86.96%、78.26%、95.65%;特异度分别为78.26%、83.94%、76.64%、56.93%。
5.
NETs及相关标志物对CAP诊断价值的ROC分析图
[NETs]中性粒细胞胞外网状陷阱;[LL-37]抗菌肽-37;[cfDNA]胞外游离DNA;[DNaseⅠ] DNA酶Ⅰ
8.
NETs、LL-37、cfDNA及DNaseⅠ对CAP诊断及病情严重程度的预测价值
| 组别 | 指标 | AUC | 约登指数 | 最佳截断值 | 灵敏度 (%) |
特异度 (%) |
阳性预测值 (%) |
阴性预测值 (%) |
P值 |
| 注:[NETs]中性粒细胞胞外网状陷阱;[LL-37]抗菌肽-37;[cfDNA]胞外游离DNA;[DNaseⅠ] DNA酶Ⅰ;[AUC]曲线下面积。 | |||||||||
| CAP组 | NETs | 0.844 | 0.621 | 182.89 | 88.12 | 74.00 | 90.97 | 65.45 | < 0.001 |
| LL-37 | 0.648 | 0.276 | 46.26 ng/mL | 35.63 | 92.00 | 91.94 | 30.41 | < 0.001 | |
| cfDNA | 0.727 | 0.404 | 233.13 ng/mL | 54.37 | 86.00 | 91.67 | 36.84 | < 0.001 | |
| DNaseⅠ | 0.913 | 0.673 | 0.39 U/mL | 91.25 | 76.00 | 92.31 | 70.37 | < 0.001 | |
| 重度CAP亚组 | NETs | 0.873 | 0.615 | 257.7 | 83.21 | 78.26 | 42.86 | 95.76 | < 0.001 |
| LL-37 | 0.924 | 0.709 | 49.11 ng/mL | 86.96 | 83.94 | 46.51 | 97.44 | < 0.001 | |
| cfDNA | 0.820 | 0.549 | 252.54 ng/mL | 78.26 | 76.64 | 35.29 | 95.41 | < 0.001 | |
| DNaseⅠ | 0.778 | 0.526 | 0.29 U/mL | 95.65 | 56.93 | 6.73 | 71.43 | < 0.001 | |
6.
NETs及相关标志物对CAP严重程度预测价值的ROC分析图
[NETs]中性粒细胞胞外网状陷阱;[LL-37]抗菌肽-37;[cfDNA]胞外游离DNA;[DNaseⅠ] DNA酶Ⅰ。
3. 讨论
CAP是儿科最常见的疾病之一,流行病学调查结果显示,CAP已成为发展中国家儿童死亡的第二大原因,死亡人数占儿童总死亡人数的1/5 [12]。目前临床上对儿童CAP的早期明确诊断存在一定难度,探索与CAP相关的新血清学标志物,对于儿童CAP发病及病情严重程度的及早诊断与治疗具有重要临床意义。
中性粒细胞作为固有免疫系统中重要的效应细胞,能够在炎症发生时抵御外来微生物对人体的入侵,在连接先天性免疫与获得性免疫中发挥关键作用。经典的中性粒细胞杀伤机制主要通过释放氧自由基和各种蛋白酶,研究表明,中性粒细胞能够在胞外形成由核酸物质和颗粒蛋白组成的网状结构,即NETs,捕杀病原体,发挥抗细胞免疫效应,是中性粒细胞杀菌并阻止病原微生物在机体内扩散的新方式[13]。中性粒细胞作为气道中重要的细胞类型,其经典杀伤功能在呼吸道感染的发生发展中起重要作用,但NETs在其中的具体作用机制目前尚未明确。近来研究发现,NETs与多种自身免疫性疾病和炎症性肺疾病有关[14]。中性粒细胞被病原微生物激活后,通过释放由双链DNA、组蛋白、蛋白酶类和抗菌肽形成的NETs来识别、捕获并捕杀金黄色葡萄球菌、肺炎链球菌、肺炎克雷伯菌等多种革兰阳性菌、革兰阴性菌以及病毒等[15-16]。但由于组成NETs的组蛋白、弹力蛋白酶、MPO、LL-37等胞内和核内成分对机体免疫系统而言是潜在的自身抗原,也可造成肺组织损伤[17-18],尤其是细胞外的组蛋白可直接损伤肺泡内皮细胞和上皮细胞[19]。此外,NETs中的补体成分C1q可进一步募集中性粒细胞至炎症病灶[20],促使更多的NETs形成,从而形成炎症和损伤的恶性循环。因此,NETs也可能起到致病作用。已有研究证实,NETs在类风湿性关节炎、系统性红斑狼疮等疾病中过度形成,与自身抗体形成有关[9]。本研究发现,CAP组外周血NETs水平较对照组明显增多,且重度CAP亚组外周血NETs水平显著高于轻度CAP亚组。LL-37是中性粒细胞的特异性抗原肽,其血清水平能够反映体内NETs的形成程度[6]。机体内残留的NETs是血浆cfDNA的主要来源之一,cfDNA亦能间接反映机体内NETs的形成情况[7]。为分析人体内NETs的形成情况,本研究通过进一步检测NETs的两个间接血清标志物LL-37和cfDNA水平发现,CAP组血浆LL-37和cfDNA水平显著高于对照组,且重度CAP亚组中的水平显著高于轻度CAP亚组。同时,血浆NETs荧光强度与LL-37及cfDNA水平均呈正相关。证实CAP患儿体内NETs形成增多,且机体NETs水平与CAP患儿病情严重程度有关。CRP、PCT等指标是反映CAP患儿机体炎症情况的重要指标[21],本研究也证实CAP组CRP、WBC、PCT水平显著高于对照组,且血浆NETs水平与CRP、WBC、N%、PCT、TNF-α均呈正相关。因此推测,CAP患儿血清NETs水平的增高除与病原微生物感染有关外,也可能与CAP患儿体内炎性细胞因子的表达增加有关。及时清除NETs对预防疾病发生进展至关重要。有研究证实,DNaseⅠ可以降解胞外形成的NETs [8]。因此本研究进一步测定血浆中DNaseⅠ的活性以分析CAP患儿体内NETs不能有效降解的原因。结果发现,CAP组血浆DNaseⅠ活性显著低于对照组,提示DNaseⅠ活性在CAP患儿呈明显降低,且重度CAP患儿中降低更显著。因此推测,血浆DNaseⅠ的活性不足可能是导致血浆NETs不能有效降解的原因。
本研究进一步分析血清NETs及相关标志物对重度CAP患儿的诊断价值发现,NETs及相关标志物对鉴别儿童CAP病情严重程度有较高敏感度与特异度,在指导CAP治疗时具有一定参考意义。尽管NETs可杀伤病原微生物,但病原微生物感染也可引起CAP患儿体内促炎因子增多,从而造成异常NETs的形成。这些过度形成的NETs能够刺激浆细胞样细胞释放Ⅰ型干扰素,并进一步扰乱细胞因子网络[22],从而导致恶性循环。CAP患儿体内过度形成的NETs不能被DNaseⅠ及时降解,残留的NETs可能会进一步破坏机体内环境稳态,导致病情进一步恶化。因此,体内NETs调节异常可能是儿童CAP发病的一个潜在因素,而DNaseⅠ可能成为新的治疗靶点。
综上所述,CAP患儿体内NETs形成能力显著增强,且降解NETs的能力显著降低,体内NETs的调节异常可能是CAP发病的潜在因素之一。血浆NETs及相关标志物水平对CAP及其病情严重程度具有一定诊断价值。然而,本研究未对NETs及相关标志物进行动态监测,且样本量较小,可能导致结果存在偏倚,在今后的工作中,会增加NETs的检测时间点和病例数、结合病理实验等做更为详尽的研究。
Biography
陈丹, 女, 硕士, 主治医师
References
- 1.赵 德育, 陈 慧中, 杨 倩媛, et al. 临床征象对识别儿童社区获得性肺炎支原体肺炎价值的系统综述. 中华儿科杂志. 2016;54(2):104–110. doi: 10.3760/cma.j.issn.0578-1310.2016.02.008. [DOI] [Google Scholar]
- 2.崔 立静, 孙 恬敏, 王 丽飞, et al. 肺炎患者病情严重程度及预后的评估. 国际呼吸杂志. 2017;37(13):1018–1022. doi: 10.3760/cma.j.issn.1673-436X.2017.13.014. [DOI] [Google Scholar]
- 3.宋 向楠, 刘 彦虹. 中性粒细胞胞外诱捕网与相关疾病的研究进展. 国际免疫学杂志. 2017;40(1):57–60. doi: 10.3760/cma.j.issn.1673-4394.2017.01.012. [DOI] [Google Scholar]
- 4.Barnado A, Crofford LJ, Oates JC. At the bedside:neutrophil extracellular traps (NETs) as targets for biomarkers and therapies in autoimmune diseases. J Leukoc Biol. 2016;99(2):265–278. doi: 10.1189/jlb.5BT0615-234R. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Grayson PC, Kaplan MJ. At the bench:neutrophil extracellular traps (NETs) highlight novel aspects of innate immune system involvement in autoimmune diseases. J Leukoc Biol. 2016;99(2):253–264. doi: 10.1189/jlb.5BT0615-247R. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Ebrahimi F, Giaglis S, Hahn S, et al. Markers of neutrophil extracellular traps predict adverse outcome in community-acquired pneumonia:secondary analysis of a randomised controlled trial. Eur Respir J. 2018;51(4):pii:1701389. doi: 10.1183/13993003.01389-2017. [DOI] [PubMed] [Google Scholar]
- 7.Brinkmann V, Reichard U, Goosmann C, et al. Neutrophil extracellular traps kill bacteria. Science. 2004;303(5663):1532–1535. doi: 10.1126/science.1092385. [DOI] [PubMed] [Google Scholar]
- 8.Kessenbrock K, Krumbholz M, Schönermarck U, et al. Netting neutrophils in autoimmune small-vessel vasculitis. Nat Med. 2009;15(6):623–625. doi: 10.1038/nm.1959. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.倪 金凤, 高 长俊, 郝 冬荣, et al. 血清炎症因子在评估儿童社区获得性肺炎病情严重程度中的临床价值. http://d.old.wanfangdata.com.cn/Periodical/yycyzx201604019 中国医药导报. 2016;13(4):69–72. [Google Scholar]
- 10.中华医学会儿科学分会呼吸学组, 《中华儿科杂志》编辑委员会 儿童社区获得性肺炎管理指南(2013修订)(上) 中华儿科杂志. 2013;51(10):745–752. doi: 10.3760/cma.j.issn.0578-1310.2013.10.006. [DOI] [Google Scholar]
- 11.Manzenreiter R, Kienberger F, Marcos V, et al. Ultrastructural characterization of cystic fibrosis sputum using atomic force and scanning electron microscopy. J Cyst Fibros. 2012;11(2):84–92. doi: 10.1016/j.jcf.2011.09.008. [DOI] [PubMed] [Google Scholar]
- 12.Gonzalez DJ, Corriden R, Akong-Moore K, et al. N-terminal ArgD peptides from the classical Staphylococcus aureus Agr system have cytotoxic and proinflammatory activities. Chem Biol. 2014;21(11):1457–1462. doi: 10.1016/j.chembiol.2014.09.015. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.Jenne CN, Wong CH, Zemp FJ, et al. Neutrophils recruited to sites of infection protect from virus challenge by releasing neutrophil extracellular traps. Cell Host Microbe. 2013;13(2):169–180. doi: 10.1016/j.chom.2013.01.005. [DOI] [PubMed] [Google Scholar]
- 14.Keshari RS, Jyoti A, Dubey M, et al. Cytokines induced neutrophil extracellular traps formation:implication for the inflammatory disease condition. PLoS One. 2012;7(10):e48111. doi: 10.1371/journal.pone.0048111. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.Caudrillier A, Kessenbrock K, Gilliss BM, et al. Platelets induce neutrophil extracellular traps in transfusion-related acute lung injury. J Clin Invest. 2012;122(7):2661–2671. doi: 10.1172/JCI61303. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.Cheng OZ, Palaniyar N. NET balancing:a problem in inflammatory lung diseases. http://d.old.wanfangdata.com.cn/OAPaper/oai_pubmedcentral.nih.gov_3553399. Front Immunol. 2013;4:1. doi: 10.3389/fimmu.2013.00001. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.Leffler J, Martin M, Gullstrand B, et al. Neutrophil extracellular traps that are not degraded in systemic lupus erythematosus activate complement exacerbating the disease. J Immunol. 2012;188(7):3522–3531. doi: 10.4049/jimmunol.1102404. [DOI] [PubMed] [Google Scholar]
- 18.Khandpur R, Carmona-Rivera C, Vivekanandan-Giri A, et al. NETs are a source of citrullinated autoantigens and stimulate inflammatory responses in rheumatoid arthritis. http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=7854cfdd13eb2d4b6dde4e444dd65d14. Sci Transl Med. 2013;5(178):178ra40. doi: 10.1126/scitranslmed.3005580. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.Bosch X. Systemic lupus erythematosus and the neutrophil. N Engl J Med. 2011;365(8):758–760. doi: 10.1056/NEJMcibr1107085. [DOI] [PubMed] [Google Scholar]
- 20.Margraf S, Lögters T, Reipen J, et al. Neutrophil-derived circulating free DNA (cf-DNA/NETs):a potential prognostic marker for posttraumatic development of inflammatory second hit and sepsis. Shock. 2008;30(4):352–358. doi: 10.1097/SHK.0b013e31816a6bb1. [DOI] [PubMed] [Google Scholar]
- 21.王 凤娇, 田 海容, 陈 天昱. 血清CRP、WBC及PCT检测在小儿肺炎诊断中的临床应用. http://www.wanfangdata.com.cn/details/detail.do?_type=perio&id=qqhryxyxb201624009 齐齐哈尔医学院学报. 2016;37(24):3015–3016. [Google Scholar]
- 22.Garcia-Romo GS, Caielli S, Vega B, et al. Netting neutrophils are major inducers of type Ⅰ IFN production in pediatric systemic lupus erythematosus. http://med.wanfangdata.com.cn/Paper/Detail/PeriodicalPaper_PM21389264. Sci Transl Med. 2011;3(73):73ra20. doi: 10.1126/scitranslmed.3001201. [DOI] [PMC free article] [PubMed] [Google Scholar]


